线粒体因其在细胞增殖和死亡中的关键作用和功能而成为药物靶向的重要细胞内细胞器。在过去的几十年里,一些研究揭示了线粒体的功能,吸引了许多研究人员的注意力,集中在核靶向这一领域。线粒体靶向始于 1995 年,使用三苯基鏻-硫代丁基缀合物作为抗氧化剂。癌细胞中线粒体靶向的主要驱动力是与细胞质相比更高的线粒体膜电位,这使得一些分子能够选择性地靶向线粒体。在这篇综述中,我们讨论了线粒体靶向配体缀合的抗癌药物及其体外和体内行为。此外,我们描述了一种用于抗癌药物输送的线粒体靶向纳米载体系统。正如之前报道的,已知有几种药物具有线粒体靶向潜力;然而,它们不足以直接应用于癌症治疗。因此,许多研究集中于靶向配体与治疗剂的直接缀合以提高其功效。最佳线粒体靶向药物的开发有许多变量,例如选择正确的靶向配体和接头。然而,使用纳米载体系统可以解决一些与溶解度和选择性相关的问题。因此,本综述重点关注用于抗癌药物递送的线粒体靶向药物缀合物和线粒体靶向纳米载体系统。
介绍
线粒体作为能量来源和反应底物的产生者在活细胞中发挥着重要作用,而反应底物对活细胞有害。因此,针对线粒体的研究引起了医学界的高度关注。线粒体靶向的想法是在确定线粒体结构和一些具有线粒体亲和力的分子后于1950年提出的。离域亲脂性阳离子 (DLC),例如三苯基膦、地喹啉和罗丹明 123,是第一个线粒体靶向分子。后来,许多研究将这些配体用于线粒体靶向抗氧化剂和抗癌药物的开发。线粒体靶向的概念基于线粒体膜电位,其不同于质膜电位。线粒体膜电位约为-180 mV,比质膜高3至5倍。因此,带正电荷的分子容易在线粒体中积累。然而,由于线粒体具有四层结构(外膜、膜间隙、内膜和基质),许多分子难以进入线粒体。因此,利用亲脂性分子的膜通透性,通过疏水相互作用使这些分子能够穿过线粒体膜。在一些情况下,癌细胞和转化细胞的线粒体跨膜电位明显高于正常细胞。这种生物学差异已被用作开发线粒体靶向化合物的基础,这些化合物可能优先在癌细胞的线粒体中积累。另一种针对癌细胞线粒体而非正常细胞线粒体的方法是,癌细胞通过有氧糖酵解产生高活性氧(ROS)和三磷酸腺苷(ATP)的能力,这与正常细胞通过克雷布斯循环产生这些物质的能力相比要强得多。因此,线粒体容易出现功能障碍和线粒体 DNA 突变。癌细胞中的有氧糖酵解被称为瓦伯格效应。此外,许多抗癌药物(阿霉素、顺铂、紫杉醇、白藜芦醇和卟啉衍生物)已知会在线粒体膜和基质中被激活,并且会被线粒体核酸酶激活。如果我们能够增强抗癌药物在线粒体中的积累,治疗效果可能会得到改善,而且药物耐药性问题或许也能得到解决。另一方面,靶向线粒体的抗癌药物被称为“线粒体靶向抗癌剂”,它们会选择性地在线粒体中积累,并破坏线粒体膜,从而导致活性氧生成和细胞凋亡。
线粒体药物递送的两种著名方法是:将靶向配体直接与药物连接以及将靶向配体连接到纳米载体上。在这篇综述中,我们讨论了这些方法以及近期取得的成果。在将靶向配体直接与药物连接的情况下,有许多方面需要考虑,包括连接类型和靶向配体的类型。目前有许多线粒体靶向共轭物,其中大多数是基于三苯基膦(TPP)的共轭物,因为 TPP 具有很强的线粒体靶向能力。在过去的三十年里,纳米技术在医学领域引起了极大的关注,一些纳米颗粒已被研究用于线粒体靶向。用于线粒体靶向的首批纳米材料是二奎宁(DQA)胶束(DQAsomes),它们在水溶液中表现出类似脂质体的自组装特性。随后,包括聚合物纳米粒子、金属纳米粒子和脂质体在内的其他纳米材料被制备成线粒体药物递送载体。
直接将药物与靶向线粒体的配体进行偶联,操作简单且易于控制,药物能够轻易到达线粒体;然而,这种偶联过程可能会降低药物的治疗效果和溶解性。对于纳米载体系统而言,由于物理相互作用和溶解性问题得以解决,所以无需担心治疗效果的损失,但由于制备纳米载体时使用了多种不同的成分,优化工作一直是个挑战,而且由于纳米载体的特性,药物向线粒体的递送也可能被延迟。
线粒体靶向配体 - 抗癌药物偶联物
将治疗剂直接连接到分子上以增强其物理化学和生物制药效率,从而形成前药。在大多数情况下,前药在被代谢之前是无活性的。最成功的例子是抗体药物偶联物,它们在到达靶点后可通过酶切激活。要成功制备前药,选择连接方式起着重要作用。通常,连接方式(键)是刺激响应型的,例如对酶、pH 值、温度或辐射有响应。用于前药形成的常见键有酰胺键,这是生物体内蛋白质和肽形成的主键,可被蛋白酶水解;腙键,在酸性条件下可降解;酯键,在水溶液中易水解;二硫键,可被谷胱甘肽裂解;以及醚键,在强酸或强碱条件下可降解。
相比之下,线粒体靶向配体-抗癌药物偶联物在裂解前后都可能具有活性。因此,这种键不像前药那样重要,但仍应予以考虑。已报道了多种直接偶联物,用于利用各种靶向基团将抗癌药物递送至线粒体,包括肽(线粒体穿透肽(MPP)、线粒体靶向序列(MTS)肽和 SS 肽)和亲脂性阳离子(TPP、罗丹明 123 和 DQA),并采用各种连接方式。用于线粒体递送的最常见抗癌药物是阿霉素(Dox)、5-氟尿嘧啶(5-FU)、紫杉醇、顺铂、苯丁酸氮芥、卟啉衍生物和香豆素,因为这些药物可在线粒体中被激活并发挥治疗作用。简而言之,阿霉素是一种抗癌药物,它能嵌入 DNA 并抑制拓扑异构酶 II 的进展,从而导致细胞死亡。此外,阿霉素衍生物已知可通过破坏线粒体的主要功能与线粒体相互作用,损害膜结合蛋白和酶。顺铂可与核 DNA 结合并诱导 DNA 交联,一些研究证实它也能与线粒体 DNA 相互作用。紫杉醇衍生物已知可使微管解聚,还有一些研究表明它们可通过激活线粒体膜蛋白诱导细胞色素 c 释放。苯达莫司汀是一种 DNA 甲基化剂,可对核 DNA 和线粒体 DNA 进行甲基化。许多卟啉衍生物在存在辐射的情况下已被证实可诱导线粒体功能。在此,我们比较了通过不同连接方式从多种靶向配体获得的各种缀合物,以及连接体和靶向部分对其活性的影响。我们在表 1 中总结了线粒体靶向药物缀合物的一些特定性质。
肽-抗肿瘤药物偶联物
由于在生理学中的生物相容性,肽是医学应用中的理想分子。作为靶向配体,已开发出许多肽,其中最广泛使用的是细胞穿透肽(5 - 30 个氨基酸),例如 TAT(转录激活因子,GRKKRRQRRRPQ)。大多数肽带正电荷,这有助于细胞膜穿透,并且序列较短。为了实现线粒体靶向,基于细胞穿透肽序列制备了一些肽,并已成功应用。线粒体靶向肽(线粒体穿透肽、线粒体靶向序列、SS 肽及其他肽)与各种抗肿瘤药物偶联,以提高其治疗效果。
线粒体穿透肽(MPP)-药物偶联物
凯利的研究小组基于如 TAT 等细胞穿透肽开发了一系列用于线粒体靶向的短肽。她的团队在精氨酸分子之间引入疏水性环己基单体以提高其亲脂性,并进一步探究了短肽序列的线粒体靶向能力。这些肽被连接到几种抗癌药物上,以评估它们是否能提高线粒体靶向性并增强治疗效果。Chamberlain 等人假设这种方法能够预防耐药性,这是当前许多癌症化疗面临的最关键问题。
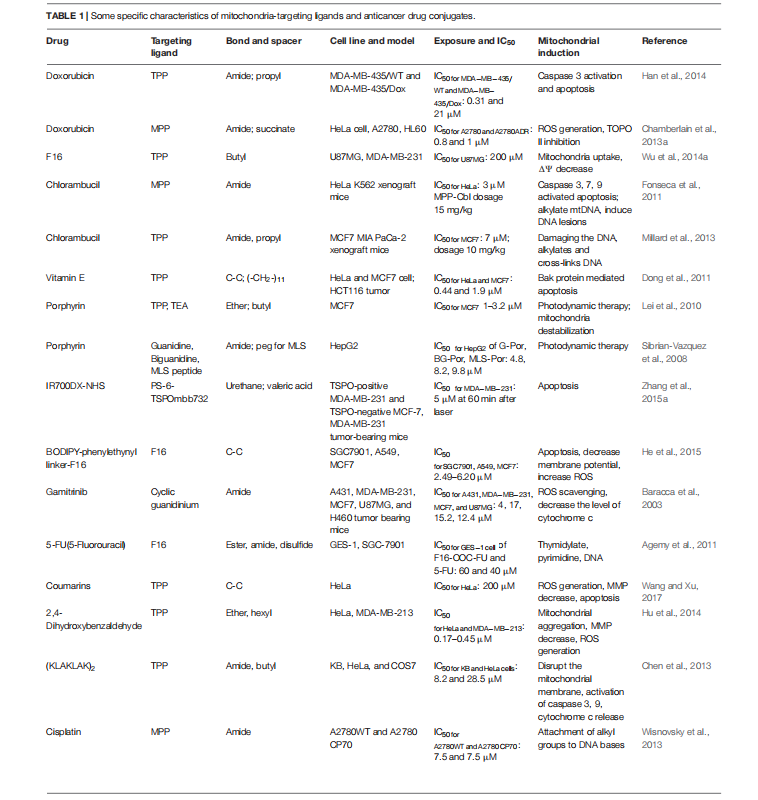
在几种短肽中,(L-环己基丙氨酸-D-精氨酸)3(Fx,r)3 已知具有良好的线粒体靶向特性。因此,该肽已被连接到阿霉素、顺铂和苯达莫司汀上,以探究其在耐药细胞中的活性。肽-阿霉素共轭物(mtDox)是通过阿霉素的游离胺基与短肽的羧基端之间形成的酰胺键制备而成。众所周知,阿霉素在耐药细胞中会被 P-糖蛋白(Pgp)转运蛋白泵出,而且阿霉素还会因溶酶体 Pgp 活性而积聚在溶酶体中。然而,与游离阿霉素相比,mtDox 在线粒体中的积累量更高(图 1)。在药物敏感和耐药细胞中都进行了进一步的研究。尽管在药物敏感细胞中,mtDox 的细胞杀伤作用不如游离阿霉素,但在耐药细胞中却表现出很强的活性(图 1B)。这种行为的原因在于,即使作为底物,mtDox(1)也不会被 P-糖蛋白(Pgp)转运蛋白泵出,这是由于 Dox 的游离胺基团被阻断,而该胺基团是 Pgp 转运蛋白结合所需的活性部分;(2)mtDox 对线粒体定位具有选择性。这些作者声称,mtDox 会嵌入到线粒体 DNA 中,而且已知 Dox 通过抑制 DNA 拓扑异构酶 II 蛋白发挥作用并引发细胞凋亡。
相比之下,这种肽 MPP-顺铂偶联物(mtPt)的制备是为了克服癌细胞对顺铂的耐药性,因为顺铂是一种广泛使用的抗癌药物,已知对多种癌症具有耐药性。mtPt 在敏感细胞和耐药细胞(A2780 野生型(WT)和顺铂耐药的 A2780 CP70 细胞系)中的活性非常相似。亚细胞摄取研究表明,mtPt 优先定位于线粒体,进一步的研究表明,mtPt 产生的活性氧(ROS)水平约为其游离形式的两倍,从而损害线粒体 DNA 并诱导细胞凋亡。此外,通过将短肽与苯丁酸氮芥偶联以提高苯丁酸氮芥的治疗效果,还获得了 MPP-苯丁酸氮芥(mtCbl)偶联物,并证实由于肽序列中的环己基丙氨酸和正电荷,其定位于线粒体。初步结果表明该结合物能够诱导细胞凋亡,但后续研究证实,由于烷基化活性,mtCbl 导致细胞坏死性死亡,这一点通过激活的半胱天冬酶 3/7 以及蛋白酶活性的增加得到了证实。在这些结合物中,效力最强的是 mtCbl,其次是 mtDox 和 mtPt,与它们各自的对照相比。
线粒体靶向序列(MTS)肽-药物偶联物
线粒体靶向序列肽由 20 至 40 个氨基酸组成,可被线粒体表面的受体识别。线粒体外膜和内膜上的多种转位酶介导含 MTS 肽的导入和线粒体内部分配,这一过程由 ATP 或线粒体跨膜电位驱动。多种 MTS 已成功用于不同化学性质货物的线粒体递送,包括蛋白质、具有催化活性的酶和核酸。这种方法的主要缺点与 MTS 的大分子量、溶解性和固有的膜通透性差有关。Lin 等人(2015)将 MTS 肽(MLRAALSTARRGPRLSRLL),一种来自线粒体定向蛋白醛脱氢酶(ALDH)的著名天然前序列,与具有细胞内化能力的细胞穿透肽(R8)偶联,以增强细胞穿透能力。在该结合物中引入了三个组氨酸,以在内体或溶酶体中咪唑环质子化时提供缓冲作用,从而诱导内体/溶酶体膜破裂,使被包裹的结合物有效释放到细胞质中。疏水性卟啉分子还与 MLS 肽(MSVLTPLLLRGLTGSARRLPVPRAKIHSL,从人细胞色素 c 氧化酶的 VII 亚基中分离得到)相连接,该肽在短聚乙二醇(PEG)间隔基存在的情况下,被编码在商业上可获得的表达载体(pShooter)中,该载体可将重组蛋白靶向哺乳动物细胞的线粒体。它显示出高水平的细胞摄取,但线粒体摄取水平较低。高细胞摄取可能与结合物在水介质中的聚集倾向降低有关,这是由于分子间和分子内相互作用减少所致。由于卟啉外围取代基在细胞摄取和亚细胞分布机制中的重要作用,该结合物在溶酶体中的定位少于在线粒体中的定位。此外,由于该共轭物广泛定位于溶酶体,可能表现出较差的内体逃逸能力,从而导致线粒体积累量较低。
分散的亲脂性阳离子(DLC)-抗肿瘤药物偶联物
分散的亲脂性阳离子是同时具有亲脂性和正电荷的分子。因此,它们能够通过扩散轻易穿过磷脂膜、质膜和线粒体外膜。分散的正电荷使这些分子能够通过蛋白质梯度过程进入带强负电荷且具有强负膜电位(-180 毫伏)的线粒体基质。几种 DLC 被用作线粒体靶向配体,例如 TPP、罗丹明 123、DQA、胍和 F16。这些线粒体靶向配体可通过共价键(如酰胺键、二硫键、酯键、醚键和肼键)与各种抗肿瘤药物连接(表 1)。我们在下面的示例中更详细地讨论了这些偶联物及其具体结果。
三苯基膦(TPP)-药物偶联物
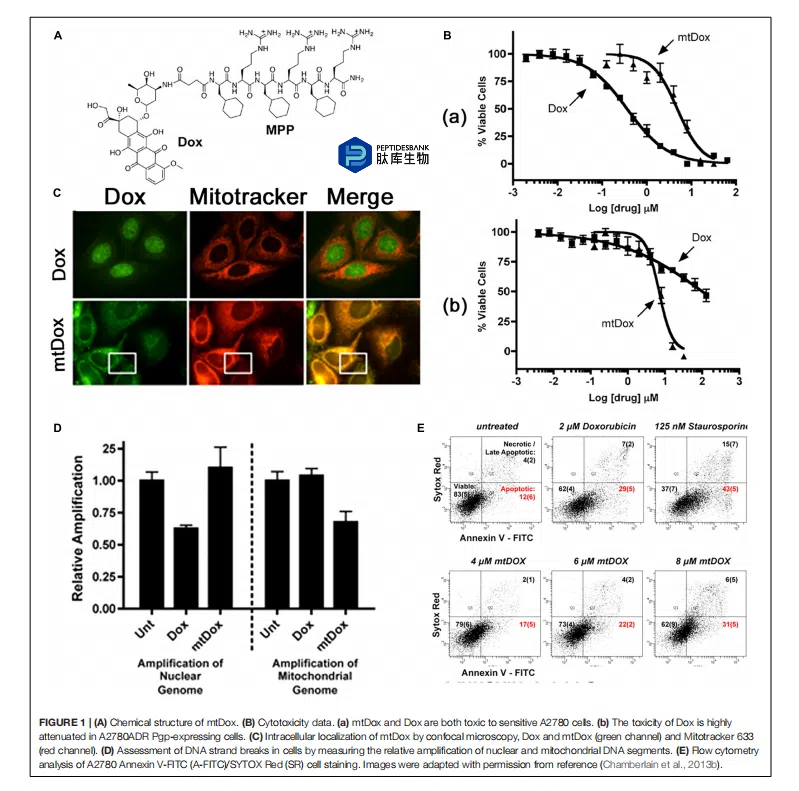
最常见的药物脂质偶联物(DLC)实例是三苯基膦(TPP),它是一个带正电荷的磷原子,周围有三个亲脂性苯基,这增加了其结合能力。TPP 基团作为探针用于探索线粒体膜电位已有 40 多年。因此,其行为以及与线粒体的相互作用已得到明确界定。对于每 60 毫伏的负膜电位,带负电荷的膜室内的相对 TPP 浓度会增加一个数量级。由于膜结合泵对盐离子的主动运输,细胞质膜的内侧与外侧相比带负电荷。因此,质膜电位通常在 -30 至 -60 毫伏之间,足以使细胞内 TPP 的积累增加多达 10 倍。许多 TPP 抗癌药物偶联物,包括 TPP-阿霉素、TPP-苯丁酸氮芥、TPP-F16、TPP-维生素 E、TPP-治疗性肽、TPP-卟啉光敏剂以及 TPP-香豆素,已被报道,并在最近的一篇综述中有所描述。在此,我们简要讨论并比较一些具体的例子。Han 等人(2014 年)通过 TPP 部分的羧基与阿霉素的胺基之间的反应合成了 TPP-阿霉素(TPP-Dox),旨在将药物递送至线粒体,以克服耐药性(图 2A)。细胞摄取研究表明,TPP-Dox 偶联物在 MDA-MB-435/WT 细胞中的摄取量低于游离阿霉素,表明 TPP 部分影响了细胞膜转运。相反,在 MDA-MB-435/Dox 细胞中,TPP-Dox 的细胞摄取量远高于游离阿霉素,这支持了 TPP-Dox 可能通过 P-糖蛋白和其他在耐药细胞系中过表达的泵进行旁路转运的可能性。共聚焦显微镜下的亚细胞定位研究表明,在药物敏感细胞中,游离的阿霉素主要存在于细胞核内(图 2B),而在耐药细胞中则未在细胞核内发现。相反,在两种细胞系中,TPP-阿霉素共轭物均未定位于细胞核,而是在线粒体中大量聚集(图 2B)。进一步的时间依赖性细胞毒性研究显示,在耐药细胞中,经过 48 小时和 72 小时的孵育,TPP-阿霉素的 IC50 值比游离阿霉素低约四倍(图 2C)。这些结果表明,TPP-阿霉素共轭物能够克服耐药性,但由于其溶解度低,难以在体内应用。类似的研究已使用阿霉素硝基氧或3-phenylsulfonylfuroxan conjugates在人结肠癌细胞系中进行过报道。
另一个例子是维生素 E(VE)类似物与 TPP 分子的结合物。已知 VE 类似物通过影响线粒体复合物 II 诱导细胞凋亡,在复合物 II 将琥珀酸转化为延胡索酸的过程中,它们会影响作为天然电子受体的泛醌(UbQ)的琥珀酸脱氢酶活性。作为抗癌剂,VE 类似物α-生育酚琥珀酸酯(α-TOS)、维生素 E 琥珀酸酯(VES)和 VE 与 TPP 部分结合。在这些结合物中,MitoVES(在生育酚琥珀酸酯和 TPP 部分之间具有 11 碳连接体)与其它结合物及其对应物相比,在各种癌细胞系中强烈诱导细胞凋亡(超过 90%)。VES4TPP 凋亡活性降低是由于其游离羧基被阻断,而该羧基对于化合物的凋亡活性至关重要。此外,MitoVES 不会诱导非恶性细胞凋亡。在各种癌细胞系中,MitoVES 的 IC50 值比非靶向对照低 10 至 30 倍,而在非恶性细胞中,MitoVES 的 IC50 值则远高于恶性细胞。此外,流式细胞术分析表明,MitoVES 会生成活性氧(ROS)。通过共聚焦显微镜证实,由于正电荷的 TPP 基团对线粒体内膜(MIM)基质面高负电位的亲和力,MitoVES 在线粒体中的定位更显著。已知 MitoVES 可诱导线粒体依赖性细胞凋亡,这涉及 bcl-2 家族蛋白的转录调节。此外,一项抗肿瘤研究显示,在荷瘤小鼠中,MitoVES 对肿瘤生长的抑制作用远大于α-生育酚琥珀酸酯(α-TOS)。
此外,米尔勒等人(2013 年)将一种 TPP-苯丁酸氮芥偶联物与其他类似的阳离子部分连接的苯丁酸氮芥偶联物进行了比较,以评估其增强的治疗活性。如前所述,苯丁酸氮芥是一种破坏 DNA 的抗癌药物。作者合成了三种不同的偶联物,即 TPP-、三丁基磷(TBP)- 和三环己基磷(TCP)-苯丁酸氮芥,以及一个阴性对照物 TPP-二羟基苯丁酸氮芥,并在 MCF7 癌细胞系中筛选了细胞毒性。游离苯丁酸氮芥、TPP-苯丁酸氮芥、TBP-苯丁酸氮芥、TCP-苯丁酸氮芥和阴性对照物的 IC50 值分别为 100、7、35、40 和 80 μM。这一结果表明,芳环的存在比饱和烃的存在具有更高的效力。此外,还对游离苯丁酸氮芥和 TPP-苯丁酸氮芥在另外 10 种癌细胞系中进行了细胞毒性研究,在所有情况下,偶联物的效力都更高,敏感性比值在 7.7 至 79.9 之间。接下来,他们发现该共轭物在细胞线粒体中大量聚集,并导致线粒体 DNA 损伤,从而引发氮芥诱导的细胞死亡。体内抗肿瘤实验表明,与游离形式相比,TPP-环磷酰胺共轭物具有更强的肿瘤抑制效率,但并不能完全抑制肿瘤生长。
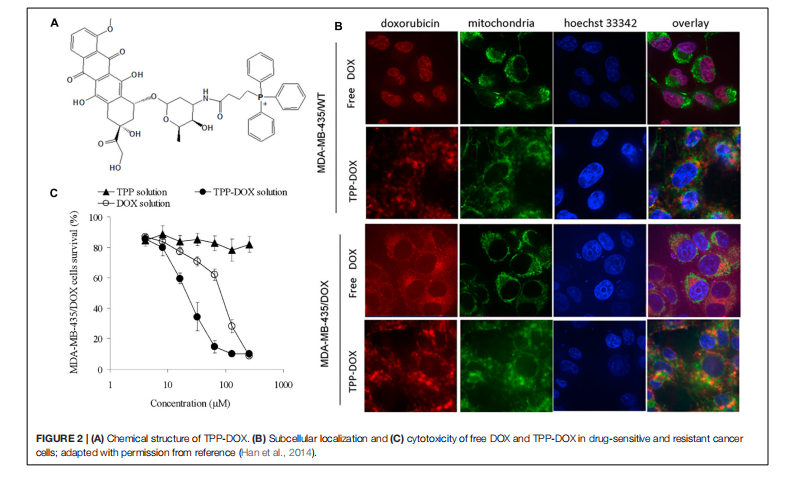
陈等人(2013 年)开发了一种双靶向促凋亡肽(KLAKLAK)2,用于递送至线粒体并增强该肽的活性。通过酰胺键将 TPP 连接到肽上,叶酸则与细胞膜靶向配体相连,通过受体介导的内吞作用增强细胞对肽的摄取(图 3A)。已知促凋亡肽会破坏线粒体膜,并诱导线粒体依赖性细胞凋亡,且在细胞外无毒性。为避免被蛋白酶降解,采用 D-氨基酸进行合成。该缀合物(IC50 8.2 μM)在 KB 和 HeLa 细胞中的细胞毒性比单独的叶酸-KLA 肽缀合物(IC50 28.5 μM)强得多(图 3B),表明 TPP 靶向有助于细胞毒性。进一步的研究表明,该缀合物能够激活癌细胞中的细胞色素 c 和 caspase 3/9 蛋白,导致细胞凋亡(图 3C)。此外,细胞的 TEM 图像证实,在缀合物处理后线粒体遭到破坏(图 3D)。
F16 ((E)-4-(1H-indol-3-ylvinyl)-N-methylpyridinium iodide)-药物偶联物
F16 是一种离域阳离子,会在线粒体基质中积累。最初,Xiang 等人制备了 F16-5-FU 直接偶联物,但其降低了 5-FU 的疗效。因此,他们决定使用其他易断裂的连接键,包括酯键、酰胺键和二硫键。在这些偶联物中,F16-OOC-FU 在 SGC-790(人胃癌)细胞系中表现出最强的毒性。他们研究了这种毒性是否与细胞摄取有关。结果表明,F16-OOC-FU 和 F16-SS-FU 能够迅速被细胞内化,而 F16-5FU 和 F16-NHOC-FU 则内化效果不佳,这可能是由于亲脂性所致。F16-OOC-FU 增强的细胞摄取导致了更强的细胞毒性,但 F16-SS-FU 由于细胞质中谷胱甘肽含量不足,对细胞毒性没有影响。此外,通过苯乙炔基连接子将线粒体靶向基团 F16 引入到硼二吡咯亚甲基(BODIPY)中,合成了具有治疗和成像特性的双功能线粒体靶向抗癌药物偶联物[F16-苯乙炔基-BODIPY 偶联物(FPB)]。当将 FPB 应用于癌细胞和正常细胞时,其在癌细胞(例如 SGC-7901)中的内化程度高于正常细胞(例如 GES-1)。
罗丹明-药物偶联物
罗丹明衍生物也是线粒体靶向剂,因其与线粒体膜的结合亲和力,随后会损害电子传递链。从机制上讲,它们在线粒体中的积累是由其亲脂性和阳离子性引起的,这有助于穿过双层线粒体膜并留在带负电荷的线粒体基质中。与罗丹明123类似,罗丹明 19 是一种潜在的线粒体靶向基团。利用罗丹明,已有几份报告描述了抗氧化剂向线粒体的靶向,但很少有报告涉及抗癌剂。罗丹明 123 本身已通过偶联或不偶联另一种分子的方式用于癌症治疗的研究。尽管在前列腺癌治疗的临床研究中进行了测试,但剂量(92 毫克/平方米)无法耐受,因此效率不足。
胍基-药物偶联物
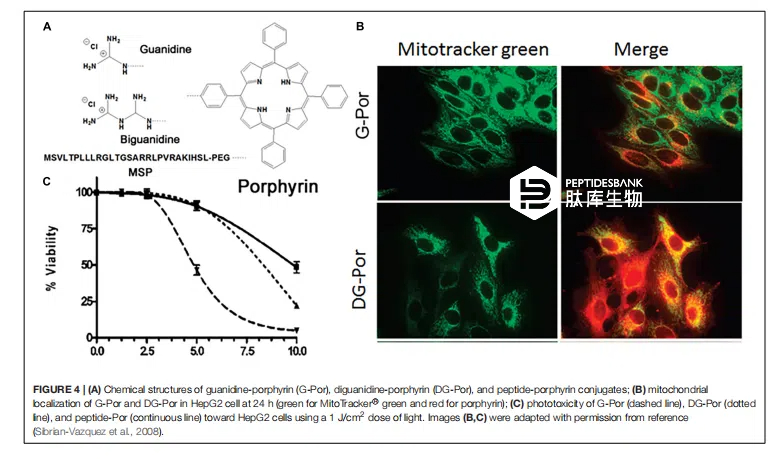
胍基和双胍基带有离域正电荷,它们与疏水性卟啉分子(一种光敏剂(PS)和光毒性剂)偶联,以通过线粒体内膜的高膜电位来提高线粒体积累,从而用于癌症治疗(图 4A)。细胞摄取和亚细胞定位研究表明,与主要定位于细胞膜、溶酶体和线粒体的双胍基-卟啉(BG-Por)相比,胍基-卟啉(G-Por)更容易被细胞摄取,并在细胞内积累于线粒体和内质网,这与它们的结构以及与细胞膜上带负电荷基团相互作用的能力有关(图 4B)。G-Por 偶联物的光毒性比BG-Por偶联物高 1.8 倍,这可能与细胞摄取和定位的差异有关(图 4C)。此外,胍基是平面结构,可作为双齿配体,但双胍基分子由于需要减少烯丙基张力而非平面结构。G-Por 和 BG-Por 的部分线粒体定位可能使胍基和双胍基团得以结合,这些基团在通过膜破裂实现共轭物从溶酶体/内体逃逸的过程中发挥着重要作用,可能是通过质子海绵效应实现的,从而使得 PS 能够分布到其他细胞器。Kang 等人(2009 年)将 Hsp90ATP 酶抑制剂 Gamitrinib 与四种环状胍基共轭于人类线粒体。将环状胍基的单体、二聚体、三聚体和四聚体引入 Gamitrinib 中,合成了 Gamitrinib-G1、Gamitrinib-G2、Gamitrinib-G3 和 Gamitrinib-G4。其中,Gamitrinib-G4 和 Gamitrinib-G3 与 Gamitrinib-G1 和 Gamitrinib-G2 相比,线粒体积累增加,抗癌效力提高 6 至 10 倍,这是由于它们具有不同的膜去极化活性。
线粒体靶向纳米载体
尽管直接偶联在实现线粒体靶向方面显示出有希望的结果,但由于生物相容性差,治疗剂的溶解性和临床应用方面仍存在一些挑战。因此,使用纳米载体可以增强治疗剂的潜力。近三十年来,纳米技术在医学领域引起了广泛关注,这得益于其大的比表面积、易于功能化、载药量大以及生物相容性好等特点。相比之下,诸如癌症之类的疾病允许纳米颗粒在目标区域选择性聚集。迄今为止,在医学领域,特别是在药物递送领域,已经开发出了多种纳米载体系统,包括聚合物纳米颗粒、脂质体、胶束、金属纳米颗粒、碳纳米颗粒和树枝状大分子。纳米载体系统必须具备一些理想特性,例如 10 - 200 纳米的平均尺寸以利用 EPR 效应、中性表面电荷、高生物相容性和低毒性。对于线粒体靶向而言,纳米载体的尺寸应尽可能小。在大多数情况下,纳米粒子会附着靶向配体以将其递送至线粒体,但在少数情况下,由于其自身特性,纳米粒子本身就可以作为线粒体的靶向剂。载药纳米粒子的一些物理和生物特性总结在表 2 中。
聚合物纳米粒子和胶束
聚合物纳米粒子通常由可生物降解的两亲性聚合物制备而成。聚合物纳米粒子的优势在于生物相容性好、尺寸小、载药量高、水溶性好、毒性低以及易于修饰。用于线粒体靶向药物递送的一些聚合物纳米粒子的例子包括聚乙二醇、聚己内酯(PCL)、多糖(例如壳聚糖、透明质酸和葡聚糖)、聚[(2-羟丙基)甲基丙烯酸](pHPMA)、聚乳酸-羟基乙酸共聚物以及由小两亲性分子形成的胶束。
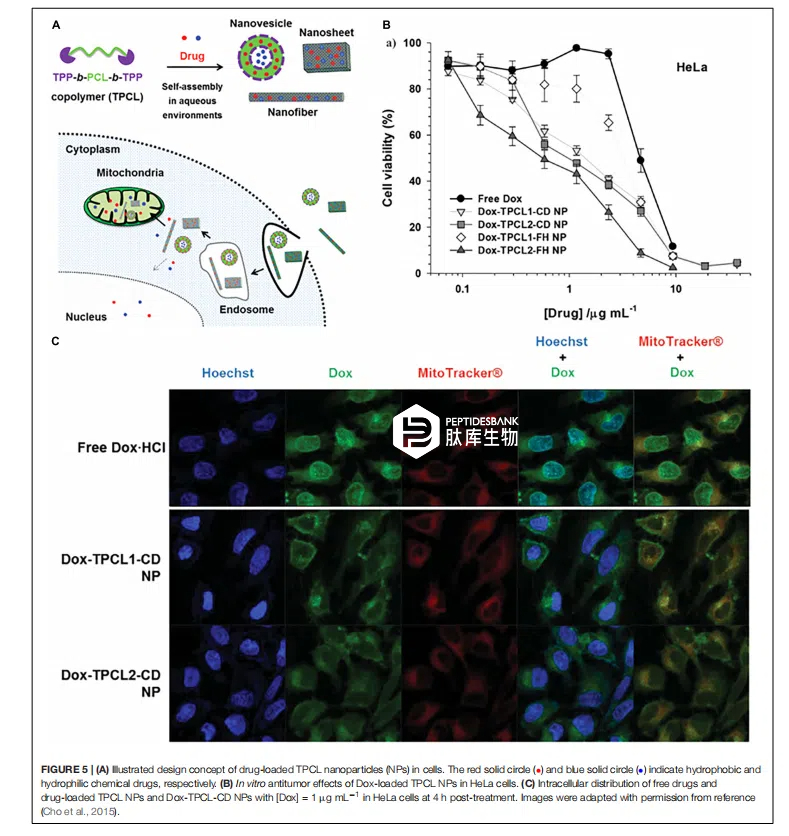
将线粒体靶向配体连接到聚合物纳米颗粒上以将治疗分子递送至其活性部位的方法已被广泛研究。使用聚合物纳米颗粒进行线粒体靶向的概念在于降低治疗分子的毒性并提高药物的生物相容性。聚合物纳米颗粒具有生物相容性,且由于其高负载能力,能够同时将大量货物材料递送至靶点。已有多种聚合物纳米颗粒被应用于线粒体靶向,例如低分子量的聚己内酯(PCL)、壳聚糖、树枝状大分子、脂质体、金纳米颗粒和氧化石墨烯。我们团队开发了多种 TPP 共轭的 PCL 纳米颗粒,并在癌细胞系中证明了它们的线粒体靶向能力。我们在低分子量 PCL 聚合物(0.5、1.25 和 2 千道尔顿)的两端连接了 TPP 基团。这些聚合物在有或无疏水性抗癌药物的水性环境中自组装(图 5A)。这些纳米颗粒的平均直径约为 100 纳米,这是药物载体的理想尺寸。如图 5B、C 所示,与游离的阿霉素相比,载有阿霉素的聚己内酯纳米颗粒更倾向于在 HeLa 细胞的线粒体中聚集,导致其细胞毒性比游离阿霉素高 3 至 5 倍。此外,聚己内酯聚合物纳米颗粒能够将疏水性和亲水性的阿霉素(阿霉素盐酸盐)都递送至线粒体。由于其带正电荷,观察到了与 TPP 相关的细胞毒性。这些结果支持了聚合物载体系统在靶向线粒体药物递送方法中的潜力。
刘等人(2017 年)描述了用于线粒体靶向癌症治疗的载有多柔比星(Dox)的 TPP-氯尼达明自组装纳米颗粒。他们还在纳米颗粒上连接了聚乙二醇(PEG)以增强其在血液中的稳定性。这些纳米颗粒的大小约为 110 纳米,表面电荷呈中性。据作者称,与多柔比星相比,纳米颗粒的细胞摄取速度较慢,但它们更倾向于在细胞线粒体中定位。此外,与包括游离多柔比星在内的其他对照组相比,纳米颗粒在药物敏感和耐药癌细胞中表现出更强的细胞毒性。结果证实,纳米颗粒能产生高水平的活性氧(ROS),降低线粒体膜电位,并激活诱导细胞凋亡的半胱天冬酶 9 和半胱天冬酶 3 蛋白。此外,纳米颗粒在血液中的半衰期比游离多柔比星长 12 倍,并且抑制肿瘤生长的效果比其他组高出 2 至 4.5 倍。有趣的是,作者声称在纳米颗粒上引入聚乙二醇并未影响其细胞摄取和抗癌效果。
谭等人(2018 年)制备了一种负载雷公藤红素(Cela)的 TPP 连接的壳聚糖硬脂酸共轭物(TPP-CSOSA),雷公藤红素是一种弱酸性抗癌药物,用于以 pH 值依赖的方式向线粒体递送药物。TPP-CSOSA 胶束的大小为 86 纳米,负载雷公藤红素后其大小减小至 63 纳米。他们使用了一种弱酸性药物,这种药物在诸如线粒体基质(pH 值 8)这样的碱性 pH 值环境中容易解离。共聚焦数据显示,荧光素标记的 TPP-CSOSA 以时间依赖的方式定位于线粒体。通过透射电子显微镜成像分析纳米颗粒的细胞内定位,并证实其存在于线粒体中。进一步的研究证实,纳米颗粒在癌细胞中的细胞毒性比对照组更强,并产生 3.2 倍更高的活性氧,这导致膜电位降低和去极化。体内研究表明,TPP-CSOSA/Cela 纳米颗粒在肿瘤组织中大量积聚,并具有肿瘤抑制效果。TPP 与纳米颗粒的结合增强了细胞摄取和肿瘤蓄积,弱酸性药物 Cela 的使用导致在较高 pH 值时快速释放,从而提高了药理作用。刘等人(2018 年)利用腙键合制备了透明质酸-多柔比星-TPP 共轭物,以特异性地将 TPP-多柔比星递送至线粒体。该共轭物形成大小为 192 纳米且表面带负电荷的纳米颗粒。细胞摄取研究表明,在 MCF/ADR 细胞中,纳米颗粒在线粒体中的蓄积量更大,进一步的细胞毒性和抗肿瘤研究证实,与游离多柔比星和 TPP - 多柔比星共轭物相比,其疗效得到了增强。比尔斯基等人描述了一种具有不同数量 TPP 的 TPP - 聚(酰胺胺)树状大分子,表现出不同的线粒体靶向行为。TPP 部分通过直接酰胺键或使用 PEG 间隔基连接到树状大分子上。与非靶向树状大分子相比,直接共轭和使用 PEG 间隔基共轭均增强了线粒体靶向行为。在直接共轭的情况下,线粒体靶向与树状大分子中 TPP 的密度之间存在直接关联,而在 TPP-PEG 树状大分子中,线粒体靶向不受影响。另一个使用 PEG 使纳米颗粒靶向线粒体的例子是,在 TPCL 存在的情况下将叶绿素 a(PheoA)递送至线粒体。数据表明,纳米颗粒将 PheoA 递送至线粒体,但未实现游离 PheoA 的细胞杀伤效果。
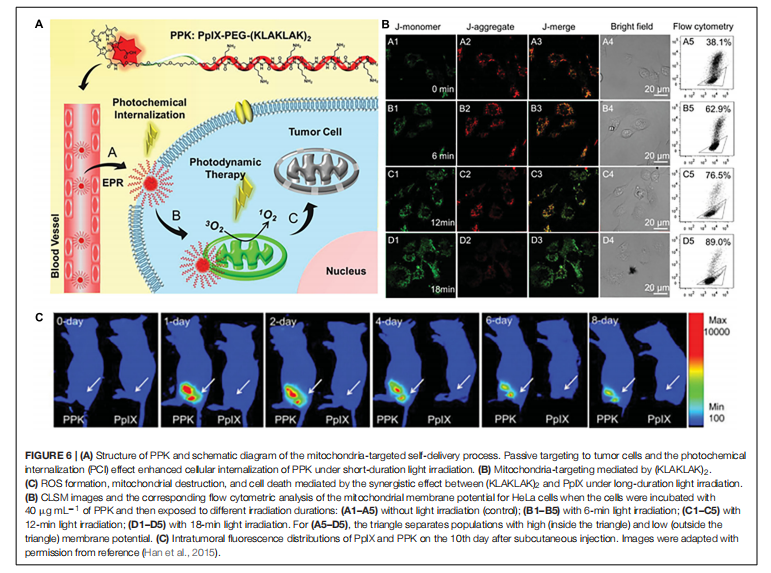
韩等人(2015 年)将临床可用的光敏剂卟啉(PpIX)与聚乙二醇化促凋亡肽(KLAKLAK)2 相连接,从而获得了一种线粒体靶向光动力剂(图 6A)。该缀合物自组装形成大小为 91 纳米的纳米胶束。发现该胶束可降低线粒体膜电位(图 6B),导致细胞色素 c 释放和细胞凋亡。动物研究表明,胶束在肿瘤区域积聚达 8 天(图 6C),并强烈抑制肿瘤生长。
DQAsome和脂质体
DQAsomes是早期用于线粒体靶向的纳米载体,由 DQA 在水溶液中自组装形成,这是由于其存在带正电荷的头部基团和烷基链。在 21 世纪初,DQA 球状体被掺入 pDNA、抗氧化剂和抗癌剂,但它们的转染效率低,从内体逃逸的能力减弱,这给其货物的靶向递送带来了困难。此外,与正常成纤维细胞相比,它们在癌细胞中表现出较高的细胞杀伤活性,这是由于线粒体跨膜电位的破坏、ATP 合成的阻断以及活性氧的生成。因此,许多研究都集中在 DQA 脂质体作为载体。Bae 等人(2017 年、2018 年)开发了由 DQA/DOTAP/DOPE 或 DQA80s(80% DQA)组成的 DQA-脂质体,这种脂质体能够将治疗剂递送至线粒体,并表现出抗癌效果。由于使用了 DOPE(一种中性脂质膜破坏脂质),脂质体能够从溶酶体中逃逸。细胞毒性研究显示,DQA80s 在癌细胞中的活性高于 DQAsomes。亚细胞研究显示,DQA80s 在线粒体中的积累程度高于简单的 DQAsomes。随后的透射电子显微镜(TEM)研究证实了 DQA80s 在细胞内的定位。此外,DQA80s 与 pDNA 结合,制备了 DQAplexes。这种脂质体的大小约为 400 纳米,表面带正电荷。
已有报道表明,基于 DQA 的载药脂质体能够特异性地将药物递送至线粒体。盐酸拓扑替康是喜树碱的一种衍生物,也是一种拓扑异构酶 I 抑制剂,已被载入 DQA 和 TPGS 脂质体中。针对线粒体的载拓扑替康 DQA 脂质体在 MCF7 和 MCF7/ADR 细胞中的细胞毒性分别是游离拓扑替康的 2 倍和 4 倍。共定位研究表明,通过流式细胞术检测,脂质体将药物递送至线粒体的水平比游离形式高 21.2 倍,比非靶向脂质体高 12.9 倍。进一步的研究证实,脂质体在细胞凋亡死亡后能够释放细胞色素 c。体内生物分布研究表明,Cy7 标记的 DQA 脂质体在肿瘤中蓄积,而在 MCF7/ADR 荷瘤小鼠中的进一步抗肿瘤研究表明,与其它组相比,DQA 脂质体能显著抑制肿瘤生长。
无机纳米粒子载体
由于具有生物相容性、适宜的尺寸、较大的表面积、易于功能化以及特定的物理性质,诸如氧化石墨烯(GO)、金纳米粒子、二氧化硅纳米粒子、量子点和碳纳米球等众多纳米粒子已被用于药物递送、成像和治疗目的。最近开发的一些针对线粒体的纳米粒子包括 GO、脂质包被的碳量子点、碳硅纳米粒子、多金属氧酸盐和金纳米粒子,以将治疗剂递送至线粒体并克服耐药性。纳米粒子已知能够成功地将抗癌药物递送至线粒体,无论是否带有靶向配体。纳米粒子的一些特定特性见表 2。
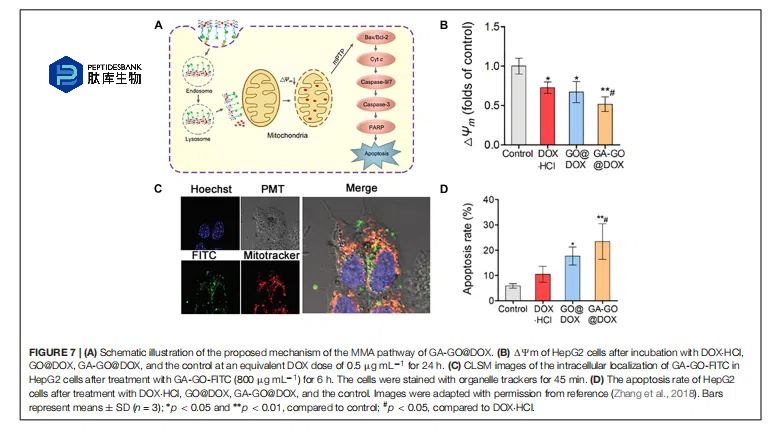
张等人(2018 年)描述了以甘草次酸(GA)修饰的氧化石墨烯(GO)负载阿霉素(Dox)作为针对线粒体的癌症治疗模型药物(图 7A)。作者选择甘草次酸用于线粒体和细胞膜的双重靶向,是因为其能够与线粒体呼吸链相互作用,并且对蛋白激酶 C(PKC)α 具有亲和力,而 PKCα 在某些癌细胞中过度表达。此外,氧化石墨烯具有较大的比表面积、高稳定性、多功能性以及适合药物递送的理想尺寸。通过阻断甘草次酸发现细胞摄取依赖于 PKC。此外,纳米颗粒被证实能够降低膜电位并激活半胱氨酸天冬氨酸蛋白酶 3 和 9,从而导致细胞凋亡(图 7B)。结果表明,在 HepG2 细胞中,负载阿霉素的 GA-GO 的细胞毒性是游离阿霉素的两倍,这通过细胞和线粒体的大量摄取得到了证实(图 7C)。作者发现,由于 GA 的靶向亲和力,纳米颗粒在肿瘤组织和肝脏中大量聚集,从而导致细胞凋亡介导的死亡(图 7D)。另一个例子是 GO 光敏剂复合物,已被用于线粒体靶向癌症治疗。作者声称,与游离 PS 相比,纳米颗粒更倾向于在细胞线粒体中聚集,这是由于极化 GO 与线粒体膜之间强烈的电子相互作用以及通过简单穿越脂质膜实现的内体逃逸特性。进一步的研究表明,GO-PS 具有更强的光毒性,并诱导细胞凋亡性死亡。
张等人(2017 年)制备了靶向线粒体的载阿霉素碳量子点(CQD)纳米颗粒,以克服耐药性。纳米颗粒中加入了 Pgp 抑制剂 D-α-生育酚聚乙二醇琥珀酸酯(TPGS),以抑制耐药癌细胞中 Pgp 的表达。由于碳量子点具有强而稳定的荧光和低毒性,因此被用作生物成像、生物标记和生物传感的荧光探针。TPGS 与 TPP 共轭并覆盖在碳量子点上。细胞毒性结果表明,载阿霉素的 CQD 纳米颗粒在耐药 MCF7 细胞中的 IC50 值比游离阿霉素低五倍。进一步的细胞内研究显示,纳米颗粒在耐药细胞中优先定位于线粒体。机制研究目前尚未完成。
此外,张等人(2015 年 b)开发了肽 - 多金属氧酸盐(POM)纳米粒子作为线粒体靶向抗癌剂。POM 纳米粒子具有光致发光特性,但其快速猝灭效应不允许细胞成像。作为线粒体靶向剂,选择带正电荷的短肽 Dmt-D-Arg-Phe-Lys-NH2 是由于其对线粒体的选择性靶向。通过共聚焦和透射电子显微镜成像证明了纳米粒子的线粒体优先定位。作者声称,这些纳米粒子可以通过帕金(帕金森青少年疾病蛋白 2)介导的过程诱导线粒体自噬。
王等人(2018 年)描述了一种基于丙酮酸的线粒体靶向脂质膜包覆的硅碳(LSC)杂化纳米粒子,以解决耐药性问题。这些纳米粒子可通过近红外(NIR)激光照射产生活性氧(ROS)。在纳米粒子的制备过程中,形成了丙酮醛基团,其结构与丙酮酸非常相似,能够特异性地与线粒体外膜上的单羧酸转运蛋白结合。因此,丙酮醛可以作为这种纳米粒子的线粒体靶向基团。将阿霉素(Dox)封装在这种纳米粒子中,并对其对药物敏感和耐药癌细胞的作用进行了评估。通过共聚焦显微镜和透射电子显微镜成像证明了载有阿霉素的纳米粒子在线粒体中的积累。通过预先用丙酮酸处理,测试了丙酮酸介导的线粒体摄取,随后线粒体摄取降低了 40%至 3%。进一步的细胞毒性研究表明,与游离阿霉素和 LSC 纳米粒子相比,激光照射下的 Dox-LSC 纳米粒子对耐药癌细胞具有更强的杀伤作用。体内生物分布和抗肿瘤研究显示,LSC 纳米颗粒优先在肿瘤组织中积聚,并完全抑制了肿瘤生长。这些结果归因于 LSC 纳米颗粒在近红外光照射下能够靶向线粒体并产生活性氧,将 NADH 氧化以抑制 ATP 的生成,从而降低外排泵的功能并克服耐药性。
线粒体靶向药物偶联物负载的纳米颗粒
在大多数情况下,线粒体靶向配体 - 药物偶联物的水溶性较差,因此难以应用于临床前和临床研究。一种解决方案是使用载体系统将其递送至靶点,例如肿瘤。随后,偶联物可以从纳米载体中释放出来并到达线粒体。包括 TPP - 多西他赛偶联物和 TPP - 光敏剂负载的白蛋白纳米颗粒、紫杉醇、顺铂或 Dox - α - TOS 偶联物负载的脂质纳米颗粒以及 DQA - Dox 负载的 pH 响应性胶束在内的多项研究揭示了对肿瘤区域和线粒体的双重靶向。纳米级材料的定向靶向可能会由于其尺寸而延迟进入线粒体,但小的线粒体靶向分子可以很容易地进入线粒体。因此,纳米载体的作用可能是将小分子递送至肿瘤区域和细胞胞质。
丁基羧基 TPP 通过酯键与多西他赛(DTX)连接,并负载于叶酸靶向白蛋白纳米颗粒中以增强 DTX 的治疗活性。白蛋白与胆固醇锚定基团偶联形成自组装纳米颗粒,其具有较高的载药量且粒径约为 120 纳米。因此,将 TPP-DTX 共轭物负载于胆固醇-白蛋白中,并进行了体外和体内评估。结果表明,该共轭物在细胞线粒体中积累,并诱导了细胞凋亡介导的细胞死亡。相比之下,为了将光敏剂定位在线粒体中,制备了负载有 TPP-光敏剂共轭物的白蛋白纳米颗粒,因为通过激光照射由 PS 产生的 ROS 半衰期较短,必须将其定位在特定的目标部位。如果在远离目标部位的地方产生 ROS,由于损伤不足,治疗将会失败。一些光敏剂已知会在线粒体中积累,但它们也会定位于其他细胞器。因此,有必要选择性地将光敏剂递送至线粒体。TPP-PS 共轭白蛋白纳米颗粒在荷瘤裸鼠体内表现出对线粒体的优先积累、线粒体膜的不稳定、细胞凋亡性死亡以及增强的抗肿瘤功效。
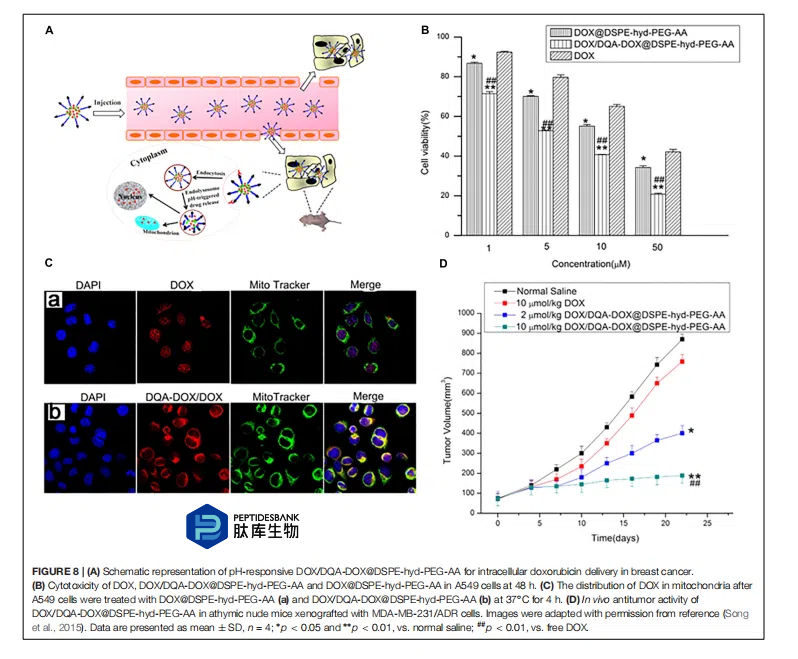
宋等人(2015 年)进一步描述了负载 DQA-Dox 共轭物的 pH 响应型胶束,以实现对癌细胞的耐药性。作者通过酰胺键合合成了 DQA-Dox 共轭物,并通过 DSPE(1,2-二硬脂酰-sn-甘油-3-磷酰乙醇胺)与 PEG 之间的腙键反应合成了 DSPE-hyd-PEG-茴香胺(AA)共轭物,该共轭物在低 pH 值下可裂解,旨在在溶酶体/内体中分解(图 8A)。在 DSPE-hyd-PEG 共轭物上连接 AA 以实现对癌细胞上表达的西格玛受体的主动靶向。将 Dox/DQA-Dox 装载到胶束中,并在耐药癌细胞中进行评估。在 MDA-MB-231/ADR 细胞中的细胞毒性研究表明,装载有 Dox/DQA-Dox 的纳米颗粒具有更高的活性(图 8B)。使用共聚焦显微镜进行的亚细胞定位研究表明,纳米颗粒优先定位于线粒体(图 8C)。此外,抗肿瘤研究表明,在耐药肿瘤模型中,载有 2 和 10 μmol/kg Dox 的纳米颗粒的肿瘤抑制效果分别是 Dox(10 μmol/kg)的 2 倍和 5 倍(图 8D)。马利克等人(2015 年)分别通过单羧酸酯、酰胺或酯键将α-托辛(一种靶向线粒体的药物)与顺铂、阿霉素或紫杉醇直接连接。然后将这些共轭物装载到直径小于 200 纳米的 DSPE-PEG 胶束中。共轭物负载的纳米颗粒显示出比游离药物高得多的细胞杀伤效果,但将共轭物装载到纳米颗粒后其效力有所下降。这些研究表明,共轭物负载的纳米颗粒定位于线粒体并破坏线粒体膜,导致细胞色素 c 释放和细胞凋亡。α-托辛-紫杉醇共轭物破坏了 HeLa 细胞的微管蛋白。
结论
迄今为止,许多研究都对线粒体靶向药物递送进行了探究,尤其是抗癌药物递送。早期的研究主要集中在将线粒体靶向配体与抗癌药物直接连接上。尽管直接连接物能够解决诸如耐药性等问题,但诸如溶解性问题等其他挑战仍然存在,这限制了其在临床前和临床中的应用。在过去十年中,许多研究探索了利用生物材料和无机纳米粒子开发线粒体靶向载体,以解决与药物相关的溶解性和选择性问题。常用的线粒体靶向配体是二氢卟吩(DLCs),特别是三苯基膦(TPP)和二喹啉甲酸(DQA),但这些配体已知存在毒性问题。因此,一些近期的研究描述了用其他分子替代 TPP,包括短肽和阴离子分子。直接连接和纳米载体通常都在耐药性癌细胞中进行测试,因为耐药性是当前化疗的主要限制之一,而且在大多数情况下,连接物和纳米载体在药物敏感细胞和动物模型中提供了更好的结果。未来,针对纳米载体系统的更详尽的临床前和临床研究以及替代靶向剂的开发将成为线粒体靶向药物递送领域的核心。此外,我们注意到用于直接偶联和纳米载体进行线粒体递送的最常用药物是阿霉素。由于还有其他几种线粒体介导的药物,也应对这些药物进行研究。