
摘要:合成肽基生物材料在许多情况下能够模仿其全长内源性对应物的结构和功能。再加上与全长蛋白质相比,短模拟肽更容易生产,表现出更强的可加工性和易修饰性,并且能够在明确定义和受控的条件下制备;很明显,为什么最近人们热衷于从这些分子中开发再生生物材料。越来越多的证据表明,将肽纳入再生支架可以产生结构识别基序,从而增强细胞附着或诱导细胞信号通路,改善细胞浸润或促进各种其他调节性生化反应。通过强调短模拟肽的设计和应用的当前方法,我们希望展示它们在软组织愈合中的潜力,同时提请关注迄今为止取得的进展以及需要克服的问题,以推动这些材料在临床上应用于心脏、皮肤和角膜修复。
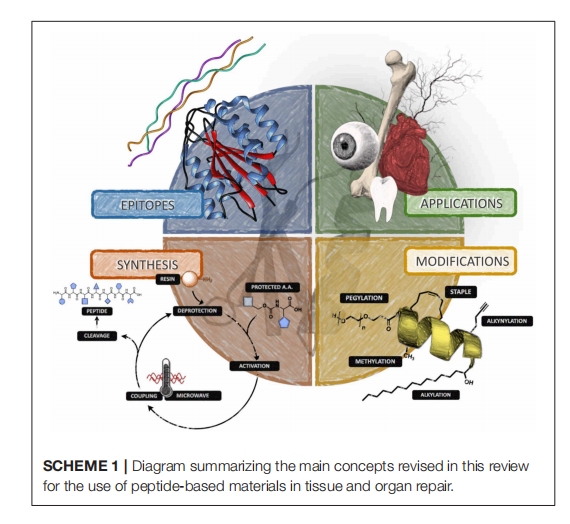
虽然设计选项几乎是无限的,但这些模拟物通常通过呈现特定的氨基酸序列、功能结构或两者的组合来与目标相互作用。在本篇评论中,我们将重点介绍使用固相肽合成 (SPPS) 制备的肽结构,对于当今大多数系统来说,该过程是在循环自动合成设备中进行的,其中肽结构中的每个氨基酸被顺序地掺入。有兴趣了解更多有关使用转基因生物进行肽合成的读者,我们鼓励他们寻找关于这个特定主题的评论。
SPPS 的概念形成于 1959 年,并于 20 世纪 60 年代初由诺贝尔奖获得者 Robert Bruce Merrifield 首次报道,随着肽化学技术的进步使该过程更加稳健,SPPS 在 20 世纪 70 年代和 80 年代逐渐流行并被主流采用。通过将肽链与下一个连续aa的羧基末端偶联,从而延长肽链的概念彻底改变了肽链的生产方式,而下一个连续aa的其他功能基团受到保护。这些保护基可防止 aa侧链发生氧化和非特异性反应。数十年来的深入合成研究已经产生了许多多功能保护基,例如原型的芴甲氧羰基 (Fmoc) 基团。带有单个氨基酸的 Fmoc 基团在市场上很容易买到。SPPS 的技术改进,例如使用微波反应器和先进的温度控制系统,与室温和对流加热方法相比,可以合成含有数百个氨基酸的肽,产量更高,反应时间更短,2014 年这些技术进步也促进了所谓困难肽序列的快速合成。困难肽序列是指在合成过程中或去除保护基后聚集形成不溶性产物的肽序列,这一过程导致产量降低或肽失活,从而阻止进一步修饰。在大多数情况下,这些问题是由于引入了能够参与非共价相互作用的功能性而产生的,例如氢键和偶极-偶极相互作用。因此,在为 SPPS 设计肽时,单个氨基酸. 应筛选所得偶联产物(在树脂上),以确定是否可能形成自组装结构、是否发生副反应以及是否倾向于折叠到树脂上。已证明以下参数有助于合成困难的肽序列:(i) 高温(例如,微波辅助合成时为 95°C),(ii) 存在盐或去垢剂以提高溶解度,(iii) 在酰胺基团处使用保护基以避免潜在的氢键相互作用,(iv) 结合具有非反应性侧链的氨基酸以防止发生不良相互作用,以及 (v) 糖基化或聚乙二醇化以提高肽溶解度。
生物活性肽序列模拟物
促血管生成序列
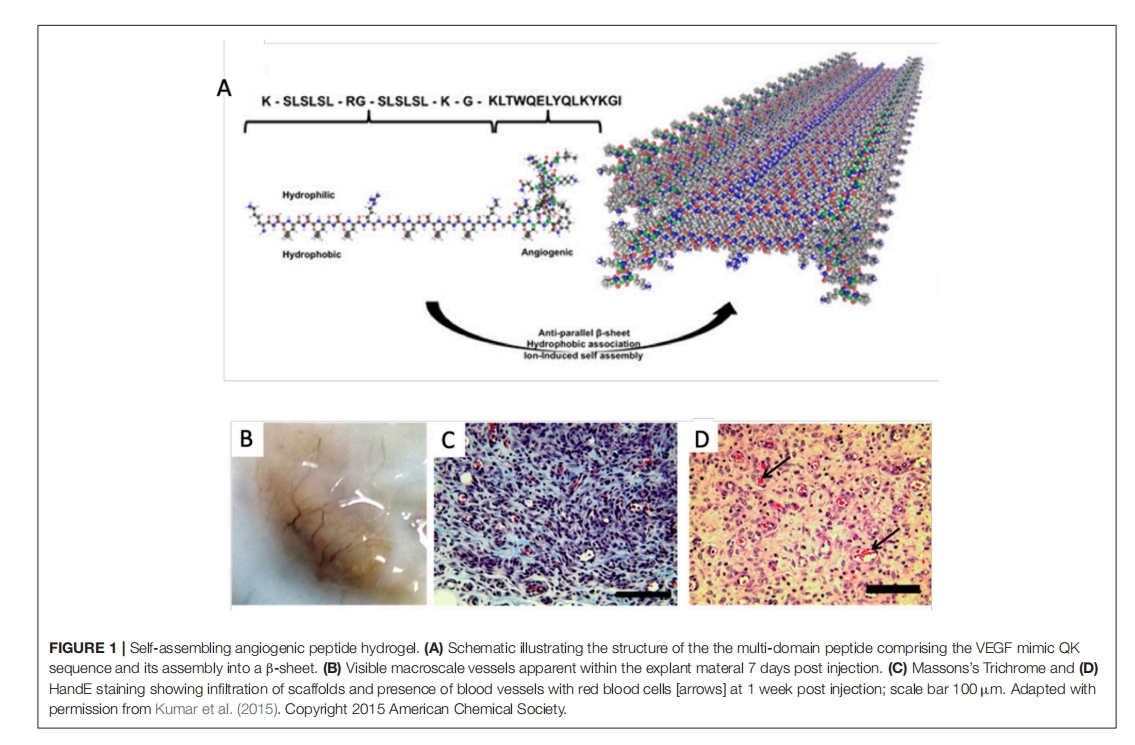
探索这些 VEGF 类似物结合肝素的能力也可能很有趣,因为有大量文献报道了不同 VEGF 亚型结合肝素的倾向以及这种结合对促进内皮细胞生长和增殖的必要性。此外,将 VEGF 掺入产氧或缺氧诱导水凝胶或基质中可能会影响缺氧诱导因子,这些因子对 VEGF 的表达和功能很重要。
其他在调节血管生成方面显示出前景的肽是生长因子受体的靶标,这些受体通常与 VEGF 协同作用。例如,成纤维细胞生长因子以及神经细胞粘附分子 (NCAM) 已被证明可以与成纤维细胞生长因子受体结合,也可以促进血管生成。FGF2 和 NCAM 的肽模拟物已通过合成制备,虽然它们可能以典型或非典型方式发挥作用,但有强有力的证据表明它们会影响血管生成。还有许多血管生成素-1 模拟物,它们通过与酪氨酸激酶受体 (Tie2) 相互作用,有望调节血管生成,而酪氨酸激酶受体主要存在于血管内皮细胞和造血细胞中 。人们可能希望在用于血管化组织的材料中加入的其他肽是能够模拟转化生长因子 (TGFα 和 TGFβ)、肿瘤坏死因子 (TNFα)、血管生成素、白细胞介素 8 (IL8) 或肝细胞生长因子 ( HGF) ,因为这些有丝分裂原和趋化因子已被证实可通过控制内皮细胞生长和/或与 VEGF 介导途径相互作用来促进血管生成。考虑到这些因子对 VEGF 表达和功效的影响,以及它们通常是表面结合受体的靶标,将它们掺入软材料中可能需要以不妨碍它们与靶标受体相互作用的方式进行,这可能会限制基质内的共价连接。
抗炎序列
在设计用于组织工程和再生的支架和生物材料时,宿主免疫系统是需要克服的最大障碍之一。然而,这并不意味着要完全避免免疫反应;事实上,为了最大限度地提高植入物的治疗效果,它们必须调节由此产生的免疫反应。此外,炎症会促进血管生成,新血管的形成会导致进一步的炎症。因此,重要的是要了解炎症是一个复杂的过程,它最终通过促进细胞浸润、增殖和随后的极化为受影响的组织带来体内平衡。虽然免疫反应涉及许多因素,巨噬细胞被认为是最重要的细胞之一,因此本节将重点介绍肽模拟物如何或可能用于调节巨噬细胞。巨噬细胞是动态细胞,其表型受细胞外环境以及活性信号分子。传统上,在讨论巨噬细胞的表型时,据说有两个不同的亚群 (i) M1(促炎)和 (ii) M2(抗炎/促愈合)。然而,这是一种高度简化的观点,因为朝向任一表型的极化实际上更像是一个连续体,M1 和 M2 之间的差异不是离散的。通过设计与 M2 巨噬细胞的免疫原性受体(如 TGF-bR、IL-4R、IL-6R、IL-10R 和 MCSFR)相互作用的短肽,可以调节与组织损伤和修复以及引入异物相关的免疫反应。通过作用于促炎和抗炎细胞因子(如 IL 6 和 TNF-α)的表达以及活性氧的产生,可以开发出能够减少炎症、通过趋化作用募集细胞并最终改善伤口愈合的材料。虽然大多数与异物反应相关的炎症可以通过使用重组或自体蛋白质或蛋白质/肽模拟物来消除或减少,但可能包括小肽模拟物来激活和极化巨噬细胞,使其向 2 型表型发展。然而,由于激活过程的复杂性,很难确定一个或多个可以带来所需反应的序列;因此,目前已知的调节免疫反应的序列并不多,这些序列有利于组织再生和再生生物材料的设计。还有许多序列被定义为抗菌和抗炎,一类在调节免疫反应方面显示出良好前景的肽是先天防御调节肽 (IDR)。这些阳离子抗菌肽是天然存在的宿主防御肽或蛋白质 (HDP) 的合成阳离子类似物。它们是相对较短的肽(10-50 个氨基酸),没有特定的共识序列。虽然它们具有直接杀死微生物的能力,但它们也能够调节免疫和炎症反应。例如,它们能够影响趋化性、刺激趋化因子的产生、引导巨噬细胞极化以及调节中性粒细胞粘附和活化标志物的表达。IDR-1018 是此类肽中由 12 个氨基酸组成的肽。(VRLIVAVRIWRR-NH 2),已证实能够增强抗炎反应,同时维持对抗感染的重要促炎过程,这种能力是因为它能够驱动巨噬细胞极化至中间 M1-M2 状态。此类肽的其他成员包括 IDR-HH2 和 IDR-1002,它们都具有相似的免疫调节能力。抗菌肽 LL-37 和 SET-M33 也已证实能够通过减少促炎细胞因子、酶和转导因子来介导炎症。
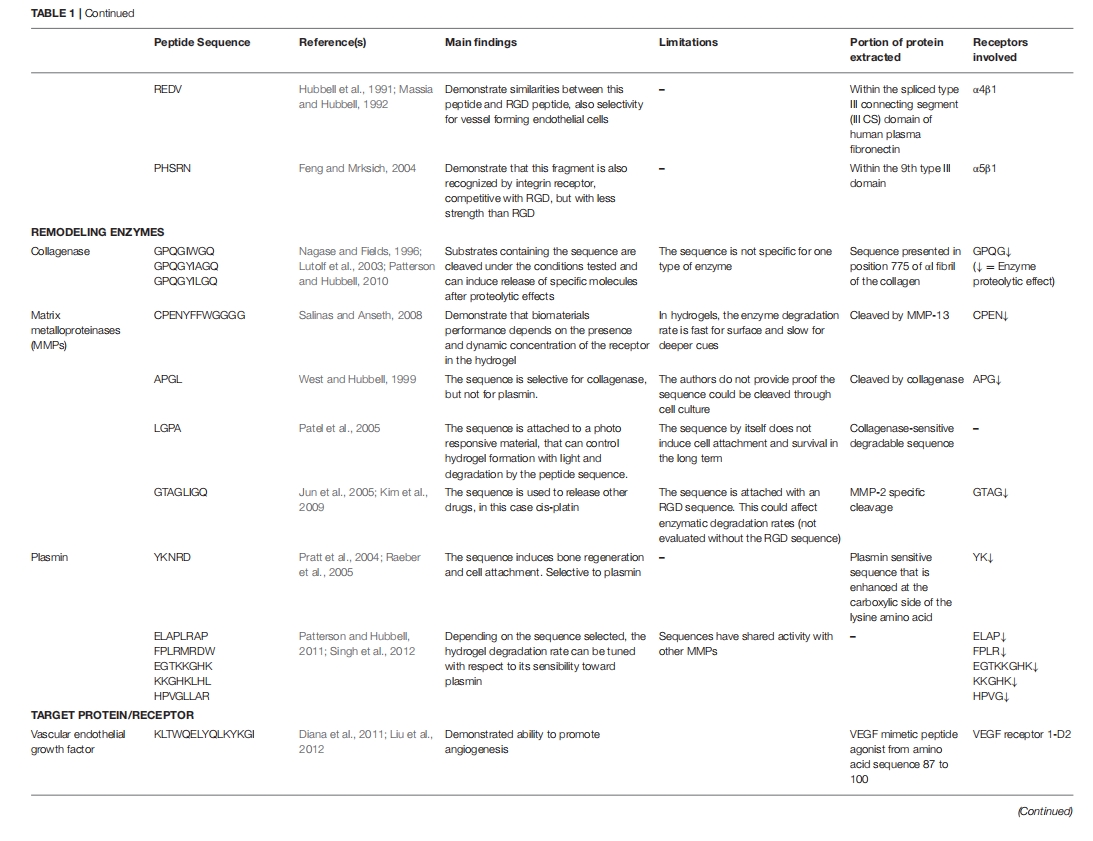
巨噬细胞活化控制免疫反应的方式之一是通过表达/产生基质金属蛋白酶 (MMP)。MMP 是一类蛋白水解酶,它们本身能够通过调节细胞因子和趋化因子来调节免疫反应。MMP 有多种不同的类型,它们都能够降解细胞外基质蛋白并通过蛋白水解裂解或其他修饰激活生物活性分子。通过在构成材料的肽内加入 MMP 结合和裂解序列,可以增加其局部浓度,同时增强材料的蛋白水解降解,从而可以用内源性基质替换材料并释放小肽片段,进而调节其他细胞反应。I 型胶原蛋白中发现的 MMP 表位的一个例子是氨基酸序列 GPQGIAG. 研究表明,胶原蛋白-PEG 复合物中存在此类序列可增强 MMP-1 和 MMP-2 的蛋白水解降解作用。
促依从序列
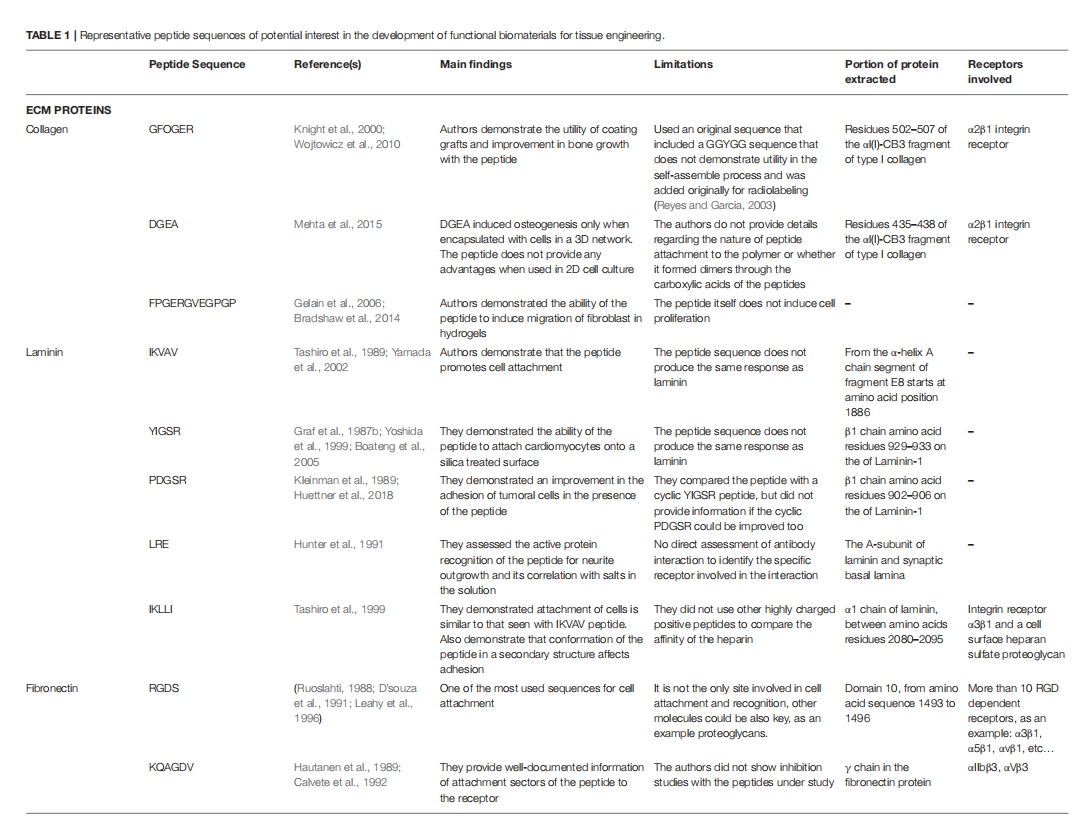
再生生物材料的关键要求之一是支持内源性细胞的生长、附着和增殖。确保细胞附着在材料上的一种方法是修改材料,使其包含显示特定结合序列的肽。最普遍和最简单的结合序列之一是 RGD 和 RGDS 基序,它们在粘附蛋白(如纤连蛋白和纤维蛋白原)以及结构蛋白(如胶原蛋白和层粘连蛋白)中很突出。它们充当多种不同 α 和 β 整合素结合受体的锚定位点。RGDS 序列还被证明可以抑制血小板聚集,因此显示出一些抗血栓溶解活性。与 RGD 截然相反,KGD 序列被发现能通过抑制整合素结合来破坏细胞附着。另一种来自粘附蛋白纤连蛋白的促粘附序列是 PHSRN。PHSRN 和 RGD 一样,是一种整合素细胞粘附基序,但它与许多其他线性细胞附着序列不同,因为该序列的空间组织必须模仿纤连蛋白中的空间组织才能发挥作用。同样来自纤连蛋白的还有 REDV、LDV 和 KQAGDV 整合素结合基序,它们已被证明有助于人脐静脉内皮细胞(HUVEC)的锚定以及促进平滑肌细胞粘附。层粘连蛋白衍生序列(如 IKVAV 和 YIGSR)也是重要的整合素结合配体。虽然 YIGSR 也表现出一些抗癌特性,但 YIGSR 和 IKVAV 序列均已证实能够刺激神经突生长,并已用于设计多种治疗材料。结构蛋白(如胶原蛋白)也显示出一些细胞粘附序列,其中描述最详尽的序列来自 I 型和 IV 型胶原蛋白。与前面提到的促粘附序列一样,短 DGEA、GFOGER(其中 O 是羟脯氨酸)和 GFPGER 序列在整合素识别中起关键作用,因此已被纳入多种组织修复策略。
肽在组织工程和生物材料中的应用
通过生物工程技术对材料进行改性,为生成合成和混合材料提供了一条有前途的途径,这些材料不仅具有生物功能和相容性,而且还能够控制细胞微环境。组织工程领域正在不断发展和改进,改变了科学家和工程师治疗受损组织的方式。组织工程最重要的方面之一是设计具有生物相容性并能够与细胞和宿主环境相互作用以促进愈合的材料。为此,已开发出多种基质,用于从组织置换和修复到药物输送等各种应用。肽越来越多地被掺入或自组装到基质中,以增强细胞信号传导和生物活性、改善药物输送、提供抗菌特性以及许多其他应用。在本节中,我们将简要回顾一些基于肽的心脏、皮肤和角膜再生疗法的代表性例子。在选择文献时,我们将搜索范围限制为包含材料体内评估的文章,见表2。
角膜和皮肤治疗中的肽序列
胶原蛋白和弹性蛋白样肽是皮肤和角膜组织修复中常用的肽。胶原蛋白是细胞外基质中最丰富的蛋白质,常用于生物材料。全长人胶原蛋白合成复杂,因为它需要大量的转录后修饰,并且不溶于大多数缓冲液,因此很难研究。然而,短的胶原蛋白模拟肽序列正被用于模拟全长胶原蛋白,通过在一小部分长度处加入重要的肽序列。这些胶原蛋白模拟序列通常需要在每个第三个位置上存在一个甘氨酸残基,并含有许多脯氨酸和羟脯氨酸重复序列。这些序列形成左手多脯氨酸 II 螺旋链,然后以三组为一组自组装成右手超螺旋。肽序列 (PKG) 4 (POG)4 (DOG) 4也被设计为自组装的胶原蛋白模拟肽。然后修改此自组装肽的 N 端以包含甘氨酸间隔物和末端半胱氨酸 (CG-linker)。添加末端半胱氨酸允许肽通过马来酰亚胺化学附着到 8 臂 PEG 聚合物上。将这种新的胶原蛋白模拟肽混合聚合物用作固体植入物,在猪模型中植入 12 个月后,可产生透明且形状良好的角膜,并沉积新的胶原蛋白和基质细胞浸润。通过添加分子 2-甲基丙烯酰氧乙基磷酰胆碱 (MPC) 实现了配方的改进,该分子已被证明可以减少炎症并改善水凝胶的生物相容性。就 12 个月后的恢复而言,改进配方与由 III 型重组人胶原蛋白制成的角膜模型移植物之间发现了相同的上皮、基质和神经恢复。
层粘连蛋白粘附五肽基序 YIGSR 也被移植到由水合胶原蛋白和N-异丙基丙烯酰胺共聚物组成的生物合成角膜上,并在尤卡坦微型猪身上进行了测试。该材料的直径为 5.5 毫米,厚度为 200 微米,通过板层角膜移植术植入。6 周后,植入物能够成功再生宿主角膜上皮、基质和神经。相比之下,在实验期间,接受同种异体移植的对照眼中没有观察到神经再生。
肽也可以通过各种方式进行功能化,使其与纳米粒子结合,生成仿生平台,改变物理性质和细胞相互作用,或使其融入原纤维或水凝胶中用于各种应用。
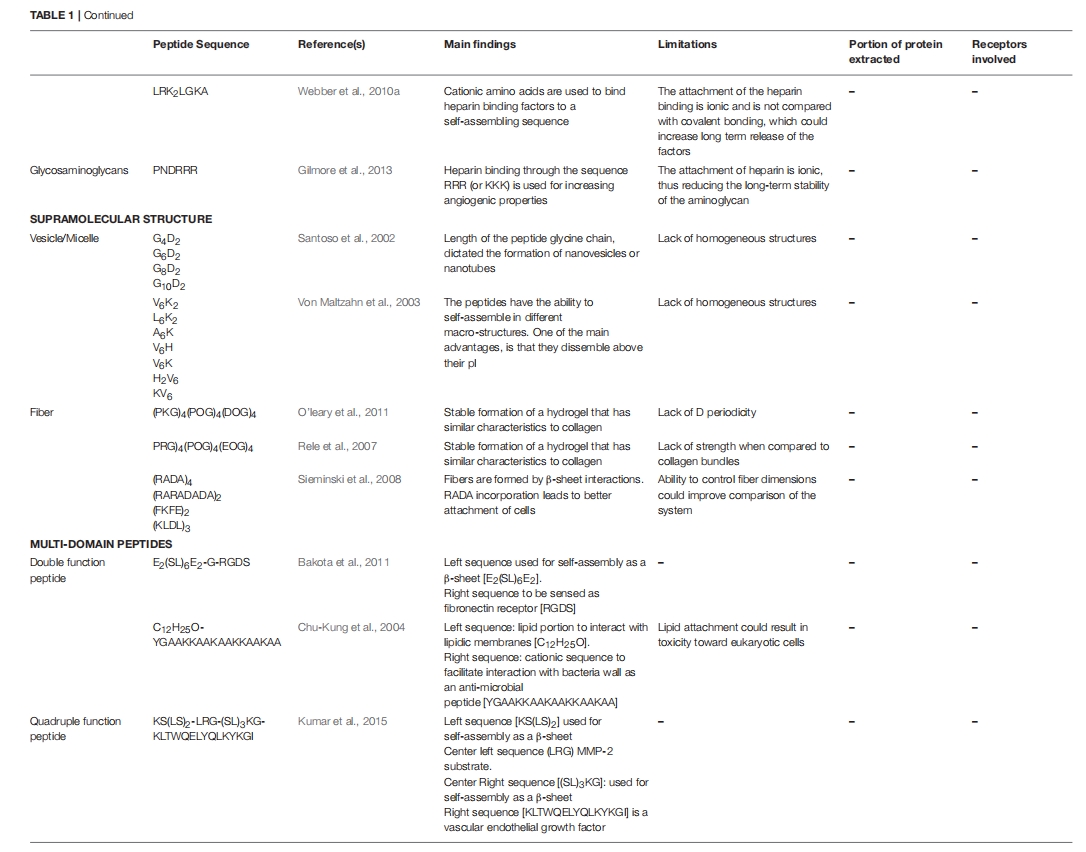
弹性蛋白样肽 (ELP) 已被证明在组织工程中非常有用,因为它们具有弹性,可以帮助它们模仿许多不同组织和器官的物理特性 。虽然人体中的弹性蛋白含量很低(占皮肤干重的 2-4%),但它在皮肤的机械强度和支撑中起着重要作用,并且还被证明参与细胞信号传导。ELP 通常来自弹性蛋白的五肽序列 (VPGXG),其中 X 可以是任何氨基酸 该序列在交联时保持其弹性特性。有研究表明,人体无法区分 ELP 与内源性弹性蛋白,而 ELP 基质表现出与内源性弹性蛋白相似的机械性能,这使得人体能够使用支架重建天然 ECM。
Q11 和 RADA-16 等肽也已被加入生物材料并用于组织工程。RADA-16 与 EGF 结合已证实能改善皮肤细胞的流动性,从而改善伤口愈合,尤其是不愈合伤口。最后,伤口愈合抗菌肽 (AMP) 也已用于治疗不愈合感染伤口,如糖尿病足溃疡。这些肽可预防感染、减少炎症反应并促进细胞增殖和迁移,AMP具有广泛的氨基酸序列,但它们通常由两亲结构组成,其中包含大量碱性残基。在人体皮肤中,AMP由颗粒层的角质形成细胞合成和储存。
心脏中的应用
心肌梗塞 (MI) 是全球范围内导致死亡的主要原因,最终可能导致心力衰竭 。为了有效,肽基疗法需要对局部蛋白酶具有抵抗力,并保留足够长的时间以在心肌中发挥预期效果。所用的自组装肽通常由交替的亲水性和疏水性氨基酸组成,在暴露于生理渗透压和 pH 值时,它们会迅速组装成纳米纤维结构,可注射到心肌中形成 3D 微环境,此类疗法在治疗心肌梗塞方面已显示出良好的前景。RADA 类离子自互补肽是第一代自组装肽之一,也是在 MI 中应用研究最深入的肽,因为它是市售的。当与血小板衍生的生长因子 (PDGF) 一起输送时,由 RADA 序列制成的自组装纳米纤维在大鼠 MI 模型中减少了梗塞面积并改善了心脏功能。尽管 PDGF 家族的几个成员在心脏中存在过度表达,而且据报道它会诱导成纤维细胞过度生长和心脏纤维化,这项研究表明,与自组装纳米纤维结合的 PDGF 实际上减少了心脏纤维化,表明 PDGF 的释放得到了很好的控制。当与 VEGF 结合时,RADA 衍生的纳米纤维水凝胶也被证明可以改善大鼠和猪 MI 模型中的血管生成和心脏功能。RADA 序列也与细胞疗法结合使用。例如,将 RADA 衍生的水凝胶注射到含有骨髓单核细胞 (MNC) 的猪 MI 模型中,可使细胞保留率增加约 8 倍,并改善 MI 后 1 个月的心脏功能。同样,将成纤维细胞生长因子 (FGF) 固定在 RADA 水凝胶中的人类脂肪衍生基质细胞 (ADSC) 注射到大鼠 MI 心脏中,并证明其可促进血管生成并改善心脏收缩 。同样,将胰岛素样生长因子-1 (IGF-1) 束缚到自组装肽上可提高大鼠 MI 模型中移植的新生大鼠心肌细胞的存活率。细胞介导疗法也通过某些类型的趋化因子的良好控制释放得到增强。将基质细胞衍生因子-1 (SDF-1) 结合到 RADA 纳米纤维中,并证明其可通过募集内皮祖细胞 (EPC) 来改善心脏功能,值得注意的是,SDF-1 还附着于易受 MMP-2 裂解的 6 个氨基酸序列上,以实现梗塞部位趋化因子的“智能释放”,尽管在体内没有表现出额外的作用。
自组装肽两亲物已成为多功能生物材料。肽的两亲性使其能够在水性介质中自组装,无需使用有机溶剂,因此扩大了其适用性。为了提高细胞保留率,将肽两亲物支架与 RGDS 结合,并与 MNC 一起皮下递送。加入 RGDS 可改善体内细胞的保留和增殖,同时增强体外内皮标志物的表达。同样,肝素结合肽两亲物 (HBPA) 也被开发出来并被评估为 MI 治疗的生物材料,旨在模拟天然肝素结合蛋白并能够与多种蛋白质结合,从而提高细胞对这些因子的识别 。当与 VEGF 或 FGF 结合时,HBPA 在小鼠中表现出改善的血管生成和心脏收缩力。众所周知,肝素可以保护生长因子免于蛋白水解,从而保持其活性形式,并增强其对各自受体的亲和力,从而实现生长因子的持续释放;然而,由于肝素来源于动物,因此使用肝素可能会引发免疫反应。为了克服这一限制,开发了合成的糖胺聚糖 (GAG) 模拟肽纳米纤维支架并在体内进行了评估。GAG 支架在梗塞心肌中诱导了新血管形成,同时增加了 VEGF 表达和血管细胞募集,从而显著改善了心脏功能。
鉴于梗塞心脏内的“恶劣”环境,另一种方法是将可溶性肽递送到聚合物支架内,以模拟细胞外基质降解产物,这些降解产物可以以细胞因子的方式发挥作用。支架胶原水凝胶中装载的促血管生成层粘连蛋白衍生的 C16 和抗炎胸腺素 β4 衍生的 Ac-SDKP 已被证明可以上调皮下植入的血管生成反应,同时下调炎症,因此有望成为治疗心肌梗死后缺血和炎症的策略。胸腺素 β4 也已成功整合到胶原-壳聚糖水凝胶中,以便在心肌梗死后释放到心脏中,与未改性水凝胶相比,其血管生长和心肌修复效果更佳。
细胞联合疗法的改进
一些较大的细胞外基质 (ECM) 分子,如胶原蛋白和纤连蛋白,具有多个肽序列,这些肽序列可被细胞识别并诱导多种再生反应。为了解决 MI 修复细胞成分保留和存活率较差的问题,人们已使用天然 ECM 的纳米拓扑结构模拟物来改善整合、增殖和分化。RGD 序列已被确定为纤连蛋白中的主要细胞结合域,并且能够作为心肌细胞表达的整合素 αvβ5、αvβ3 和 α5β1 的配体。具有 RGD 基序的材料功能化可能通过更好的粘附和细胞整合对再生心肌发挥有利特性。已证明,将 RGD 掺入胶原蛋白和藻酸盐支架可改善心肌细胞的收缩性和活力 。RGD-藻酸盐系统还能够改善血管内皮细胞的粘附和增殖,并增加体内血管的形成。当用作包覆间充质干细胞 (MSCs) 的微球时,RGD-藻酸盐组合改善了注射部位的细胞保留,此外还增强了大鼠 MI 模型中的小动脉形成。同样,用环状 RGDfK 肽修饰的藻酸盐支架(该肽具有蛋白酶抗性并对细胞整合素具有高亲和力)可提高移植 MSC 的存活率并促进大鼠 MI 模型中的血管生成。RGDSP 也是一种粘附序列,可促进细胞粘附并刺激与早期心脏发育相关的整合素。当与自组装肽 RADA16 结合时,RGDSP 支架可对骨髓衍生的心脏干细胞产生保护作用,这些干细胞从 MSC 中分离出来并被鉴定为 c-kit、Nkx2.5 和 GATA4 阳性群体,并通过增强心脏分化改善 MI 后大鼠的心脏功能。RGDSP 与 RADA16 组装时呈现纳米直径的纤维结构,提供三维支架,可能有利于移植细胞生长的微环境。YIGSR 序列(层粘连蛋白衍生)是另一个 ECM 衍生肽的例子,已被研究作为功能性添加剂来增强细胞疗法。在一项研究中,YIGSR 与一氧化氮供体聚赖氨酸序列(KKKKK)结合固定在自组装肽两亲物中。这些肽的组合在捕获 EPC 并诱导其分化为内皮细胞方面表现出色。QHREDGS 也是一种 ECM 衍生肽,基于血管生成素-1 的纤维蛋白原样结构域。由于整合素配体的同源性,据报道 QHREDGS 序列在体外对心肌细胞和内皮细胞具有双重保护作用。在大鼠MI模型中,胶原蛋白-壳聚糖水凝胶中加入 QHREDGS 可改善心脏功能,并通过 β1-整合素募集心脏细胞。虽然这些数据在细胞募集到治疗部位方面很有希望,但引发的下游信号可能与天然基质不同,这可能是由于 ECM 蛋白中含有的其他成分或结构差异。在体外研究表明,用RGD和YIGSR肽培养的肌细胞表现出粘着斑激酶(FAK)表达降低,FAK是机械转导途径的一部分,尽管细胞的粘附性与天然蛋白质纤连蛋白和层粘连蛋白相当,并且β1-整合素表达水平没有变化。
还研究了对特定细胞类型至关重要的其他肽配体。例如,由于 Notch 信号已被证明可促进心脏祖细胞 (CPC) 介导的心脏修复 ,RADA 自组装肽已用 Notch1 配体 Jagged1 的肽模拟物进行功能化,并证明在与 CPC 一起移植时具有治疗益处,可改善急性滞留并改善大鼠 MI 模型中的心脏重塑。开发能够调节对内源性细胞类型(如 NOTCH1)至关重要的信号通路的生物材料非常重要,因为这些细胞内源性地存在于具有确定成分的微环境内,并根据损伤、衰老或疾病后的环境线索发挥修复作用。循环血管生成细胞 (CAC) 是 MI 细胞疗法的另一个有希望的候选者,在血管生成和心肌再生中发挥着重要作用。甲酰肽受体 2 (FPR2) 属于 G 蛋白偶联受体家族,已被建议刺激和促进单核细胞系、中性粒细胞和 B 淋巴细胞的趋化性。WKYMVm 是一种对 FRP2 具有强亲和力的合成六肽,注射到 MI 后小鼠体内,可增强骨髓 CAC 的动员,从而保护心肌免于凋亡,增加血管密度并保持心脏功能。同样,基质细胞衍生因子 1 (SDF-1) 是造血干细胞的关键调节因子之一,可影响 EPC(CAC 的主要群体之一)的增殖和动员,从而诱导血管生成并在心肌缺血中显着上调。然而,外源性 SDF 会被多种蛋白酶迅速降解。为了克服这一限制,研究人员设计了一种多肽类似物,与天然 SDF 相比,该类似物表现出更强的生理能力,可以诱导 EPC 迁移并改善心室功能。在另一项研究中,RoY 是一种 12 个氨基酸的合成肽,可特异性结合 78 kDa 葡萄糖调节蛋白 (GRP78) 受体,该受体在缺氧条件下主要表达于血管内皮细胞,与温敏性壳聚糖氯化物水凝胶结合。该材料诱导了大鼠 MI 模型中的血管生成活性并减轻了心肌损伤。组蛋白去乙酰化酶 7 (HDAC7) 衍生的磷酸化 7-氨基酸肽也已成功整合到胶原水凝胶中,以便在心肌梗死后释放到心脏中,通过增强干细胞抗原 1 (Sca-1) 阳性干细胞募集和分化实现血管生长和心肌修复。虽然基于肽的策略可以控制细胞粘附、信号定位和细胞因子释放,但肽通常高度普遍存在,并不特定于特定的细胞类型或信号通路。在这些治疗材料准备好用于临床应用之前,还需要进一步研究。
结论与展望
随着该领域寻求开发临床可转化的组织再生仿生材料,显然肽基生物材料能够产生治疗方法,不仅可以提高生活质量,还可以解决与动物源材料的异种性质和重组制备蛋白质的高成本相关的当前问题。由于 SPPS 的最新进展以及对复杂生物环境中肽和蛋白质的结构-功能关系的更好理解,设计能够引发所需反应或增强生物相容性的靶向生物材料变得更加可行。这些短的模拟肽通常也比其全长类似物更易于加工,因此更容易通过各种不同的功能进行修改,从而赋予其有益的特性,例如增强溶解度、简单的一步连接到聚合物骨架或刺激响应性(pH、光、温度等)。鉴于伤口愈合过程的复杂性,随着我们对决定组织再生的因素的了解越来越多,我们很可能会开始看到组合方法的发展和由许多不同结构和序列的肽模拟物组成的材料的设计增加。虽然这种复杂的材料目前很难设计,但随着预测模型的改进和大型生物活性肽数据库的出现,这项任务将大大简化。