以肽为基础的癌症疫苗依赖于强活化的适应性免疫反应来激发其效应功能。他们已经证明是高度特异性和安全,但尚未在临床中证明自己是一种有效的癌症治疗方法。这是由多种原因造成的,包括肿瘤异质性、自身耐受性和免疫抑制。人们重视以肽为基础的癌症疫苗的总体设计,这些疫苗已从癌症抗原的简单肽衍生物发展到复杂药物;结合重叠区域、偶联物和递送系统来靶向和刺激抗原呈递细胞的不同成分,并加强抗原交叉呈递。基于肽的癌症疫苗正变得越来越个性化,以适应个体的肿瘤抗原库,并经常与现有的癌症治疗相结合。这一战略最终有助于克服更广泛的疫苗战略的缺点,并提供综合治疗,同时考虑到癌细胞的可变性及其避免免疫审讯的能力。
癌症背景下的抗原呈递
疫苗用于治疗传染病已有200多年的历史,其基本原理是给个体接种一种减弱或无活性的微生物或其组成成分,目的是激发适应性免疫反应,对外来抗原提供长期获得性免疫。癌症疫苗的工作原理与此相同,它通过编程使免疫系统将癌症抗原识别为“外来”抗原。它可以预防肿瘤的发生,也可以治疗已经感染了这种疾病的人。
癌症疫苗需要T细胞介导的适应性免疫反应的强烈激活来激发其抗肿瘤潜能。适应性免疫反应是由抗原呈递细胞(APC)对免疫原性抗原的摄取、加工和呈递引起的。树突状细胞(Dendritic cells,DCs)是主要的专业抗原提呈细胞之一,是连接抗原非特异性先天免疫应答和抗原特异性适应性免疫应答的纽带。当遇到外源抗原时,树突状细胞通过受体介导的内吞作用或巨噬作用将其内化,并在内体内处理抗原,将其装载到MHC II类分子上,并提呈给CD4+ T细胞。这导致Th1反应的激活,包括细胞因子如IFN-γ的产生增加,IFN-γ促进和维持巨噬细胞和细胞毒性t淋巴细胞(CTL)效应功能。一小部分内化抗原可以通过出口到树突状细胞的细胞质中而逃离这一经典途径,在那里它们被蛋白酶体处理。由此产生的肽被运输到内质网,在那里它们被装载到MHC I类分子上,呈递给CD8+ T细胞,这一过程被称为抗原交叉呈递。CD8+ T细胞通过抗原交叉呈递的识别和随后的成熟导致对呈递该抗原的细胞的抗原特异性反应。在癌症中,CD8+ T细胞识别肿瘤表面表达的癌症抗原,并通过释放穿孔素、Fas配体和颗粒酶等凋亡因子,通过细胞介导的细胞毒性启动细胞凋亡。树突状细胞激活T细胞需要三个信号,任何一个缺失都会导致不完全激活。第一个信号是由t细胞受体(TCR)在CD4或CD8共受体的帮助下与肽结合的MHC结合产生的,后者稳定了这种结合并促进了TCR信号传导。信号二是由树突状细胞和T细胞之间的细胞表面分子相互作用引起的共刺激信号形成的,例如T细胞上的CD28和DCs上的B7。最后,第三种信号是由树突状细胞释放的细胞因子提供的,这些细胞因子驱动T细胞进入特定类型,例如IL-12促进T辅助细胞的Th1表型并促进CD8+ T细胞的扩增。
然而,癌症是一种复杂的疾病,肿瘤微环境中的免疫抑制细胞如调节性T细胞(Treg)和骨髓源性抑制细胞(MDSCs)调节免疫反应并帮助癌细胞免疫逃逸。最终,癌症疫苗的目的是强烈激活CD8+ T细胞途径,由CD4+ T细胞介导,从而克服自身耐受和免疫抑制,最终消灭癌细胞。
基于肽的癌症疫苗的原理
基于肽的癌症疫苗通常由来自肿瘤特异性或肿瘤相关抗原(TSA/TAA)的氨基酸序列组成,区别在于抗原是否对癌细胞特异性(TSA),或者它是否可以在健康细胞和癌细胞上发现,但在癌症细胞中水平升高(TAA)。为了使基于肽的癌症疫苗有效,它们必须含有CD8+表位来利用抗原交叉递呈途径,从而激活CTL抗肿瘤免疫,以及CD4+表位来激活T辅助细胞,从而维持CTL效应细胞的功能。因此,为了促进强免疫原性应答,肽疫苗的序列长度是重要的。如果肽太短,它可以结合非专业APCs的MHC,这些APCs缺乏完整T细胞激活的二级信号机制,导致T细胞反应差或免疫耐受。较短的肽也倾向于HLA型限制,因为它们的长度不允许在一般人群中HLA的高多态性所需的多样性。最后,短肽也容易被酶消化和从体内更快地消除,除非修饰。然而,较长的肽长度允许更广泛的hla类型覆盖,包含多表位肽以增强CD4+和CD8+反应,并允许包含结合或识别基序以增强免疫原性。
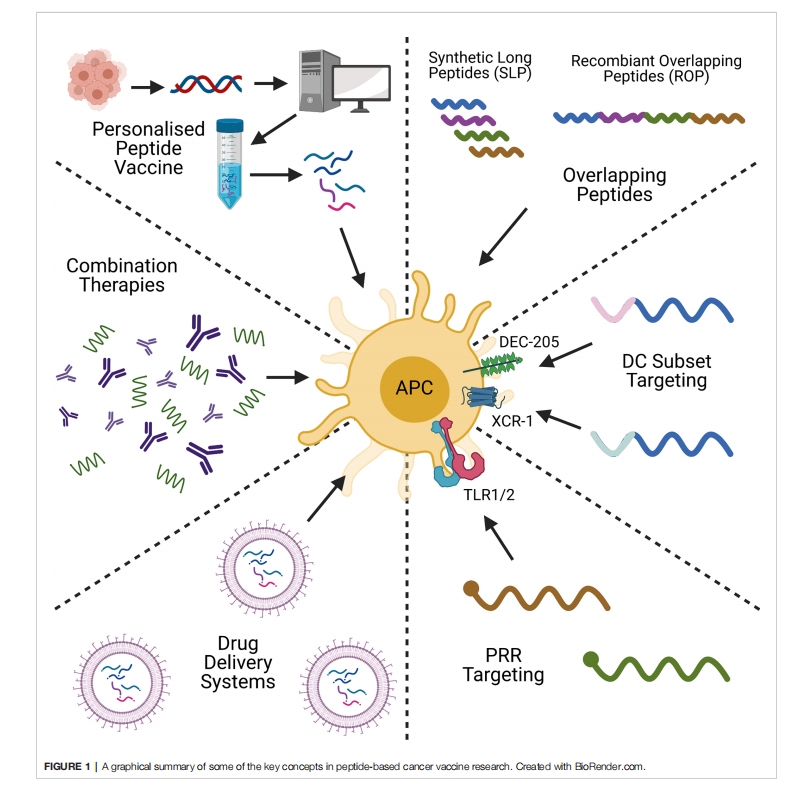
基于肽的癌症疫苗是癌症治疗的众多治疗策略之一,包括DNA/RNA疫苗和过继细胞转移(ACT)。与基于肽的癌症疫苗一样,基于DNA和rna的疫苗生产成本低廉,并且具有不针对hla的优势。DNA/RNA疫苗也能够编码多种抗原,这些抗原可以激活适应性免疫反应和先天免疫反应,但DNA疫苗在人类中的免疫原性很差。这部分是由于有限的细胞吸收和身体的快速消除。RNA疫苗也相对不稳定,并且可能产生强烈的不必要的先天免疫反应,然而,通过修改以减少这些问题,mRNA疫苗显示出自己是有希望的癌症疫苗候选物。另一方面,ACT是通过取出病人的细胞,在体外进行扩增和改造,然后再将它们移植回体内来发挥作用。CAR-T和TIL疗法就是这样的例子,并且已被证明是具有强大和高度个性化免疫原性的优秀抗肿瘤疗法。然而,ACT是一个昂贵、耗时和劳动密集型的过程,并且可能导致毒性作用,正如CAR-T患者的细胞因子释放综合征所见。ACT通常与其他类型的癌症疫苗联合使用,包括用肿瘤抗原衍生肽脉冲DCs,或用肿瘤相关抗原mRNA转染。基于肽的癌症疫苗的希望在于通过高度特异性、低制造成本和可靠的安全记录来弥合这两种替代策略之间的差距。然而,在提高它们的免疫原性和在临床应用方面仍然存在挑战。这篇综述的目的是评价最近提高基于肽的癌症疫苗免疫原性的策略,并寻找可能导致其临床应用的趋势。讨论的主题将是肽设计、偶联、配方、个性化肽疫苗和联合治疗(图1)。我们将讨论每种策略如何克服突出的问题,以及基于肽的癌症疫苗的未来。
设计基于肽的癌症疫苗
长肽和重叠肽作为癌症疫苗
基于肽的癌症疫苗是根据从含有T细胞表位的TSA/TAAs中选择肽序列作为模板的原理建立的。这可以采取单表位的形式,长链多肽与多个表位,或肽池。然而,为了产生强大的免疫原性应答,基于肽的癌症疫苗需要包含多个表位,这些表位可以被CD8+和CD4+ T细胞在不同HLA单倍型的不同人群中识别。这种策略的基本原理是,与主要基于结构的抗体识别不同,T细胞受体识别来自抗原的短线性肽序列。因此,可以使用硅生物信息学和T细胞表位定位来预测和选择目标肿瘤抗原的序列。通过使用多表位或重叠肽序列而不是短的单表位肽,可以克服肿瘤异质性、肿瘤抗原下调和HLA单倍型多样性等问题。
一种基于肽的癌症疫苗是合成长肽(SLPs),它是由25-35个氨基酸的肽池衍生自TAA/TSAs。SLPs从一开始就成功地引发了强烈的免疫原性反应,并且与它们所衍生的整个抗原相比,已被证明具有更强的免疫原性。使用长肽而不是与T细胞表位大小相等的短肽,意味着肽必须在树突状细胞内加工后才能呈递给T细胞,而不是直接与树突状细胞或非apc的mhc - 1结合。然而,肽池需要对该池中的每个肽进行质量控制,这可能会妨碍其制造能力和成本。
最近,从 MELOE-1黑色素瘤抗原衍生的SLPs被组织蛋白酶敏感连接体从I类和II类表位中分离出来。组织蛋白酶是树突状细胞中参与抗原呈递的关键蛋白酶,研究发现,组织蛋白酶敏感连接体的组成和大小对CD4+和CD8+ T细胞表位的呈递有显著影响。在所检测的连接子序列中,LLSVGG显示出最强的免疫原性。使用基于LLSVGG的疫苗评估SLPs在初始-增强免疫策略中的小鼠研究显示,CD8+ T细胞应答较强,但与人类PBMC试验相比,CD4+较低,可能产生不太全面的应答,并显示小鼠和人类模型之间表位敏感性差异。小鼠肿瘤模型也显示,与未接种疫苗的小鼠相比,7只小鼠中有4只的肿瘤生长减少,但不具有显著性。为了帮助澄清这些结果,需要进一步研究显示物种之间相似的表位反应性的替代抗原模型,以及增加样本量。这项研究证明了SLP技术在肽疫苗设计中的灵活性,通过结合战略性和特异性酶裂解位点来增强抗原呈递。
在许多其他抗原中,Survivin是一种癌症抗原,一直是基于肽的癌症疫苗设计的目标。Survivin是一种抗凋亡蛋白,是细胞凋亡抑制剂家族的成员。它是一种典型的肿瘤相关抗原,通常不存在于体细胞中,但在许多癌症中被上调。最近开发了一种基于survivin的疫苗,由具有8个CD4+表位和6个CD8+表位的3个SLPs组成。尽管Survivin在大部分癌细胞中被发现,但它通常具有免疫耐受性,然而,Survivin- SLPs疫苗被证明可以通过自体树突状细胞刺激激活CD4+和CD8+免疫反应,而不管测试人群的HLA类型如何。在此基础上,SLP疫苗在结肠直肠癌和b淋巴瘤移植小鼠模型中显示出显著的肿瘤根除水平,继发性攻击也显示出肿瘤生长减少和完全生存长达60天。疫苗增强了CD4+和CD8+ T细胞的细胞因子释放谱,并增加了穿孔素和颗粒酶B,这是CTL反应的一部分.
重组重叠肽(ROPs)是肽疫苗的另一种设计策略,已显示出有希望的临床前疗效。ROPs由覆盖靶标整个序列的连续重叠的长肽序列组成,肽序列重叠之间有Cathepsin S蛋白酶敏感连接体。重叠区域允许表位的多样性,特别是MHC-II分子,它们在HLA单倍型之间显示出不同但重叠的CD4+表位识别。ROPs不同于其他合成肽库,因为它们是作为具有多个表位的单链多肽重组生产的,这使得ROPs在生产和药物审批方面具有潜在的优势。然而,处理长肽也伴随着溶解度的问题。在CD4+和CD8+ T细胞中,ROP已经显示出对天然蛋白产生强烈的免疫原性反应,并且能够像Survivin ROP那样打破自身耐受性,这主要是由于其设计导致与天然蛋白相比同源性降低。
克服免疫耐受是基于肽的癌症疫苗的一个重大障碍,因为对自身抗原反应的T细胞作为中枢和外周耐受机制的一部分被消除。但是,通过结合CD4+和CD8+ T细胞活化的多个表位,到目前为止的例子已经表明,在不同的HLA类型中具有免疫原性,而单表位疫苗可能无法做到这一点。
个体化肽基癌症疫苗
肽疫苗设计是靶向肿瘤新抗原的关键,随着全外显子组测序(WES)和单细胞RNA测序(RNA-Seq)的出现,基于肽的癌症疫苗越来越多地针对个体的新抗原库进行定制。通过针对每个患者及其遗传背景制造特异性疫苗,个性化免疫疗法避免了“现成”肽疫苗可能不考虑肿瘤异质性和HLA单倍型的问题。该领域的报道很有前景,例如,通过将WES和RNA-Seq与计算机新表位预测相结合,Ott P.A.等人创建了20个针对患者HLA类型的独特SLPs 。离体实验显示,CD4+抗原有很强的特异性反应,而CD8+反应在体外扩增一轮后才检测到。事实上,CD8+ T细胞反应较弱可能是由于只有16%的肽含有CD8+ T细胞表位,而CD4+表位为60%。这可能表明预测CD4+表位位点的软件存在偏差,或者与MHC-I相比,MHC-II肽结合的混杂程度更高。进一步的实验表明,CD4+和CD8+免疫反应是高度特异性的,86%的T细胞对突变抗原起作用,而对野生型不起作用。在一项I期疫苗接种试验中,4名IIB/C期患者在2年后无病,另外2名IVM1b期患者需要进一步接受抗pd -1治疗以实现肿瘤消退。另一个例子是Hilf n等人的临床研究,他们研究了针对胶质母细胞瘤的个性化疫苗接种策略。胶质母细胞瘤因其预后不良而臭名昭著,使用替莫唑胺和放疗的平均生存期为14.6个月。在I期研究中,采用双管齐下的疫苗治疗策略,使用预先制作的胶质母细胞瘤未突变抗原文库,并对每位患者对它们的反应进行排序。随后是第二种疫苗,由以下两种成分组成;预测与mhc - 1结合并产生免疫反应的突变抗原肽,或未包含在第一种疫苗文库中的任何其他未突变表位。对于第一种疫苗,大约一半的总评估肽是CD8+和CD4+免疫原性的,CD8+表现出主要的记忆表型,而第二种疫苗主要是Th1 CD4+应答。值得考虑的是,第二种疫苗的最初想法是使用下一代测序技术,通过质谱法将患者的基因组突变与hla结合肽进行比较,但未能匹配任何突变。这项研究表明,个性化策略尚处于起步阶段,但也显示了它作为一种针对个人的高度具体治疗方法的前景。目前,基于新抗原的肽疫苗的主要问题是生产所需的成本和时间,但测序、软件预测、数据库和制造方面的进步有望使其在更大、更具成本效益的规模上使用。
Peptide-Conjugate疫苗
靶向模式识别受体
单独以肽为基础的癌症疫苗免疫原性差,需要强效佐剂或免疫刺激剂才能产生有效应答。但是,通过将基于肽的癌症疫苗与刺激或靶向树突状细胞的偶联物结合,肽偶联疫苗显示出比单独使用肽疫苗更大的潜力。一种常见的方法是包含树突状细胞激活标记物,如病原体相关分子模式(PAMPs)或损伤相关分子模式(DAMPs),通过结合树突状细胞表面的模式识别受体(PRRs)作为佐剂。PRRs的例子包括toll样受体(TLR)、c型凝集素受体(CLR)和NOD样受体(NLR)。PRRs的激活诱导DCs成熟,导致MHC-II表达上调、共刺激信号传导和促炎细胞因子的释放,从而增强抗肿瘤反应。在基于肽的癌症疫苗的背景下,PRRs从简单的佐剂与肽疫苗混合到PRR配体-肽缀合物不等。
这种新技术的一个例子是TLR2配体Pam3CSK4与TLR1共价结合形成的共轭物。由于TLR1是TLR2的异二聚体伴侣,因此该偶联物增强了TLR1对TLR2二聚的靶向性,并通过代理其偶联的SLP的免疫原性。该组的研究表明,使用SLP-Conjugate的SIINFEKL(一种OVA CD8+表位)阳性H-2kb+细胞的频率显著高于Pam3CSK4, DC成熟标记物显著增加。在HPV16 TC-1肿瘤模型中,它们也显示出更大的CD8+ T细胞浸润,肿瘤生长减少,生存时间延长。
靶向树突状细胞亚群
靶向树突状细胞的另一种方法是结合DCs或DCs亚型特异性配体。DEC-205 (CD205)是一种参与受体介导的内吞作用的树突状细胞受体,并且在CD8+树突状细胞中与抗原交叉递呈有关。虽然其天然配体尚不完全清楚,但有证据表明其作为PRR参与CpG寡脱氧核苷酸的结合和凋亡细胞的识别。理论上,通过将癌症肽偶联到DEC-205识别的配体上,可以增强疫苗的抗原呈递能力。最近,Liu Z.等人设计了一种靶向DC标记物DEC-205与HPV E7 SLP融合的ScFv,与单独的SLP相比,具有较强的靶向作用。然而,作者注意到,研究中使用的共轭基序本身就能刺激CD4+反应。虽然这并不一定是负面的,但可能夸大了DEC-205 ScFv靶向DCs的效力。
除了前面提到的PRRs外,DCs还含有许多趋化因子受体,用于其迁移或吸引适应性免疫反应的其他细胞。其中一个例子是XCR1受体,一种结合XCL1的趋化因子受体,将Dcs吸引到CTLs上。对XCR1+ DCs特别感兴趣的是它们在抗原交叉呈递方面的高效率。Botelho N.K.等人研究了XCL1与OVA SLP和突变的IgG1 Fc融合,以阻止Fc介导的内吞作用,以评估其在表达OVA的肿瘤模型中的免疫原性潜力。在B16-OVA肿瘤模型中,将XCL1- fc融合到OVA肽中显示出显著的抗肿瘤免疫,与单独的OVA SLP和游离XCL1的OVA相比,CTL反应增加。有趣的是,包含游离XCL-Fc的OVA SLP表现出与完全融合非常相似的反应,作者推测这可能是由分子聚集引起的。值得注意的是,本文没有考虑同样重要的CD4+反应,这将为这种靶向策略作为抗癌治疗的可行性提供有价值的见解。
基于多偶联肽的癌症疫苗
到目前为止,作为例子的所有结合物都集中在每个肽疫苗的一个靶标或结合物上。从逻辑上讲,通过将多种偶联物与不同的效应物或靶向基序结合,肽偶联疫苗可以协同促进适应性免疫反应的多个分支。其中一个例子是最近开发的细胞穿透肽(CPP)、激活APCs的TLR2/4激动剂和刺激CD4+和CD8+ T细胞的多抗原结构域的组合。TLR激动剂促进DCs成熟和激活,而细胞穿透肽允许抗原结构域进入DCs发生抗原交叉呈递的细胞质室,增加抗原特异性CD8+ T细胞的产生并增强抗肿瘤免疫。采用这种策略,在HPV TC-1治疗小鼠肿瘤模型中,观察到生存时间显着增加,肿瘤大小减小,并且在多个小鼠模型中,抗原特异性CD8+ T细胞肿瘤浸润增加。最后,他们在非人类灵长类动物中发现了通过诱导T细胞对EPCAM和Survivin的反应来打破自我耐受性的能力。但值得考虑的是,CPPs是非特异性的,会穿透大多数细胞,可能导致大量脱靶效应,并通过非专业APCs的吸收降低DCs的生物利用度。或许,一种结合CPPs穿透细胞的能力,以一种更有针对性的方法来对付树突细胞,可能有利于创造一种有效的基于肽的癌症疫苗。
肽疫苗配方和药物输送系统
PLGA和脂质体作为颗粒给药平台
通过适当的配方可以改善基于肽的癌症疫苗的缺点。例如,将药物递送系统纳入疫苗制剂可促进肽递送至抗原提呈细胞。通过使用药物递送系统,肽以及佐剂和靶向基元可以被封装或合并到表面上,允许递送单个“包装”来保护肽并传递强t细胞介导的反应。
PLGA和脂质体是两种药物传递系统的例子,它们已经在实验中使用了多年,并且在安全性和可生物降解性方面具有良好的记录,FDA批准它们作为药物传递系统使用。脂质体是由磷脂双层组成的高度可定制的细胞膜模拟物。脂质体的电荷、大小、表面分子和传递机制都是可定制的——这一特性允许脂质体模仿病原体的大小和表面标记物。由于微粒系统可以保护肽免于降解并控制其释放,脂质体为含有较高比例交叉呈现dc的肽提供了更大的进入脾脏和淋巴结的途径。在内化后,脂质体可以通过使其肽货物从溶酶体逃逸到细胞质中继续促进抗原交叉呈递,这是抗原交叉呈递和刺激强大的CD8+ T细胞反应的关键步骤。
以脂质体为基础的递送系统的多样性的一个例子是Rueda等人设计的纳米脂质体,它含有针对LHR激素的多抗原T辅助细胞表位,作为佐剂的破伤风毒素免疫原,以及增加DCs对脂质体摄取的外部Fc受体配体。佐剂促进DCs成熟,并且包含多种独立的TLR激动剂协同作用以增强体外DCs的刺激。然而,该策略在体外和体内肿瘤模型中的有效性尚未研究,需要充分评估其对自身抗原LHRH治疗前列腺癌的抗肿瘤反应。
在脂质体的可定制性以及脂质组成如何影响抗原摄取的另一个例子中,Zamani, P.等人设计了一种DOPE-脂质体系统,该系统结合了单磷酰脂质a (MPL),一种解毒LPS佐剂衍生物和Pan HLA-DR表位(PADRE)肽。PADRE被认为是一种“通用”HLA-DR (MHC II类)限制性CD4+表位,在大多数患者中刺激CD4+反应。通过在脂质体设计中使用DOPE,纳米颗粒在低pH下形成六角形结构,允许颗粒与内体壁融合并逃逸到细胞质途径中进行MHC I类交叉呈递。作者将DOPE: PADRE: MPL脂质体与HER2/新乳腺癌表位衍生的P5肽结合,发现接种了P5+DOPE: PADRE的小鼠肿瘤生长减少,生存时间延长。另一项使用不同HER2/neu衍生肽的研究显示了类似的结果,CD4+肿瘤浸润淋巴细胞的存在也增加了。总之,这些研究表明,通过优化疫苗配方,有可能将抗原呈递途径从MHC-I转向MHC-II。然而,优化是重要和必要的,因为弱CD4+细胞因子谱和TME内Treg细胞数量没有明显减少,可能会损害疫苗在临床中的功效。
在一项观察突变KRASSLP-脂质体的研究中,单独使用KRAS G12突变SLP主要导致CD4+反应。只有当SLP与脂质体结合时,疫苗才产生强烈的CD8+反应,尽管CD4+活性略有下降。作者确实注意到肿瘤PD-1和TIL衰竭标志物的增加,这导致了治疗反应,减缓了肿瘤的生长,但没有导致倒退。然而,在与PD-1检查点抑制疗法联合使用后,他们发现10只使用Neo-lpx疫苗的小鼠中有5只肿瘤消退。这项工作的一个亮点是疫苗对突变型KRAS的显著特异性,而不是对野生型的特异性,强调了配方肽基癌症疫苗的安全性。
制定一个适当的颗粒为基础的递送系统的重要性是必不可少的,以肽为基础的癌症疫苗的效力。通过比较PLGA和脂质体与游离肽,证明了这一点。研究发现,尽管使用颗粒为基础的系统优于游离肽和佐剂,但脂质体在引发抗肿瘤免疫反应方面始终优于PLGA。可能的原因是脂质体的阳离子电荷,其相对较小的尺寸比PLGA,促进脂质体更强的吸引力和提高吸收DCs。
制定疫苗输送系统需要注意的一个问题是,建造和制造的复杂性。jacobberger - foissac, C.等人通过尝试不同的CD4+和CD8+表位与佐剂联合使用来优化脂质体的递送,证明了这一点。通过实验和顺序筛选,他们展示了脂质体作为递送系统的多功能性和模块化性质。然而,他们也强调了其建设的经验性质以及制造和优化的困难。
基于肽的癌症疫苗的新型递送系统
到目前为止,重点一直放在PLGA和脂质体的使用上,但许多小组正在探索基于肽的癌症疫苗递送系统及其组成的新配方。例如,已经证明,仅仅使用氨基酸l -酪氨酸与佐剂配方相结合,就可以作为肽疫苗的储存库。这种效果可以提高肽的持续时间和有效性,并且被发现与反复注射肽的效果相似。尽管最终研究表明该策略并不比重复接种疫苗更好,但这种储备效应仍然有其好处,即允许较少的疫苗接种达到相同的效果。
被称为纳米凝胶的交联聚合物网络也在探索中,它可以根据不同的尺寸、电荷和特性进行定制,从而通过pH值或酶裂解等触发因素释放其有效载荷。事实上,一个小组利用了这一点,他们设计了一种纳米凝胶,可以在还原环境中释放肽负载,就像在核内体中发现的那样。他们在体外和体内实验中发现,纳米凝胶疫苗在用佐剂刺激CD4+和CD8+反应方面优于可溶性SLP,尽管CD4+反应在体内不如在体外那么强。
最后,一个小组设计了一个巧妙的PPV递送平台,该平台由电荷修饰的TLR7/8a共轭物组成,无论其共轭肽是什么,都能够自组装成精确的20nm直径的颗粒。自组装颗粒诱导的CD8+ T细胞应答比相同剂量的PLGA和脂质体高20倍。体内实验还显示,与可溶性SLP和微颗粒(直径大于200 nm的颗粒)相比,纳米颗粒在M39小鼠的淋巴结中积累更多,并且产生更高的CD8+ T细胞反应,并显着降低肿瘤生长速度。由于该系统似乎可以在不考虑肽负载的情况下工作,它可以减少传统载体系统所需的经验测试,同时减少肽负载的可变性和对肽完整性的潜在损害。
基于肽的癌症疫苗联合疗法
基于肽的癌症疫苗和免疫检查点抑制剂
以肽为基础的癌症疫苗作为一种单一疗法尚未在临床中显示出有效的反应。然而,迄今为止的数据表明,基于肽的癌症疫苗可以与其他药物或疗法联合使用,以提高单个单一疗法的疗效。一个突出的例子是基于肽的癌症疫苗与检查点抑制剂(如抗PD-1)的结合。检查点阻断作为免疫系统的刹车来调节T细胞反应,对于自我耐受和预防自身免疫性疾病至关重要。然而,检查点阻断也通过抑制肿瘤上的效应CTL功能来破坏癌症免疫治疗。检查点抑制剂阻断这种作用,克服免疫抑制,使抗原特异性T细胞对肿瘤产生更大的反应。通过将检查点抑制剂与基于肽的癌症疫苗相结合,免疫系统从抑制中释放出来,使其能够特异性地靶向癌细胞。
在这篇综述中,许多小组将他们的治疗与检查点抑制剂和其他抗癌药物联合使用,以测试联合治疗的疗效。Liu, Z.等人发现以DEC-205为靶点的ScFv-HPV E7 SLP融合后,PD-L1的表达更高,并且当抗PD-L1抗体与疫苗联合使用时,能够显示出更有效的应答。Zom, G.G.等人使用Pam3CSK4-TLR-SLP融合作为单药治疗的治愈率为10%,然而当与宫颈癌化疗药物顺铂联合使用时,生存率增加到71%,光动力治疗的生存率增加到89%。作者列举了可能的原因;免疫抑制性骨髓细胞耗竭,TNF-α敏感性增加,或诱导免疫原性细胞死亡。最后,Belnouse, E.等人发现,将他们的模块化自佐剂疫苗策略(由具有多抗原结构域的CPP和TLR2/4激动剂组成)与抗PDL1 治疗相结合,比单独接种疫苗获得更大的疗效。这充分说明,即使使用靶向基序或PRR激动剂来增强肽疫苗的免疫原性,以肽为基础的癌症疫苗作为单一疗法仍然不如与其他治疗策略联合使用。这归因于肿瘤免疫学的复杂性和肿瘤微环境的抑制性。
基于肽的癌症疫苗与现有癌症疗法的结合
将基于肽的癌症疫苗与现有的抗癌疗法相结合是很常见的,因为患者通常接受既定的化疗、放疗和免疫疗法作为标准护理实践的一部分。例如,曲妥珠单抗是一种用于治疗乳腺癌的抗HER2单克隆抗体,已被证明使HER2+肿瘤细胞更容易受到抗体依赖性和T细胞介导的细胞毒性的影响。在一项研究中,anti-HER2 antibodies enabled DCs to expand HER2-derived peptide E75 specific CTLs greater than peptide alone 。抗HER2抗体的体内实验显示,自发和植入式HER2小鼠模型中抗原特异性ctl的增加相似。在一项将曲妥珠单抗与GM-CSF和E75联合使用的IIb期临床试验中,发现该疫苗是安全无毒的
另一组将他们的肽库与多西他赛(一种用于治疗去势抵抗性前列腺癌的标准化疗药物)联合使用。多西紫杉醇已被证明可以通过减少Treg细胞数量来减轻肿瘤内的免疫抑制,并且人们认为,将多西紫杉醇与肽疫苗联合使用可能会增强其疗效。不幸的是,在一项随机II期试验中,该组合没有显示出强大的协同效应,即使PSA水平降低和免疫抑制MDSCs减少,也没有增加总生存期。
环磷酰胺(CPA)是一种高剂量具有直接细胞毒性的化疗药物,但在低剂量使用时具有免疫调节作用,包括抑制Treg细胞和调节抗原特异性T细胞反应。在一项随机II期试验中,研究了个体化肽疫苗(PPV)与CPA联合治疗先前治疗过的晚期胆道癌患者的疗效,与PPV和CPA联合治疗相比,预先接种过个体化肽疫苗的pbmc患者使用PPV时IFN-γ没有显著增加。然而,在临床环境中,他们发现与单独使用PPV相比,PPV/CPA联合使用的无进展和总生存期增加了一倍,IL-6降低;较低的IL-6提示预后较好。然而,当使用PPV/CPA联合治疗时,低剂量CPA治疗所显示的Treg减少并未发生,并且MDSCs的频率和数量观察到混合的情况,这与总生存期的增加无关。综上所述,这表明尽管与临床结果相关的结果是有希望的,但需要更多的研究来优化PPVs与CPA的组合。
三个研究之间的混合结果突出,强调需要仔细考虑的实验设计和需要实证调查的组合值得追求。特别是在使用联合疗法时,剂量、给药途径和时间等变量的变化可能对疫苗的能力产生重大影响。
调节基于肽的癌症疫苗功能的新疗法
正在研究的一些药物与基于肽的癌症疫苗联合使用并不具有直接的抗癌特性,但有助于调节基于肽的癌症疫苗发挥作用所需的机制。例如,Avasimibe是一种ACAT1抑制剂,它可以阻止胆固醇的酯化和脂筏的衰减,从而增加CD8+ T细胞中的胆固醇水平,促进T细胞受体信号转导,增强抗肿瘤反应。一个研究小组发现,在预防性小鼠模型中,通过将Avasimibe与KRAS多肽疫苗联合使用,与单一疗法相比,肿瘤体积显著减少,TME中的CD8+ T细胞水平增加。在治疗模型中,Avasimibe/KRAS联合治疗没有显示出肿瘤发生的显著减少,但确实显示出肿瘤负荷的减少和肿瘤进展的延迟。这再次强调了根据疫苗设置可能出现的效力差异。
这篇综述的大部分内容都集中在CD8+ T细胞活性如何对强抗肿瘤反应至关重要,CD4+ T细胞在激活和维持免疫反应中发挥支持作用。然而,有证据表明CD4+活性在直接产生所谓的细胞毒性CD4+ T细胞抗肿瘤反应中的重要性。细胞毒性CD4+ T细胞的特点是它们能够产生颗粒酶B和穿孔素。Kumai T.等人专注于诱导与CD8+相反的抗肿瘤CD4+反应,通过将CD4+表位特异性肽与TLR配体、CD40单克隆抗体和各种共刺激激活剂结合以优化CD4+活性。OX40 (CD134)是共刺激激活剂的一个例子,它通过促进存活和增殖来维持T细胞的长期活性。OX40激动性单克隆抗体与CD4+表位肽疫苗联合在治疗模型中显示出增强的肽特异性CD4+ T细胞应答,并减缓肿瘤进展,同时增加IFN-γ、TNF- γ和颗粒酶B的产生。有趣的是,这将指向可能的细胞毒性CD4+活性,因为在CD8+缺失的小鼠中,抗肿瘤反应仍然降低。这项研究强调了在设计肽疫苗策略时考虑CD4+和CD8+活性的重要性;将其与CD8+特异性疫苗结合观察其效果将是一件有趣的事情。
溶瘤病毒是一种利用工程病毒靶向并杀死癌细胞的新兴疗法,2015年FDA批准了首个溶瘤病毒。一组将由HPV16产生E6和E7序列的Maraba病毒与HPV16/18 E6和E7野生型序列表位定位衍生的SLP肽结合。通过使用SLP作为Prime -boost疫苗策略中的“Prime”,他们发现CD8+ T细胞释放的IFN-γ和TNF-α增加,但与SLP Prime -boost单药治疗相比,小鼠模型中的存活时间没有显著增加。这一策略值得进一步研究,以优化疫苗和给药策略,进行更多的试验,并区分肽靶点和病毒。
结束语
基于肽的癌症疫苗是一种多样化和通用的手段,通过将肿瘤抗原表位抗原呈递到T细胞,引发细胞介导的抗肿瘤反应。然后,被激活的T细胞识别并对癌细胞表面的肿瘤抗原作出反应,启动免疫反应,随后导致T细胞介导的癌细胞杀伤。许多缀合物和聚合物被用于增强基于肽的癌症疫苗的免疫原性,通过将肽靶向特定亚型的免疫细胞,或通过含有刺激分子来增加树突状细胞的激活和成熟。许多研究小组已经显示出将多肽疫苗与化疗药物以及最初不是作为抗癌药物设计的药物结合使用的良好结果。其他人正在将肽疫苗整合到高度可定制的疫苗载体系统中,将CD4+和CD8+表位、佐剂和靶向基序整合到单个颗粒中。一般来说,以肽为基础的癌症疫苗作为单一疗法难以达到疗效,但作为联合治疗策略的一个组成部分显示出巨大的希望。联合治疗可能是肽基癌症疫苗作为一种可行的临床治疗方法所需要的方法。
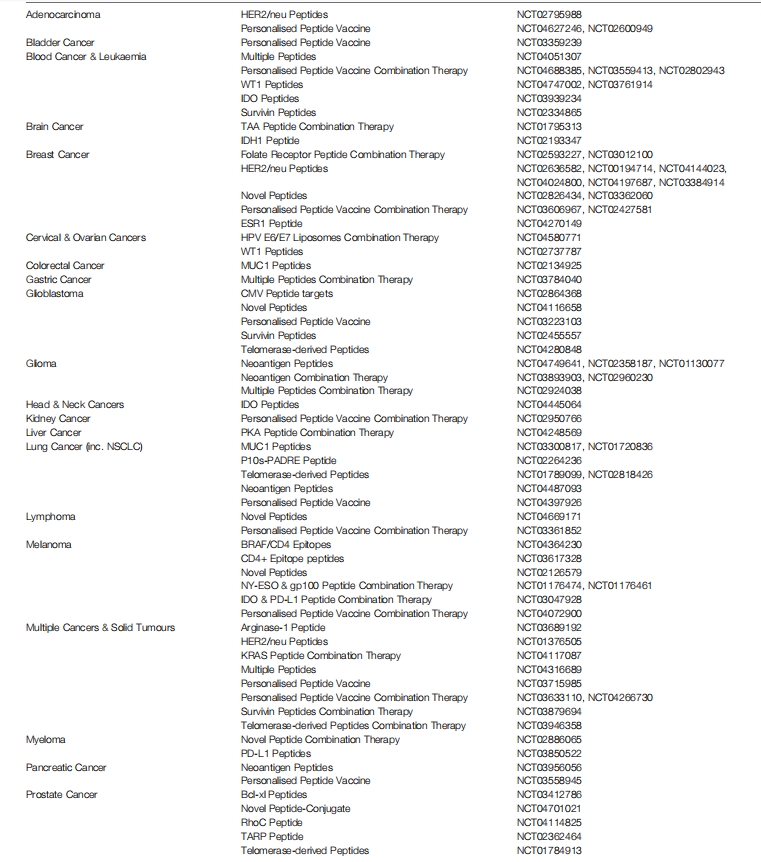
随着疫苗越来越多地针对个体患者定制,个性化肽疫苗代表了一种有希望的候选疫苗。个性化肽疫苗的设计和制造目前是一个昂贵且耗时的过程,但随着新的测序技术、生物信息学、T细胞表位预测和改进的制造实践的出现,未来将成为一个有价值的工具包。从这篇综述中,我们可以认识到设计基于肽的癌症疫苗的复杂性,以及在递送方法和模式、半衰期、表位选择和免疫原性之间取得良好平衡以产生有效的疫苗策略的挑战。虽然本综述中概述的许多研究是临床前或临床试验的早期阶段,但临床中基于肽的癌症疫苗的研究很多。截至2021年5月,利用基于肽的疫苗策略治疗癌症的I期或II期临床试验接近80项,其中20项目前处于活跃状态,自2019年初以来已完成20项。表1总结了目前正在进行和/或正在招募的基于肽的I期和II期癌症疫苗试验。名单上最突出的是针对乳腺癌、肺癌、血癌和脑癌的基于肽的癌症疫苗。显示目标的多样性,基于肽的癌症疫苗正在进行试验。然而,很明显的是缺乏超过II期的试验,这说明了目前基于肽的癌症疫苗所面临的有效性问题。然而,令人鼓舞的是,在目前的试验中,有一个明确的趋势是采用更个性化的方法来选择患者新表位,越来越多的人关注基于肽的癌症疫苗与其他癌症治疗策略的联合使用。为了进行更详细的分析,Bezu, L.等人专业地整理和回顾了截至2018年基于肽的癌症疫苗的试验。