
摘要:恶性肿瘤已经威胁到人类的健康。随着对肿瘤免疫循环机制的深入了解,肿瘤免疫诊断和治疗已成为研究的热点。多肽具有良好的亲和力、高特异性、良好的生物相容性、易修饰等特点。肽试剂在肿瘤免疫诊断和治疗中具有广阔的应用前景和巨大的应用潜力。综述了针对肽探针的筛选和构建的一些新方法和新策略。此外,我们还重点研究了靶向蛋白基肿瘤免疫成像和蛋白基免疫检查点治疗的一些研究进展。
分子识别是分子间通过非共价键形成的特异而专一的相互作用. 在生物体系内, 分子识别网络精确控制着高度复杂的生命过程. 发现新的分子识别体系, 针对特定靶点建立高亲和力及高特异性分子检测新方法, 是精准医疗下对于新型靶向诊疗技术的迫切需求. 与抗原-抗体识别相比, 低分子量的识别元件具有如靶向多肽、核酸适配体等独特优势. 其中, 靶向多肽是指针对特定的生物靶标具有特异性亲和作用的肽分子. 多肽由几个到几十个结构、性质、功能各异的氨基酸按照一定的顺序通过酰胺键连接. 多肽虽然体积小、结构简单, 但是通常具有与天然蛋白/抗体类似的生物学功能. 相比抗体识别, 靶向多肽穿透性强、免疫原性低、易于化学合成与修饰、批次重复性高; 相比其他类型的低分子量单元, 如核酸识别等, 由于氨基酸种类更多且亲疏水性、电荷各不相同, 多肽具有更高度的多样性和更巨大的信息量[1,2]. 因此, 通过有效的筛选、合理的设计和多模式的合成策略可以产生多种功能性的靶向多肽. 此外, 多肽还具有一种与生俱来的能力, 即可在特定的条件下实现可控自组装. 多肽可在氢键、π-π堆积、疏水作用、静电力等驱动下, 自发组装形成有序的超分子拓扑结构, 如纳米管、纤维、囊泡、片层等, 展现出单分子或分子低聚体所没有的特性[3]. 自发的聚集和组装使得局部配体“密度”增高, 可与靶标实现多价结合. 由于多肽紧密组装, 能避免被酶降解, 具有生物稳定性. 尤其是多肽具有生物活性和生物相容性, 能够赋予超分子探针独特的生物学功能[4]. 综上所述, 不论是针对小分子多肽探针识别还是纳米化的自组装多肽靶向诊疗, 都已经成为分子识别领域的研究前沿, 取得了众多的研究成果. 目前已有很多综述对此领域进行了报道[5~7]. 本文简述了关于多肽分子探针筛选构筑的新方法和新策略, 并选取此前鲜有报道的多肽分子探针在肿瘤免疫诊疗领域的应用角度进行了详细综述. 希望通过本文传递近来研究靶向多肽探针筛选构筑领域一些思路新颖并具有借鉴意义和应用前景的研究成果.
2 小分子靶向多肽探针筛选的新方法
从数千万计的多肽配体文库中高效地筛选出针对靶标具有亲和力和特异性的多肽既是关键, 也是难点. 传统的组合化学筛选方法周期长、效率低、分析鉴定耗时, 传统的噬菌体展示方法难以进行非天然氨基酸插入或修饰, 具有局限性. 因此, 发展新的筛选方法是高效获得靶向亲和配体的关键途径. 显然, 实现高效筛选的手段其一是采用合理的设计使肽库简并, 其二是发展新型高通量的方法可以快速完成筛选.
赵课组[8] 利用反义肽简并性和正义肽-反义肽靶向识别原理构建了靶向小分子多肽文库. 反义肽现象是根据遗传密码的简并性由核酸向蛋白衍生出来的一种自然现象, 相当于把大量随机的氨基酸排列组合用核酸碱基编码. 例如, 可将一个库容量为20 10 的十肽全库通过理性设计降低8个数量级. 利用反义肽作用的专一性, 筛选到新型的靶向多肽与关键膜蛋白的相互作用, 有效地干扰病毒对细胞的穿透. 作为亲和配基用于蛋白质的分析检测中, 可实现疾病相关诊疗探针的研发. 尤其是该课题组发展的新型溶酶体四次穿膜蛋白的靶向多肽在细胞定位、靶向杀伤、肿瘤诊疗方面具有广泛应用[9,10].
上述提及的两种手段各自用巧妙的方法实现了肽库的简并, 使得目标分子最大可能地留在小范围的肽库中. 然而, 很多情况下肽库简并并不能遵循一定的规律, 大规模的筛选不可避免, 开发一类高效而通用的高通量筛选技术非常有必要. 这就需要借助一些自动化的高效的筛选工具. 首先, 新型质谱技术的发展为高效的多肽筛选提供了强有力的工具. Yang课题组[12]基于新型的质谱技术发展了高通量糖基化肽段的筛选方法, 该方法基于阶梯能量的一步质谱采集法, 提高了糖肽鉴定的通量并开发了pGlyco 2.0糖肽检索引擎, 从糖链、肽段、糖肽三个层面对糖肽数据库检索进行精确质控, 从而大幅提升了N糖蛋白质组学分析的通量和精准度. 最后, 这一研究报道了目前最大的糖基化数据集: 在1%的假阳性率下, 研究人员在小鼠的5个脏器中鉴定到了超过一万条N糖肽.
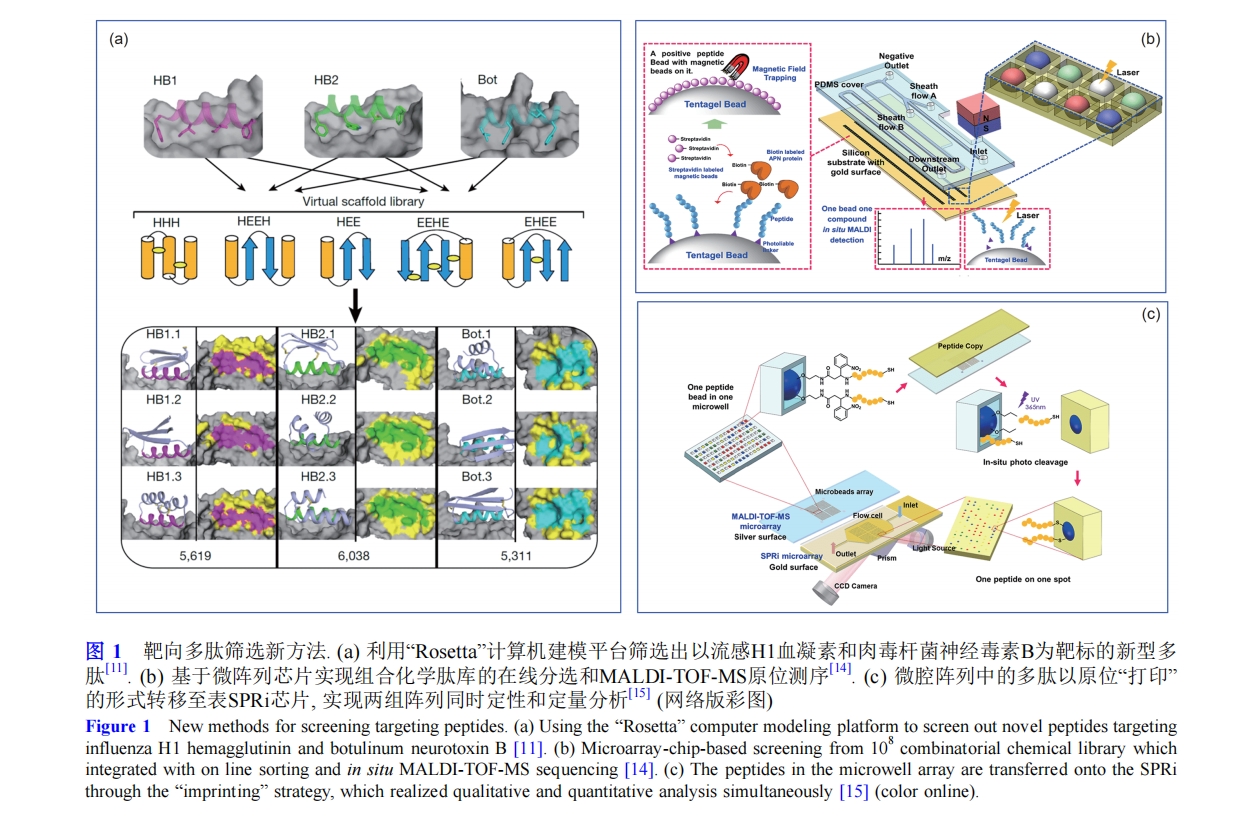
此外, 微流控芯片系统因分析效率高、可灵活设计、自动控制并通量集成等特点在高通量筛选方面显示了独特的优势, 利用微流控芯片技术进行配体文库筛选是研究热点之一. 例如, Xu课题组[13] 报道了一种高通量微芯片, 将不同的蛋白点在芯片上形成微阵列, 配体库与芯片进行相互作用, 与阳性蛋白或阴性蛋白结合均会在响应的点阵发出信号, 整个富集过程通过扫描微阵列就可以进行实时监测. 本课题组在微流控芯片高通量多肽筛选新方法上也进行了多年的研发. 基于光刻微腔阵列芯片, 实现10 8 库容量的组合化学肽库分选和基质辅助激光解吸电离-飞行时间质谱(MALDI-TOF-MS)原位测序. 全流程可在几小时内完成, 相较于常规方法数天的筛选周期, 效率显著提高(图1(b))[14]. 基于高效率筛选, 进一步发展高内涵筛选, 同时获得更多参数. 将微腔阵列中的多肽以原位“打印”的形式转移至表面等离子体共振成像(SPRi)芯片, 实现实时、在线、免标记检测, 创新地实现了两组阵列同时定性(原位测序)和定量(原位亲和力表征)分析, 检测灵敏度达到纳克级(图1(c))[15]. 利用上述的高效平台, 筛选得到新型多肽靶向多肽CP, 其针对肿瘤干细胞标志物CD133的K D 达到7.37×10 −9 M, 与多克隆抗体相当. CP血液循环半衰期近3 h,与常见多肽的活体半衰期只有数分钟相比, 稳定性显著提高. 将CP与新型近红外二区(NIR-II)信号单元IRT偶联后(CP-IRT)进行活体造影, 肿瘤/健康组织信号比值接近9, 显著优于此前报道的小分子光学探针. 进而, 其还可快速排泄,6小时内约90%的CP-IRT可经泌尿系统排出. 相比之下, 虽然同样具有靶向功能, 抗体修饰的IRT在肝脏大量富集, 显示了小分子探针的优势[16].
3 . 超分子多肽纳米探针筛选构筑的新进展
通过设计制备结构有序、构象可控、多价识别、性质稳定的超分子探针实现纳米尺度检测有望解决上述问题. 尤其是多肽具有生物活性和生物相容性, 能够赋予超分子探针独特的生物学功能. 近年来, 基于多肽超分子的生物医学检测已成为纳米分子诊疗研究的热点, 涌现了许多成果. 例如, 多肽在形成组装体过程中, 可改变肿瘤细胞黏度, 扰乱胞内生理平衡, 从而杀灭肿瘤细胞[17]. 又如, 在活体中, 一些多肽配体在受体处特异自组装形成纳米结构, 可作为药物或信号分子载体, 实现靶向输运[18]. 这些前瞻性工作彰显了超分子在性质和功能方面的优势.
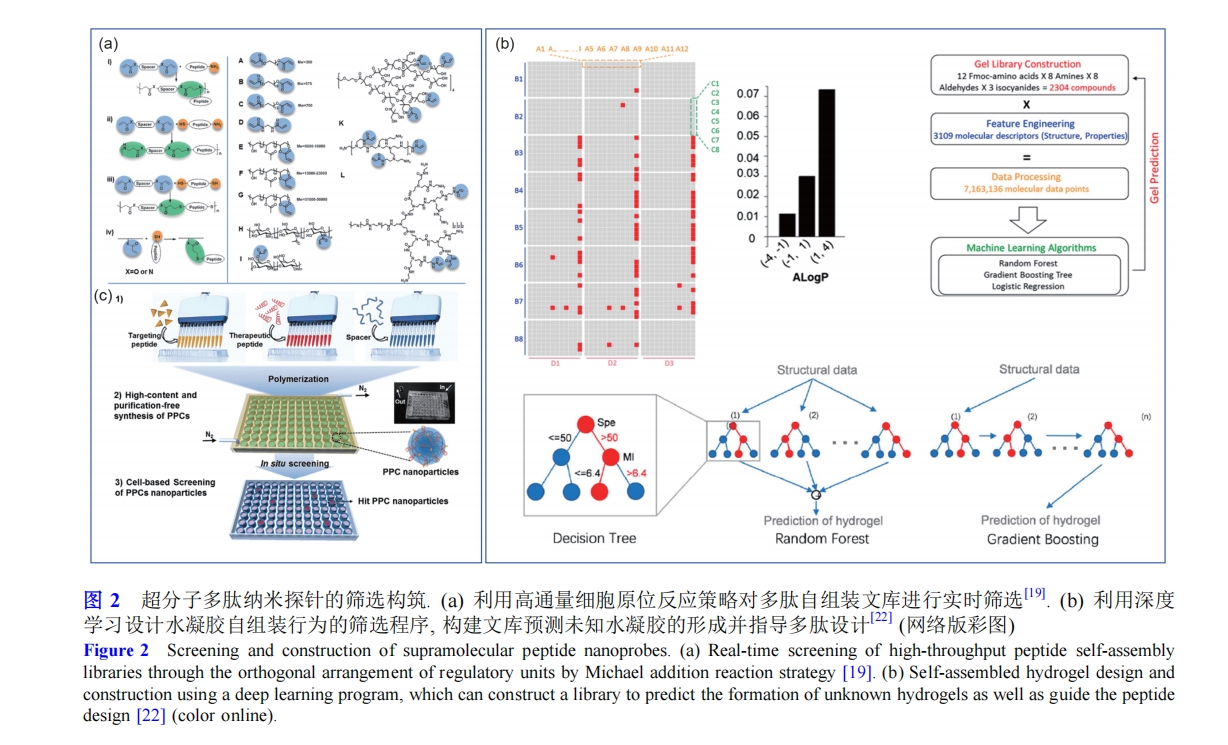
多肽类超分子材料还有一个显著的优点是组织相容性, 其中, 基于肽的水凝胶由于具有易于合成修饰、 可生物降解和有一定的力学性能等特点在组织工程、药物缓释等方面表现出广泛的应用潜力. 然而, 多肽水凝胶分子结构具有多样性, 此前对于多肽分子水凝胶材料既没有形成一定的构筑和预测规律, 也没有成熟可行的大规模筛选方法, 极大地限制了多肽水凝胶领域的研究进度. 随着人工智能技术的发展, 机器学习成为信息化时代发展科技的重要工具, 为众多领域的研究工作提供了新方法. Li课题组[22]建立了一个多肽水凝胶文库, 通过分析其化学特征并进行机器学习设计了一个多肽水凝胶自组装行为的筛选程序, 可以实现高通量筛选数据传输. 这种方法将物理结构、化学特性及其自组装行为联系在一起, 加快了生物医学用途的新型多肽分子的结构设计. 该研究通过高通量组合化学策略建立了容量为2304的多肽文库, 通过氨基酸单元的设计, 使得可形成水凝胶的多肽分子涵盖其中. 利用深度学习的方法, 使得机器习得并总结出自然界中多肽形成水凝胶的内在规律与机制, 实现对肽库中的每个多肽分子的计算、模拟与分析, 可以得到二维结构、三维结构、亲疏水、共轭等在内的3000余个生物、物理及化学参数并计算这些参数所代表的数据点之间的关系, 预测未知水凝胶的形成, 并指导设计(图2(b)). 随着大数据时代的到来, 利用人工智能方法辅助实现生物材料及超分子药物等的发现将成为趋势.
4 多肽在肿瘤免疫诊断中的应用进展

分子探针需要在血液中循环最终滞留于病灶部位, 环化是增加多肽稳定性的有效手段. Bristol-Myers-Squibb (BMS)公司筛选出了两类大环肽可靶向PD-L1, 展现出了良好的结合能力与生物稳定性, 这两种大环肽与PD-L1结合形成的复合物晶体结构也为PD-1/PD-L1途径的小分子阻断剂的设计提供了依据[29,30]. 其中WL12肽具有单个伯胺, 适合修饰, 常被放射标记后用于成像诊断. Nimmagadda课题组[26,27] 基于此分别设计了 64 Cu和 68 Ga修饰的WL12分子探针用于正电子扫描成像(PET)造影剂, 均可以在注射后60分钟之内快速而无创的成像. 除此之外, Li课题组[31]利用噬菌体展示技术筛选的多肽TPP-1也可通过与PD-L1特异性结合来激活T细胞. Zhang课题组[28] 用 18 F或 64 Cu对其进行标记并将其中一部分TPP-1聚乙二醇化形成四聚体, 并对制备的探针进行分析, 发现 64 Cu标记的探针显示出较好的成像潜能, 且聚乙二醇化后的探针在血液中的停留时间更长. 虽然这些研究不断提升着分子探针的性能, 但目前还多处于基础研究阶段.
5 多肽在肿瘤免疫检查点阻断中的应用进展
免疫检查点表达于免疫及相关细胞, 与肿瘤细胞上的受体结合后通过抑制免疫细胞的活性和增殖能力来抑制免疫应答, 从而诱导免疫逃逸[32,33]. 目前, 科学家发现了一系列可以作为肿瘤诊疗靶标的免疫检查点, 其中研究最深入的是在上一节中提及的程序性死亡受体1 (programmed death 1, PD-1)和细胞毒性T淋巴细胞相关蛋白4 (cytotoxic T lymphocyte-associated antigen-4, CTLA-4). 筛选及制备出的一些分子可以与免疫检查点或其配体特异性结合, 通过阻断其相互作用而使免疫细胞发挥正常功能, 这类化合物被称为免疫检查点阻断剂(immunocheckpoint blockade). 目前美国食品药品监督管理局(Food and Drug Administration, FDA)批准的免疫检查点阻断剂主要为抗体类药物. 上一节论述了抗体诊疗试剂的不足, 同样, 用免疫原性较低、稳定性高、合成简单的多肽替代单克隆抗体作为免疫检查点阻断药物也成为可能.

一般来说, 在多肽文库中筛选出的特异性多肽亲和力达不到转化临床应用的强度, 这也是多肽类诊疗试剂一直以来面临的挑战. 将PD-L1的内源性配体PD-1胞外域部分分离并进行改造后得到的分子, 其与PD-L1的结合能力可得到提高. Ring课题组[45]利用蛋白质定向进化技术将PD-1胞外域改造为具有高亲和力的PD-L1结合蛋白,K D 可达到110 pM级别. 另外, 将该蛋白用 64 Cu标记, 可用作PET成像示踪剂, 由于其极强的亲和力极有希望用于临床. 最近, Hong课题组[43]报道了一种β-发夹状的多肽树状大分子系统, 其是将PD-1胞外区结构域分离改造得到的多肽片段与树状大分子多价缀和, 形成的多肽-树状大分子复合物由于拓扑作用而折叠形成了β-发夹状, 不仅由于多价缀和而增强了靶向亲和力, 还具有较高的稳定性, 可用于活体内的靶向成像与示踪, 并且可发展成为纳米型PD-1阻断剂.
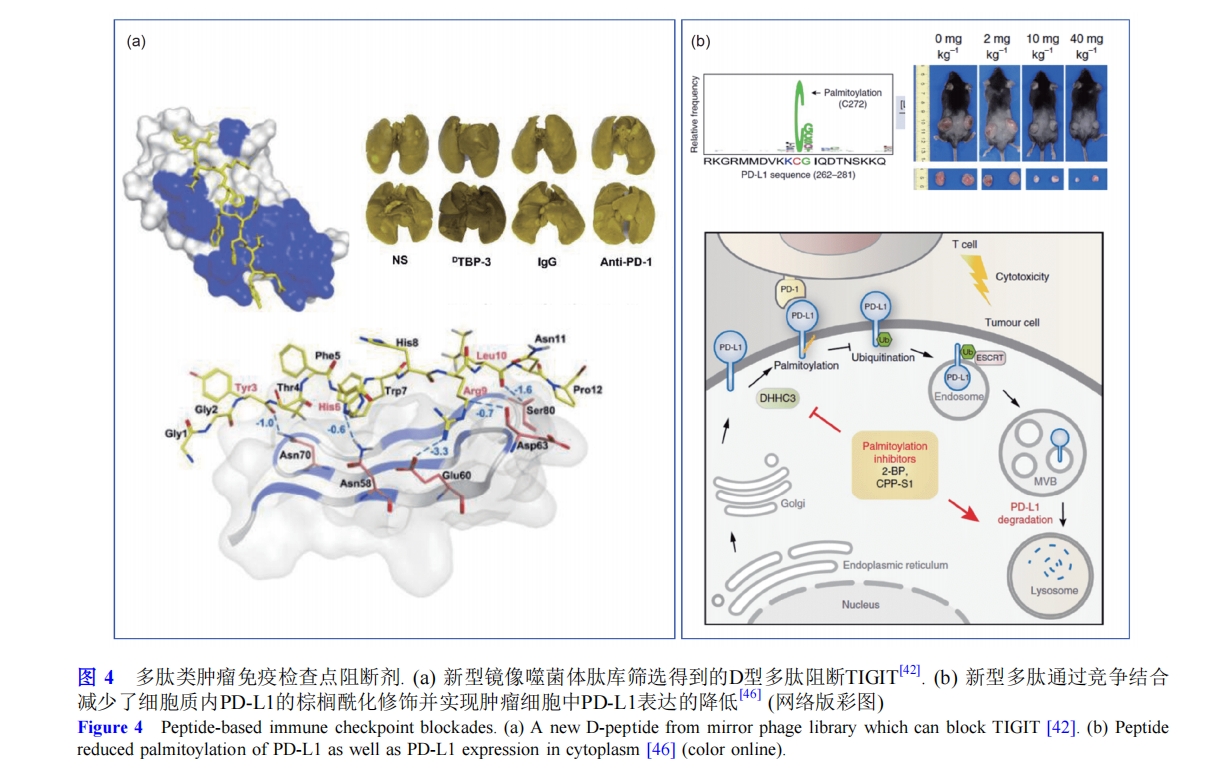
事实上, PD-L1不仅存在于细胞膜表面, 在细胞质中也有大量储存, PD-L1可通过囊泡动态转运到细胞表面, 与癌症的转移和复发密切相关. 研究人员发现, 在细胞质中存在的PD-L1会在酶的催化下被棕榈酰化修饰, 从而抑制溶酶体对PD-L1的降解, 增强PD-L1的表达和功能. Xu课题组[46]基于此开发出了棕榈酰化竞争性多肽CPP-S1, 由细胞穿透肽和PD-L1胞质结构域中棕榈酰化修饰作用的序列组成, CPP-S1通过竞争作用减少了PD-L1的棕榈酰化修饰, 降低了肿瘤细胞中PD-L1的表达, 从而增强了T细胞的免疫力. 对PD-L1来说, 该多肽既是阻断剂, 又是抑制剂, 这为基于免疫检查点筛选构筑新型靶向药物的策略提供了新思路(图4(b)).
对于多肽类诊疗试剂来说, 由于人体结构复杂精妙以及肿瘤微环境的错综复杂, 如何开发具有良好的亲和力和稳定性的多肽是需要解决的难点问题, 环化、定向进化或多价缀和为这些问题提供了一些解决策略. 另外随着对免疫检查点探索的不断深入, 研究者们可以开发出不同功能、种类的多肽类诊疗试剂, 更全面、有效地应对肿瘤免疫诊疗中出现的各种问题如普适性、耐药性等. 总而言之, 虽然目前肿瘤的免疫治疗效果极佳, 但目前仅对少部分患者起效, 免疫检查点诊疗技术仍然存在巨大的创新研发空间, 有望从多个思路和角度实现突破和革新.
6 总结与展望
通过理性的设计与高效的筛选发现新的具有亲和力、特异性和稳定性的多肽分子探针技术在生物医学领域具有极大的应用价值. 通过高效筛选和精准控释策略构筑的小分子和超分子多肽探针在肿瘤以及非肿瘤等重大疾病诊断和治疗方面发挥着重要作用. 当然, 在多肽靶向探针筛选研究以及在免疫诊疗的应用中, 我们还面临着一系列的困难. 首先, 生命体系极其复杂, 许多具有良好性能的多肽在溶液中经过严格的纯度、浓度、酸度控制, 可形成精巧的纳米结构, 然而这种结构在复杂的活体中却很难实现稳定可控. 加之目前报道的靶向分子探针大多从分子层面入手设计, 由于各单元的设计和合成都相对独立. 在复杂活体环境中各功能难以协同达到最佳.
此外, 组装序列通常模仿少数天然的蛋白序列, 难以在形貌及功能上有所突破. 随着有机化学、合成生物学的发展, 以及基于人工智能技术的深度学习等技术的辅助, 高效地锚定、筛选、合成具有更好协同性能、更精准选择性靶点和更高稳定性的多肽探针是该领域创新发展的必由之路. 尤其是在本文所论述的免疫相关的靶点识别与抑制方面, 与传统的靶点不同, 该类靶点涉及的生理病例过程及相关信号通路复杂, 涉及多器官、多系统联动, 因此, 诊疗试剂的稳定性、长效性和可控性显得尤为重要.
最后, 在发展新的功能性多肽探针的同时, 提高多肽探针的生物利用度和降低多肽探针的生物毒性是相辅相成的两方面研究. 一方面, 为了提高多肽探针的生物利用度, 往往对其进行改性修饰, 如引入一些非天然的分子, 如D型氨基酸、高分子等. 同时这些改性也带来一些生物相容性等方面的隐患. 两方面如何权衡与评估也依赖于生物化学、计算化学、纳米毒理学等领域的进一步发展.
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。