
前言:细胞穿透肽 (CPP) 是短肽(少于 30 个氨基酸),过去 30 年来主要用于基础和临床前研究。由于它们不仅能够转运到细胞中,还能促进药物或 CPP/货物复合物转运到质膜,因此它们在疾病诊断和治疗方面具有潜在应用,包括癌症、炎症、中枢神经系统疾病、耳科和眼科疾病以及糖尿病。然而,美国食品药品管理局 (FDA) 尚未批准任何 CPP 或 CPP/货物复合物。在将 CPP 转化为临床之前,应该解决许多问题。在这篇评论中,我们总结了基于使用 CPP 改善递送的临床前研究和临床试验的最新发展和创新,这表明 CPP 或基于 CPP 的递送系统具有出色的诊断治疗递送潜力。
成功的系统性药物给药通常包括一系列步骤,例如长循环、穿透生物屏障、受体细胞吸收以及内吞后内体逃逸到细胞质空间,每个步骤都有各自的限制。事实上,许多生物活性分子难以接近靶标,并穿透细胞膜以达到治疗效果。由于质膜作为有效的生化屏障,它们在防止外源性入侵方面发挥着关键作用。例如,肽和寡核苷酸已在各种治疗研究中得到广泛评估,但它们的跨膜效率往往相对较低,因此,在治疗部位达到所需的药物浓度具有挑战性。目前用于递送大分子的策略包括纳米颗粒、脂质体、病毒载体、微注射和电穿孔,可能导致高毒性、特异性差、免疫原性以及低递送效率和功效。因此,迫切需要一种高效、有效的将大分子递送到靶细胞的方法。
一般认为亲水性大分子只能通过经典的内吞途径被细胞吸收,然而一些具有膜穿透功能的多肽可以通过能量非依赖的途径将亲水性大分子转运到真核细胞中。它们被称为细胞穿透肽(CPP),又称蛋白转导结构域(PTD),是一类短肽(不超过30个残基),主要用于癌症、炎症、中枢神经系统疾病、耳部保护、眼部疾病和糖尿病等疾病诊断和治疗的基础和临床前研究中。它们不仅能够转运小分子药物、核酸、蛋白质、病毒、成像剂跨质膜运输,但也允许 CPP/货物复合物通过不同的内吞途径运输到细胞膜外,具体取决于 CPP 的类型 。与上述其他递送策略不同,CPP 可以以非侵入性的方式进入细胞,因为它们通常不会扰乱质膜的结构,并且被认为是安全且高效的。CPP 于 1988 年由两个研究小组首次引入 。Frankel等人和Green等人都观察到HIV转录激活因子(TAT)蛋白能够进入组织培养细胞,靶向进入细胞核,最终导致目的基因表达。1991年,Joliot等人发现触角足同源结构域(pAntp),一个由60个氨基酸组成的合成肽,能够被神经细胞内化。随后,Derossi等人在触角足同源结构域第三螺旋(RQIKIYFQNRRMKWKK)中发现了一个由16个氨基酸组成的短肽,命名为穿透素,能够穿透质膜。此后,各种CPPs相继从天然来源和合成来源被鉴定。
CPPs 已成功应用于不同类型的药物、纳米颗粒和脂质体的递送,用于疾病的诊断和治疗。尽管基于 CPP 的临床试验数量已大大增加,但事实上,美国食品药品管理局 (FDA) 尚未批准任何 CPP 或 CPP/货物复合物。在这篇综述中,我们将系统地总结过去 5 年 CPPs 在各种疾病诊断和治疗中的最新应用策略,并强调 CPPs 的临床前研究和临床应用。我们提出了 CPPs 的分类,并解释了这些肽的细胞摄取机制。我们将讨论 CPPs 在临床应用中的不足和局限性。回答这些问题将使我们能够开发更有效的药物递送系统。最后,我们将讨论CPP在不同疾病诊断和治疗中应用的各种新策略。
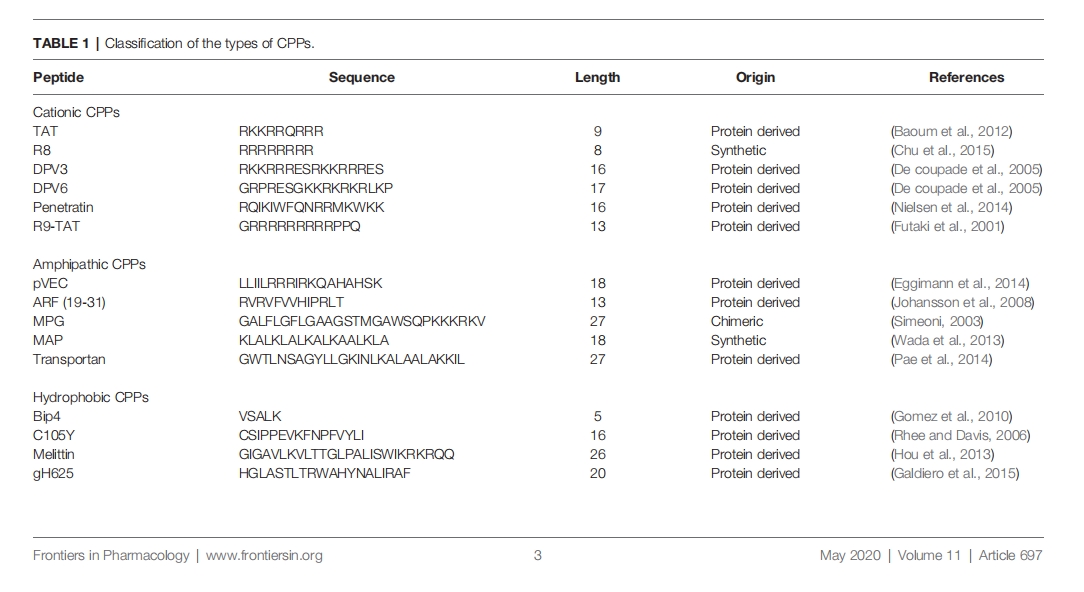
CPPs的分类

根据来源分类
根据形态分类
根据构象不同,CPPs可分为线性CPPs和环状CPPs。目前许多研究证实,环状CPPs相较于线性CPPs具有诸多优势。与线性CPPs相比,环状CPPs具有更高的细胞通透性,与细胞上靶受体的亲和力更高,从而通过受体介导的摄取进一步提高跨膜能力。此外,线性CPPs通常对蛋白水解敏感,导致体内药代动力学性质较差,而环状CPPs一般对蛋白水解有较高的抵抗力,同时,一些环状CPP无需经过内体降解即可被吸收,并具有靶向细胞核的特性
根据理化性质分类
根据理化性质的不同,CPPs可分为阳离子CPPs、两亲性CPPs和疏水性CPPs三类。在正常生理pH条件下,阳离子CPPs带正电荷,与细胞质膜有很好的亲和力,阳离子CPPs通过静电作用与带负电荷的细胞膜糖蛋白结合,通过不依赖受体的机制内化到细胞内。影响阳离子CPPs活性的关键因素是CPP结构中带正电荷的精氨酸的数量和位置,大多数阳离子CPPs通常含有5个以上带正电荷的氨基酸。聚精氨酸片段的细胞摄取能力最高,具有治疗潜力。研究结果表明,寡精氨酸的内化能力随其长度增加而增加,但就递送目的而言,最佳长度为R8至R10。过高的值会对细胞产生不可逆的副作用,并降低整体递送效率。核定位信号(NLS)是一种富含精氨酸、赖氨酸或脯氨酸的小肽,常见于CPP中。NLS可通过经典的核引入途径转运到细胞核中,由于NLS所带正电荷有限、穿透膜能力有限,因此常将其与疏水性或两性氨基酸序列结合,制成有效、多功能的两亲性载体,包括MPG和Pep-1。
目前发现的CPP中,两亲性CPP最为常见,占比超过40%。两亲性CPP含有极性和非极性氨基酸区,非极性区富含疏水性氨基酸(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸等)。一些两亲性CPP完全来源于天然蛋白质,如pVEC、ARF(19–31)。ARF(19–31)来源于肿瘤抑制基因p14ARF蛋白(19–31)的N末端结构域。通过两亲性CPP将疏水片段和 NLS 部分共价结合而获得的嵌合肽,例如 Pep1 (KETWWETWWTEWSQPKKRKV)、MPG (GLAFLGFLGAAGSTMGAWSQPKKKRKV) 均基于 SV40 NLS (PKKRKV) 。先前的研究表明,同一种两亲性CPP可能具有不同的二级结构,其与疏水/亲水界面的结合能力在不同条件下可能会发生变化。两亲性CPP,如MAP,能与带负电荷的磷脂发生强烈的相互作用,具有α螺旋结构的MAP会自发插入到脂质单层中。此外,肽/脂相互作用的结构分析表明,具有β-折叠结构的MPG比α-螺旋结构的MPG对电荷更敏感。
疏水性CPP数量相对较少,其结构中含有大量非极性残基或者仅含有少量带电氨基酸(不足序列的20%)。目前发现的天然疏水性CPP包括C105Y、Bip4和K-FGF。与已知的大多数两亲性阳离子CPP不同,疏水性CPP的肽序列对细胞摄取没有显著影响。
CPP 的细胞摄取机制
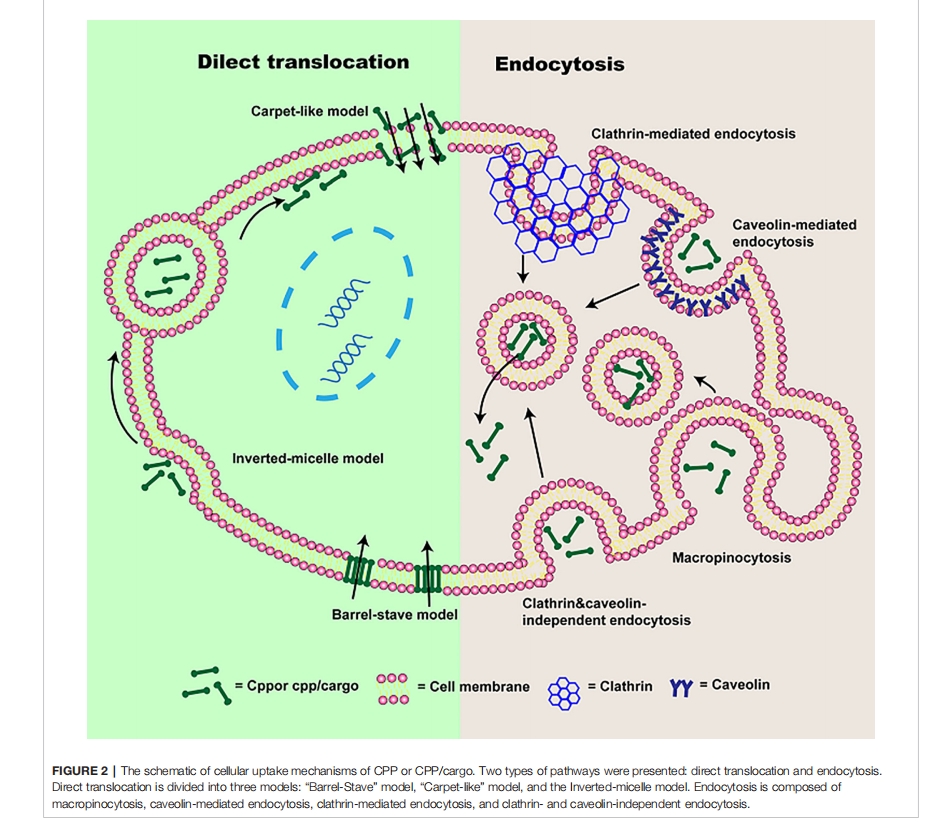
直接转运
直接转运又称非内吞吸收途径,是一种能量依赖性转运方式。直接转运最初通过磷脂双层与 CPP 或 CPP/货物之间的静电相互作用或氢键作用进行,随后CPP 或 CPP/货物通过成孔或膜不稳定作用进入细胞。根据转导机制不同,直接转运主要分为三种模式:“Barrel-Stave”模式、“Carpet-like”模式和反胶束模型,如图 2所示。
基于成孔的“桶状-壁状”模型中,两亲性CPP或CPP/货物插入细胞膜,其疏水区与细胞膜中的磷脂结合,而其亲水区与磷脂的亲水头结合,形成“桶状”孔道,跨膜运动增强,随后CPP被运送到细胞质中。而反胶束模型则依赖于磷脂双层的内陷和反胶束的形成,在此过程中,带电的CPPs或CPP/cargoes残基与细胞表面的磷脂结合,CPPs或CPP/cargoes的疏水区与细胞膜相互作用,形成倒胶束,进而通过倒胶束将CPPs或CPP/cargoes转运到细胞内。但值得一提的是,倒胶束模型适用于带有疏水性氨基酸残基的CPPs或CPP/cargoes。在“Carpet-like”模型中,CPPs或CPP/cargoes是通过CPPs与细胞膜之间的电荷相互作用转运到细胞内的,CPPs或CPP/货物像地毯一样覆盖在细胞膜表面,其疏水部分与细胞膜的疏水区相互作用。当CPPs或CPP/货物浓度较高时,其疏水部分会被细胞膜疏水核心翻转,细胞膜流动性增加。最终,细胞膜被破坏,CPPs或CPP/货物被运输到细胞内。但直接转运最适合与小分子货物相关的CPPs或CPPs进入细胞,大分子量的CPPs或CPP/货物主要依靠内吞作用进入细胞。
内吞作用
除了直接转运摄取外,CPPs 或 CPP/货物还可以通过内吞作用转运到细胞中。研究表明,能量依赖性内吞作用是大分子量 CPPs 或 CPP/货物的主要细胞摄取机制。到目前为止,四种不同的途径已被用于描述内吞作用,包括巨胞饮作用、caveolin 介导的内吞作用、网格蛋白介导的内吞作用以及网格蛋白和 Caveolin 独立的内吞作用,示意图也显示在图 1。
基于受体非依赖性和脂筏依赖性的巨胞饮作用是携带大分子货物的CPPs优先选择的内吞途径。在生长因子的诱导和肌动蛋白的刺激下,CPP/货物可以通过成熟的囊泡转移到细胞内。巨胞饮作用下的细胞摄取过程如下:首先,CPP/货物与膜蛋白聚糖相互作用,激活胞浆中的rac蛋白,rac蛋白发出信号触发F-肌动蛋白组织,肌动蛋白微丝收缩,细胞膜变形、突起,形成内吞囊泡,最后CPP/货物被内吞进入细胞,网格蛋白介导的内吞作用又称受体介导的内吞作用,是细胞特异性地摄取细胞外物质的过程。CPP/货物首先附着在细胞膜上的受体上,epsin蛋白与细胞膜相互作用后产生弯曲,随后通过募集网格蛋白和异四聚体蛋白(AP-2)形成小窝,并发展成含有CPP/货物的网格蛋白包被的囊泡,随后在细胞质中形成内体。而caveolin介导的内吞作用与网格蛋白介导的内吞作用类似,但与caveolin有关。在此过程中,CPP/cargoes会特异性地识别脂筏上的受体,脂筏是富含胆固醇和鞘磷脂的疏水区。Cavin-1与caveolin连接,随着cavin-1和caveolin复合物数量的逐渐增加,小坑形成并内陷。得到caveolin包裹的囊泡,形成内体。此外,还有一条不依赖网格蛋白和caveolin的内吞途径,主要发生在巨噬细胞等特殊细胞中。CPP/cargoes可被调理素识别和标记,并附着在细胞膜上的Fc受体上,当肌动蛋白受到刺激时,产生包裹在细胞膜上的CPP/cargoes,随后CPP/cargoes被转位到细胞质中。虽然能量依赖性的内吞作用是CPP/cargoes进入细胞的主要途径,但CPP/cargoes始终包裹在内体中,难以发挥其生物活性。因此,为了避免被溶酶体降解,CPP/cargoes必须逃离内体。有研究表明,pH梯度的形成、囊泡浓度的增加以及带不同电荷的内体膜与CPPs的吸引均导致膜变硬和破裂,导致CPP/cargoes逃离内体。然而,这仍然是一个挑战。
CPP在多种疾病诊断和治疗中的应用
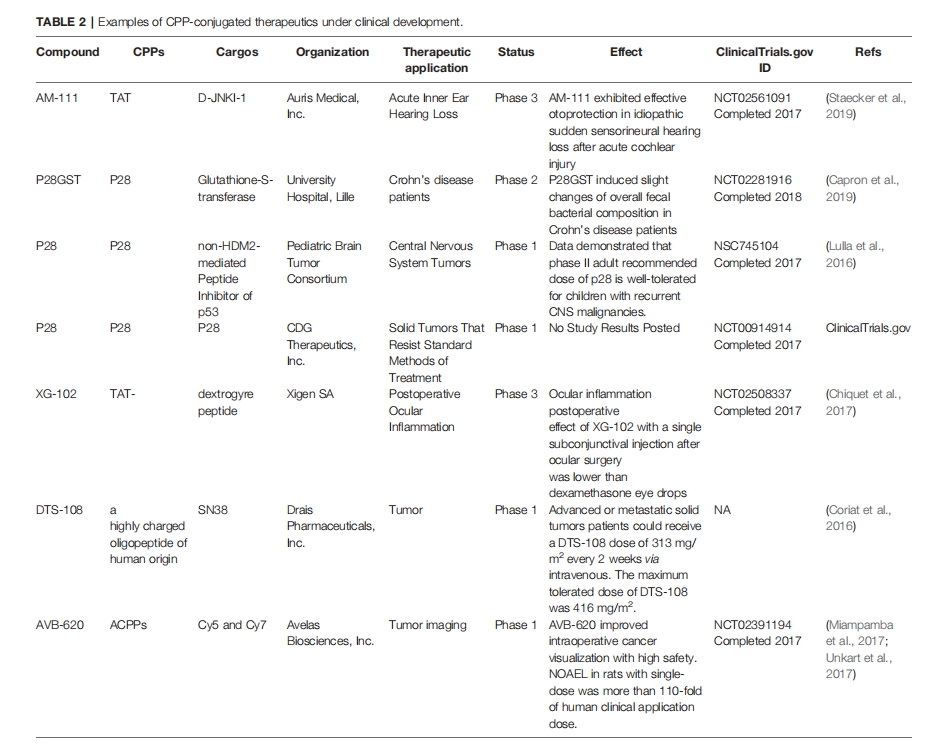
CPP在癌症治疗中的应用
大部分CPPs带有正电侧链,与细胞膜上高密度的阴离子电荷相互作用。不同长度的聚精氨酸在药物递送中被广泛应用。CPPs的阳离子电荷密度是影响药物转染效率的重要参数。Favaro等利用大肠杆菌设计了四种聚精氨酸融合的绿色荧光蛋白(R3-GFP-H6、R6-GFP-H6、R7-GFP-H6、R9-GFP-H6 )生物制备。带不同电荷的聚精氨酸尾部影响GFP变体的折叠状态,R7-GFP-H6、R9-GFP-H6可以在Tris葡萄糖缓冲液中自组装形成纳米颗粒。在与HeLa细胞孵育的早期阶段,单分子R3-GFP-H6、R6-GFP-H6、R7-GFP-H6通过CXCR4受体的细胞摄取随精氨酸残基数的线性增加而提高。当R7-GFP-H6组装纳米颗粒时,穿透性高于游离R7-GFP-H6。多价阳离子精氨酸增加了纳米颗粒的摄取,多聚化可以进一步增加内化效果。游离Rn-GFP-H6主要通过CXCR4依赖性途径进行内吞,寡聚化状态转换为受体独立的摄取机制。CPPs 的内化能力也与货物状态有关 。此外,Kadonosono等发现NRP1结合也能促进CPP/PTD外渗。CPP也被用来介导细胞对除蛋白质和纳米颗粒以外的细胞外囊泡的摄取。用聚精氨酸修饰细胞外囊泡,通过诱导主动微胞饮作用来提高内化率,精氨酸残基的数量影响有效的细胞内化率。十六肽精氨酸(R16)修饰的细胞外囊泡表现出相对有效的抗癌活性。

一般而言,线性结构的CPPs由于电荷数低,很难获得令人满意的寡核苷酸转染效率,导致纳米载体的络合性较差,结构不稳定。Yoo等利用二硫键合成了支链状的R9,并进一步以R9为载体构建了一种新型的生物可还原阳离子网络(B-mR9),支链结构对pDNA或siRNA具有强大的静电吸附能力。B-mR9在体外表现出良好的生物相容性和细胞内运输能力。此外,B-mR9 通过长达 48 小时的 EPR 效应表现出对肿瘤的特异性靶向作用。与对照组相比,B-mR9/siVEGF 显著抑制了 56.5% 的肿瘤生长,在 NCI-H460 荷瘤 BALB/c 裸鼠模型中的治疗效果优于 PEI25k 和 R9 载体。CPP 衍生的阳离子网络为设计基因递送平台提供了一种新方法。Wang 等人还利用基于 Chol 的 CPP 组装了一种 pH 敏感、生物相容性的胶束体系,该系统可以共同递送 ULK1 siRNA 和 AMPK 激活剂水环克拉辛,在临床前研究中通过调控程序性细胞死亡有效抑制肝细胞癌。近期研究证实 CPP 将成为 siRNA 寡核苷酸的新范式。
由于正电荷会引起非靶标毒性和全身毒性,CPPs 的临床应用范围较窄。阳离子或两亲性 CPPs 的穿透能力通常比中性 CPPs 更强。Gao 等人发现了一种新型的具有电中性的高疏水性环状 CPPs (环孢菌素 A,CsA),其在 MCF-7 细胞中的穿透能力比 PFV (PFVYLI) 和五肽 VPT (VPTLQ) 高出数倍,比传统的中性 CPPs 更有效。通过递送膜不可穿透的促凋亡肽 (PAD),将环孢菌素 A 的效率和毒性与 TAT 进行了比较。当 CsA 与 PAD 结合时,在用 CsA 测试的肿瘤细胞系中 PDA 的摄取提高了 2.2 到 4.7 倍,并且 CsA-PAD 的细胞摄取通常高于 TAT-PAD。CsA-PAD 在四种不同的肿瘤细胞系中的细胞毒性与 TAT-PAD 相似或更强,具体取决于细胞类型,但明显强于 PAD。在异种移植 MCF-7 裸鼠模型中,CsA-PAD 表现出与 TAT-PAD 相当的抗肿瘤活性,但全身毒性降低。电中性 CPP 可能具有更好的潜在应用价值体内分布优于阳离子CPP,但中性CPP的准确组织分布有待进一步评估,另一降低正向CPPs毒性和非靶向性的策略是利用多聚阴离子材料包裹纳米粒子,如透明质酸(HA),它是肿瘤表面特异性过表达标志物CD44的高亲和力配体。Zhao等制备了TAT和HA修饰的多功能脂质体用于递送10-HCPT治疗肝细胞癌(HA/CPPs-10-HCPT-NPs),利用低强度聚焦超声精确控制药物在肿瘤组织中的释放。HA修饰后脂质体的Zeta电位由+45.5mV逆转为-6.55mV。TAT修饰后脂质体的穿透深度在多细胞肿瘤球模型中提高了2.76倍。超声辅助下脂质体联合应用HA和CPPs对肝癌的抑瘤率明显高于其他组。HA 包覆纳米载体是 CPPs 应用的一个有价值且有前景的策略体内。
肿瘤治疗的主要挑战是预后不良,尤其是胰腺癌、神经胶质瘤和淋巴转移。难治性肿瘤的疗效缺乏重大进展,因为递送系统无法克服复杂的肿瘤微环境,将药物递送到治疗部位。CPP 可用作药物深入肿瘤的分子驱动器。胰腺导管腺癌 (PDAC) 的肿瘤基质中含有丰富的胶原纤维,可抵抗药物渗透。Lo 等人尝试解决 PDAC 中的靶标和肿瘤基质渗透挑战,合成了两种串联肽 (pTP-PEG-iRGD 和 pTP-iRGD) 以制备用于 siRNA 全身递送的混合胶束。它可以有效绕过PDAC的递送障碍,在三维类器官和原发性肿瘤模型中实现肿瘤穿透。此外,混合胶束复合的siRNA显着延缓了肿瘤的生长。CPPs可诱导货物穿过血脑屏障(BBB)用于治疗胶质瘤。Liu等还制备了阴离子随机卷曲多肽(PLG)包被的CPPs(PVBLG-8)胶束来运输针对胶质瘤的siRNA。PLG与PVBLG-8 / siRNA复合物缠结以在血清中获得稳定的结构,并将胶束的表面电位反转为负电荷。此外,胶束可以响应肿瘤细胞外微环境中的低pH值,从而发挥PVBLG-8的细胞穿透功能。在胶质母细胞瘤肿瘤球体和U-87 MG异种移植小鼠模型中,该载体比几种商业转染试剂(如聚(L-赖氨酸)(PLL)或Lipofectamine 2000)表现出优异的治疗优势.为了进一步提高CPPs在胶质瘤应用中的靶向性,将CPPs与胶质瘤归巢肽结合以特异性地转运siRNA。通过共价结合和非共价复合两种CPPs(PF14,PF28)与靶向肽的结合形式进行优化,以提高肿瘤特异性靶向性和基因敲除效果。作者建立了一种非共价复合的PF14:TG1 siRNA递送系统,该系统对U87细胞具有特异性,其基因沉默效率是PF14的2倍。共价结合的PF32的基因沉默效率明显低于PF14:TG1,可能是因为CPPs屏蔽了靶向肽与U87 MG受体的相互作用或阻碍了siRNA释放到胞质中。数据表明,靶向肽非共价复合的 CPP 是针对肿瘤进行 siRNA 靶向递送的可行策略。淋巴转移是肿瘤播散的重要途径,邻近淋巴结是肿瘤最初转移的部位,并进一步延伸至全身。目前针对淋巴转移的治疗主要通过由于血淋巴屏障的存在,静脉注射卡巴他赛纳米粒子的非靶向性和穿透能力较差。R9修饰的卡巴他赛纳米粒子(R9-CN)粒径为13nm,带微量正电荷,经证实静脉注射后具有明显的淋巴靶向性和深层穿透作用,可用于抗转移治疗。R9-CN的荧光信号在原发肿瘤部位至少维持24小时的高水平。在乳腺癌淋巴转移模型中,R9-CN显著抑制了1.4倍的肿瘤生长速度,对肺转移的抑制率为63.3%。CPPs修饰纳米粒子是一种有效的抗转移平台,具有深层淋巴穿透性。
CPP 在炎症中的应用
CPP 在中枢神经系统疾病中的应用
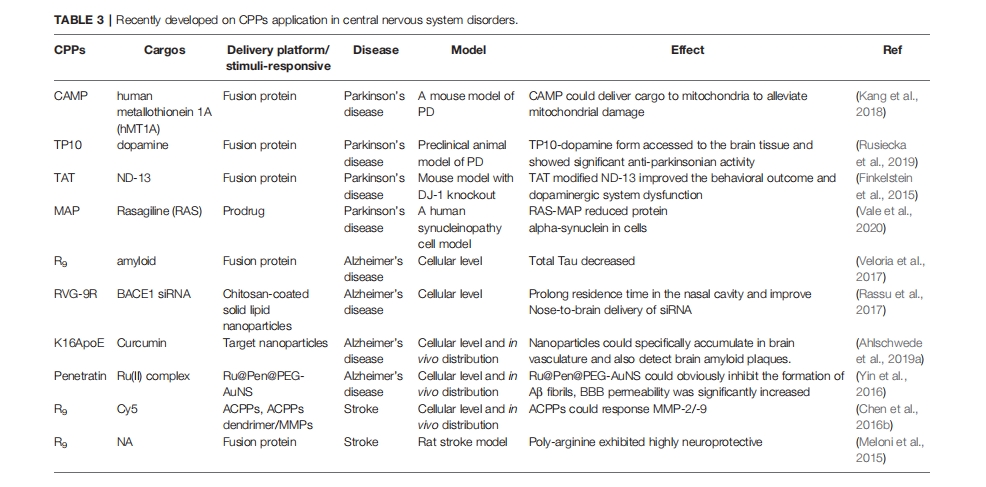
CPP 是治疗帕金森病的有效药物脑内递送工具。Kang 等利用 TAT 和线粒体靶向序列 (YGRKKRRQRRRLLRAALR-KAAL) 合成了一种融合 CPP,命名为 CAMP,并用它将抗氧化蛋白人类金属硫蛋白 1A (hMT1A) 递送到线粒体中,靶向 ROS 损伤,以预防帕金森病。CAMP-hMT1A能有效挽救帕金森病小鼠模型的运动障碍。Kim等构建了一种PEP-1-PON1融合蛋白,将PON1转导到细胞中,以防止LDL和HDL氧化引起的炎症,氧化LDL水平与帕金森病有关。PEP修饰后,神经母细胞瘤SH-SY5Y细胞和小胶质细胞BV2细胞对PON1的细胞摄取显著增强。腹腔注射后评估了PEP-1−PON1在体内穿过BBB的递送能力,通过免疫组织化学观察PON1在脑内的生物分布。PEP-1−PON1大量聚集在中脑的黑质区域。然而,未修饰 CPP 的 PON1 未发现具有脑递送。PEP-1–PON1 降低了 MMP-9 的表达,并保护多巴胺能神经元免于 MPTP 诱导的小鼠帕金森病模型中的细胞死亡。Ahlschwede 等人构建了壳聚糖修饰的 PLGA 纳米颗粒,以延长血浆半衰期并提供针对脑血管淀粉样蛋白沉积物的靶向能力,用于治疗阿尔茨海默病。阳离子血脑屏障穿透肽(K16ApoE)通过物理吸收添加到纳米粒子表面,产生血脑屏障转胞吞作用。在接受 DutchAβ 40 治疗的小鼠中,靶向纳米粒子的血浆 AUC 比 K16ApoE 靶向纳米粒子高约 23 倍。然而,在 K16ApoE 修饰后,靶向纳米粒子在 DutchAβ 40 治疗小鼠的大脑各个区域的分布增加了 7 到 9 倍。结果表明,K16ApoE 可以诱导纳米粒子在大脑中的积累,从而降低血浆药物浓度。K16ApoE 修饰的纳米粒子显示出显著更高的大脑摄取,还可以提供特定的 MRI 对比来检测大脑淀粉样斑块。TAT 也是一种脑渗透性载体,已用于阿尔茨海默病治疗。此外,已证明TAT可以与细胞外脑淀粉样蛋白沉积物的硫酸肝素氨基葡聚糖结合,从而靶向治疗阿尔茨海默病。MMP 参与了中风后的神经血管损伤,ACPP 的特洛伊木马策略可用于中风特异性检测。陈等人设计了一种明胶酶可激活的 CPP,用于检测培养原代神经元和体内缺血小鼠脑中的 MMP 活性。R9的细胞穿透功能被阴离子聚谷氨酸屏蔽,它们通过MMP-2/-9裂解肽接头结合。Cy5结合的ACPP响应中风衍生的MMP的高表达,从而增加中风检测的细胞摄取。此外,CPP还具有针对中风的神经保护作用,例如聚精氨酸和富含精氨酸的CPP,随着精氨酸含量的增加功效增强。它们具有减少谷氨酸诱导的神经元钙内流的能力,以及由硫酸肝素前体聚糖介导的内吞作用诱导所需的神经保护作用。CPP是改善中枢神经系统疾病治疗药物脑输送的有前途的工具。
CPP 在耳部和眼部保护中的应用
创伤性急性神经性听力损失越来越受到重视。JNK 通路抑制剂 D-JNK-1(AM-111)是一种治疗急性耳蜗损伤的药物。D-JNK-1 经 TAT 修饰,可通过局部给药途径快速内化。AM-111 的 III 期临床试验已于 2017 年完成,AM-111 对急性耳蜗损伤后特发性突发性神经性听力损失具有有效的耳部保护作用。
眼球由两部分组成,前段包括角膜、结膜、房水、房水、晶状体和虹膜,后段包括玻璃体、后巩膜、脉络膜、视网膜。它们共同形成一道生物屏障,通过多种静态、动态和代谢屏障保护眼部,同时阻止眼部治疗药物的输送。局部用药适用于前段疾病,局部注射适用于后段疾病。眼部的生理学对眼部药物有效输送是一个挑战,(1)角膜对亲水性生物大分子具有很强的抗性,(2)局部注射后药物进入全身循环系统。CPP 是眼部药物输送的潜在工具,可提高跨屏障的生物利用度。CPPs 的结构对局部给药后的眼部分布有影响。Liu 等评估了几种阳离子 CPPs 的眼部渗透性,包括 TAT、聚精氨酸 R8、聚丝氨酸 S8、鱼精蛋白和穿透素。穿透素对细胞摄取和体外渗透具有最佳活性。Chu 等通过眼部局部给药制备了 iRGD 和 TAT 双修饰脉络膜新生血管靶向纳米粒子。iRGD 和 TAT 分别修饰后,纳米粒子的角膜渗透性提高了 5.50 倍和 4.56 倍。双修饰纳米粒子在体外具有最多的细胞摄取,并且在体内也表现出良好的靶向和渗透能力。Tai等开发了一种纳米复合材料,通过局部滴注的方式递送反义寡核苷酸(ASO)用于眼内肿瘤的基因沉默。通过缩合ASO,以聚酰胺胺(PG5)作为基因载体,并引入穿透素(Pene)以提高摄取效率。纳米级的PG5/ASO/Pene通过静电相互作用稳定地结合。纳米复合材料经Pene修饰后表现出细胞穿透和基因沉默能力。PG5/ASO/Pene还可显著抑制皮下和原位裸鼠肿瘤模型中的肿瘤体积增长
CPP 在糖尿病中的应用
目前胰岛素给药的常用方式为患者持续皮下注射,若能用口服胰岛素替代皮下注射,患者的痛苦将大大减轻。但胰岛素在小肠内不稳定,在肠上皮内通透性差,口服生物利用度低,因此需要开发一种改进的胰岛素给药系统。利用CPP给药是一种很有前途的候选方法。在前期研究中,当TAT与胰岛素B29赖氨酸残基共价连接时,可以显著提高胰岛素在Caco-2细胞培养模型中的渗透性,CPP制备的胰岛素的生物利用度是普通胰岛素的6~8倍。此后,包括聚精氨酸和穿透素在内的CPPs被视为胰岛素的潜在载体。Mariko等人的研究表明,胰岛素与寡精氨酸(R8)联合使用可显著增加肠道胰岛素的吸收,且不会对细胞产生明显的副作用,另一项研究,Mie Kristensen 等发现共价结合穿透素与胰岛素可增加胰岛素的上皮渗透,这是因为穿透素富含Arg和Lys残基,且具有较高的pI值,在生理pH下带正电荷,促进与细胞表面带相反电荷的成分发生静电相互作用。并证实CPP序列中精氨酸残基的存在是增强胰岛素上皮渗透的前提条件,聚精氨酸可以增强胰岛素在大鼠肠黏膜的传递,从而降低血糖水平,而这一作用也依赖于聚精氨酸肽的长度。在最新的研究中,Feng Guo等人将两亲性壳聚糖衍生物(ACS)与CPP共价结合,制备出用于口服胰岛素输送的纳米载体。作者声称在药效学研究中,TAT修饰的纳米载体对胰岛素有明显的降血糖作用(降低40%)。可以预见,通过CPPs修饰纳米粒子表面是一种提高胰岛素吸收和输送的潜在方法。
CPP 作为成像剂和诊断的应用
显像剂是疾病诊断所必需的物质,能够追踪或及时提供药物治疗效果的信息。然而,由于许多非天然化合物无法被细胞膜吸收,因此将显像剂递送至患病组织仍然是一个巨大的挑战。CPPs由于其优异的渗透性、高亲和力、高稳定性,在显像剂的递送中起着非常重要的作用。许多研究者也致力于CPPs作为诊断显像剂的研究,并在临床前和临床上取得了一定的进展
CPPs 介导的分子探针作为诊断成像剂
为了准确探测病变部位,许多 CPP 介导的分子探针如可激活 CPP (ACPP) 、AVB-620已被研究用于分子成像。研究表明,ACPP 可以被肿瘤中过表达的基质金属蛋白酶激活,通过基于荧光共振能量转移 (FRET) 效应的 FI 和 PA 试剂可以对不同的酶进行成像。在 ACPP 工作的基础上,Miampamba 等人通过使用 Cy5 和 Cy7 作为荧光团对改变 FRET 的比率荧光读数,设计并开发了一种新型静脉注射 AVB-620。AVB-620是一种用于乳腺癌诊断的荧光成像剂。实验结果表明,AVB-620可以在荧光成像摄像系统下对肿瘤进行可视化,在转移性小鼠乳腺癌模型中对淋巴结状态的诊断具有很高的敏感性和特异性,为临床应用提供了良好的基础。此外,AVB-620在乳腺癌患者中处于临床I期研究阶段。结果表明,AVB-620在给药后通过对手术标本进行术中成像获得肿瘤特异性荧光检测剂量下是安全的,耐受性良好。此外,Zhu et al.还设计合成了CPPs介导的分子探针作为成像剂。他们首先合成了三种热活化延迟荧光(TADF)化合物(4CzIPN、NAI-DPAC、BTZ-DMAC),将TADF负载到两亲性CPPs(F6G6(rR)3R2)中,利用CPPs在水中自组装成纳米粒子,构建了TADF纳米粒子作为成像剂,具有细胞毒性低、膜穿透性强等优点,时间分辨荧光成像结果显示随着孵育时间的增加,更多的TADF纳米粒子在细胞内聚集,并且在细胞质中观察到更亮的荧光信号,说明了TADF纳米粒子作为成像剂的可行性。然而,TADF纳米粒子仍处于基础研究阶段,预计在体外或体内进行更多的研究。
CPPs 介导的纳米平台作为诊断成像剂
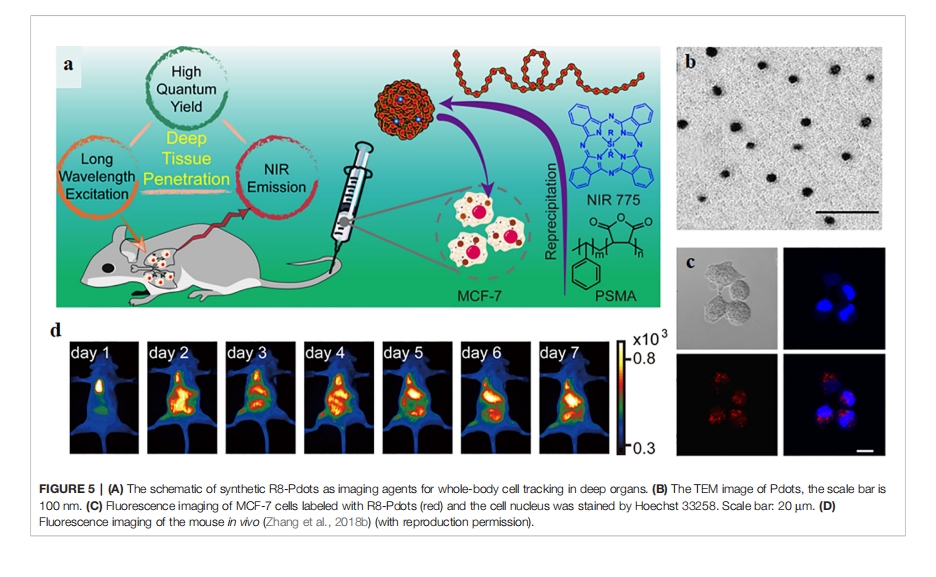
放射性标记的 CPP 作为诊断成像剂
放射性标记肽作为传统的显像剂,由于其高精度而得到最广泛的应用。放射性标记的CPPs作为肽介导的显像剂之一,也被开发用于疾病诊断。最近,一些放射性标记的CPPs如[ 18 F]-FPPRGD2、[ 18 F]Galacto-RGD和18F-RGD-K5已投入临床试验。[ 18 F]Galacto-RGD是第一个应用于人体的RGD PET示踪剂,在癌症患者中实现了高特异性和快速代谢。而[18F]-FPPRGD2是第一个被FDA批准用于人体的二聚RGD肽,表明其在胶质瘤中的治疗效果良好。此外,还将18F-RGD-K5应用于人体,并通过全身PET/CT测定其放射剂量。结果表明,18F-RGD-K5在膀胱壁的放射剂量最高,可通过频繁排尿来降低。此外,18F-RGD-K5可被肾脏系统快速清除。
CPP 介导应用的局限性
在过去的 30 年中,CPP 越来越多地用于各种疾病的诊断和治疗,是转染不同细胞类型的最有用的方法之一。CPP 是实现难以靶向的细胞和组织中治疗浓度的关键因素,从而改善其治疗效果。它们的成功不仅取决于其强大的跨膜递送特性,还取决于其多功能性。它们可以简单地合成、修改和改进。
然而,CPPs是一把双刃剑,它们可能由于各种原因引起严重的副作用。到目前为止,还没有一种CPP结合药物获得FDA批准,一些临床试验也已终止。原因如下:(1)体内组织稳定性。快速从血液中清除是一个缺点,因为治疗有效载荷可能在到达治疗部位之前在血液循环中因酶降解而降解。(2)免疫原性问题。由于CPPs的多肽特性,它会增加患者发生不良免疫反应的风险,这不仅会降低药物效果,还会引起不必要的免疫应激反应。(3)细胞毒性。由于正常组织对治疗剂的脱靶细胞吸收,CPPs可以被几乎所有类型的细胞内化。大多数研究报道CPPs的毒性较低,但应该注意到,任何物质在高浓度下都可能具有细胞毒性,在正式应用于患者之前,还有许多问题需要解答。CPPs的细胞毒性令人十分担忧。例如,MAP是一种典型的CPP,其结构与抗菌裂解肽相似,通过扰乱微生物细胞的质膜来影响微生物细胞。据报道,通过进行各种细胞毒性试验,MAP在浓度高于1μM时对各种细胞类型均表现出相当高的毒性作。由于MAP在人工胶束存在下的两亲作用,MAP可诱导质子、蛋白质、金属离子等的泄漏,从而因质膜受损而导致细胞死亡。(4)特异性低。阳离子CPP可以与糖胺聚糖结合是公认的事实,但CPPs是否能与特异性膜受体相互作用仍是一个未知领域。CPP结合药物的广泛组织分布可能会因局部浓度较低而降低药物效率。因此,最大限度地靶向特定细胞而忽略正常细胞是至关重要的。(5)进入胞质溶胶后在内体降解。CPPs和CPP/货物复合物在溶酶体降解之前从内体运送到胞质溶胶是另一个关键问题,人们认为,药物若停留在核内体中则无法发挥其生物学功能,因此需要对CPPs进行改造,使其能够有效地从核内体逃逸,从而加速载体从核内体释放到胞质溶胶中。同时,CPPs最重要的递送方式不仅是转运至靶组织或器官,而且要靶向进入细胞内的特定细胞器,如细胞核和线粒体,以实现有效的治疗。
综上所述,为了实现CPP的临床应用,克服CPP所面临的治疗难题,迫切需要优化低毒、高效、特异性的CPP。
基于 CPP 的优化
如上所述,CPPs的临床应用依赖于一些重要特性的改善,包括增强稳定性,延缓CPPs在循环中被酶降解,降低细胞毒性,提高内体逃逸效率和靶向性。
内体逃逸效率
到目前为止,已经提出了内体逃逸的潜在机制。一种可能的解释是基于带正电荷的 CPP,人们认为它们会与内体膜中带负电荷的成分结合。这将导致膜孔的形成,从而导致 CPP 泄漏。逃逸的另一个可能原因是带负电荷的磷脂和带正电荷的 CPP 之间形成离子对,从而跨越内体膜。
为了增加CPPs从内体中的释放,人们采用了一些最常见的策略,例如,使用融合脂质来改善CPPs在内体的释放。二油酰磷脂酰乙醇胺(DOPE)可以显著增加药物从内体的释放和活性。El-Sayed等人指出,DOPE与脂质体复合物或TAT-pDNA复合物结合后,转染效果显著提高。在pH值较低的内体中,DOPE从层状相转变为倒六边形相。这种转变相促进了CPP/货物复合物与内体磷脂的融合,导致膜不稳定,从而将CPP/货物复合物释放到细胞内空间,质子海绵效应也用于促进CPPs在胞内体的释放。当溶酶体的pH降低时,药物的缓冲能力可以捕获大量质子并引起Cl-内流,导致溶酶体渗透性肿胀,最终导致溶酶体破裂,将内化的CPP/货物复合物释放到胞浆中。另一种常用的药物是组氨酸,组氨酸中的咪唑基团可以质子化引起溶酶体渗透性肿胀和胞内体破裂,已被广泛用于增强TAT/pDNA复合物的基因表达。另一种有效的方法是使用膜破坏肽来促进CPPs在胞内体的释放( Wadia等,2004 )病毒能够轻易突破内体陷阱,因此将病毒融合序列与CPP/货物复合物结合,利用病毒的机制实现内体逃逸。源自流感病毒血凝素蛋白的HA2肽是一种pH敏感的融合肽。HA2肽的N端为α螺旋结构,可插入脂质体中。在内体内低pH环境下,构象变化使α螺旋结构暴露并与内体脂质融合,导致胞质中蛋白质和转运蛋白-肽核酸(PNA)复合物的复合物释放到内体
细胞器特异性递送:线粒体递送
线粒体被公认为细胞的“动力工厂”,控制着大多数甚至全部的程序性细胞死亡机制。在代谢性疾病的病因学中,线粒体功能障碍被认为是导致患者出现一些异常的罪魁祸首,例如高血压、癌症和一些神经退行性疾病,严重损害人类健康。然而,很少有治疗药物能够进入线粒体. Cerrato等设计合成了一系列靶向线粒体的新型小分子CPPs,用于调控线粒体内过程,增强其生物学效应。线粒体穿透肽(mtCPP-1)能将5(6)-羧基荧光素(5-FAM)转运至质膜,并选择性地富集到线粒体中,对线粒体膜电位没有影响,且与SS-31相比,活性氧释放抑制率降低2倍。实验数据分析表明,与SS-31相比,线粒体的摄取量增加了35%,且在较高浓度下也没有检测到毒性。这些结果表明mtCPP-1是一种线粒体CPP。Kang等(2018)开发了一种可穿透细胞的人工线粒体靶向肽(CAMP),该肽可与抗氧化蛋白人类金属硫蛋白 1A(hMT1A)结合,形成成功定位到线粒体的 CAMP-hMT1A。CAMP-hMT1A 治疗细胞帕金森病模型后可恢复线粒体活性、酪氨酸羟化酶产生并抑制 ROS 释放。此外,将 CAMP-hMT1A 注射到 PD 小鼠模型的脑内可保护多巴胺能神经元变性和运动障碍。
“智能”细胞内药物输送系统

Shin 等(2014)利用基因工程方法成功制备了重组嵌合TAT–gelonin融合毒素(TAT-Gel)。TAT-Gel通过静电作用与阴离子肝素结合,当系统注射硫酸鱼精蛋白时,30 min内75%的TAT-Gel瞬间释放,随后CPPs跨过质膜进入肿瘤细胞内,表现出明显的肿瘤抑制作用。此外,基于ATTEMPTS体系,TAT-Gel通过静电力与肝素偶联的抗CEA mAb(T84.66)结合,可以特异地靶向作用于大肠癌细胞上高表达的CEA。与小鼠单独给予TAT-gelonin相比,TAT-gelonin/T84.66-Hep的靶向递送率显著提高,约58倍。
提高细胞特异性系统:可激活的 CPP
CPP内化的机制是与细胞膜上的双层磷脂非特异性结合,这严重限制了CPP的临床应用。一种可能的增强特异性的方法是利用ACPP来实现CPP的细胞穿透作用,同时利用刺激敏感的可裂解连接子,如pH敏感、酶敏感、温度敏感、电、磁敏感或光敏感的可裂解连接子。一旦进入特定的组织环境,ACPP受到外界刺激,连接子就会被裂解,CPP恢复正常活性。
酶在生物体内具有多种功能。在病理组织中,例如炎症或癌症部位,蛋白酶、糖苷酶或酯酶等特异性酶的表达水平,通常高于其在正常组织中的浓度。因此,许多肿瘤相关酶因其组织特异性浓度梯度而被广泛用于酶敏感疾病的诊断和治疗。CPP/货物复合物递送与酶触发系统的结合不仅克服了传统递送系统的细胞通透性障碍,而且克服了基于CPP的递送系统的选择性障碍。
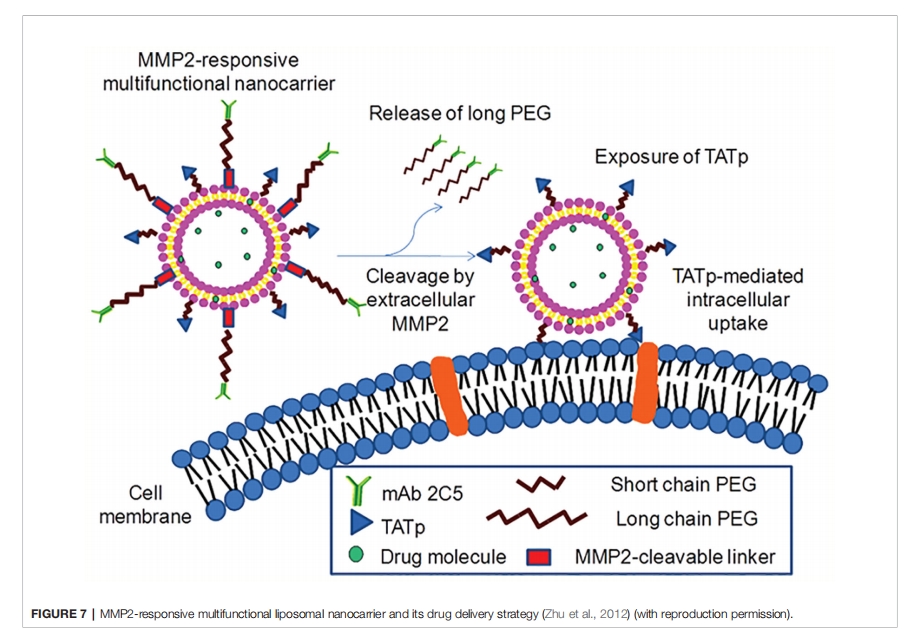
Jiao 等人还利用 MMP-2 反应肽作为酶促可降解连接体,建立了一种名为 ch-Kn(ss)R8-An 胶束的基因递送系统,用于 BBB 和胶质瘤双靶向治疗。该连接体结合了血管肽素-2,它可以特异性地结合胶质瘤细胞上过表达的低密度脂蛋白受体相关蛋白-1 (LRP1)。当 MMP2 可裂解连接体被过表达的细胞外 MMP2 降解后,胶束可以有效地靶向胶质瘤细胞,然后进一步迁移到肿瘤中心,导致 R8 暴露。该递送系统表现出较高的基因转染效率,并提高了胶质瘤细胞的摄取率。将 ch-K5(ss)R8-An/Dbait 与放射疗法联合应用可显著抑制体外肿瘤的生长。
在肿瘤递送中,pH是触发CPPs活化的最常见条件,pH响应性阴离子材料通常联合使用。Yu等合成了两种多肽结合胆固醇聚氧乙烯山梨醇油酸酯,(HE)5-CPSO和(RG)5-CPSO。它们被用来形成混合胶束,以高耐受性将PTX递送到大脑中。多聚阴离子(HE)5屏蔽了(RG)5的正电荷,以减少生理条件下的非靶向摄取。然而,当(HE)5位于细胞外肿瘤或pH值较低的内体时,其表面电位发生逆转,电荷转变可以激活(RG)5,促进PTX的定向胶束摄取和药物释放。混合胶束优先在肿瘤组织中聚集,与胶质瘤小鼠模型中的对照组相比,显著抑制了74.84%的肿瘤生长。Tang et al. 也制备了PEG-PLA纳米粒用于递送PTX,并通过(HE)10G5R6肽修饰该纳米粒以获得pH敏感特性,其策略与上述类似,通过在不同pH条件下发夹结构转变来控制R6筛选的ON/OFF。
如上所述,这些ACPP具有创新性和令人兴奋的特性,但人们普遍认为其激活过程是不可逆的,而且仍然经常发生在非靶位点而不是靶位点。为了克服ACPP在体内靶向递送应用中缺乏可逆性的问题,合成了一类新的ACPP,称为可逆激活CPP(RACPP)。RACPP对生物刺激具有很高的响应性,它们在离开特定的激活位点后会恢复到原来的形式,以避免ACPP/货物复合物在激活后的非特异性摄取。Tang等人设计了一种新型的pH敏感RACPP(HE-CPP),它使用一个高度pH敏感的掩蔽序列通过聚甘氨酸连接体(HE-CPP)可掩盖其正电荷,防止ACPPs/货物复合物的脱靶吸收。聚乙二醇-聚乳酸(PEG-PLA)与HE-CPP序列偶联,组成聚合物胶束(PMs-HE-CPP),可增强特异性并促进包封的紫杉醇(PTX)靶向性。PTX/PMs-HE-CPP表现出根据周围pH值可逆的电荷转换,以及令人满意的负载容量、包封效率和尺寸分布
结论和未来展望
CPP 是跨质膜转运药物或 CPP/货物复合物的热门研究对象。自 1988 年发现 TAT 肽以来,已开发了大量的 CPP。CPP 已广泛用于递送不同类型的治疗剂、成像剂和 CPP/货物复合物(包括脂质体和纳米颗粒),用于诊断和治疗多种疾病。尽管 CPP 正在如火如荼地发展,但许多基于 CPP 的临床试验已大大扩展。事实上,到目前为止,还没有 CPP 或 CPP/货物复合物获得 FDA 批准。在将 CPP 转化为临床之前,应该解决许多问题,如下:体内稳定性、免疫原性、细胞毒性、缺乏特异性细胞内摄取和无法从内体逃逸。当然,在临床应用方面,还应考虑成本、合成的难易程度、适合工业生产和消除。未来CPPs的应用应致力于解决这些问题,并应评估大量新的基于CPP的递送系统。我们可以使用融合脂质、“质子海绵”效应或膜破坏肽等策略来递送CPPs,以促进有效的内体逃逸。一系列小的新型CPPs已被设计和合成,不仅可以递送到目标组织或器官,还可以递送到特定的细胞内细胞器内,以实现更有效的治疗。基于 CPP 的递送系统的主要障碍是有限的细胞类型特异性,因为大多数 CPP 被所有细胞类型吸收,并且由于存在蛋白酶,血浆半衰期较短。已经评估了新策略来提高 CPP 对靶位的特异性,例如以共价或非共价形式将 CPP 与特定配体连接。靶向配体包括抗体、叶酸、转铁蛋白和 RGD 肽,这些靶向配体的受体通常在某些肿瘤类型而非正常组织中过表达。此外,“ATTEMPTS”策略不仅可以提高CPP基递送系统的特异性,还可以保护CPP免受酶降解。ACPP是另一种有前途的提高特异性的系统。在该系统中,CPP被刺激敏感的可裂解连接子所掩盖,该连接子在特定的组织环境中被裂解,然后CPP恢复其正常活性,有效地将CPP基递送系统递送到细胞内,避免递送到非靶向部位。
设计一种安全、高效、特异且易于生产、成本低廉的基于 CPP 的递送系统在临床应用方面具有巨大的潜力和重要的前景。CPP 和 CPP/货物复合物有可能为人类疾病的诊断和治疗提供更有效的方法,例如癌症、炎症、中枢神经系统疾病、耳部保护、眼部和糖尿病。此外,我们坚信 CPP 药物或 CPP/货物复合物将在未来几年内进入市场。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。