
摘要:生物活性肽在整个生理系统当中发挥着重要作用,对于生物活性肽的精确分析将有助于进一步开发其功效,然而当前对复杂生物系统中肽的分析依然存在相当大的难度,这是由于肽通常与高浓度蛋白质共存这一特质所造成的,严重降低了色谱中肽的分离效率,并在质谱中抑制肽的峰信号。鉴于此,人们引入金属-有机框架材料对活性肽进行富集分析。金属-有机框架(MOFs),是由金属离子或团簇和有机配体,通过配位键自行组装形成的具有多孔结构的有机-无机杂化材料。由于它们具有框架结构可调、高孔隙率、化学稳定性良好、可再生性、合成过程简单等优点而广泛应用于活性肽富集、气体吸附与分离、传感器、药物缓释与催化反应等领域。本文系统梳理了近年来MOFs材料用于磷酸肽、糖肽和内源肽等活性肽富集的研究进展,在此基础上总结了当前MOFs材料在该领域中存在的局限,并对研究新趋向提出了展望。
生物活性肽(Bioactive Peptides,BAP)是对生物机体的生命活动有益或具有多种生物学功能的肽类化合物,其分子结构复杂程度不一,小至两个氨基酸多至数十个氨基酸通过肽键连接而成,而且这些多肽可通过磷酸化、糖基化或酰基化等修饰而增强其功能特性。生物活性肽的活性或功能取决于它们的结构,例如:氨基酸组成、N-末端的氨基酸类型、肽链的长度和重量、疏水性、氨基的电荷特性、酸和空间结构等[1]。这些生物活性肽大都以非活性状态存在于蛋白质的长链之中,当用适当的蛋白酶水解时它们的活性就被释放出来[2]。目前糖肽[3]、磷酸肽[4]、内源肽[5]等活性肽已经成为多肽类药物和功能性食品添加剂的开发热点。
由于高浓度的共存蛋白质会严重降低色谱中肽的分离效率,并在质谱中抑制肽的峰信号,因此有必要消除干扰蛋白以提高肽的检测灵敏度。目前已经开发了许多用于肽的分离方法,例如溶剂沉淀[6]、离心超滤[7]和固相萃取[8]。其中,溶剂沉淀作为一种简单、快速和经济的方法被广泛应用于生物样品中高丰度蛋白质的消耗,但低分子量肽可能在蛋白质沉淀过程中丢失。离心超滤是一种常用的方法,可根据超滤膜的大小捕获特定分子量的蛋白质。然而,蛋白质过滤器的离心过程耗时且难以避免样品残留导致肽的低回收率。固相萃取利用吸附剂的界面特性来富集目标肽,这是目前较为快速、有效和经济的富集肽的方法,但回收率低、重现性差和样品提取物不够纯净。研究表明各种材料,包括碳[9]、硅[10]、聚合物[11]、金属[12]、金属氧化物[13]、共价-有机骨架(COFs)[14]、金属-有机骨架(MOFs)[15]和上述两种或更多种的复合材料[16],对于肽显示出良好的富集性能。其中MOFs作为一种新型材料受到越来越多的关注,在气体储存[17,18]、分离[19]、能量转换[20]、催化[21]、化学传感[22]、生物医学[23]、富集肽[24]等方面得到实际应用。其中Peng等[25]对MOFs应用于蛋白质组学和多肽组学上进行了总结,本文着重对近年来MOFs应用于生物活性肽富集的研究进行深入的回顾,对不足之处进行讨论,然后进一步介绍MOFs在生物活性肽富集中的应用前景。
2 MOFs应用于内源肽富集
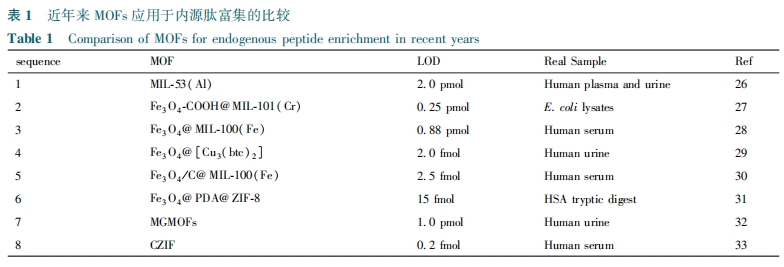
内源性肽以细胞因子、生长激素、激素肽等形式在人体的内分泌、神经、细胞生长和生殖各个领域发挥功能。体液中内源肽的类型和数量反映了细胞内酶的活性状态,与个体健康密切相关。然而,内源肽的复杂性使得富集这些肽成为一项挑战。近年来,MOFs在内源肽的富集中显示出巨大的潜力(表1)。2011年,Gu等[26]首次尝试用MOFs富集多肽,制备了MIL-53(Al)、MIL-100(Cr)和MIL-101(Cr)对标准肽、人体血浆和尿液进行富集。在用MIL-101(Cr)富集后,通过MS观察到低于10 kDa的显著肽峰。由MIL-53(Al)和MIL-100(Cr)富集的肽的最大分子量分别约为8 kDa和4.2 kDa。Wei等[27]将MIL-101(Cr)直接组装到Fe3O4-COOH的磁性纳米粒子上,合成Fe3O4-COOH@MIL-101(Cr)复合材料(图1)。Fe3O4-COOH颗粒不仅赋予Fe3O4-COOH@MIL-101复合材料良好的分散性和磁响应性,还有助于对细菌蛋白的吸附。该复合材料对2~18 kDa质量范围内的内源肽显示出较高的富集效果,可用来富集细菌细胞裂解物中的肽标记物,但对具体的富集原理未能进一步研究。由于磁球的表面官能团有限,有研究者利用功能分子对磁球进行改性以增强富集选择性。Xiong等[28]用巯基乙酸(MAA)对磁性纳米球进行修饰,将Fe3O4-MAA在FeCl3·6H2O和H3btc中循环反应30次得到Fe3O4@MIL-100(Fe),该材料成功富集分子量在900~4500 Da范围的多肽并从5 mL人体血清中鉴定出563种肽,但反应周期较长,较为繁琐。Zhao等[29]通过将巯基乙酸和Cu-MOFs组装在Fe3O4纳米颗粒表面上,得到的Fe3O4@[Cu3(btc)2]对肽表现出较强的亲合力,使得肽峰在10 pM的低浓度下仍然可以被检测到。Wei等[30]将Fe3O4/C磁性纳米球与MIL-100(Fe)进行组装,合成Fe3O4/C @MIL-100(Fe)。测定微波辅助酸裂解以特异性消化氨基酸残基上的血清蛋白后,肽信号显著增强。在800~5000 Da的质量范围内观察到超过170个S/N>3的肽峰,通过MALDI-TOF MS发现46种蛋白质,但过程中用到的微波辅助酸裂解应用范围较窄。另外,Zhao等[31]通过用聚多巴胺(PDA)对磁性微球进行改性,然后用ZIF-8在Fe3O4纳米颗粒的表面上涂层。制备的Fe3O4@PDA@ZIF-8复合材料对内源肽具有很强的亲合力。由于组氨酸的咪唑基团与Zn-MOFs之间的相互作用,可用来消除很少或没有组氨酸残留物的干扰。Fe3O4@PDA@ZIF-8在BSA胰蛋白酶酶解物与BSA(牛血清白蛋白)的摩尔比为1∶200时,表现出高选择性。具有沸石和MOFs的独特性质的沸石咪唑金属骨架(ZIF)可在温和的生物相容性条件下组装,使得它们可用于生化分析。
Cheng等[32]通过可控的自组装,制备MOFs涂层的磁性石墨烯(MGMOFs)复合材料。基于其良好的亲合力,独特的多孔结构和强磁性,MGMOFs可选择性地分离人尿中的多肽。MGMOFs作为分层磁性石墨烯可控构造的第一个例子,它可能为石墨烯模板导向的MOF设计提供新的思路。但是成功控制金属有机骨架(MOFs)层的石墨烯或石墨烯基复合材料的均匀和完全涂层是一个难题。可通过在N2下直接热解ZIF-67合成有序中孔磁性材料CZIF[33]。CZIF对肽有良好富集作用,可从人体血清中富集402个内源肽,实现了低至0.2 fmol/μL的BSA的检测,其均匀中孔结构有助于排除蛋白质来实现高选择性(BSA胰蛋白酶酶解物∶BSA=1∶1000)。
3 MOFs应用于糖肽富集
蛋白质糖基化是真核生物和原核生物中最普遍存在的蛋白质修饰系统之一,与许多生物和细胞功能密切相关,包括信号转导、细胞增殖和分化[34,35,36]。对糖肽的定性及定量研究具有重要意义。目前,质谱(MS)是鉴定糖肽的重要且有效的方法。然而,由于糖肽的丰度相对较低以及存在具有高丰度非糖肽的样品,运用质谱对糖肽直接分析需要首先解决丰度低的问题[37]。MOFs材料由于其多孔结构和易于修饰的表面可用做选择性富集糖肽的新型亲和探针(表2)。
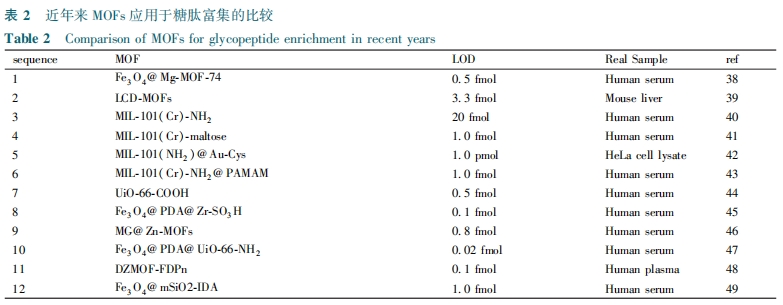
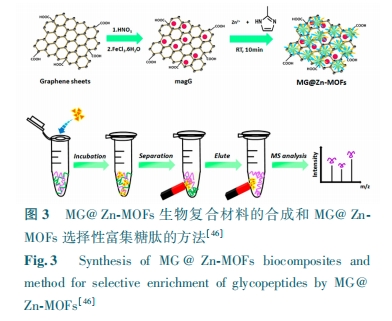
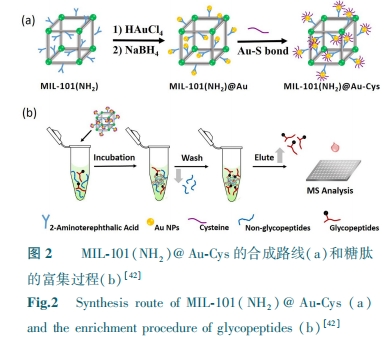
由于MIL-101(Cr)-NH2的笼状结构,甚至其麦芽糖(亲水基团)官能化结构,在人血清中富集对应于42种糖蛋白中的116种糖肽和65种糖蛋白中的111种糖肽。这些结果促使我们关注孔隙参数,如大小和形状(笼、1D通道、3D交叉点等)以及亲水亲合力。在通过Fe3O4@Mg-MOF-74富集后,即使当糖肽、BSA和HRP的质量比为1∶800∶800时,通过MALDI-TOF MS仍可以鉴定出8个匹配的糖肽信号[38]。效率的显著提高可归因于1D通道(与MIL-101的笼状结构相比)和适当的孔径(延伸其孔径将导致富集效率的急剧降低)。Ji等[39]用γ-环糊精作为结构单元与K+和乙二醇二缩水甘油醚组装LCD-MOF。在选择性评估中,LCD-MOF能有效去除对糖肽的离子有抑制的非糖肽信号,从而达到增强糖肽信号的目的。即使当人体免疫球蛋白的胰蛋白酶酶解物处于3.3 fmol的极低水平时,也可以检测到S/N>3的4种糖肽,低于两性离子HILIC材料(10 fmol)的浓度。使用稳定同位素二甲基标记方法,计算LCD-MOFs 富集糖肽后的回收率为84% ~103%。对于100 mg胰蛋白酶小鼠肝脏酶解物,在用LCD-MOFs富集后,通过LC-MS/MS可鉴定290种糖蛋白和344种糖肽。由于亲水性γ-CD作为配体,所得到的纳米尺寸LCD-MOF复合材料具有所需的亲水性。同时证实了糖肽和LCD-MOF之间存在多种相互作用(氢键、静电和偶极相互作用)。Zhang等[40]基于亲水相互作用,用MIL-101(Cr)-NH2对糖肽进行富集测试。由于其高比表面积、多孔结构和强亲水性等特性,可有效富集标准糖蛋白消化物,从10 mL人体血清中鉴定出42种糖蛋白及116个独特的N-糖基化位点。氨基官能化的MOFs可以用官能团或分子进一步修饰,用于选择性富集糖肽。Ma等[41]在室温下用TMSN3和tBuONO对MIL-101(Cr)-NH2进行处理形成叠氮化物官能化的MIL-101(Cr)-N3。MIL-101(Cr)-N3和1-炔丙基-O-麦芽糖发生“点击化学反应”合成MIL-101(Cr)-maltos。该材料可富集浓度低至50 fmol 的免疫球蛋白,观察到至少9种糖肽。当免疫球蛋白的浓度低至1 fmol时,可以在S/N>3时检测到两种糖肽。检测限远低于大多数亲水性吸附剂,如二氧化硅基两性离子聚合物(10 fmol)。由于极度温和的叠氮化步骤和“点击化学反应”的通用性,这种后合成方法对于从氨基衍生的MOFs的快速官能化是通用的,但对MOFs有一定要求,需能与叠氮基发生反应。Ma等[42]进一步用L-半胱氨酸(L-Cys)修饰MIL-101(Cr)@Au得到MIL-101(NH2)@Au-Cys,具有孵育时间短(5 min)、结合能力大(150 mg/g)、选择性良好(1∶50)、回收率高(超过80%)和检测限低(1 fmol)的优点(图2)。可从复合物HeLa细胞裂解物中鉴定出1069个N-糖肽和614个N-糖蛋白,检测出多达1123个N-糖基化位点。Wang等[43]通过在MIL-101(Cr) -NH2表面接枝有亲水性树枝状大分子聚酰氨基胺(PAMAM)合成双重亲水性材料。在标准糖蛋白富集中,当非糖肽的浓度比目标N-糖肽高100倍时,功能性MOFs材料显示出低检测限(1 fmol/μL)和良好的选择性。但聚酰氨基胺(PAMAM)仅能与部分MOFs发生结合且结合原理不明。功能性MOFs材料可以在制备过程中添加功能性配体合成不同的亲水材料。Liu等[44]通过ZrCl4和二元配体对苯二甲酸(TPA)和间苯二甲酸(IPA)的一步反应制备具有大量游离羧基的亲水性UiO-66-COOH。与单配体的UiO-66相比,二元配体的UiO-66-COOH表现出更大的亲水性和更好的糖肽富集能力。在富集之前,从1 pmol/μL免疫球蛋白消化物的原始MS谱中能检测到6种糖肽,而在UiO-66-COOH富集后,检测出24种高强度的糖肽。此外,Xie等[45]将PDA层引入磁性Fe3O4核的表面,然后与亲水性2-磺基对苯二甲酸和锆离子组装通过机械分离合成Fe3O4@PDA@Zr-SO3H。当HRP:BSA的质量比为1∶100时,15个糖肽在光谱中占主导地位,同时没有出现BSA峰。用Fe3O4@PDA@Zr-SO3H对人体血清胰蛋白酶酶解物富集后,通过MS可检测到177个N-糖肽和275个糖基化位点。Fe3O4@PDA@Zr-SO3H材料合成是将反应物置于机械分离而不是反应容器中合成,虽使其易于制备但应用范围较窄。Wang等[46]制备一种亲水型多孔复合材料MG@Zn-MOFs(图3)。由于其强的磁响应性,高比表面积、优异的生物相容性和独特的尺寸排阻效应,MG@Zn-MOFs显示优良的灵敏度、选择性以及良好的可回收性。在实际应用中,经过MG@Zn-MOFs处理后,从1 mL人体血清中检测到517种N-糖肽和151种特征性糖蛋白。通过改变MOFs外壳的类型,可以改变磁性材料的表面特性。控制金属-有机骨架(MOFs)层的石墨烯或石墨烯基复合材料的均匀和完全涂层是一个难题。Xie等[47]使用Fe3O4@PDA@UiO-66-NH2从人体血清中富集来自121种不同糖蛋白的307个N-糖基化肽和来自16种不同磷酸蛋白的33种磷酸肽。Peng等[48]通过在UiO-66-NH2上引入磷酸基团及固定锆制备DZMOF。然后将DZMOF与果糖-1,6-二磷酸(FDP)反应得到DZMOF-FDPn。即使当免疫球蛋白与牛血清白蛋白的摩尔比达到约1∶5000时,该MOF在模拟糖肽复合物的抗干扰富集中也具有极佳的富集性能,可从人体血浆中鉴定出380个N-糖肽。双亲水金属-有机骨架不仅含有亲水表面位点还含有亲水基质,FDP修饰的DZMOF对非肽和干扰蛋白的抗干扰能力,有助于制备高选择性亲水探针富集糖肽。Sun等[49]设计并合成了亲水性磁性介孔二氧化硅材料(Fe3O4@mSiO2-IDA)。通过利用其较大比表面积、优异的亲水性和对所有类型的糖肽的无偏性亲合力的优点,Fe3O4@mSiO2-IDA纳米材料成功鉴定了来自辣根过氧化物酶酶解物中的25种糖肽和人体免疫球蛋白中的33种糖肽。但将亚氨基二乙酸(IDA)基团接枝到磁性介孔二氧化硅(mSiO2)纳米材料的内壁的条件较为苛刻。
4 MOFs应用于磷酸肽富集
细胞中近30%的蛋白质都处于磷酸化状态[50]。蛋白磷酸化作为蛋白质最重要和普遍存在的翻译后修饰之一,在控制许多错综复杂的生物过程中起着重要作用,如细胞生长和分裂,代谢途径和信号转导[51,52]。MOFs及其配位化合物凭借可控框架和丰富的金属位点的优势,已被用作质谱分析前选择性富集磷酸肽的新型亲和探针(表3)。

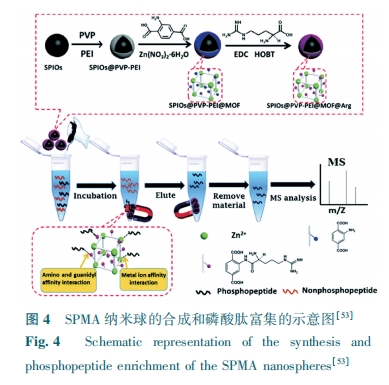
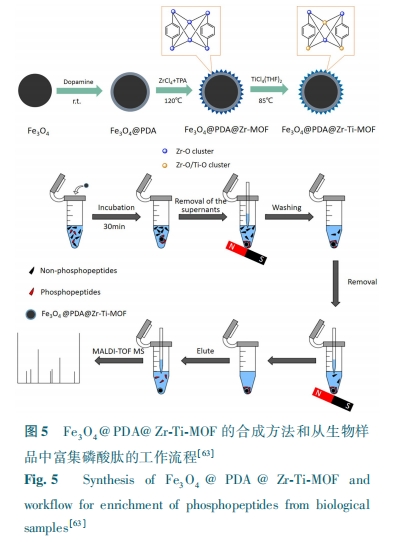
因为有丰富的固有Zr-O簇、高比表面积和高度有序开放孔隙结构,Zr-MOFs (UiO-66和UiO-67)可用于磷酸肽富集[15],用UiO-66和UiO-67对人体血清富集后,质荷比m/z为1389.6、1460.8、1545.5和1616.6的4种磷酸肽都可通过MALDI-TOF MS检测出来。Yang等[54]利用尿素对MIL-101(Cr)进行改性,得到MIL-101(Cr)-UR2亲和材料。它具有较大的比表面积、良好的溶剂稳定性和对某些磷酸盐的高亲合力的特点。它成功应用于富集非脂肪乳中的磷酸肽,并且从非脂肪乳中检测到9种磷酸肽,但大部分MOFs不能用尿素改性,应用范围较窄。最近,一种双金属中心锆有机框架(DZMOFs),用于高选择性地提取磷酸肽[55]。通过将锆固定在UiO-66-NH2上制备DZMOFs。由于不仅拥有固有的Zr-O簇还具有固定的Zr中心的双金属中心,这种亲合性探针表现出高灵敏度(0.07 fmol/mL)、优异的抗干扰能力(β-酪蛋白∶BSA=1∶5000)和高回收率(91.4%±3.2%)。可通过MALDI-TOF MS从α-酪蛋白、β-酪蛋白和卵清蛋白消化物的混合物中富集14种磷酸肽,从5 mL人唾液中检测出17种磷酸。Chen等[56]通过逐层方法在巯基乙酸改性的Fe3O4纳米颗粒上覆盖MIL-100(Fe)壳来合成Fe3O4@MIL-100(Fe)。Fe3O4@MIL-100(Fe)具有较高的富集能力(60 mg/g)、高选择性(β-酪蛋白:BSA=1∶500)、低检出限(0.5 fmol)、高回收率 (84.47%±1.2%)的优点。但反应需循环反应31次,周期较长。另一方面,将聚多巴胺(PDA)涂层磁性Fe3O4用于与Zr-MOFs进行组装[57]。在用Fe3O4@PDA@Zr-MOF富集后,可以观察到m/z为1389、1460、1545和1616 Da的4种磷酸化肽。Xie 等[58]通过将1,3,5-均苯三甲酸(H3btc)接枝在聚多巴胺 (PDA)涂层的Fe3O4上设计了磁性Fe3O4@PDA@Er(btc)。在β-酪蛋白与BSA质量比为1∶500时,显示出超高灵敏度(检测限为20 amol/μL)和选择性。Han等[59]通过带负电的L-Cys官能化Fe3O4和带正电荷的MIL-101(Fe)之间的静电自组装,合成了Fe3O4/MIL-101(Fe)。Fe3O4/MIL-101(Fe)对磷酸肽具有优异的富集性能,包括低检测限(8 fmol)、高选择性(β-酪蛋白:BSA=1∶1000)、高回收率(89.8%)。可从罗非鱼卵蛋白的酶解物中富集共51种磷酸肽。复合材料具有大量Fe3O4和MIL-101(Fe)的配位Fe(Ⅲ),这为磷酸肽富集提供了突出的能力。Zhao等[60]用magG@PDA @Zr-MOFs从小鼠肝组织中鉴定出261个磷酸化位点,其中237个磷酸化位点为丝氨酸(90.80%),21个为苏氨酸(8.05%),3个为酪氨酸(1.15%)。将PDA引入石墨烯后均匀涂层并与MOFs结合是一个难题。另一方面,MOFs可用作前体以获得具有特定形貌和结构的新型材料。Zhao等[61]通过将MIL-125(Ti)热分解制备分级多孔锐钛矿型TiO2 (HPT)。由于其分级的多孔结构、大的总孔体积和丰富的钛位点,所获得的HPT被用作多功能纳米反应器。纳米反应器具有分层的大孔和中孔,可以容纳蛋白质和酶,从而加速蛋白质水解。其次,锐钛矿型TiO2对磷酸肽表现出强亲合力,因此能够将磷酸肽与其他蛋白水解产物分离。Luo等[53]使用磁性Fe3O4纳米粒子(SPIOs)与PEI(聚醚酰亚胺)、PVP(聚乙烯吡咯烷酮)和Zn-MOFs进行组装合成SPIO@PVP-PEI@MOF,最后与精氨酸结合生成SPIOs@PVP-PEI@MOF @Arg纳米粒子(图4)。SPMA具有较大的比表面积(124.33 m2/g)、孔径(0.06 cm3/g)、高选择性(β-酪蛋白:BSA=1∶1000)和低检测限(10 pmol)。SPMA纳米球合成简单且稳定均匀,分离磷酸肽富集过程同时保持富集的磷酸肽的活性。另外,Wu等[62]用PDA涂层的磁性Fe3O4与MIL-125(Ti)进行组装合成mMIL-125(Ti),进一步加入氯金酸和L-半胱氨酸进行修饰,成功合成mMIL-125(Ti) @Au@L-Cys纳米粒子。mMIL-125(Ti)@Au@L-Cys 可同时应用于糖肽和磷酸肽的富集。Liu等[63]用PDA作为连接剂将Zr-MOF涂层在磁性Fe3O4的表面上,Fe3O4@PDA @Zr-Ti-MOF(图5) 可从1 μL人体唾液中检测到34种单磷酸化肽和10种多磷酸化肽,证实了其在磷酸肽分析中的明显前景。但Fe3O4@PDA@Zr-Ti-MOF的合成步骤较多,在Fe3O4@PDA@Ti-MOF上掺杂锆元素也不易实现。Li等[64]通过自由基反应成功地制备了MOFs掺杂的毛细管整体柱并作为选择性富集磷酸肽的有效吸附剂。由于具有较大比表面积和高度有序孔径的MOF以及毛细管整体柱的结合,具有极佳选择性、超强耐受性和操作简单等优点;但仅有部分MOFs能与MAA-co-PEGDA整体柱发生自由基反应,应用范围较窄。Cao等[65]使用双金属MOF的协同合成涂层合成了具有较大比表面积和出色亲水性的Fe3O4@MIL(Fe/Ti)材料,该材料可用于富集磷酸肽,具有高选择性(β-酪蛋白:BSA=1∶500)、低检测限(3 fmol)、高回收率(85%)和较强的结合能力等优点。
5 结论与展望
由于MOFs具有较高的比表面积,有助于高效富集目标物并在富集过程期间降低蛋白质组复杂性,从而在MS分析中提高检测灵敏度。基于MOFs的亲和材料的孔隙率显示出尺寸排阻效应,消除了高丰度蛋白质影响。具有所需特征的MOFs中的各种配体和金属有利于构建多个位点与活性肽进行相互作用。可调表面化学性质的MOFs可以与金属氧化物和聚合物等材料制造复合材料,以提高富集效率。
目前基于MOFs的肽富集过程中的许多难题仍未得到解决,如:如何改善大量水稳定性较差的MOFs的水稳定性,促使其可以应用于活性肽富集;部分MOFs的合成效率低,使用的配体较为昂贵,进一步限制了MOFs的大规模应用;MOFs用于直接富集抗氧化、免疫、抗衰老等功能特性活性肽的研究还较少。为了解决这些难题,根据MOFs与肽之间的相互作用,首先应尽量选择价格低廉的配体高效率地合成可用MOFs用于活性肽的富集。其次,通过利用可修饰的表面活性基团和可设计的结构单元等来设计多种MOFs或MOFs复合材料与肽进行相互作用,用于富集生物活性肽和具有目标功能的活性肽。再次,还可以通过理论计算预测MOFs与肽之间的相互作用机制,以指导富集具有目标功能的活性肽。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。








