
传统药物输送系统在药物分布、药代动力学、体内降解、药物溶解度及渗透生物系统的能力等方面均存在一些局限性[1-2]。常规化疗药物在给药后会无差别全身输送,治疗不具有靶向性,发展前景狭窄。近年来,纳米疗法领域发展迅速,可通过修饰单个纳米载体同时完成药物释放和药物分布监测[3-4]。目前纳米药物主要包括:高分子聚合物、脂质体、聚合物胶束、纳米囊、纳米混悬剂等,多肽作为天然聚合物,极易以自组装形式与其他材料连接整合,形成不易降解的胶束、聚合物等,使多肽可在体内完成长循环,提高生物利用度。本文从多肽纳米药物的角度综述近年来肿瘤靶向治疗研究进展。
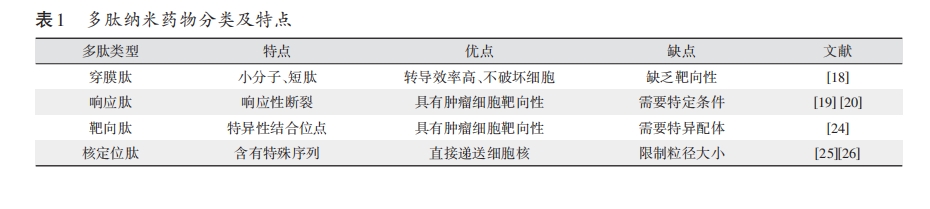
1.1 多肽聚合物的形成 近年来,生物可降解聚合物和核酸、肽、蛋白质等生物分子已被认为是重要的有效聚合物疗法。多肽是一种常见的天然聚合物,通过多个氨基酸及肽链之间相互驱动力组成,驱动力主要包括疏水作用、范德华力、氢键、π-π 堆积等。自然形成的多肽通过氨基酸残基与肽链间的电荷性不同、亲疏水性不同、极性差异等作用力产生驱动力形成二级结构,即自组装多肽,通常以稳定的纳米或微米级的胶束、囊泡、管状等形态存在[5-7]。
1.2 自组装多肽分类与特点 自组装多肽可分为自发型与触发型两种。自发型自组装是指在水溶液中当胶束或聚集达到一定条件,多肽自发聚集形成组装体。触发型自组装则透过改变一系列外界环境,包括温度、pH 值、酶等,触发多肽分子聚集进行自组装。多肽作为蛋白质前体不存在高级空间结构,这决定了多肽形态的多样化。通过改变外界环境触发氨基酸的数量、类型和序列改变,可以设计出具有特定物理化学性质的触发型自组装多肽结构,且具有可逆性[8]。自组装多肽具有高活性、易降解、无免疫原性、无明显毒副作用的优点,同时也有半衰期短、稳定性差、不易保存的缺点,相比于蛋白质可不经消化、降解,以完整形式参与血液循环。人体内包括肿瘤组织中含有大量形态各异的多肽,部分肿瘤组织中的多肽可作为特殊配体的受体,接受合成的触发型自组装多肽[9]。这构成了纳米药物递送系统的条件基础。
1.3 纳米药物递送系统 一般的抗肿瘤药物作为生物大分子难以透过细胞膜屏障、血脑屏障等一系列生物屏障而直接作用于肿瘤细胞内,生物利用度低。构建多肽聚合物纳米颗粒修饰药物表面,可特异性的选择肿瘤组织作为靶点,通过纳米颗粒搭载有效药物成分透过屏障,释放药物破坏肿瘤细胞,这一搭载传送系统被称为纳米药物递送系统(nanodrug delivery systems,NDDS)。
肿瘤组织的快速增殖导致新生微血管畸形,从而使血管壁具有高渗透性,纳米级粒子得以选择性通过血管壁,靶向分布药物富集于肿瘤组织中,这种效应称为 EPR 效应[10-11]。聚合物胶束纳米颗粒载体为具有亲水性、亲脂性的两亲性嵌段共聚物(ABC),可以通过自组装过程形成纳米颗粒(nanoparticles,NPs)。两亲性聚合物的疏水部分之间的良好相互作用形成胶束核,胶束电晕通过聚合物的亲水部分形成[12-13],生物可降解聚合物形成胶束的核心。药物有效负载于疏水内核中,通过NDDS 将高度细胞毒性药物分配到肿瘤部位,直到载体培养基由于 EPR 效应聚集在受感染的肿瘤部位,被称为增强渗透性和保持力[14]。NDDS 具有高载药率、延长体内循环、降低药物毒性和肿瘤靶向性的特性[15-16]。
2 肿瘤药物的靶向治疗
2.2 化疗药物靶向 化疗药物本身对肿瘤组织不具有聚焦性杀灭能力,且副反应大。纳米药物的修饰很好的解决了这一问题,目前临床试验和临床前开发中的纳米药物数量显著增加。紫杉醇聚谷氨酸(PPX)是一种高分子化合物,由紫杉醇和生物可降解聚合物聚 L-谷氨酸偶联而成。聚合物组分延长的循环半衰期使 PPX 能够利用 EPR 效应,然后通过内吞作用将其内化并运输到溶酶体。PPX 两项Ⅲ期临床试验表明[32-33],与吉西他滨或长春瑞滨(STELLAR 3)相比,PPX 化疗初期患者的总体生存率相近;与多西紫杉醇相比,二者生存获益相似,但PPX 毒副作用更低。
目前医学研究不仅单独搭载化疗药物,还通过联合负载免疫药物,使表面 NPs 修饰的化疗药物靶向性富集于肿瘤组织,诱发一系列免疫应答杀灭肿瘤细胞。一项关于乳腺癌的研究中,A7R 半胱氨酸肽增强了囊泡摄取,从而增加了 BC 异种移植物的细胞毒性和蓄积,这证实了肽作为靶向配体在紫杉醇在靶向递送中的重要性[34]。
2.3 中药靶向 近年来中药抗肿瘤作用已被许多研究证实,但部分中药具有水溶性差、口服生物利用度低的缺点。吴茱萸碱(Evo)是一种吲哚醌生物碱,被运用于防治结直肠癌,Li 等[35]运用 NDDS 系统技术,构建 EGFR 靶向 Evo 封装的聚氨基酸纳米颗粒(GE11 Evo NP)。与游离 Evo 相比,GE11 EvoNP 对结肠癌细胞的细胞毒性显著增强,并能有效抑制结肠癌 LoVo 细胞的黏附、侵袭和迁移,提高生物利用度。EGFR、VEGF 和 MMP 蛋白的表达显著下调,这可能是它们抑制大肠癌侵袭和转移的部分原因。
2.4 诊断性药物靶向 在癌症检测治疗方面,NPs技术被运用于构建癌症识别和药物输送的放射性标记剂用于放射性诊断治疗。Hafsi 等[36]探索 RGD肽功能化磁小体增强两种放射治疗方式,与未修饰的磁小体相比,RGD 磁小体在体外和体内均表现出非常高的细胞内化和放射治疗效果,因此 RGD 磁小体可作为 X 射线和质子的肿瘤放射增强剂。有趣的是在 RGD 磁小体同等剂量下,质子疗法的杀伤效果优于 X 射线疗法。
3 小结与展望
多肽纳米颗粒在化疗、免疫药物及中药、诊断性肿瘤靶向治疗方面的运用均得到了一定的有效性验证与突破。中医治疗方面创新性的设计由NDDS 系统递送解决部分抗肿瘤中药口服生物利用度低、水溶性差等问题,为中医抗肿瘤的进一步发展提供了启发性思维。
尽管 NPs 具有提高治疗效果、延长体内循环时间、有效的细胞内化、持续药物释放、在药物到达靶细胞之前减少药物降解、可以在体内自然降解为无害物质等优点[12],但仍存在药物富集肿瘤组织后深层渗透性问题。成纤维细胞活化蛋白-α(FAP-α)是一种Ⅱ型跨膜细胞表面蛋白,由肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs)高度特异性表达,已在 90% 以上的人类上皮性肿瘤中发现,但在正常细胞中很少表达[37]。在 TME 中,FAP-α 阳性的 CAFs 主要分布在肿瘤来源的血管内皮细胞周围,限制了纳米药物向更深肿瘤区域的有效渗透。这是现在诸多阻碍深层渗透的原因之一。目前已有研究针对此问题进一步研究辅助肿瘤穿透的自适应纳米团簇(nanoclusters,NCs)[38]等技术,体内环境复杂,NDDS 的研究还需持续进行。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。