
摘要:环二肽是两个氨基酸通过肽键缩合而成的化合物。环二肽具有独特的结构赋予其两个氢供体与氢受体的特征,它与不同靶标物质结合后能产生诸多效应,从而表现出多种生物活性。环二肽来源广泛,随着现代科技的发展,可以从真菌和细菌中提取分离出环二肽,也可以通过生物或化学方法合成环二肽。除了在抗生素、抗肿瘤药物研发、抗氧化、降血糖等方面具有巨大的潜力外,在调节能量代谢、调控食欲、改善神经系统和降低心脏传导速率等方面也有很广阔的前景。因此,本文对近5年来发现的环二肽进行综述,主要介绍了环二肽的来源、结构与理化性质,并对其生物活性展开重点阐述,并提出了建议和展望。
环二肽是由2个氨基酸首尾相连形成的、具有优异刚性结构和生物活性的哌嗪二酮类化合物(diketopiperazines,DKPs)。Curtius等[1]在1888年首次合成出第一种环二肽cyclo(Gly-Gly)。环二肽来源广泛,随着现代科技的发展,可以从真菌和细菌中提取分离出环二肽,也可以通过生物或化学方法合成环二肽。环二肽的结构种类丰富,仅仅是常规天然氨基酸进行环化所形成的环二肽种类就多达210种,其结构的多样性使得环二肽具有多种生物活性。在过去的几年中,越来越多的研究报道了环二肽的生物活性,包括参与细胞间信息传递、抑菌和抗肿瘤等,其中研究最为广泛的是其抗菌和抗肿瘤的功效。例如cyclo(D-Ala-D-Trp)能有效抑制人宫颈癌细胞的生长[2],以及cyclo(Tyr-Gly)抑制大肠埃希菌的繁殖[3]。后又陆续报道证实了环二肽的抗氧化和降血糖等作用。如今病原菌的耐药性越来越普遍,滥用抗生素等问题也未受到重视,这些现象都促使对环二肽生物活性进行深入研究。本文主要对环二肽的生物活性进行综述,同时对其药物生产及临床应用等方面做出展望。
1 环二肽的来源
环二肽来源广泛,迄今为止,绝大多数环二肽来自革兰阴性菌[4],少部分来自于植物、动物、革兰阳性菌以及真菌[5]。例如2017年,Gowrishankar等[6]从解淀粉芽胞杆菌(MMS-50)提取的cyclo(L-LeuL-Pro)(CLP)能抑制细菌生物膜,但这并非杀菌作用。2020年,郭庆丰等[3]在大黄鱼共生菌(Bacillus coagulans LL1103)的代谢产物中发现的cyclo(TyrGly)、cyclo(Pro-Gly)和cyclo(Pro-Val)对大肠埃希菌具有抑制作用。
目前环二肽的合成方法主要分为以下2种。
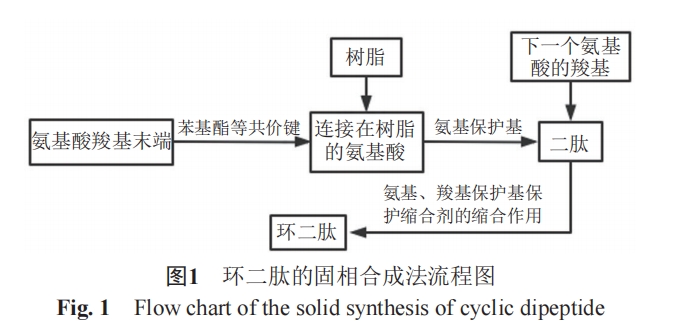
而合成环二肽的经典方法是溶液合成法。即将线性肽放置于溶液中,并使用缩合剂使其连接成环,也可以将线性肽的C端通过硫酯法等活化然后再进行成环。优点在于避免氨基酸的异构化[8]。
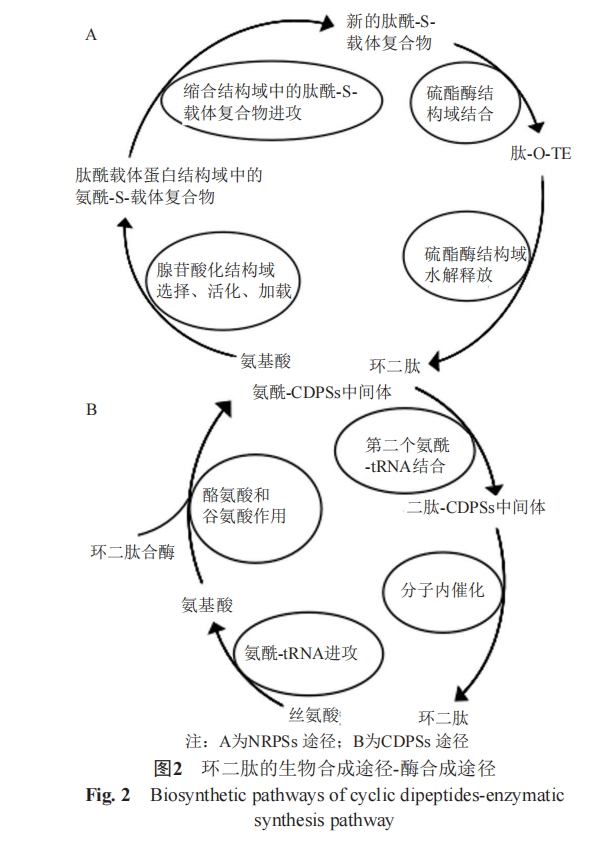
2 环二肽的结构与理化性质
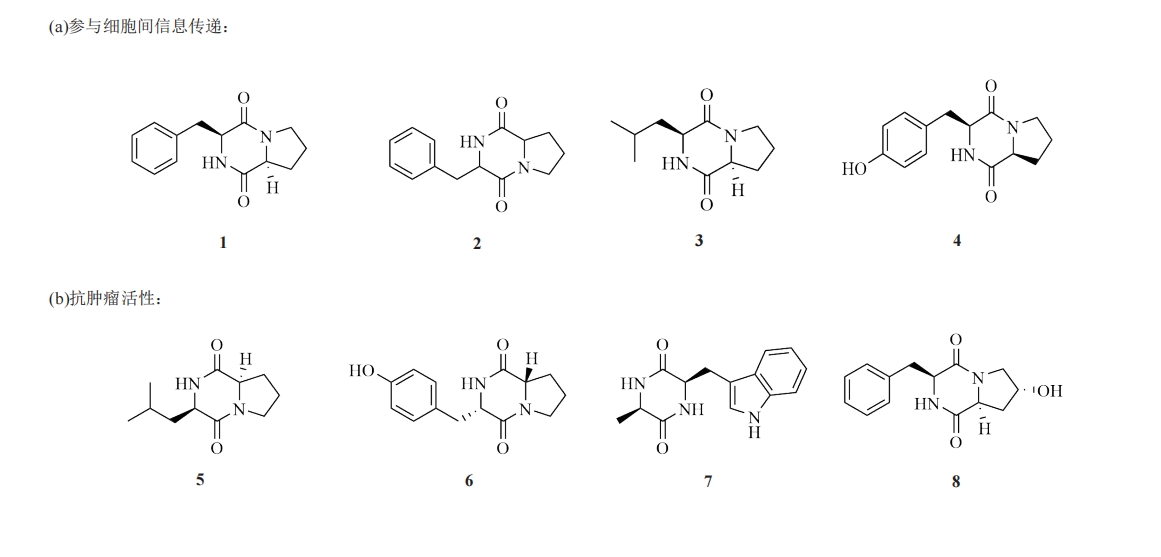
大多数的环二肽呈弱碱性,常常微溶于水,易溶于甲醇等有机溶剂中,形态一般为结晶或粉末,熔点一般高于200 ℃[19]。通常采用强氧化剂去检测环二肽的存在,环二肽与不同试剂反应会呈现出不同颜色的斑点[20],例如荧光指示剂、碘化铋钾试剂。
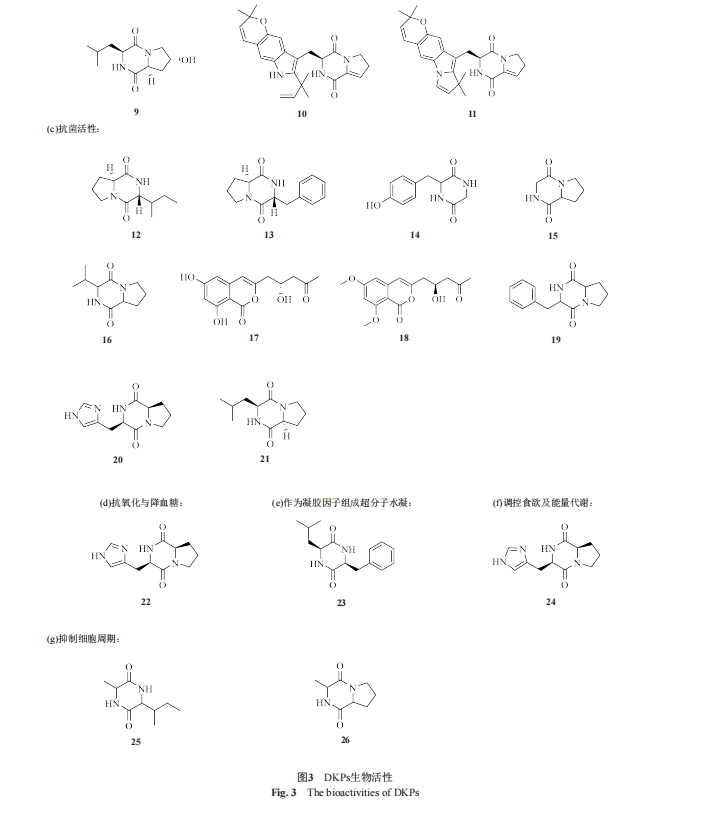
3 环二肽的生物活性
近年来的研究表明:群体感应(quorum sensing,QS)是细菌通过自诱导物质(auto-inducer,AI)监测其种群密度,用于调节生物的群体行为的一种信息传递机制。如生物膜形成、助细菌感染、分泌毒力因子等[21]。目前,最常见的是高丝氨酸内酯(acylhomoserine lactones,AHL)信号传递途径,在群体感应通路中,信号分子AHLs与LuxR型蛋白结合,产生反应,调节相关基因的表达,从而使细菌进行一定的生理活动。由AHLs介导的群体感应系统的物质被认定为群体感应抑制剂。据报道,DKPs能够调节LuxR型受体活性。如,创伤弧菌(Vibrio vulnificus)产生的cyclo(L-Phe-L-Pro)可以诱导费氏弧菌V. fischerilux基因的表达[22]。DKPs还可以有效提高相关基因的转录水平。例如,在气味沙雷菌(Serratia odorifera)中新发现了一种QS系统,其中cyclo(ProPhe)等AI可以提高真姬菇(H. marmoreus)木质素降解酶基因的转录水平[23]。具体的相关信号分子及机制还待进一步研究。
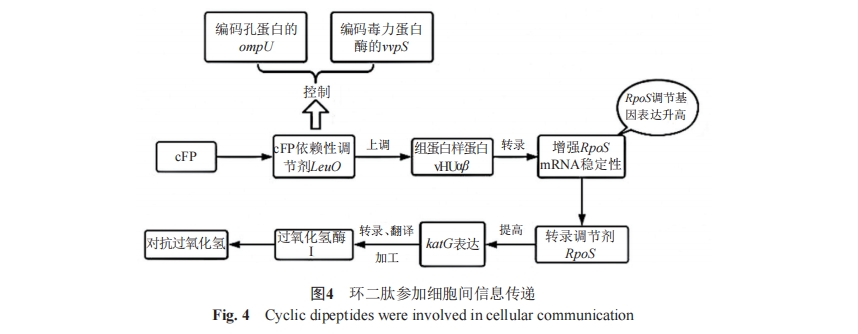
近年来,为了解决病原菌的耐药性日益严重的问题,人们越来越关注通过抑制生物膜的形成和毒力因子的合成等途径阻碍其进化为耐药菌株的方法。2019年,Shanmugaraj等[25]研究了cyclo(LLeu-L-Pro)(CLP)对黏质沙雷菌(Serratia marcescens)的抗QS效果。他们进行了体内、体外的多种实验研究,其中包括最小抑菌浓度(minimum inhibitory concentration,MIC)试验、蛋白酶试验、游动和群集运动试验,秀丽隐杆线虫(Caenorhabditis elegans)模型等。并通过qPCR技术证实了CLP确实能有效抑制黏质沙雷菌中QS控制的灵杆菌素的产生。在分子水平上,通过下调fimA和fimC的表达,减少菌毛蛋白的合成,进而抑制黏质沙雷菌的附着,阻碍生物膜的组装。此外,CLP还下调了FlhD、FlhC和bsmB基因的表达,发挥抑制黏质沙雷菌的游泳和群集运动以及妨碍黏质沙雷菌的体内复制和移植的功效。其结果表明CLP对生物膜的抑制作用是开发生物膜剂的基础。2020年,从米曲霉(Aspergillus oryzae)的代谢产物中分离得到的环二肽对荧光假单孢菌(Pseudomonas fluorescens)的群体感应表型具有很好的抑制作用,由此推测环二肽可能是一种新群体感应抑制剂[26]。2021年,从海洋真菌DXY-1粗提物中分离鉴定出的cyclo(L-Tyr-L-Pro)对紫色色杆菌(Chromobacterium violaceum CV026)和铜绿假单胞菌(P. Aeruginosa PA01)表现出显著的QS调控的毒力抑制作用[27]。环二肽有望成为一个抗菌药物开发的新的潜在靶点。
据统计,在我国尽管食管癌、肝癌等癌症的肿瘤死亡率逐年降低,肺癌、乳腺癌、结直肠癌、宫颈癌和前列腺癌的发病率仍然呈现上升的趋势。研发针对性的靶向药物的脚步刻不容缓[28]。
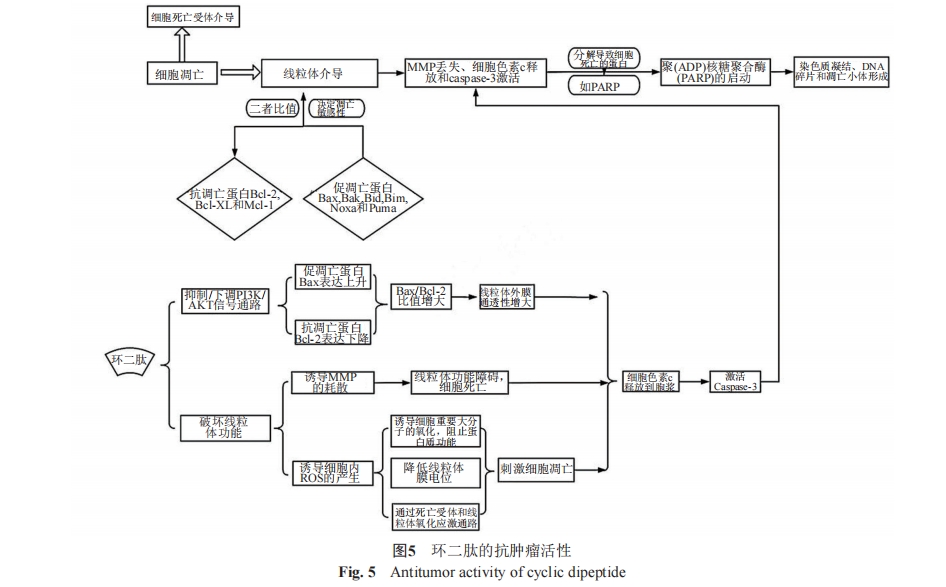
通过实验数据可以发现两个影响毒性作用的因素。首先是癌细胞的类型,Ye等[33]从红树林链霉菌(Mangrove Streptomyces sp. Q24)中分离出来的cyclo(L-Phel-L-Hyp)在人胶质瘤U87-MG和U251细胞的增殖抑制实验中,分别当IC50为5.8 和18.6 μmol/L时表现出一定效力,而在HCT-116、OVCAR-8和SF-295细胞系上测试时发现在25 µg/mL[34]上也无法显示出明确的细胞毒性作用。除了靶向癌细胞的类别造成的差异外,环二肽本身的结构对毒性作用的产生也有影响,例如cyclo(L-Leu-L-Hyp)及其结构类似物cyclo(L-Leu-L-Pro)对U251和U87-MG细胞系的毒性实验中,二者分别在IC50为29.4与14.5 μmol/L以及IC50为19.8与1.3 μmol/L[33]时对该细胞系表现出毒性作用。以上表明,环二肽虽然具有抗肿瘤的生理特性,但是环二肽类(CDPs)化合物不能对所有的肿瘤细胞都具有较强的抑制作用,其更强的毒性作用体现在细胞特异性方面[35]。
近年来,关于含硫DKPs的研究报道了一些环二肽对癌细胞的毒性作用,这些DKPs大多来自于真菌[36]。冠毛杆菌(C. cristatum)中发现的Cristazine通过死亡受体途径诱导细胞凋亡,对HeLa和A451具有细胞毒作用[32-37]。叶催产素是一种含二聚硫的DKPs,对实体肿瘤和血液肿瘤都表现出广泛的细胞毒性作用[38-39],在Lai等[40]的研究中,其在急性髓系白血病细胞HL-60、U937和KG-1a中诱导分化,并与其他表观遗传药物显示协同细胞毒性。除了细胞毒性作用,部分DKPs还能抑制一些肿瘤相关物质的合成[36]。BRD4蛋白经常在各种类型的肿瘤中表达,在Yu等[41]的报道中,基于脯氨酸的几种五环、六环或二聚体DKPs可能是BRD4蛋白(含溴域蛋白4)的有效抑制剂。
Song等[42]在2018年分离并鉴定了3株对茄科雷尔氏菌(Ralstonia Solanacearum GMI1000)具有高抗菌活性的新菌株。在前期工作中发现大肠埃希菌(Escherichia coli GZ-34)对茄科雷尔菌相对防治效果最佳,达到82.27%,且疾病指数降低至最小,达到16.67。研究人员对大肠埃希菌GZ-34的抗青枯病活性做进一步研究。在活性研究中发现cyclo(L-Pro-DIle)和cyclo(L-Pro-L-Phe)是大肠埃希菌GZ-34产生的主要抗青枯病活性物质。且后者是该菌株对稻瘟病菌(Magnaporthe grisea)孢子形成的抑制活性的关键成分。这些发现提示,大肠埃希菌中的环二肽可能被开发为新的潜在抗菌剂,用于农业防治。
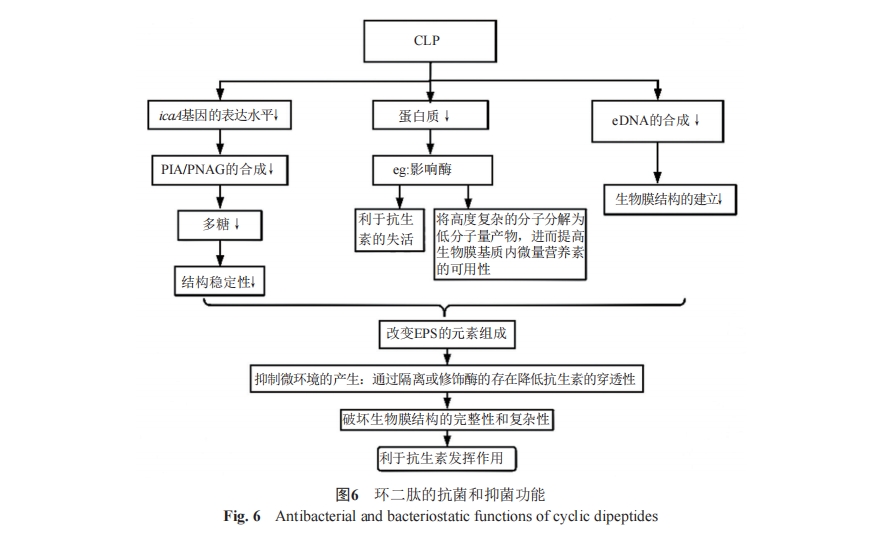
2020年郭庆丰等[3]在研究抑菌活性中发现:化合物cyclo(Tyr-Gly)、cyclo(Pro-Gly)和cyclo(Pro-Val)对大肠埃希菌有较强的抑制作用,MIC分别为16.0、4.0和8.0 µg/mL。2022年,Youssef 等[43]在对曲菌属中新发现的两种化合物进行的圆盘扩散实验结果表明:cyclo(L-NMe-Leu-L-NAc-Phe)和cyclo(D-6-OH-Pro-D-Phe)对大肠埃希菌和金黄色葡萄球菌(Staphylococcus aureus)的抑菌作用高于白念珠菌(Candida albicans)。目前已知的比较有效的是cyclo(Phe-Pro)(CFP)和为cyclo(His-Pro)(CHP)。其中CFP主要是通过刺激外膜孔蛋白OmpU的表达进而发挥作用;CHP主要通过增加抗促凋亡蛋白Bcl-2的表达,降低由氧化应激所引起的细胞凋亡进而发挥作用[44]。
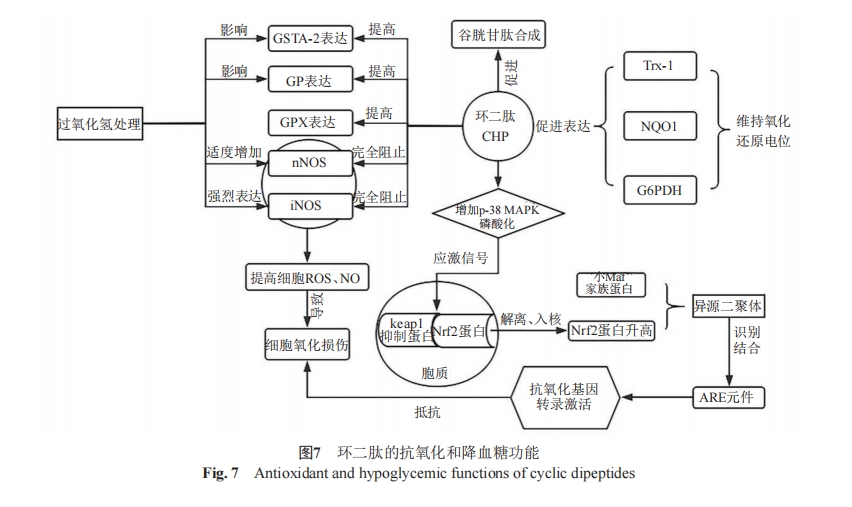
迄今为止,已有3种可能的机制来解释CHP的降血糖作用[48]。①肠促胰岛素样机制,促进胰岛素分泌。Mori等[49]在测定大鼠胰腺提取物中的CHP时推论cyclo(His-Pro)可能通过参与儿茶酚胺代谢、促进胰岛素及胃肠激素的分泌来参与糖代谢。②促进肠道对锌的吸收以及刺激肌肉细胞对葡萄糖的吸收的机制。已知Goto-Kakizaki大鼠模型是研究与肥胖无关的糖尿病的最佳模型。Song等[50]利用此模型研究锌加CHP在遗传性糖尿病中的抗高血糖活性时发现,CHP能通过刺激葡萄糖利用来改善血糖代谢。其过程可能是通过影响胰岛素受体亚基的自磷酸化来刺激大鼠肌肉组织中的葡萄糖摄取。③基于对活性羰基物种(reactive carbonyl species,RCS)具有显著的解毒作用的特性,促进高级脂质氧化终产物(advanced lipoxi-dation end-products,ALEs)的生成减少。已知持续的高血糖水平会促进自由基的生成,而自由基会催化RCS的生成,最后造成β细胞的功能障碍[51]。这些生物效应对抗氧化、降血糖等肽类药物的研发具有提示意义。
环二肽可以通过抑制酶的活性来改善中枢神经系统。申丽等[52]在研究裙带菜内生菌(Bacillus sp.QD4)发酵液的化学成分时发现,在400 µg/mL浓度时,cyclo(L-Pro-D-Tyr)和cyclo(L-Pro-L-Tyr)对AChE的抑制率分别为5.62%±1.63%和11.62%±2.29%。据研究表明,部分阿尔茨海默病 (alzheimerdisease,AD)患者的海马和新皮质的乙酰胆碱(acetylcholine,ACh)会显著减少。上述2种环二肽抑制AChE活性,导致AChE的减少,达到明显改善和缓解AD患者的症状的成果。这为研发AChE抑制剂提供了新方向。
此外,环二肽还可以发挥神经保护和神经调节功能。已知cyclo(Gly-Pro)(CGP)对中枢神经系统有良好作用,包括抗健忘、促进记忆作用[53],神经保护作用[54]。Kaneko等[55]对口服CGP促进大鼠中风模型的任务学习展开研究。已知达到学习标准所需天数的主要影响因素可能是病变区的大小。而且脑室下区(subventricular zone,SVZ)神经干细胞数量的增加被认为是皮质损伤后新神经元的来源。在该实验中,他们监测到大鼠在口服CGP后损伤体积减小,干细胞数量增加。低CGP组大鼠学会任务的所需时间更短。据研究表明[56]:大多数内源性IGF-1与IGFBP-3结合,少部分游离的IGF-1通过与IGF-1R结合,影响神经元生长、存活和生长。CGP可以通过与内源性IGF-1竞争结合IGFBP-3来调节游离的IGF-1。他们认为是因为外源性CGP的添加调节了IGF-1的量。损伤区域附近的IGF-1浓度增加,促进了学习。该报道首次阐述了口服最佳剂量的CGP可通过神经可塑性和网络重构的方式,促进局灶性缺血性梗死大鼠的感觉-运动联想学习,而非通过神经保护作用。该研究结果提示CGP给药有望成为加速脑损伤修复的策略[55]。
4 总结和展望
综上所述,环二肽的生物活性不仅限于抗菌、抗肿瘤,还包括影响抗氧化、降血糖、加速脑损伤修复等作用。现在的科学技术越来越发达,我们能够更容易地提取出环二肽类化合物,也能更容易合成环二肽类化合物,环二肽是环肽类化合物里最小,最简单的环肽化合物,也是最有特点的化合物。本课题组在对20余种化学合成的环二肽样品进行细胞毒性实验时,发现几种对NIH-3T3细胞生长具有促进作用的活性结构。由此可见,通过合理设计与化学合成有望开发出新型功能环二肽。

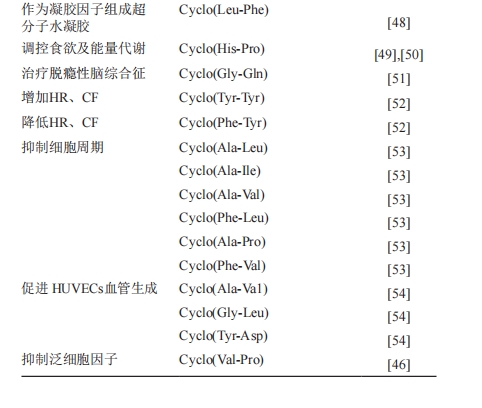
根据最新的文献及数据总结了多种环二肽的生理活性,它们可以作为信息分子参与细胞间信息传递,也可以抗肿瘤、抑菌、抗氧化、降血糖和提高心血管系统能力等,如表1所示等。综上所述,希望加强环二肽的生物学活性和药理价值方面的研究,更加充分地了解它的特性,发掘它在抗菌、抗肿瘤药物研发、农业应用等方面更大的潜力,创造出更大的应用价值。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。