
摘要:对水产加工过程中的鱼皮废弃物进行深加工处理,对其高附加值利用可以变废为宝,减少环境污染;鱼皮来源生物活性肽具有抗氧化、抗高血压、抗菌等功效。对鱼皮废弃物中生物活性肽的提取、分离鉴定方法及其功能活性进行深入探讨,可为食品、保健品、化妆品、医药品和化工产品等相关产品的开发提供理论基础。本文综述了酶法、化学法及发酵法提取鱼皮来源生物活性肽的优缺点,酶法相对于化学法应用广泛,获得的生物活性肽活性高,发酵法成本低,适用于批量生产。归纳总结了超滤、纳滤、凝胶过滤、离子交换和高效液相色谱及质谱联用等鱼皮生物活性肽的分离纯化和鉴定方法,多种分离、鉴定方法相结合来获取具有特定功能活性的鱼皮生物活性肽是首选,但获得高纯度及高活性的目标产物仍是当前亟待突破的难点。此外,分析了鱼皮生物活性肽在抗氧化性、血管紧张素转换酶(angiotensin converting enzyme, ACE)抑制活性、抗菌性及其他生物活性的研究现状,归纳了功能活性与肽的分子量大小、肽序列结构及位置的构效关系。最后展望了生物活性肽在功能活性研发方面的不足之处及进一步研究的方向,以期可为鱼类加工业打造高值化利用功能性产品提供参考。
我国是水产养殖大国,每年水产加工产生的鱼皮、鱼鳞和鱼骨等下脚料高达250万吨,其中,鱼皮价格低廉,在水产品加工副产物中占主导,约占鱼类加工总量的7%-8%。目前,仅加工成鱼饲料等低值化产品或者掩埋丢弃的方式处理鱼皮等加工副产物,不仅造成资源浪费,甚至可直接导致环境污染[1]。与陆生动物性副产物资源相比,鱼皮来源广泛、易于加工、生物安全性高[2]。鱼皮中蛋白质含量丰富,可通过蛋白酶水解法、化学法或微生物发酵法等生产功能性生物活性肽[3]。由于肽的生物活性与其氨基酸组成及序列密切相关,不同的提取方法得到的产物功能活性不一[4]。鱼皮生物活性肽丰富的疏水性氨基酸,使其具有一定的抗氧化性[5]、ACE抑制活性[6-7]。此外,鱼皮生物活性肽还具有抗菌[8]、免疫调节[9]、抗癌[10]等功效。鱼皮生物活性肽一般含有2-20个氨基酸残基,相对分子质量低于6 000 Da,属于小分子肽。由于小分子肽更能抵抗内源性消化酶的水解,与氨基酸和蛋白质相比具有更高的生物可利用性[11]。因此,对水产加工产生的鱼皮废弃物中生物活性肽的提取、分离鉴定方法及其功能活性进行深入探讨,不仅有助于以之为基础的新功能食品、保健品、化妆品、医药品和化工产品等的开发,提高其附加值,而且能将其变废为宝,减少环境的污染,为鱼类水产加工业的发展提供更加广阔的前景。
基于此,本文对近年来国内外鱼皮来源生物活性肽的提取、分离纯化、结构鉴定及其功能活性等方面的研究进展进行全面介绍,重点介绍生物活性肽在抗氧化性、ACE抑制活性、抗菌性、免疫调节性、神经保护活性与肽结构的构效关系,以期为我国水产鱼皮废弃物高值化功能性产品的深入打造提供理论指导和有力借鉴。
1 鱼皮生物活性肽的提取

酶法是指蛋白质在一定条件(温度、pH、酶浓度等)下水解生成肽的方法。酶法生产条件温和、安全、过程容易,反应过程可以控制,且不会破坏蛋白质中的氨基酸,目前在胶原蛋白肽制备中得到广泛应用[12-13]。酶法步骤包括材料前处理、蛋白酶的选择、水解度的测定、均质和加热灭活蛋白酶等[16]。常用的商业化蛋白酶主要有碱性蛋白酶、木瓜蛋白酶、胰蛋白酶、中性蛋白酶和复合蛋白酶等[17-18]。
酶法提取鱼皮生物活性肽既可采用单一蛋白酶进行,也可采用复合蛋白酶或分步酶解法配合进行。酶的最适反应浓度、pH值和温度均因酶的种类不同而有所差异,酶浓度(0.001%-0.005%,W/W)、pH值(1.5-11)和温度(35℃-60℃)是常用的制备条件[19]。秦倩倩等[20]以1,1-二苯基-2-三硝基苯肼自由基(1,1-diphenyl-2-picrylhydrazyl, DPPH·)清除率为指标,从5种蛋白酶中筛选出碱性蛋白酶为草鱼皮胶原蛋白的最佳水解酶;通过Plackett-Burman试验设计、最陡爬坡试验和Box-Behnken中心组合试验优化,得出最优酶解条件为酶解时间3.0 h,酶解温度46.5℃,用酶量7 025.2 U/g;在此条件下,酶解产物对DPPH·清除率达78.3%。此外,Himaya等[21]采用分步酶解法水解太平洋鳕鱼(Gadus macrocephalus)皮,采用胃蛋白酶水解鱼皮,再采用胰蛋白酶及胰凝乳蛋白酶双酶法酶解,最终得到相对分子量为1 301 Da的寡肽,该酶解产物具有较强的ACE抑制活性。
为了提高酶解产率,需优化蛋白酶的水解条件,如蛋白酶用量、水解pH值和温度等[22]。靳书杰[23]以日本黄姑鱼(Nibea japonicus)鱼皮为原料,分别采用中性蛋白酶、木瓜蛋白酶、胰蛋白酶、碱性蛋白酶和胃蛋白酶对其进行酶解,以DPPH·清除率为评价指标,结果显示中性蛋白酶酶解产物DPPH·清除能力最大,而后选取中性蛋白酶为最优酶,再进行单因素实验,优化得到其最优水解条件为酶解时间5 h、加酶量1 500 U/g、料液比1∶6、酶解温度45℃和pH 7.0。
综上所述,为了提高酶解生物活性肽的提取效率,首先应选择合适的蛋白酶或者复合蛋白酶水解鱼皮,并对蛋白酶的水解条件进行优化,提高蛋白酶的水解效率。
化学法包括酸法、碱法提取或者酸碱法混合提取,是通过强酸或者强碱水解蛋白质使肽键断裂的方法。鱼皮被碱水解后,特定的氨基酸,如色氨酸、丝氨酸和苏氨酸会被强碱破坏,因此在水解的过程必须严格控制反应pH和温度[4]。生物活性肽通过酸法、碱法提取的一般步骤包括:用碱液(一般为NaOH)对鱼皮进行前处理,并在一定的温度下搅拌一定的时间。重复3遍碱处理除去非蛋白物质和色素等杂质后,反复用酸液(一般为HCl,也可以是醋酸)处理。在酸、碱处理后,用蒸馏水将鱼皮洗涤至中性,溶解于蒸馏水中65℃保持4 h。有些研究提取步骤还包括脱脂,如Jongjareonrak等[24]采用正丁醇脱脂处理24-48 h,每8 h换液一次,上清液用醋酸溶解并温和搅拌24 h,通过脱脂处理可以提高活性肽的纯度。上述步骤得到蛋白质水解物后,采用强酸、强碱使蛋白质水解为生物活性肽。提取条件为6-12 mol/L HCl或者4 mol/L H2SO4、100-200℃,水解12-24 h;或者6 mol/L的NaOH或2 mol/L的Ba(OH)2、水解6 h,然后经活性炭脱色,再通过701型树脂除去酸和盐[25]。Cole等[26]从比目鱼(Pleuronectes americanus)表皮和黏液提取物中得到抗菌肽,从皮肤上刮取黏液,加入50 mL 0.2 mol/L Na2Ac,0.2% Triton X-100, 1 mmol/L苯基甲基磺酰氟,均质,匀浆,再以20 000×g离心20 min,将上清液进一步纯化,得到含有25个氨基酸残基的抗菌肽,其氨基酸序列为:GWGSFFKKAAHVGKHVGKAALTHY。
化学法具有操作简便、成本低廉等优点,但是相比于酶法提取,该法存在一定的不足:反应过程难以控制,会引入有毒化学物质,还会破坏特定的氨基酸结构,如色氨酸、丝氨酸和苏氨酸[27];同时,由于化学试剂裂解多肽化学键不具有特异性,导致化学法制备生物活性肽难以复制;水解产物成分复杂,应用范围受限等。因此酶法比化学法应用更广泛。
发酵法是利用微生物菌种在生长繁殖代谢过程中产生的蛋白酶来水解蛋白质底物制备生物活性肽的方法。该法可有效回收或将食品转化为酶、有机酸等高价值产品[28]。在发酵的过程中,生物活性肽在微生物和内源性蛋白酶水解的过程中被释放出来。
目前,用于发酵法制备生物活性肽的菌种主要有枯草芽孢杆菌(Bacillus subtilis)、地衣芽孢杆菌(Bacillus licheniformis)、曲霉菌(Aspergillus)以及乳酸菌(Lactic acid bacteria)等[29]。Jemil等[30]通过一种蛋白水解菌枯草芽孢杆菌(B. subtilis)A26发酵几种鱼类蛋白质,生产蛋白质水解物。在发酵过程中,鱼皮蛋白质释放出的一些生物肽和氨基酸在蛋白质水解酶的作用下,可被菌株用作碳氮基质增长。吴海滨[31]利用米曲霉(Aspergillus oryzae)发酵鳕鱼皮制备生物活性肤,对米曲霉的发酵条件进行优化,选择最优条件进行活性肽发酵,分离得到较强抗氧化性和ACE抑制活性的肽。邢瀚文等[32]以罗非鱼(Oreochromis niloticus)鱼皮为原料,利用枯草芽孢杆菌固态发酵(solid-state fermentation,SSF)制备胶原蛋白肽,发酵活性肽中含有7种必需氨基酸,分子量小于5 000 Da的肽段抗氧化性最强,清除羟基自由基(hydroxyl free radical,·OH)、超氧阴离子自由基(·O2-)和DPPH·的IC50值分别为3.83、4.19和2.37 mg/mL,且具有较好的还原力。
发酵法的酶水解由微生物蛋白酶进行,生物活性肽无需进一步水解就可直接分离获得。相比其他方法,发酵法操作较为简便,成本较低,适合批量生产,并且可以增加产物风味、去腥。但是相比于酶法,发酵法的效率低,产物纯化比较困难,部分产酶菌株可能会对机体产生一定的毒害作用、安全性低等限制了发酵法的广泛应用[15],因而安全高效的发酵菌株的获得及选择显得至关重要。
2 鱼皮生物活性肽的分离鉴定
虽然当前已有大量的生物活性肽分离鉴定方法,但探索可获得高纯度及高活性的目标产物仍是当前迫切需要突破的难点。目前我国鱼皮生物活性肽的研究发展非常迅猛,开发出高效且精准的鱼皮生物活性肽分离鉴定技术,可推动鱼皮生物活性肽的健康有序发展[44]。
3 鱼皮生物活性肽的功能活性

从以上结果可以看出,鱼皮来源抗氧化肽分子量大部分小于1 000 Da,且大部分含有疏水性氨基酸,如丙氨酸(Ala)、亮氨酸(Leu)、脯氨酸(Pro)、酪氨酸(Tyr)、苯丙氨酸(Phe)和赖氨酸(Lys)。鱼皮胶原蛋白中含有丰富的抗氧化活性肽,是理想的抗氧化活性肽的来源之一,有望应用在药品、化妆品和食品中。不过,未来的研究方向应该是鱼皮生物活性肽在体内的实际应用效果。
血管紧张素转化酶ACE(EC 3.4.15.1)是一种金属二肽酶,它在血压的调整上具有必不可少的作用。ACE是肾素-血管紧张素系统(RAS)的一部分,可以将血管紧张素I(Asp-Arg-Val-Tyr-Ile-His-Pro-Phe-His-Leu)从C末端切除His-Leu,转化成血管紧张素II(Asp-Arg-Val-Tyr-Ile-His-Pro-Phe),而血管紧张素II可以使小动脉收缩和加速心脏搏动导致血压升高。另一方面,ACE也是激肽释放酶-激肽系统(KKS)的重要组成部分,它可以催化缓解激肽成为失活片段,从而加速机体血压升高。因此,ACE抑制剂可以起到降低血压的作用[57]。由于传统的抗血压药物会引起一定的副作用,因此,寻找天然安全的具有抗血压活性的生物活性肽成为研究的热点。
ACE抑制活性与结构的关系尚未确定,但有研究报道,大部分ACE抑制肽包含脯氨酸、赖氨酸或芳香族氨基酸,且受肽链C端的氨基酸序列影响,尤其是当肽链C端为脯氨酸等疏水性氨基酸时,ACE抑制活性更强[58]。ACE抑制活性的检测方法主要有分光光度法、RP-HPLC法[59]、荧光法[60]和毛细血管电泳法(CE)。其中,分光光度法和毛细血管电泳法主要原理都是ACE通过水解底物马尿酰-组氨酰-亮氨酸(N-hippuryl-His-Leu hydrate, HHL)产生马尿酸(HA)的量来确定ACE抑制率,抑制率大小一般通过半抑制浓度(IC50)表示。RP-HPLC法采用C18柱检测HA的成分,虽然省去了萃取HA的步骤,但需要消耗大量的流动相,对样品量多的情况不适用。
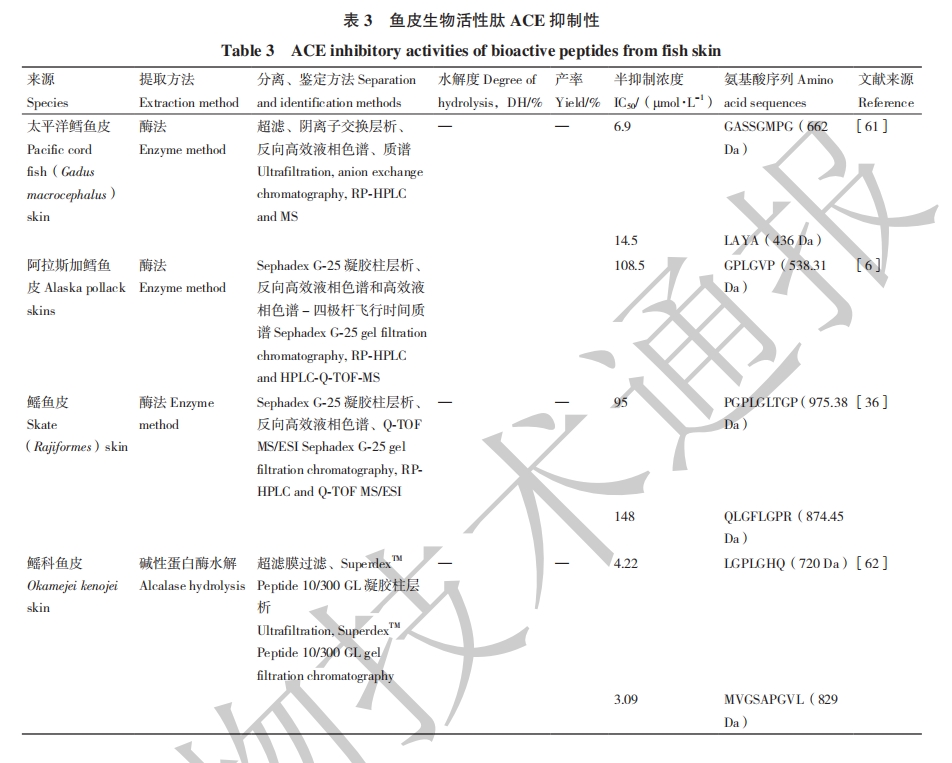
由于人体内肠道与体外的环境条件不同,因此要想了解ACE抑制肽在人体内的实际效果,需首先建立一套模拟体内消化系统的研究方法。一方面,未来的主流研究方向可能是基于电子计算机信息系统辅助建立肠胃消化酶系统模拟研究模型;另一方面,未来ACE抑制肽研究应重点在其对肠胃消化酶的抑制活性以及细胞的可行性等方面[57]。
鱼类生活环境一般都有大量致病微生物,它们经常会直接接触潜在的病原体。鱼皮可直接为鱼提供天然的物理屏障保护,也可通过天然免疫因子如抑菌肽(AMPs)作为化学保护屏障来间接保护自己[63]。AMPs的生物活性在很大程度上与其电荷、螺旋度、疏水性及序列等物理化学结构有关[64]。
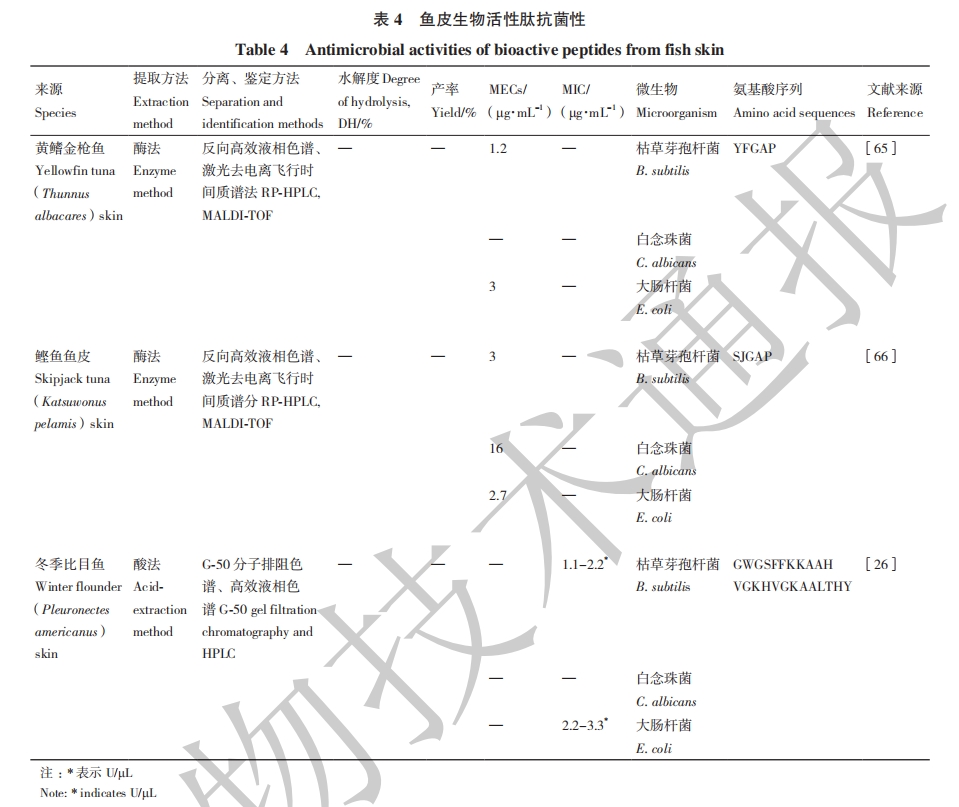
综上可知,部分鱼皮来源的多肽具有一定的抗菌性,其抗菌性强弱与肽的序列、结构、大小密切相关,将来有望应用在食品保藏和化妆品生产等领域。
4 总结与展望
通过酶法、化学法及发酵法等进行提取,进而利用超滤、HPLC、质谱等对提取物进行分离纯化及鉴定,可以获得广泛功能的鱼皮来源生物活性肽,如抗氧化性、抗血压性、抗菌性和免疫调节性等。目前,围绕鱼皮来源生物活性肽功能活性的研究主要包括以下3个方面:(1)对不同种类鱼皮来源活性肽进行工艺提取研究,并优化提取效率和产物质量;(2)分离鉴定方法的创新;(3)活性肽的结构与功能活性如抗氧化性、ACE抑制性及抗菌性等作用的关联机制研究。
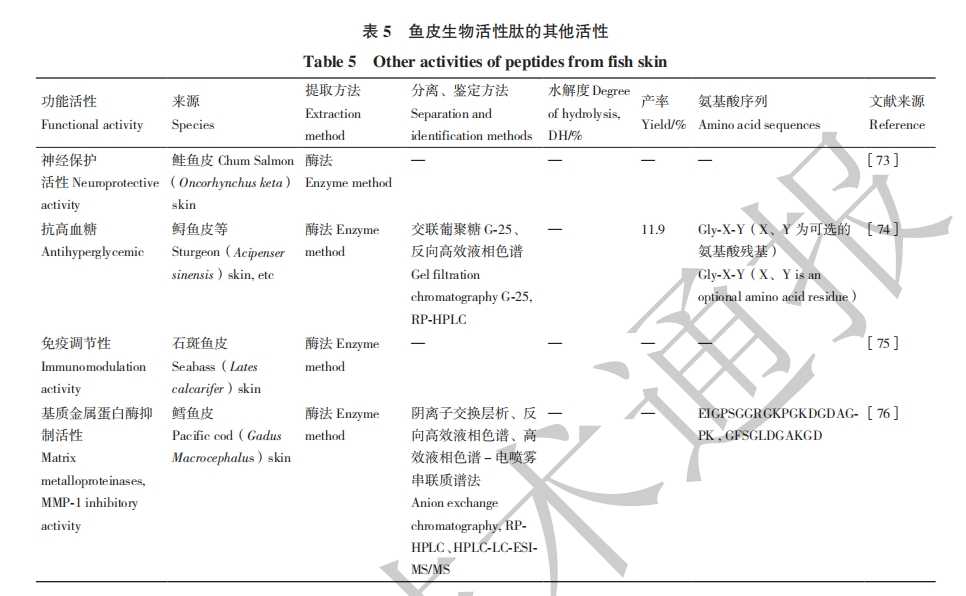
综上所述,今后鱼皮生物活性肽研究应着重在如下方面:探索高效安全的提取方法,提高提取效率;开发安全高效的发酵菌株;利用现代化信息技术,开发高效、精准的分离、纯化及鉴定技术,提高活性肽的活性和利用率;开展功能活性人体内实验,探明活性肽的结构与活性关联机制;抗氧化肽的潜在免疫调节活性,即抗炎、抗过敏和调节细胞的信号通路等值得进一步关注。另外,当前关注较少的生物活性如免疫调节性、神经保护作用、抗癌性等方面值得进一步细致全面地探索,如对阿尔茨海默症中观察到的β相关神经毒素性疾病的神经保护作用等。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志