
[摘要] 抗菌肽是一种小分子活性肽,来源广泛,在生物体免疫激活和调节中发挥重要作用,且具有抗菌活性,这为解决抗生素耐药性问题提供了可能。LL‐37是组织蛋白酶抑制素家族中唯一在人体内的成员,对革兰阴性菌和革兰阳性菌均有抑制作用。该文从LL‐37活性结构域进行分析,阐述了LL‐37在抗菌、抗内毒素、创伤愈合、免疫调节等方面的作用机制及临床治疗潜力,展望了其应用前景,为新药研发、食品防腐和动物饲料添加提供思路。
抗生素曾在世界上占有重要的地位,拯救过无数人的生命,在农药、食品添加剂、畜牧类养殖中发挥了重要作用,成为热门的抗菌药。然而,在 20 世纪70年代后,研发出高效抗生素却成为难题。由于抗生素的长期使用,越来越多的细菌表现出耐药性,甚至产生了顽强的“超级细菌”[1~4]。细菌抗药性的增强使诸多抗生素失去效力,因此,开发能够替代抗生素的新型有效产品刻不容缓[5,6]。
抗菌肽来源广泛,最早发现于昆虫的免疫系统中。随后,从细菌、真菌、两栖动物、高等植物和哺乳动物中也提取了类似的多肽。这种活性肽具有天然免疫功能,是宿主抵抗病原微生物入侵的重要分子屏障,因此被称为抗菌肽[7,8]。抗菌肽具有抗菌谱广、相对分子质量小、热稳定性高、水溶性好等特点。目前研究已涉及到分子结构、分子改良、作用机制等多方面[9]。从抗菌机制方面来看,抗生素作用于特殊受体,细菌可通过变异来对抗它的作用,最终导致耐药菌的产生。而抗菌肽可经过物理作用使细胞膜穿孔,最终达到广谱抗菌的效果,因此不易产生耐药性。所以,抗菌肽极其可能成为抗生素的替代品[10]。
其中,人源性抗菌肽细胞毒性低且排异反应小,显示出一定的临床治疗优势[11]。目前人源抗菌肽有组织蛋白酶抑制素(cathelicidin)家族、防御素(defensin)家族、富含组氨酸蛋白家族等[12]。防御素家族是一种内源性抗菌肽,抗菌活性较强,仅 1~10 µg即显示出抑菌活性。组织蛋白酶抑制素家族是哺乳类动物特有的抗菌肽,LL‐37 是其唯一在人体内的抗菌肽,具有多种作用。组织素(histatin)是一类富含组氨酸的抗菌肽,有较强抗细菌和抗真菌活性[13]。随着医学技术精进,多种人源抗菌肽已进入临床试验[14],如人乳铁蛋白1‐11(human lactoferrin1‐11,hLF1‐11)已进入临床Ⅱ期阶段,用于骨髓移植过程抗感染治疗;天蚕素 B衍生物(HB‐107)进入临床前期,用于创伤修复;来源于猪抗菌肽的类似物(protegrin analogue,IB‐367)进入Ⅲ期临床试验,用治疗黏膜炎[15~17]。所以,人源抗菌肽极有可能成为研究热点。
LL‐37 主要合成部位为中性粒细胞,具有两亲性α螺旋结构,可由巨噬细胞、单核细胞、角蛋白细胞、中性粒细胞等进行分泌[18]。LL‐37具有抑制革兰阳性(G+)及革兰阴性(G-)菌活性特点,并有抗内毒素、趋化作用、促进血管生成作用等功能,这些都显示出其代替抗生素的可能性。但抗菌肽由于含量较少,且分离纯化步骤复杂,不易提取,费用昂贵,传统分离方法已不适合大量生产[19]。现今多采用基因工程化生产,筛选出表达量高、高抗菌活性、低毒性抗菌肽,并进行下一步分析[20]。
然而,相比于抗生素,LL‐37抗菌活力仍然处于劣势,如何提高抗菌活性并降低溶血活性和细胞毒性是关键点[21]。目前,将目的基因导入载体内进行高效表达是较为理想的手段。在进行修饰改造前,人们需要在基本不改变抗菌肽优势结构前提下,通过氨基酸置换、部分序列截取和组合化学库等方法获得目的抗菌肽,这将是未来构建优效抗菌肽的重要方法[22,23]。改变抗菌肽对细菌细胞膜的结合作用,对抗菌肽抑菌活性调控有关键作用。杨艳丽等[24]分别用 Gln16、Asn26 和 Gln36 取代 Glu16、Asp26 和Glu36,使静电从+5.8 增加到+9.0。这种修饰提高了LL‐37 正电荷水平,并未改变 LL‐37 空间结构。Ga‐gnon 等[25]发现肽链长度也与抗菌活性有关。在肽链长度相同情况下,长度越长,正电荷越多的抗菌肽抗菌效果越好。
因此,本文对 LL‐37 抗菌肽的生物结构进行解析,分析不同区域的关键作用,并对生物学特性(抗菌、抗内毒素、免疫调节、促进血管生成)等方面进行阐述,将为人类抗菌肽的开发提供理论依据,并在LL‐37潜在应用方面提供思路。
1 LL⁃37生物结构及生物功能
1.1 生物结构
人阳离子抗菌蛋白18(human cationic antimicrobialprotein 18,hCAP18)是组织蛋白抑制素家族成员,以主要蛋白形式存在于中性粒细胞中,由睾丸、骨髓、肺上皮细胞、炎性上皮角质形成细胞、食管、宫颈等产生,主要通过具有抗菌活性的 C 端与脂蛋白连接[26]。hCAP18以非活性前体蛋白形式储存在颗粒中,在一定条件下分裂出其中的C端活性肽,即LL ‐37肽[27]。在体内 hCAP18 出胞后,蛋白酶 3 对其进行裂解。有实验表明,只要蛋白酶 3 浓度足够高,hCAP18就能全部生成LL‐37[28]。
LL‐37的 N端前含有的两个赖氨酸残基(L),且由 37 个氨基酸组成,因此得名 LL‐37[29]。LL‐37 可在人体各组织器官中表达,特别是在消化道、皮肤、泌尿道和口腔上皮细胞中。此外,它也表达在一些伤口渗出液、汗液和血液中[30]。LL‐37 基因启动子区域内包含 1个 TAAA 序列、1个白介素 6核转录因子(nuclear factor interleukin‐6,NF‐IL‐6)结合位点、3个 急 性 期 反 应 因 子(acute phase response factor,APRF),可与体内生成的炎症因子结合,从而增加LL‐37基因表达水平[31]。
在纯水中,LL‐37形成不规则的螺旋结构,当周围环境改变 α 螺旋结构时,会形成两亲性阳离子结构。LL‐37存在的C端和N端α‐螺旋,两端的螺旋线通过转折或弯曲分开。第 5、6、17和 27位苯丙氨酸侧链向同一方向延伸,形成疏水表面,正电荷残基和疏水表面可与负电荷分子结构直接相连,如G+脂糖、G-磷壁酸等[32]。在人体汗液中,hCAP18修出 LL‐37片段产物(KS‐30和 RK‐31),二者的 N端氨基酸含量比 LL‐37 少 6/7,具有较强的抗菌活性,但不具有免疫调节能力[33]。另外,LL‐37在缺乏N端4种氨基酸时,仍能保持抗菌活性,但大部分溶血活性丧失。这些结果表明,N端螺旋对多肽的寡聚、趋化、溶血和抗蛋白酶水解有重要作用。许多实验小组研究了截短肽的活性,以了解 LL‐37 最小抗菌区域[34]。结果表明,LL‐37的最小区域在氨基酸17~29位或 18~29 位之间,表明 LL‐37 的 C 端螺旋具有抗菌、抗病毒和抗肿瘤等作用。
研究显示,恒河猴的同源蛋白 RL‐37 净正电荷为+8,大于 LL‐37 的+6,抗菌活性要高于 LL‐37[35]。因此增加LL‐37中的碱性氨基酸数目而不改变其α‐螺旋构象可提高其抗菌活性[36]。肽链中带正电荷和疏水性氨基酸的数目也与其他活性有关,并具有构象依赖性特点,因此可通过以下方式改造:①在结构上应为管状或螺旋状,在形状上保持分子的亲水性和疏水性;②搭配正电性与负电性氨基酸、亲水性与疏水性氨基酸,辅以易形成螺旋状结构氨基酸,提高抗菌肽活性;③增加正电性和疏水氨基酸的数量来提高杀菌力和抗内毒素能力。
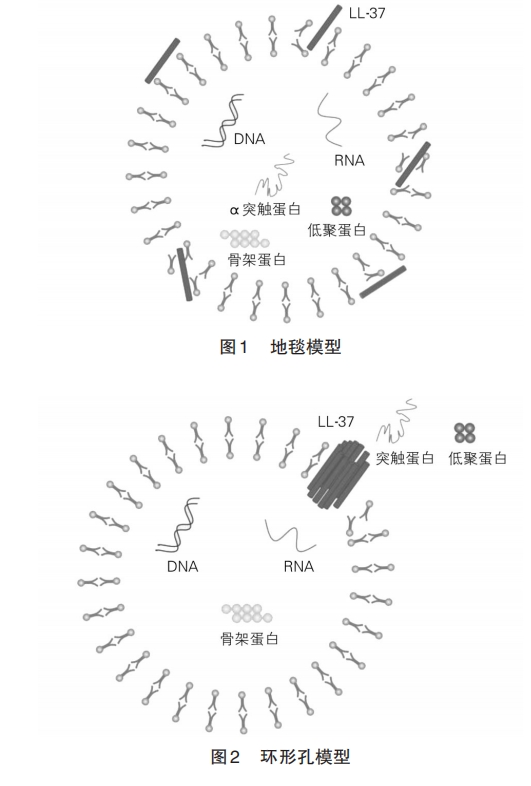
1.2.2 抗内毒素作用 脂多糖(lipopolysaccharide,LPS)主要位于 G‐细胞外膜上。参与过程主要有:①在 LPS 诱导的 Toll 样受体(Toll‐like receptor,TLR)‐核因子 κB(nuclear factor kappa‐B,NF‐κB)信号通路中,LL‐37 起调节作用。此外,LL‐37 抑制 LPS 诱导的 NF‐κB亚单位 p50及 p65的转录[41]。②丝裂原活化蛋白激酶(mitogen ‐activated protein kinase,MAPK)通道被激活,从而增加促炎反应通道活性[42]。③选择性地调节基因转录,降低促炎反应基因 p50及肿瘤坏死因子‐α(tumor necrosis factor‐α,TNF‐α)的表达。④抑制 LPS 与 LPS 结合蛋白(LPS‐binding pro‐tein,LBP)、髓样分化蛋白 2(myeloid differentiationprotein 2,MD‐2)或 TLR 复合物相结合,降低下游通路的激活。经过这些机制调节,由LPS引起的不良反应可被LL‐37有效抑制。
1.2.3 免疫调节作用 在稳定状态条件下,中性粒细胞发生结构性凋亡,以结束其短暂寿命。中性粒细胞坏死或凋亡后,在炎症部位形成中性粒细胞胞外杀菌网络(neutrophil extracellular traps,NET),可提供高浓度抗菌分子,快速控制体内细菌感染[43,44]。参与多种慢性炎症的 NET 可在体内外释放 LL‐37,同时LL‐37也促进外周中性粒细胞以剂量依赖方式形成 NET。而 NET通过 C1q(血清补体)/LL‐37特异性抑制LPS激活的巨噬细胞分泌IL‐6[45,46]。早期研究表明,LL‐37 来源的成熟树突状细胞(maturationof dendritic cell,mDC)与LPS产生了一个典型的辅助性T细胞(helper T cell,Th1)诱导细胞因子谱(IL‐12、IL‐6 和 TNF‐α 显著增加,IL‐4 显著降低)。此外,在mDC刺激下,T细胞对免疫活性物质γ干扰素(interfer‐on gamma,IFN‐γ)的合成显著增加。因此,LL‐37似乎是先天免疫系统和适应性免疫系统之间的桥梁。通过评估 LL ‐37 在外周血单个核细胞(peripheralblood mononuclear cells,PBMC)中的作用,研究人员发现LL‐37也促进调节性T细胞产生,而不影响T细胞活化;在炎症[植物血凝素(phytohemagglutinin,Pha)激活]背景下,LL‐37肽可诱导静息T细胞增殖,显著降低促 PBMC 促炎因子表达(IFN‐γ,TNF‐α);表明当肽发挥自身抗感染特性时,该反应始终控制促炎反应,以保护机体免受严重炎症反应[47]。而且,LL‐37 调节 TLR 3 的表达,促进分泌更高水平抗炎因子[吲哚胺2,3‐双加氧酶(indoleamine2,3‐dioxy‐genase,IDO)]、IL‐10和转化生长因子β(transforminggrowth factor‐β,TGF‐β),并提高间充质干细胞对过度刺激的T细胞的抑制功能。因此,LL‐37可能提供对机 体 的 保 护 ,并 通 过 多 种 途 径 发 挥 免 疫 调 节作用[48]。
1.2.4 创伤愈合 血管生成、上皮细胞迁移和增殖、成纤维细胞抑制胶原生成是上皮创伤愈合的 3个关键因素,大多数作用是通过激活表皮生长因子受体(epidermal growth factor receptor,EGFR)介导。LL‐37的存在可加速G蛋白偶联受体(G protein‐coupledreceptors,GPCR)对 EGFR 反式激活,促成角化细胞迁移,促进创面修复。LL‐37还可诱导血管生成,可将内皮前体细胞聚集到损伤需要修复部位,激活内皮细胞,促进内皮细胞增殖,形成血管样结构[49]。
除上述功能外,LL‐37还具有抗病毒、抗真菌等作用,这将为LL‐37投入到临床试验提供依据。
2 LL⁃37临床治疗潜力
嗜神经单纯疱疹病毒 1(herpes simplex virus 1,HSV‐1)是人类疱疹病毒科的一员,可作用于口腔和生殖器黏膜[50]。有研究显示 LL‐37 对 HSV 复制有显著影响。干扰素有抗病毒作用,在经 LL‐37 处理的感染 HSV‐1 角质形成细胞中,显示 5 个重要干扰素刺激基因[干扰素诱导的四肽重复蛋白1(interferon‐induced protein with tetratricopeptide repeats 1,IFIT1)、干扰素刺激外切酶基因 20 kDa(interferon stimulatedexonuclease gene 20 kDa,ISG20)等]表达增加[51]。在体外细胞培养实验中,vero 细胞(非洲绿猴肾细胞)用 LL‐37 预处理,然后用 HSV‐1 感染,也检测到HSV‐1复制显著减少[52]。有学者用脂质体LL‐37处理 HSV‐1感染的 HaCaT 细胞(人永生化角质形成细胞),结果发现,与游离LL‐37多肽相比,纳米脂质体LL‐37 毒性更小,保质期更长,更易被吸收。因此,脂质体 LL‐37 为预防 HSV‐1 感染提供了思路,很有可能成为潜力药物[53]。
严重急性呼吸系统综合征冠状病毒2型(severeacute respiratory syndrome coronavirus 2,SARS‐CoV‐2)是引起当今流行的新冠肺炎的主要病原体,这种包膜单链RNA病毒可导致急性呼吸系统疾病,严重时可致死亡[54~56]。数据结果表明,维生素 D 上调 LL‐37表达,它可直接或间接作用于 SARS‐CoV‐2,阻止其复制,增加抗炎细胞因子的产生,减少促炎免疫反 应[57] 。采 用 间 充 质 干 细 胞(mesenchymal stemcells,MSC)及其衍生物治疗 SARS‐CoV‐2 感染的临床试验正在进行中。MSC产生多种可溶性因子,包括 抗 菌 肽 LL ‐ 37,可 与 病 毒 结 合 并 使 其 复 制 失效[58,59]。然而,LL‐37抗 SARS‐CoV‐2的机制尚不明确,需进一步探索。
埃博拉病毒(Ebola virus,EV)是一种来自丝状病毒科的单链RNA病毒,有较强感染性和较高死亡率[60]。最近发现,LL ‐37 和 LL ‐37 变体(GI ‐20 和17BI)在抑制重组型水泡性口炎病毒[可表达EV‐糖蛋白(glycoprotein,GP)]和野生型 EV 感染中起到重要作用。这些LL‐37药物通过损害HeLa细胞系(人宫颈癌细胞)中的组织蛋白酶b介导的EV糖蛋白加工,能抑制 EV细胞进入,但不能控制病毒复制。更重要的是,两种含有D‐氨基酸改良抗菌肽对胞内酶解具有抵抗力,比 L型抗菌肽更有效[61]。这些有望进一步探索它们在动物模型中预防 EV 感染作用,以及与抗病毒药物联用的可能性。
结直肠癌(colorectal cancer,CRC)是第二大最致命的癌症,占癌症死亡率 9.2%[62]。LL‐37在正结肠黏膜中表达强烈,但在结肠直癌组织中表达下调。低LL‐37水平已被认为是结直肠癌的生物标志物。同时,LL‐37可降低抑制凋亡B细胞淋巴瘤‐2基因(b‐cell lymphoma‐2,Bcl‐2)水平,提高促凋亡 Bax/Bak(Bcl‐2基因亚家族成员)水平。LL‐37也增加了P53 上调凋亡调节因子(p53 upregulated modulatorof apoptosis,PUMA)和肿瘤抑制基因 p53 的表达,PUMA 是 p53 的直接靶点,也是结直肠癌细胞凋亡的调节因子。在结肠癌细胞中,LL‐37 显著诱导凋亡诱导因子(apoptosis inducing factor,AIF)和内切酶G(endonuclease G,EndoG),导致胱天蛋白酶(cysteinylaspartate specific proteinase,caspase)非依赖性凋亡。在结肠癌细胞中,一种基于LL‐37的机制激活GPCR‐p53‐Bax/Bak/Bcl‐2信号级联,触发 AIF/endog介导的凋亡[63,64]。当LL‐37附着在磁性纳米颗粒(magneticnanoparticles,MNP)表面时,其抗癌活性有所提高,显示出一定潜力[65]。
在胃癌细胞中,LL‐37 含量显著低于正常胃组织。有研究显示 LL‐37 通过骨形态发生蛋白(bonemorphogenetic protein,BMP)信号通路调节蛋白酶体激活[66]。BMP信号触发Smad(Sma‐ and Mad‐relatedprotein)1/5/8的募集和磷酸化,与Smad4形成异源二聚体,该 Smads 复合物随后上调细胞周期调控基因p21Waf1的表达水平。在该途径中,LL‐37也可诱导低水平的细胞周期蛋白 E2。p21Waf1和细胞周期蛋白E2 表达水平的改变可引起 G0/G1期细胞周期阻滞。所以,LL‐37 通过蛋白酶体依赖的机制激活 BMP 信号通路,抑制胃癌细胞增殖。
口腔鳞癌(oral squamous cell carcinoma,OSCC)属于头颈部常见恶性肿瘤,其组化分析显示,与正常口腔黏膜组织相比,LL‐37 低表达与组织学分化和淋巴结转移有关。这说明 LL‐37 可能在 OSCC 中是一种肿瘤抑制因子。hCAP18在一些口腔癌细胞系中的表达调控涉及到人类 CAMP 启动子区域的DNA 甲基化状态[68]。也有研究表明,hCAP18 在OSCCSAS ‐H1 细胞中诱导胱天蛋白酶非依赖性凋亡 ,但在人牙龈成纤维细胞或 HaCaT 细胞中则无[69]。最近报道表明,一些癌细胞具有富含胆固醇的脂筏,这也可能是控制 LL‐37 对不同癌细胞选择性的关键因素,从而为 LL‐37 抗癌机制提供了一种新的可能性[70,71]。
此外,LL‐37 在血液恶性肿瘤中也发挥一定抑制作用,机制可能与引起细胞凋亡通路有关。这些结果为肿瘤临床治疗提供了方向。
3 LL⁃37应用前景
特应性皮炎(atopic dermatitis,AD)患儿TLR2和LL‐37的低表达及血清LL‐37的低水平提示AD存在先天免疫和皮肤屏障功能缺陷等问题。维生素D可能激活维生素D受体,通过TLR2途径促进LL‐37表达,从而对 AD 起到保护作用[72]。或许未来可设计LL‐37有关药物辅助维生素D对抗特应性皮炎。
新生儿败血症主要由感染引起,随着耐药菌的产生,抗生素选择变得越来越棘手,因此提高自身抵抗力尤为重要。有研究显示维生素D可提高机体抗菌肽 LL‐37 的表达,从而提高机体防御感染的能力,为抗生素治疗提供有力保障。这将为设计抗生素替代品的药物提供思路[73]。
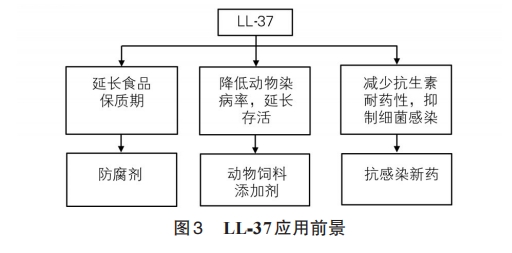
LL‐37 抗菌谱广且抗菌活性高,细菌不易产生耐药性,还能中和内毒素,可以视为抗生素的新型替代品。因此选择合适的表达模板来表达LL‐37的类似物,对于生产具有高效抗菌、高营养的动物饲料添加剂有促进作用,使其拥有一定的经济效益。
4 展望
抗菌肽LL‐37相对分子质量小,结构特殊,生物学功能多样,其广谱抗菌特性受到人们青睐,而不易产生耐药性的性质,使其很有可能成为抗生素替代品。此外,抗菌肽在食品中的无毒性表现,也有可能使其成为新一代食品添加剂。抗菌肽的使用,可更有效地防止动物疫病流行,减少畜牧业损失,这将极大促进我国畜禽养殖业健康发展。使用抗菌肽可增强动物对疾病抵抗力,减少疾病传播和抗生素使用,从而减少药物在动物体内及其产品中的残留,为我国广大消费者提供了更安全的肉类食品。由于抗菌肽具有广谱抗菌性,对G+和G-均有很好抑杀作用,因此可广泛应用于畜禽养殖业。抗菌肽具有广阔应用前景,利用基因工程技术生产重组抗菌肽产品具有很好的临床效果。国内也有部分企业开发出了抗菌肽产品(如天蚕素抗菌肽),在动物生产中得到了较好应用效果。抗菌肽的研究热潮势必带动一些产业的绿色革命,在医药方面,人们在努力开发绿色、高效、低毒抗感染药物。在农牧业方面,抗菌肽作为新型饲料添加剂也已投入生产,而其在食品工业方面也表现出巨大开发潜力。随着研究深入,抗菌肽作为添加剂在饲料中的广泛应用终将变成可能。抗菌肽在未来发展中具有无限潜力,应予以重视,以挖掘其潜在的社会应用价值。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志