肽、蛋白质和核酸等生物分子通常难以通过被动扩散穿过细胞膜。然而,细胞穿透肽(CPPs)、细菌蛋白毒素、某些真核蛋白、病毒以及许多合成药物递送载体能够以不同的效率进入真核细胞,它们通常采用一种或多种机制进入细胞并初步定位于内体中。但是它们如何穿过内体膜进入细胞浆(内体逃逸)却依然没有清晰的研究结果,这也一直是高效药物递送系统开发的主要瓶颈所在。此外,许多细菌和真核蛋白分别通过双精氨酸转运(TAT)和非常规蛋白分泌(UPS)系统在其自然状态下穿过质膜进入周质/胞外空间。同样,这些蛋白质输出系统的运作机制尚不清楚。
2022年1月,美国俄亥俄州立大学裴德华教授在Accounts of Chemical Research上发表文章,介绍了一种之前尚未提出的、基本的跨膜转运机制——囊泡萌出和破裂机制(Vesicle Budding-and-Collapse,VBC),并通过实验验证了相关结论。VBC可能是细菌TAT和真核UPS系统的驱动机制,将来可能为高效的药物递送系统的设计提供原则性指导。
细胞膜是一种高效的生物屏障,能够将细胞内物质包含其中,同时把外来物质阻挡在外。分子量小于500且疏水性达到合理平衡的小分子能以被动扩散的方式穿过细胞膜,而肽、蛋白质和核酸等生物大分子则通常不能。然而,一些生物分子能够自主进入哺乳动物细胞,如细胞穿透肽(CPPs)、非肽类细胞穿透分子(CPMs)、细菌蛋白毒素、某些哺乳动物蛋白、病毒以及合成药物递送系统(图1),它们中的大多数能够通过内吞作用进入细胞,并定位于内体中。为了成功进入胞浆,其中一些实体随后需要转运穿过内体膜进入胞浆,这一过程称为内体逃逸。
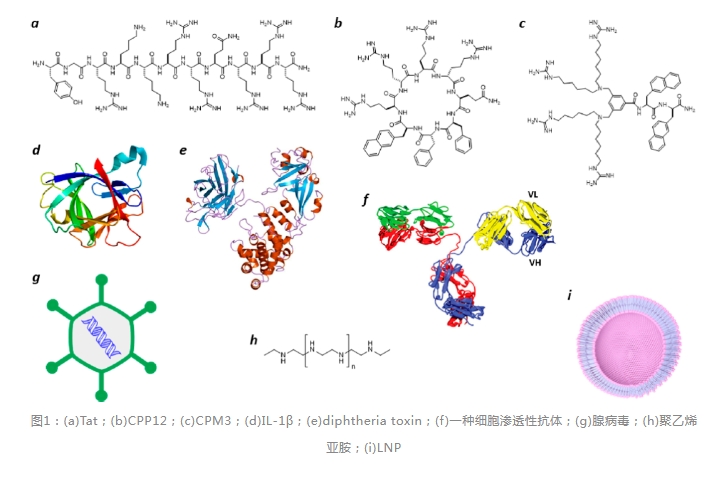
研究表明,其他实体可直接跨越细胞膜或进一步进入内质网,并逆行转运穿过内质网膜进入胞浆。折叠的蛋白质也可以反方向穿过质膜,从胞浆转运到周质/胞外空间,这一过程被称为真核细胞的非常规蛋白分泌系统(UPS)和细菌及细胞器的双精氨酸转运系统(TAT)。所有这些情况下,生物分子/实体必须穿过脂质双层膜。生物分子如何自主转运穿过脂质双层膜在许多领域一直是个谜团,而对转运机制认识的缺乏极大地阻碍细胞渗透性生物制剂作为下一代治疗药物的发展。
最近,Pei等发现CPPs和CPMs能够通过全新的VBC机制实现内体逃逸(图2)。VBC机制是一种全新的机制,上述许多(可能所有)生物分子可通过VBC机制自主地跨脂质双层膜转运。
通过VBC机制实现内体逃逸
目前,科学家已提出多种内体逃逸机制,包括质子海绵效应诱导的渗透裂解、膜融合、形成孔洞、局部膜破裂和VBC。其中VBC是唯一经过实验验证的机制,适用于以上描述的所有情况,而其他假设通常只涉及某种情况,并且难以解释许多实验观察结果。
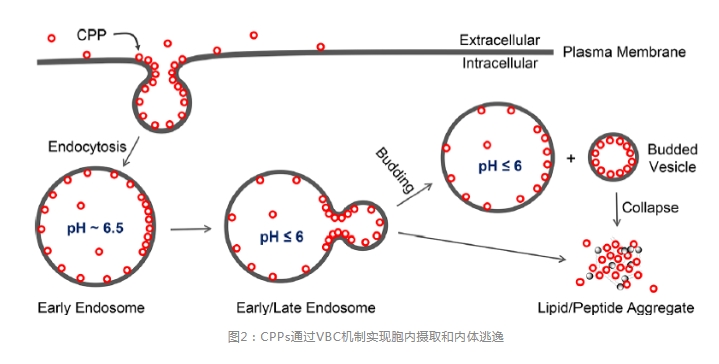
图2是环状CPPs的细胞摄取和内体逃逸机制。环状CPPs直接与质膜磷脂(以及潜在的其他膜成分)结合,通过内吞作用进入细胞形成早期内体,随着早期内体成熟为晚期内体,其内部逐渐酸化,CPPs与内体膜的亲和力增强。因为CPPs的精氨酸侧链在内体酸化过程中(pH6.5-4.5)不会进一步质子化,因此,质子化可能发生在磷脂上(如头部磷酸基团)。精氨酸的胍基能够同时与两个相邻的磷酸形成双齿氢键(图3a)。这种独特的能力加上多个精氨酸残基的存在,CPP能够将磷脂交联到富含CPP的脂质域。磷酸的部分质子化将通过减少静电排斥进一步促进脂质聚集,脂质域的形成在脂质域和其周围膜之间产生线张力,进而驱动脂质域萌出形成囊泡。在囊泡萌出过程中,萌出颈部(过渡态)呈负高斯曲率(如在正交方向上同时具有正和负曲率),并且相对于萌出事件前后的基态具有较高的势能(图3b)。
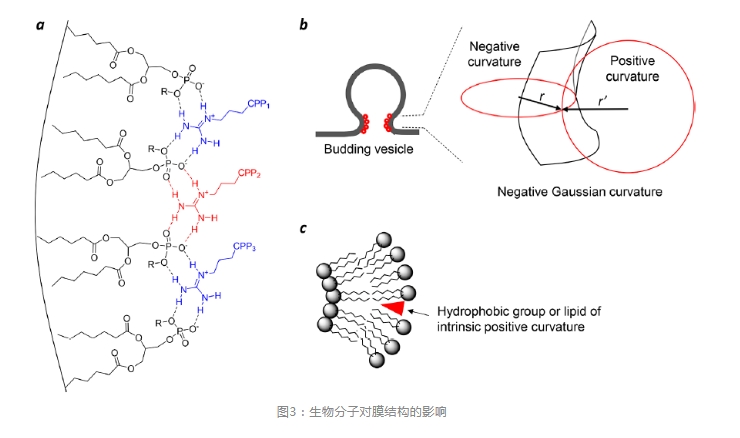
为了促进萌出事件,CPPs应该选择性结合到萌出颈部并降低能垒。具有较高内体逃逸效率的CPPs和CPMs通常呈两亲性且构象受限。刚性构象增加了CPPs/CPMs与内体膜的亲和力,而两亲性则有利于在萌出颈部产生负高斯曲率。在磷脂分子之间插入疏水基团会产生正膜曲率(图3c),而精氨酸残基可以与磷脂的头部磷酸基团通过氢键结合并聚集诱导产生负曲率(图3a)。内体膜萌出过程或萌出后,小囊泡自发地迅速解体成肽/脂质聚合体,并逐渐溶解到细胞液中。尽管小囊泡(直径约为100nm)可能由于高的膜曲率和/或高浓度的CPPs的存在而本质上不稳定,但囊泡破裂的驱动力尚不清楚。VBC机制的独特之处在于,生物分子在拓扑学意义上跨越膜,而非物理上穿过膜,并且每次内体逃逸事件之前、期间和之后,内体都保持完整。相反,所有其他膜转运机制都涉及实体物理上穿过细胞膜,因此需要部分或全部破坏细胞膜。对于不同的生物分子,进入细胞的具体细节可能有所不同。
VBC机制中,内体逃逸需要内体中具有一个最小数量的生物分子,且内体逃逸效率具有浓度依赖性。最近研究发现,一种名为Tat的线性CPP在浓度为0.2、10、20μM浓度时的的内体逃逸效率分别为0.08%、0.38%、0.66%。这一发现解释了为什么CPPs的胞内摄取效率对CPP浓度高度敏感,且随着CPP浓度的增加而呈非线性增加,因为,胞内摄取也具有CPP浓度依赖性。Pei认为诱导一次VBC的最小生物分子数量为每个内体80-360个分子,相应的内体内浓度是2-9μM(假设内体平均直径为0.5μM),但是这个数字可能会因为生物分子的性质而略微有所不同。
细胞穿透肽(CPPs)
通常认为,低浓度时,CPPs主要通过一种或多种能量依赖性的内吞作用进入细胞,随后发生内体逃逸,而高浓度时,一些CPPs也能以非能量依赖性的方式直接转运通过细胞膜。VBC的早期线索来自作者对环状CPP12和模拟内体膜成分的大单层囊泡(GUVs)的体外研究,染料标记的CPP12能结合到GUVs的外侧且最初均匀分布在GUV膜上。随着时间推移,CPP12分子聚集成强烈的荧光区域,大概是脂质域,随后这些区域以小泡的形式萌出(或者少部分进入GUV腔内)(图4a)。在萌出之前,CPP12集中在萌出颈部(图4b),然后,萌出的小泡瓦解成形状不规则、荧光强烈的聚集体,这一过程要么与萌出过程同时发生,要么在萌出完成后不久发生。
为了观察活细胞中的VBC事件,作者用一种pH敏感的染料(pHAb)标记CPP12,这种染料在内体/溶酶体的酸性环境中发出荧光,而在中性胞浆或细胞外空间中不发出荧光。用CPP12pHAb(红色)和膜标记物(TopFluor标记的磷脂酰丝氨酸(PSTopFluor))处理HeLa细胞,并用活细胞共聚焦显微镜实时成像。内体逃逸始于内体膜上的一个小囊泡的萌发;这个阶段,萌出的囊泡和剩余的内体均发出红色(CPP12pHAb)和绿色荧光(PSTopFluor)(图4c)。红色荧光(CPP12pHAb)的突然消失和绿色荧光(PSTopFluor)的保留证明了随后小囊泡的瓦解(残体暴露于胞浆pH),而完整的内体保留了红色和绿色荧光。每次内体逃逸事件发生非常迅速,通常持续时间<60秒。
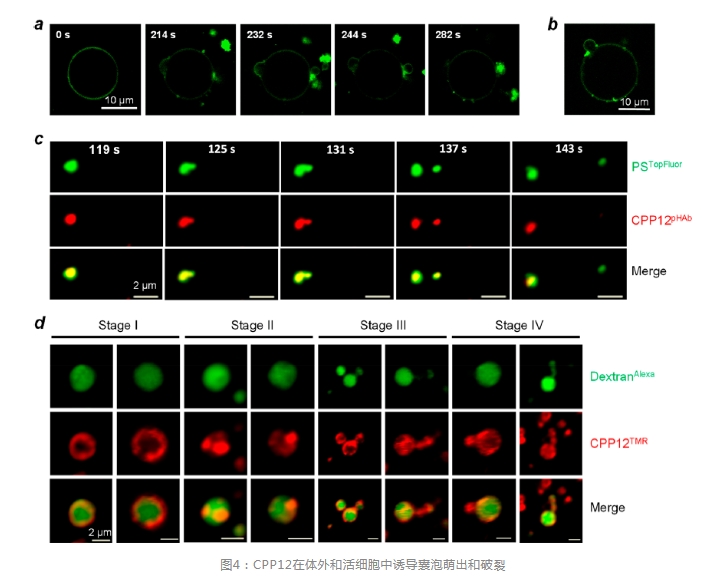
接下来,作者用激酶抑制剂YM201636预处理HeLa细胞,以扩大内体(平均直径从0.5μm增加到∼2μm),然后添加四甲基罗丹明(TMR)标记的CPP12(CPP12TMR)和内体标记物(AlexaFluor488标记的葡聚糖(DextranAlexa)),以通过延时活细胞共聚焦显微镜观察内体在经历VBC过程中的结构变化(图4d)。明显,活细胞中捕获的VBC中间体与早期GUV研究中观察到的非常相似(图4a,b)。此外,同步辐射小角X射线散射研究表明,环状CPP在人工膜上产生负高斯曲率是非常高效的。为了评估VBC机制的普遍性,作者监测了Tat(典型的线性CPP,具有低内体逃逸效率,≤0.66%)和CPM3(几乎能定量内体逃逸)在HeLa细胞中的逃逸情况。CPM3从内体中诱导出强烈的VBC事件,并产生类似于CPP12的VBC中间体,而Tat介导的VBC事件发生的频率要低得多(也很难观察到)。这些结果表明,内体逃逸效率主要取决于生物分子在内体膜诱导VBC的效率(频率)。
一项CPP文献调研表明,其他CPPs也能在内体和/或细胞膜上诱导VBC。例如,在YM201636处理的Saos-2细胞中,一种细胞渗透性的微型蛋白ZF5.3使内体(和溶酶体)形成与CPP12和CPM3诱导的VBC中间体非常相似的膜结构。渗透素、九聚精氨酸(R9)等线性富含精氨酸的CPPs和RW9能够通过诱导膜内陷和形成无定形的肽/脂聚集体而自主进入人工囊泡(如GUV和质膜球(PMSs))。同步辐射小角度X射线散射研究证实了线性CPPs也能在人工膜上产生负高斯曲率。
先前令人困惑的结果现在可以合理化,并为VBC机制提供额外的支持:(1)CPPs能够运送不同大小(从小分子到大蛋白质)和理化性质的货物,这些货物与CPP通过共价连接或非共价结合;(2)CPPs促进无关联大分子货物(如环糊精和抗体)的内体释放;(3)融合性脂质和多肽促进CPPs的内体释放;(4)提高了环状和其他构象受限的CPPs和CPM的胞内摄取效率。然而,是否所有的CPPs/CPMs都通过VBC机制离开内体或跨膜转运仍有待确定。
细菌毒素
细菌蛋白毒素的结构和其进入细胞的机制均具有多样性。一些毒素可直接通过质膜转运到细胞质中;另一些毒素则与细胞表面受体结合,通过内吞作用和内体逃逸进入细胞质中;还有一些毒素被转运到内质网,然后逆行转运到细胞质中。然而,不管采用哪种方式进入细胞,毒素在到达胞浆之前必须在拓扑学意义上穿过脂质双层膜。白喉毒素(DT)等AB类细菌毒素通常由两个功能单元组成:一个酶部分(A,是实际的毒素)和一个非酶部分(B,是递送载体),非酶部分能介导受体结合(R-结构域)和膜转运(T-结构域)。细胞摄取始于R结构域识别宿主细胞的表面受体,导致受体−毒素复合物的内吞;内体的酸化使毒素从受体上解离,并诱导T结构域的构象改变,然后T结构域插入内体膜形成离子传导孔/通道。通常认为,A部分展开并穿过T结构域形成的狭窄通道到达细胞质。然而,多年来,孔/通道假说受到了许多实验观察结果的挑战。例如,DT可以将超稳定的货物蛋白以及非共价结合的核酸运送到胞质中,表明DT能够转运折叠状态的货物。研究发现,A部分突变可以消除DT的离子通道活性,但对A部分的转运几乎没有影响,而其他突变可以阻止转运,但不会影响通道活性。DT的内体逃逸呈现“量子”动力学,即每个内体逃逸事件同时向胞浆中释放∼80个DT分子,且与细胞外DT的浓度无关,而通过孔道的DT释放是连续的(即一次释放一个DT分子)。
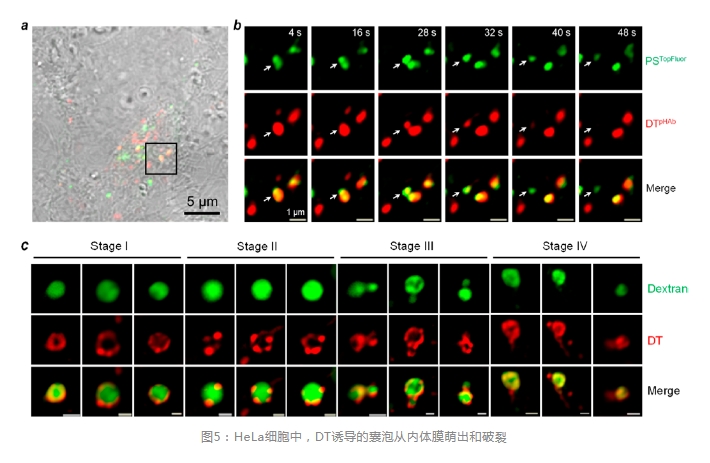
最近,Pei等发现DT通过VBC机制逃离内体。作者用pHAb或四甲基罗丹明(TMR)标记DT,并通过活细胞共聚焦显微镜监测DT的胞内转运。DT在HeLa细胞中诱导强烈的VBC并产生与CPPs/CPMs相同的内体膜结构(图5a,b,c)。例如,DTTMR定位于内体膜上,最初均匀分布于膜上,随后聚集成富含DT的脂质域,这些脂质域随后以小泡的形式萌出并瓦解(图5c)。有趣的是,一种由肠出血性和致病性大肠杆菌产生的金属蛋白酶NleC也通过VBC逃离内体。与AB类细菌毒素不同,NleC由包含330个残基的单一催化结构域组成,以其天然结构进入宿主细胞。NleC的其结构含有两个多碱基序列,这可能是其进入细胞的原因。然而,分离的每个多碱基序列都不能作为CPP发挥作用,这与细胞摄取需要完整的3D结构是一致的。这些结果表明,蛋白质跨内膜转运既不需要酸诱导的构象变化,也不需要膜插入。因此,存在一个问题:T结构域的膜插入和离子传导通道在内体逃逸过程中发挥什么作用?作者认为,T结构域的膜插入增加了毒素对内体膜的结合亲和力,确保内体中80-360个毒素分子中的大多数与内体膜结合,以促进VBC。这一特征对于在极低浓度下(如pM)发挥其病理生理作用的毒素可能是至关重要的。离子传导通道可能是T结构域插入的一个分支,且可能没有任何生物学功能。
当细胞外毒素浓度在pM范围时,80-360个毒素分子是如何聚集在单个内体中达到2-9μM浓度的呢?受体介导的内吞作用使毒素从细胞外环境进入内体达到有意义的浓度,进一步的浓缩可能通过内体融合来完成。一个典型的哺乳动物细胞有数百个内体,这些内体通过不断的囊泡融合和裂变相互连接。虽然单个内体最初可能不包含诱导VBC的最小数量分子,但内体的横向融合,加上毒素聚集到脂质域,会逐渐将毒素分子聚集成更少、更大的内体,最终达到VBC的“量子”级。这一情况可能解释了之前观察到的内体酸化和DT释放到细胞质之间浓度依赖性的时间延迟(即在较低的DT浓度下有较长的延迟)。这也可能解释为什么在没有任何细胞蛋白的情况下(尽管在相对高浓度的5−20μM),CPPs本身就能诱导GUVs产生强烈的VBC,但在囊泡交联和融合中发挥作用的HOPS复合体对于CPPs在体内的内体逃逸是至关重要的。
其他膜穿透蛋白
除了细菌毒素外,许多其他的细菌和真核蛋白可以向质膜或内体膜的任意方向转运。例如,α-synuclein的细胞间传递与帕金森病的进展有关,而PTEN-long磷酸酶的细胞间转运可以调节受体细胞中的PI3K信号。Pei等最近发现,将一个短的CPP序列(如RRRRWWW)接到哺乳动物蛋白质(如蛋白质酪氨酸磷酸酶1B和嘌呤核苷磷酸化酶)的表面环中使后者具有细胞渗透性。在相反的方向上,许多细菌和哺乳动物的蛋白质在其天然状态下通过非规范的分泌机制从胞浆运输到周质或胞外空间。
在原核生物、叶绿体和一些线粒体中发现的TAT系统允许折叠的蛋白质跨膜转运。TAT系统运输的蛋白质通常含有复杂的辅因子(如离子-硫簇)或者是多蛋白复合物的组成部分,可能是一种避免需要在胞质外重新组装复杂结构的方式,并且这种转运没有明显的离子泄漏。真核细胞的UPS系统通过质膜输出大量的无领导蛋白,如白细胞介素1β(IL-1β)家族的细胞因子。细菌似乎也有类似的UPS系统。TAT和UPS系统(通过标准的Sec途径)的一个优点是,蛋白质可以以一种受调控的方式快速跨膜运输,这对参与炎症反应的细胞因子至关重要。这些蛋白质是如何穿过细胞膜的问题一直是一个谜团。
上述蛋白质通过VBC转运穿过细胞膜有两个原因。首先,除了VBC外,对于任何机制来说,将不同大小和理化性质的折叠蛋白转运通过细胞膜而不引起大量离子泄漏是无法想象的;其次,上述大多数蛋白质都含有能够诱导VBC的多碱基和疏水基序。细胞渗透性抗体(如TMab4)在其VL结构域的 CDR3 环中含有疏水基序WYW(或类似序列),已被确定为“内体逃逸基序”。对其序列检测结果表明,抗体在VL结构域的CDR1和CDR2环中也含有多碱基序列。IL-1β的成熟和分泌需要caspase-1的加工,而caspase-1又受炎症小体的调节。Pro-IL-1β的等电点为4.6,Caspase-1去除高酸性N-末端117位残基后,成熟IL-1β的等电点增加为8.8。此外,蛋白水解加工暴露了一个C-末端多碱基序列,这被证明是IL-1β分泌所必需的。
细菌TAT机制由三种蛋白质组成:TatA、TatB和TatC。最关键的成分TatA是一种小分子膜蛋白,由疏水性α-螺旋和两亲性(多碱基)α-螺旋组成。疏水螺旋可插入质膜,两亲性螺旋平行于质膜内叶,与质膜相互作用。TatBC通过底物中高度保守的双精氨酸基序(SRRxFLK)识别底物蛋白,其转运需要TatA的寡聚作用。TatA通过促进VBC介导底物蛋白的转运,可能是在TatBC和底物的双精氨酸基序的帮助下进行的,现有文献与这一假设是一致的。例如,TatA插入脂质双分子层会导致大的单层囊泡中的钙黄绿素(一种荧光染料)“量化”、局部和暂时的泄漏。每次增加蛋白质后,荧光都会达到一个新的平台,直到增加更多的蛋白质后才会进一步增强。在没有底物的情况下,TatABC均匀分布在质膜上;当底物结合时,TatABC聚集成单个区域,与在CPP12(图4)和DT诱导(图5c)的VBC中观察到的类似。
病毒
对病毒进入细胞的研究同样有助于对生物分子胞内转运机制的新见解。有包膜的病毒通过其膜与内体膜融合而逃离内体,但对无包膜病毒逃离内体的机制了解甚少。一般认为,非包膜病毒必须破坏内体膜才能进入细胞质。目前已经发现了三类主要的“膜溶解”病毒因子:两性α螺旋结构域(如腺病毒蛋白VI)、肉豆蔻酰化蛋白(如呼肠病毒N-肉豆蔻酰化衣壳蛋白μ1)和膜重构酶结构域(如细小病毒VP1的磷脂酶A2结构域)。目前还不清楚这些结构不同的病毒因子是如何完成同样的任务的:将直径可能为∼100 nm且基本完整的病毒粒子从内体释放到胞浆中。作者认为这三种病毒因子都通过诱导VBC促进病毒的内体逃逸。
对腺病毒来说,衣壳蛋白VI是病毒内体逃逸的主要原因。Wiethoff等进一步确定,蛋白VI的N端有一个20个氨基酸的两亲性α-螺旋,它在腺病毒物种中高度保守,是导致内体逃逸的原因。这个肽以高亲和力(表观KD≈3μM)结合到GUVs的内体膜成分上,诱导囊泡弯曲,并使GUV碎裂成更小的囊泡、管状结构和肽/脂质聚集体,这些特征与CPP12类似。腺病毒进入内体后,会释放多达360份拷贝的蛋白VI,这些蛋白与内体膜结合,并诱导装载病毒的囊泡萌出和瓦解。N-肉豆蔻酰化衣壳蛋白μ1负责呼肠孤病毒的内体逃逸。该蛋白的N端41个氨基酸片段μ1N足以引起40 kDa的右旋糖酐从红细胞中释放出来。首先,通过插入到内体膜,肉豆蔻酰基将病毒蛋白靶向到内体膜上,并增加其与膜的结合亲和力。其次,短的酰基(肉豆蔻酰基有一个14碳链)插入腔内膜产生正膜曲率(图3c),这是萌出颈部所需要的。μ1N的余下部分与内体膜的相互作用可能引起膜的负曲率。
病毒PLA2是如何诱发VBC的呢?早期内体的腔内膜含有丰富的磷脂酰胆碱(PC),其成分与质膜外叶相似。PC的固有脂质曲率为∼0,有利于层状膜的形成。PC被PLA2水解产生溶血磷脂酰胆碱(LPC)和脂肪酸。LPC有一个大的极性头基和一个单一的碳氢链,当它插入到脂质双层中时,它促进了膜正曲率(图3c)。另一方面,脂肪酸会产生负曲率。因此,PLA2作用产生的脂质分子,支持内体膜上同时形成正弯曲和负弯曲,这是萌出颈部所需要的。病毒PLA2s在底物特异性上是混杂的,也能水解内体膜上发现的其他磷脂。膜重塑酶的使用似乎是病毒细胞摄取和生命周期的一种常见策略,因为腺病毒利用宿主酸性鞘磷脂酶来实现快速的胞浆进入。一些细菌蛋白毒素还利用磷脂酶A的活性来重塑宿主细胞的质膜,以实现细胞进入。
合成药物递送系统
开发的许多人工系统能够将生物分子递送到哺乳动物细胞中作为研究工具和治疗方法。本文仅讨论用于核酸递送的多聚体、脂复合物和脂质纳米粒(LNP)。虽然其中一些递送载体在临床上取得了巨大成功,如用LNP递送SARSCoV-2的mRNA疫苗,但对它们运作机理的理解明显滞后,这阻碍了具有高内体逃逸效率的递送工具的设计和开发,而这对于是治疗应用至关重要。
最近,研究人员利用先进的活细胞共聚焦显微镜技术研究了多聚体、脂质体和LNP的内体逃逸。ur Rehman等发现,在脂质复合体和多聚体介导的siRNA递送过程中,核酸和载体都是突然从内体释放出来,随后核酸在细胞质和细胞核中迅速扩散(图6)。对于多聚体而言,从内体观察到核酸和载体的瞬时和完整的排出。这些观察结果被认为是质子海绵效应的直接证据。Wittrup等后来的一项研究证实了ur Rehman等的许多发现。然而,Wittrup等发现游离的siRNA,而不是完整的脂复合物或LNP被释放到胞浆中,并且内体逃逸是不完整的,这表明内体并没有完全破裂。他们进一步观察到,在许多情况下,siRNA的释放与微小的胞质Ca2+瞬变幅度一致。

Pei对ur Rehman和Wittrup的结果(以及其他文献数据)进行分析,得出了另一种解释和结论,即合成递送系统通过诱导VBC逃离内体。ur Rehman等人的研究表明,对于每一个破裂的囊泡,附近通常会有另一个囊泡在整个实验过程中保持完整。事实上,图6a中的两个相邻的囊泡(第3个图片中的箭头标记)最初来自单个内体(图6a)。另一种解释中,在实验过程中保持完好的囊泡是萌出事件后的实际内体,而破裂的“内体”是萌出囊泡,随后瓦解。Wittrup等观察到的多步骤、部分siRNA释放可能是来自同一内体和/或不同内体的多个VBC事件。细胞内的Ca2+瞬变是可以预期的,因为每次VBC事件都会导致小的内体体积(包括Ca2+离子和任何不相关的货物)释放到细胞质中。
总结
作者通过实验证明了线性CPP(Tat)、环状CPP(CPP12)、非肽类CPM(CPM3)、AB类细菌蛋白毒素(DT)、单结构域蛋白毒素(NleC)等5种结构不同的生物分子可通过诱导VBC从内体中逃逸到胞浆内,相关文献证据表明,多聚体、脂复合物和LNP也是通过相同的机制逃离内体。
此外,其他细菌和真核蛋白以及无包膜病毒也可以通过VBC机制在细胞膜上的两个方向转运。重要的是,VBC机制可以使许多以前困惑且矛盾的观察结果得以调和而合理化。总之,VBC机制是一种全新且可能普遍存在的膜转运机制,其功能与已知的被动扩散和能量依赖的分泌途径是平行的。然而,VBC机制是否广泛适用于不同的生物分子/系统还需要进一步研究,并将确证的机制研究结果应用于设计更有效的药物输送系统。
参考文献:
DehuaPei.HowDo Biomolecules Cross the Cell Membrane? Acc. Chem. Res. 2022,55, 309-318.