
摘要 :有些天然蛋白质可通过错误折叠形成淀粉样纤维,并进一步沉积导致淀粉样病变,被认为是许多重大人类疾病的病理基础,因此,阐明天然蛋白质错误折叠、聚集形成淀粉样纤维的分子机制,是预防、诊断和治疗相关疾病的关键。研究者们从天然蛋白质中鉴定出许多能够形成淀粉样纤维的关键短肽片段,即淀粉样短肽,对它们形成淀粉样纤维的能力及其在完整蛋白质聚集过程中的决定性作用进行深入研究, 本文对近年来人类疾病相关淀粉样短肽的研究展开综述。首先,介绍鉴定淀粉样短肽的标准及其相应的研究方法和技术手段,并回顾近年来与一些重大人类疾病相关的淀粉样短肽,尤其是与神经退行性疾病相关淀粉样短肽的进展情况,对淀粉样短肽中出现频率较高的氨基酸残基及其可能的自组装原理进行总结分析。最后,展望这些淀粉样短肽作为靶点在相关疾病诊断和治疗方面的意义,并初步探讨它们作为新型生物材料在生物医学工程领域的应用前景,本文一方面为阐明天然蛋白质形成淀粉样沉淀的分子机制提供参考,另一方面也为相关疾病的治疗提供思路,同时也为新型生物材料的开发提出潜在的可能性。
淀粉样纤维是一类特殊的由天然蛋白质聚集形成的纳米纤维结构,最早进入人们的视野是由于它们与人类疾病的发生有着密切联系,现已证实,人体中的某些蛋白质能够在一定条件下发生构象变化,通过异常的聚集形成淀粉样纤维,并进一步在组织中沉积形成不溶性的淀粉样斑块,最终导致淀粉样病变的发生, 这一病变过程不但使蛋白质丧失原有的正常功能,也造成所在组织周围的细胞死亡,被认为是诱发许多人类疾病的关键因素。目前已知,至少有20多种人类疾病的发生与淀粉样纤维的形成密切相关,其中包括阿兹海默症[1]、帕金森症[2]、肌萎缩侧索硬化[3] 等神经退行性疾病,以及糖尿病和动脉粥样硬化等常见的老年疾病[4],这些疾病发生的具体机制目前仍不清楚,并且一旦发生很难逆转,给现代老龄化社会造成沉重的负担,因此,研究蛋白质形成淀粉样纤维的分子机制,从而进一步阐明相关疾病发生的机制,对于淀粉样病变相关疾病的预防、诊断和治疗有着十分重要的意义。
除了与疾病相关的淀粉样纤维,近年陆续发现一些与人类疾病发生无关的蛋白质也能在一定条件下形成淀粉样纤维[5,6],甚至自然界中还存在一些功能性的淀粉样纤维,例如细菌的菌毛和黑色素体中的PMEL17蛋白[7],这些情况表明,蛋白质形成淀粉样纤维是自然界一个普遍存在的现象,研究蛋白质在天然状态下形成淀粉样纤维的分子机制,也是阐明其结构和功能关系的重要环节,同时也能为我们开发新型纳米纤维材料带来启发。
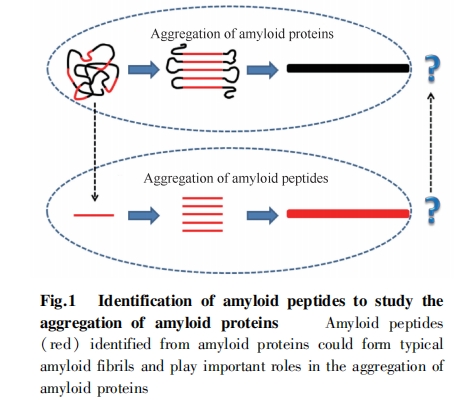
近年来,在许多与人类疾病相关的形成淀粉样纤维的蛋白质中,都鉴定出这样的短肽片段。这些来自不同蛋白质的短肽片段在序列特征上体现出一定的相似性,也为进一步阐明完整蛋白质形成淀粉样纤维的机制提供了思路。本文将主要针对从各种人类疾病相关淀粉样蛋白中发现的短肽展开综述,以期为最终阐明淀粉样纤维形成的分子机制,并指导相关疾病的预防、诊断和治疗提供有用的线索。
1 淀粉样短肽的鉴定
在淀粉样病变中,宏观上表现为淀粉样斑块的病理性沉积,在微观上是由蛋白质异常聚集形成的纳米级淀粉样纤维缠结而成。目前,淀粉样纤维的检测主要用以下典型特征为指标:外形为直径约10nm,光滑不分叉的纳米纤维,组成淀粉样纤维的蛋白质或短肽呈典型的β折叠二级结构,经刚果红染色时,淀粉样纤维在偏光显微镜下呈现出黄绿色的双折射光,淀粉样纤维与硫磺素T结合时,会在495nm附近出现特征性的荧光峰。目前,上述特征已成为鉴定淀粉样纤维的金标准[9],而从天然蛋白质的序列中鉴定淀粉样短肽的首要标准,就是这些短肽要能够自组装形成具有上述特征的淀粉样纤维。
此外,研究淀粉样短肽的聚集行为,最终的目的是研究其完整蛋白质异常聚集导致疾病的机制, 因此,一个有研究价值的淀粉样短肽,不仅自身能够聚集形成淀粉样纤维,还能对其所在蛋白质的聚集行为发挥重要的作用, 例如,淀粉样短肽片段的缺失或突变,能够在一定程度上破坏该蛋白质的聚集行为。
文献中通常把具有上述两个特点,来自天然蛋白质的、长度为几个到十几个氨基酸残基的短肽片段称为淀粉样短肽,这些短肽目前已成为淀粉样病变相关疾病领域的研究热点。此外,也有一些人为设计的短肽片段,其能够自组装形成具有典型淀粉样纤维特征的纳米纤维,有时也被称为淀粉样短肽。
2 研究淀粉样短肽的方法
除了上述成熟的技术手段,淀粉样短肽的研究同时也得益于日渐成熟的多肽固相合成技术,研究完整蛋白质形成淀粉样纤维的机制,通常需要构建相应蛋白质的表达载体,在原核或真核系统中进行表达纯化,不仅费时费力,而且很难获得高纯度的蛋白质进行研究,而常见的淀粉样短肽序列,长度多在几个至十几个氨基酸残基之间,因此非常容易利用多肽固相合成技术,获得高纯度的短肽进行研究。此外,计算机辅助的分析技术,例如分子动力学模拟,也在近年来被广泛用于对淀粉样短肽的聚集行为进行模拟分析[10].在这些成熟而先进的技术的支持下,淀粉样短肽的研究一直是近年来国际上的研究热点。
3 各种疾病中的淀粉样短肽
3.1 神经退行性疾病中的淀粉样短肽
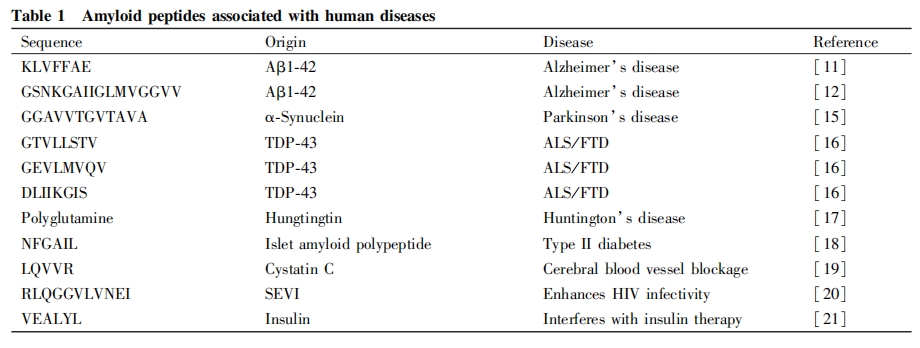
在各种疾病相关淀粉样纤维的研究中,与神经退行性疾病相关的淀粉样纤维是当前研究的重点。而在目前已报道的淀粉样短肽中,研究得最多的是与阿兹海默症相关的淀粉样短肽Aβ16-22。阿兹海默症是目前最流行的神经退行性疾病,其发病机制与患者脑部淀粉样多肽Aβ1-42异常聚集,并形成淀粉样斑块密切相关,在围绕淀粉样多肽Aβ1-42聚集形成淀粉样纤维的分子机制进行的大量研究中,发现该多肽中由第16位至22位氨基酸残基组成的一个7肽片段KLVFFAE (即Aβ16-22)能够自组装形成以β折叠为基础的淀粉样纤维,在Aβ1-42的异常聚集过程中发挥着关键作用[11]。最近的研究报道表明,Aβ1-42中由第25位至40位氨基酸残基组成的片段Aβ25-40,也具有形成淀粉样纤维的能力,可能对Aβ1-42的聚集也发挥了重要作用[12],最近有研究发现,相比于形成淀粉样纤维,Aβ 形成的寡聚体反而是细胞毒性更强的聚集状态,而形成淀粉样纤维有可能是降低淀粉样聚集物细胞毒性的一种自我保护机制[13],因此,将来对于 Aβ 中这两个关键片段的研究,也应该更多关注它们在寡聚体形成过程中的作用。
帕金森症是继阿兹海默症之后的第二大神经退行性疾病,其病理特征表现为患者脑部大量Lewy小体的形成和产多巴胺能神经元的死亡。现已证实,Lewy小体的主要成份是由140个氨基酸残基组成的α-突触核蛋白通过异常聚集形成的淀粉样纤维,该蛋白质中由第61-95位氨基酸组成的非β淀粉样肽(NAC) 区域含有大量疏水性氨基酸残基,被认为是形成β折叠和淀粉样纤维的主要区域[14],另有研究表明,α-突触核蛋白中第67至78位氨基酸残基组成的片段,对淀粉样纤维的形成及其对神经细胞的毒性发挥关键作用[15]。
肌萎缩侧索硬化 (ALS)是一种破坏患者神经细胞,并导致肌肉逐渐无力和萎缩的神经系统疾病,通常与额颞叶型失智症(FTD)合并发作,因此两者很可能具有统一的发病机制。研究发现,反式激活反应DNA结合蛋白 (TDP-43)可形成泛素化的包涵体在细胞内沉积,引起肌萎缩侧索硬化和额颞叶型失智症的发生,因此TDP-43发生异常聚集的分子机制也是研究者们关注的重点, 最近,Kumar等[16] 从TDP-43序列里鉴定出3个能够在体外自发聚集形成淀粉样纤维的片段:GTVLLSTV、GEVLMVQV和DLIIKGIS,这些片段很可能主导了全长TDP-43蛋白在体内的聚集行为。
亨廷顿舞蹈病是一种罕见的神经退行性疾病,以影响运动功能为主,同时也会渐进性地导致认知和精神方面的障碍,亨廷顿舞蹈病的发生被认为是由3144个氨基酸残基组成的蛋白质Hungtingtin的突变和聚集导致的,位于该蛋白质N末端的重复谷氨酰胺序列(polyglutamine)是蛋白质发生异常聚集的关键序列,研究表明,该序列中谷氨酰胺的数目越多,Hungtingtin越容易发生聚集[17]。
在上述这些神经退行性疾病中,淀粉样沉淀从蓄积到致病是一个长期和缓慢的过程,早期极难发现,而一旦发病之后又难以逆转,因此,研究这些疾病的发生机制是当前生物医学非常热门的研究领域,而这些疾病中相应淀粉样短肽的研究,也因其在揭示淀粉样沉淀形成的分子机制方面的重要意义,受到广泛的重视。
3.2 其他疾病相关淀粉样短肽
胰岛淀粉样多肽是含有37个氨基酸残基的多肽激素,具有调节糖代谢等多种生物学作用,已有研究表明,胰岛淀粉样多肽在胰岛中的异常沉积与II型糖尿病的发生密切相关,对其序列的深入研究发现,胰岛淀粉样多肽中的一个NFGAIL片段,能够在体外自组装形成典型的淀粉样纤维,在该多肽发生淀粉样聚集的过程中发挥决定性作用[18]
人胱抑素( cystatin)C是由120个氨基酸残基组成的小分子蛋白质,属于胱抑素家族,广泛存在于人体各个部位的细胞和体液中,胱抑素C通过抑制半胱氨酸蛋白酶活性,在许多正常生理活动中发挥调控作用,在病理条件下,胱抑素C在脑部动脉血管中形成淀粉样沉积,堵塞血管,严重时甚至诱发危及生命的脑溢血,研究表明,胱抑素C中序列为LQVVR的五肽片段能够形成淀粉样纤维,在该蛋白质的异常聚集过程中发挥重要作用[19]
此外,精液来源的病毒感染增强子 (SEVI)能够通过淀粉样纤维的形成增加HIV病毒的感染力[20],胰岛素在储存过程中发生淀粉样聚集会影响其药效[21]。在这些蛋白质中,同样发现能够形成淀粉样纤维的短肽片段,这些短肽为进一步理解蛋白质发生异常聚集的分子机制提供重要的线索,Table1概括了上述淀粉样短肽的来源及其氨基酸序列。
4 淀粉样短肽中的常见氨基酸
上述从不同蛋白质中鉴定出来的淀粉样短肽,虽然在具体的序列上仍然各不相同,但是通过分析它们含有的氨基酸残基及其性质,不难发现其中有一些出现频率较高的氨基酸残基,这些氨基酸残基所具有的特殊性质,有望成为解释不同的短肽如何形成具有相似特征的淀粉样纤维的关键线索。
4.1 疏水性氨基酸
疏水作用作为蛋白质和多肽自发聚集的原始驱动力之一,在淀粉样纤维的形成过程中发挥重要作用。蛋白质序列中的疏水区是其发生淀粉样聚集的主要区域,这已是共识[22],Table的内容显示,目前已报道的从各种天然淀粉样蛋白质中鉴定出来的关键短肽片段,几乎都是以丙氨酸 (A)、 缬氨酸(V)、亮氨酸(L)、异亮氨酸(I)、苯丙氨酸(F)、甲硫氨酸(M)等疏水性氨基酸为主,另一方面,在我们以往研究中,人工设计的一些能够自组装形成淀粉样纤维的纳米短肽材料,也是由大量连续的疏水性氨基酸残基所组成[23,24],由此认为,疏水性氨基酸,尤其是连续的疏水性氨基酸片段,是淀粉样短肽的一个重要特征,是否含有足够的疏水性氨基酸,是预测一个短肽序列能否形成淀粉样纤维的重要指标,同时也是阐明天然蛋白质异常聚集分子机制的重要线索。
4.2 甘氨酸(G)
甘氨酸虽然通常被归类为亲水性的氨基酸,但是由于其侧链为不可解离的-H,其性质其实是介于亲水和疏水之间的,此外,甘氨酸也是侧链最小和最具柔韧性的氨基酸,在短肽和蛋白质发生构象变化导致聚集的过程中,能够提供柔韧性连接而促进聚集的发生,在自然界中,形成高强度纤维的蛛丝蛋白,在其核心区域就含有大量重复的甘氨酸序列[25],在设计功能化的自组装短肽纳米纤维材料时,甘氨酸也常被用作自组装片段和功能片段之间的连接元件[26],而分析目前已研究的淀粉样短肽,不难发现甘氨酸也大量出现在这些短肽序列中(Table1),表明甘氨酸在短肽自组装形成淀粉样纤维的过程中发挥重要作用。
4.3 苯环结构
在常见的疏水性氨基酸中,苯丙氨酸在短肽的淀粉样聚集中发挥着尤其重要的作用,这是因为除了本身是疏水性极强的氨基酸之外,苯丙氨酸侧链中的苯环结构还能提供 π-π 堆积作用,为短肽的聚集提供额外的驱动力,有研究表明,将KLVFFAE中的苯丙氨酸替换为同样是疏水性氨基酸的丙氨酸后,其聚集形成淀粉样纤维的能力减弱[27],此外,酪氨酸虽然不是典型的疏水性氨基酸,在淀粉样纤维的形成中也发挥重要的作用,例如有研究表明,α-突触核蛋白第39位的酪氨酸,可因为其侧链中苯环结构的存在,为短肽的聚集提供π-π堆积作用[28]。
4.4 谷氨酰胺(Q)
诱导短肽发生淀粉样聚集的另一个重要的氨基酸是谷氨酰胺,虽然谷氨酰胺通常被认为是亲水性氨基酸,但是目前发现的许多蛋白质或短肽的淀粉样聚集行为,都与谷氨酰胺密切相关,在引起亨廷顿舞蹈病的Huntingtin蛋白中,其N端多聚谷氨酰胺重复序列被认为是聚集发生的重要元件[17],在来自酵母Sup35蛋白的GNNQQNY淀粉样短肽中,也有2个谷氨酰胺参与短肽自组装的发生[29]。 在 α-突触核蛋白中,当第50位的组氨酸突变为谷氨酰胺时,该蛋白质发生聚集的能力明显提高[30-31]。这些研究结果提示,谷氨酰胺在淀粉样聚集的过程中发挥着重要作用,这与谷氨酰胺侧链末端的酰胺基之间可形成氢键,诱导自组装的发生有关[32].我们最近的研究发现,虽然谷氨酰胺是亲水性氨基酸,其侧链上的二亚甲基是具有一定疏水性的基团, 这种局部的疏水性,同样在诱导短肽的淀粉样聚集中发挥着不容忽视的作用[33]。
5 研究淀粉样短肽的意义和应用
5.1 相关疾病的预防和治疗
针对来自天然蛋白质的淀粉样短肽展开研究,阐明它们形成淀粉样纤维的分子机制,有助于分析其所在的完整蛋白质形成淀粉样纤维的原理,从而最终阐明相关疾病的发病机制,为这些疾病的预防、诊断和治疗提供理论基础,另一方面,在证实淀粉样短肽对于完整蛋白质形成淀粉样纤维的重要性之后,也可针对这些短肽开展进一步的研究,在相关疾病的预测和治疗方面发挥作用。
鉴定出天然蛋白质形成淀粉样纤维过程中的关键短肽序列后,可以进一步鉴定出最关键的氨基酸残基,并通过对该残基的修饰来调控淀粉样纤维的形成。例如Godin等[34] 报道,IAPP第21位的天冬氨酸对淀粉样纤维的形成及其细胞毒性发挥重要的调控作用,将其替换为苯丙氨酸后,该多肽能够破坏细胞膜结构的完整性,引起β细胞凋亡,这一发现为预测II型糖尿病高风险基因突变提供理论指导。Xiong等[12]发现,将淀粉样多肽Aβ1-42第32位的异亮氨酸替换为丙氨酸,其形成淀粉样纤维的能力显著减弱,这也为今后用基因编辑的方法预防和治疗阿兹海默症的发生提供了可能。
在发现蛋白质中的关键淀粉样短肽序列后,也能针对该序列来设计和筛选相应的抑制剂,从而抑制其淀粉样纤维的形成,并有望开发出抑制相应完整蛋白质异常聚集的药物,例如,在Mao等[35],研究中,一系列人工设计合成的短肽被用于抑制IAP11-20片段淀粉样聚集的发生,在Katyal等[29]研究中,海藻糖被用于抑制GNNQQNY粉样聚集的发生,Chen等[36] 最近的研究发现,氧化石墨烯能够抑制淀粉样短肽Aβ33-42的聚集,这些研究,有望为将来开发针对淀粉样病变的小分子药物提供思路。
5.2 纳米生物材料的开发
此外,模拟天然形成淀粉样纤维的短肽序列,某些能够形成纳米纤维结构的短肽,也被设计作为新型纳米生物材料,在纳米医学、纳米技术等领域发挥其作用。例如Tang等[37] 设计了一系列形成淀粉样纤维的5肽,能够快速形成可注射的水凝胶,在装载细胞开展组织工程应用方面显示出巨大的潜力,人工设计的KFFEAAAKKFFE可形成典型的淀粉样纤维,并作为模板来制备一维硅纳米线[38],我们最近的研究发现,以连续的疏水性氨基酸残基为主体设计的短肽A6K也能形成典型的淀粉样纤维,并可作为疏水药物的载体,提高其在水溶液中的稳定性[39],这些研究表明,除了在相关疾病中的理论意义,淀粉样短肽也可能成为一类新型的生物材料,开发这些淀粉样短肽在生物医学工程领域的潜在实用价值,也是一个值得关注的发展方向。
6 问题与展望
综上所述,目前已经从许多天然蛋白质里发现了重要的淀粉样短肽序列,并对其进行了深入研究,这些淀粉样短肽通常含有较多的疏水性氨基酸,在疏水作用、π-π 堆积作用和氢键等分子间非共价作用力的驱动下,通过短肽β折叠二级结构相互聚集,从而形成典型的淀粉样纤维,研究这些淀粉样短肽的自组装机制,有助于进一步阐明其所在天然蛋白质形成淀粉样纤维的分子机制。然而,淀粉样短肽的研究也有其自身的问题和局限性,例如,完整蛋白质如何基于这些关键的短肽序列形成淀粉样纤维,目前仍然缺乏一个充分合理的解释,此外,蛋白质的异常聚集也不完全由序列本身决定,特定位点的修饰也会影响异常聚集的发生,例如,一些氨基酸位点的异常修饰会导致聚集的发生[40],而另一些修饰,如糖基化修饰,会降低Aβ的聚集程度,导致毒性更强的寡聚体的生成[41],因此,围绕已知的淀粉样短肽,仍然有大量的尚未清楚的机制值得进一步探索,在引起淀粉样病变的蛋白质中,仍然有许多未知的淀粉样短肽需要去发掘,除了淀粉样短肽本身的氨基酸序列,蛋白质的修饰也是值得关注的重点, 这些工作将为最终阐明天然蛋白质形成淀粉样纤维的分子机制奠定基础,另一方面,淀粉样短肽形成的纳米纤维,也可被作为一类天然的纳米生物材料,在众多领域发挥其应用价值。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志