Targeting the bacterial sliding clamp peptide 46 是一种靶向细菌滑动夹(SC)的短肽,抑制SC依赖性DNA合成。
随着市场上新分子研发的匮乏,细菌耐药性持续攀升,这凸显了开发新型抗生素的迫切需求——包括探索细菌细胞内的新作用靶点。理想的生物靶点应满足三个条件:一)对细菌生长繁殖不可或缺;二)广泛存在于各类人类病原体中;三)不存在或与人体必需生物过程相关的分子差异显著。
细菌滑动夹(SC),又称β-夹,符合上述标准,被确定为开发新型抗生素的新靶点。细菌DNA滑动夹(SC)或称复制过程性因子,是开发新型抗生素的理想靶点。这种蛋白质在细胞分裂过程中对DNA复制至关重要,通过蛋白质相互作用为复制型和特异性/透切型细菌DNA聚合酶提供锚定平台。它在不同细菌物种中具有高度保守的结合位点,而真核生物版本(称为增殖细胞核抗原PCNAs)则无序列相似性。8,9值得注意的是,EcSC与肺炎克雷伯菌(100%)、鲍曼不动杆菌(83%)和铜绿假单胞菌(94%)等其他革兰氏阴性菌的SC结合位点残基具有极高序列同源性甚至完全一致。后三种细菌属于ESKAPE菌群,已被世界卫生组织列入急需开发新型抗生素的优先细菌名单。因此,只要对SC的亲和力保持在同一水平,EcSC抑制剂可被用于对抗这些危险细菌并解决抗生素耐药性问题。
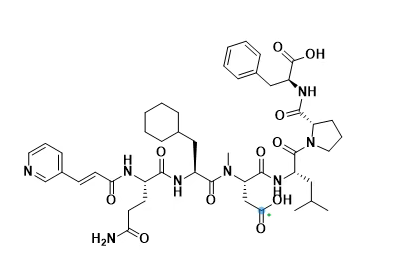
与EcSC相互作用的不同N-烷基化肽1类似物的结构、解离常数、热力学和动力学参数。
针对大肠杆菌SC(EcSC)肽结合口袋内相互作用的新系列多肽进行了构效关系研究。通过多种修饰策略提升其结合亲和力并优化理化性质:对肽键进行N-烷基化修饰、延长N端结构以增强与蛋白质表面的接触面积、在C端引入疏水性和受限残基以优化主疏水口袋的占据率。特定结构改变显著提高了亲和力,通过组合多种有益修饰进一步优化了解离常数(Kd)。对11种肽/EcSC共晶的X射线结构分析揭示了肽-蛋白界面的新相互作用。
Cas号:2756997-82-5