肽偶联纳米颗粒的摄取主要通过受体介导的内吞作用进行。然而,摄取机制会因偶联物的类型而异。它们还可以根据靶器官/细胞的位置通过主动和被动靶向被细胞吸收。赋予肽/抗体的纳米材料具有靶向特定配体的能力,从而提高了侵入单个肿瘤细胞或细胞内亚细胞器的能力。整合素、动脉粥样硬化病变和细菌脂多糖是用于递送近红外(NIR)荧光探针的特定靶点。
纳米载体在靶向给药以及跨越各种生物屏障以在化疗期间将药物递送至目标部位并减少脱靶毒性方面很有用。根据用于合成的材料类型,纳米颗粒可分为有机纳米载体和无机纳米载体。有机纳米载体的一些例子包括碳纳米管、脂质体、树枝状大分子、聚合物纳米颗粒等,无机纳米载体包括金属纳米颗粒和量子点;图1展示了一些示例,以下将作进一步阐述。
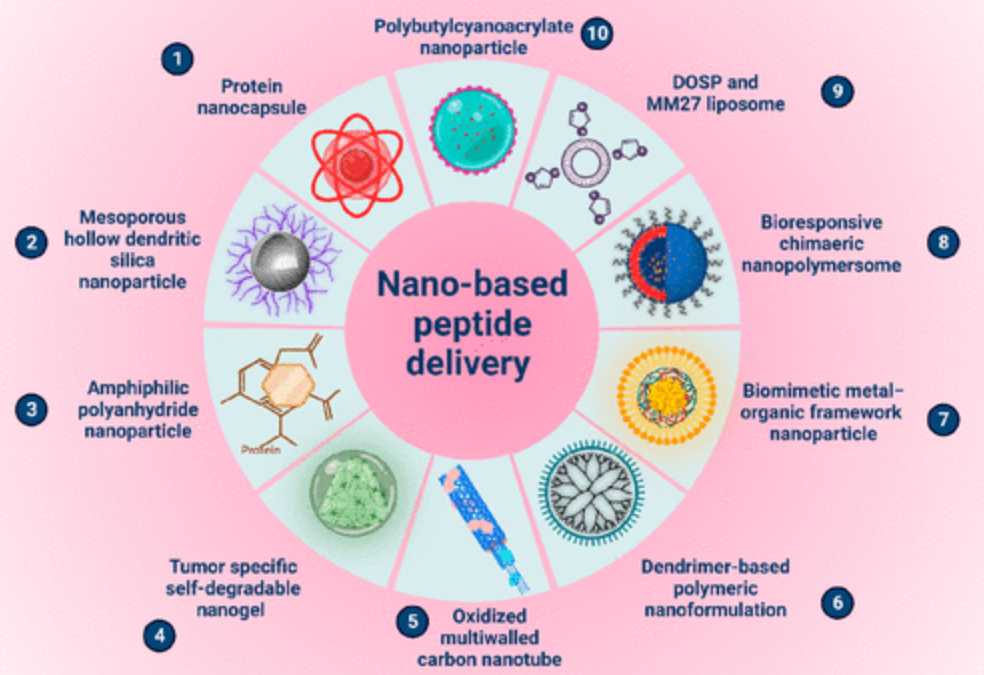
图1 纳米胶囊、介孔二氧化硅纳米粒子、聚合物纳米粒子、纳米凝胶、碳纳米管、树枝状大分子、金属纳米粒子和脂质体。上述纳米载体可用于肽类药物的递送,从而靶向肿瘤部位。
1、纳米纤维
纳米纤维是通过静电纺丝技术由聚合物制备而成的。纳米纤维可以由单一聚合物或多种聚合物合成。使用鱼肌浆蛋白合成的纳米纤维形成了用于口服胰岛素分布的运输基质,其本质上具有生物活性。纳米纤维平台有助于控制封装在纳米颗粒中的蛋白质的释放,这些纳米颗粒进一步被加载到纳米纤维中。
2、纳米胶囊
这种纳米载体的核心-壳结构由不同类型的聚合物形成球形纳米壳。这些纳米胶囊的大小取决于所采用的制备方法。通过胞吞作用进入细胞后,经内溶酶体蛋白/肽修饰/表面包被的纳米胶囊往往能逃逸内溶酶体囊泡的形成,直接到达靶向部位。一种用癌细胞膜包被的空心铁/单宁酸纳米胶囊已被用于在4T1细胞系中高效递送氨基酸氧化酶,以实现协同肿瘤治疗。杜等人开展的另一项研究开发了核靶向细胞膜包被的可生物降解二氧化硅纳米颗粒,其表面包被有靶向核区的肽,用于治疗包括癌症在内的核相关疾病。为了提高疏水性药物的亲水性以增加其在肿瘤中的积累,并了解多西他赛和阿霉素的协同作用,这两种药物都被封装在由人血清白蛋白制成并用壳聚糖包被的蛋白质载体中。扎霍等人开发了用肿瘤靶向配体修饰的基于蛋白质的纳米胶囊,用于重组p53蛋白的细胞内递送。这些纳米胶囊用诸如促黄体生成素释放激素(LHRH)肽和抗HER2抗体之类的配体进行了修饰。所开发的纳米胶囊表现出卓越的肿瘤靶向性,并有助于重新激活癌细胞中p53介导的细胞凋亡。
3、聚合物纳米粒子
聚合物纳米粒子,通常被称为纳米聚合物,是由生物相容性和生物可降解性聚合物构成的工程结构。其独特的设计和可调的特性提供了诸多优势,使其成为靶向药物递送、诊断、成像以及其他需要纳米级精度的领域的理想候选材料。聚合物纳米粒子可以通过多种方法合成,包括乳液技术、溶剂蒸发、自组装和模板辅助方法。聚合物的选择和合成方法取决于纳米粒子所需的特性和应用。抗体的物理和化学不稳定性会导致其生物活性下降,因此必须设计出合适的递送载体以降低降解风险并优化体内性能。设计并评估了一种两亲性聚酸酐纳米粒子,该纳米粒子能够持续释放功能性破伤风抗毒素和抗TNF-α单克隆抗体,同时保持抗体的功能性和生物活性,并对其体内疗效进行了评估。为解决循环稳定性差和靶向效率低的问题,利用聚乳酸 - 羟基乙酸共聚物(PLGA)制备了一种可生物降解且生物相容的 pH 响应型聚合物纳米颗粒。这些纳米颗粒通过牛血清白蛋白(BSA)壳进行交联,该壳被功能化了酸度触发的合理膜(ATRAM)肽。这些纳米颗粒表现出更高的稳定性和肿瘤靶向性。杨等人开发了一种负载颗粒酶的纳米聚合物囊泡,颗粒酶是一种针对 H460 人肺癌细胞的凋亡蛋白。体外实验表明,纳米聚合物囊泡表现出优异的抗肿瘤活性。此外,在体内实验中,这些纳米颗粒显示出更长的循环时间,在肿瘤部位的积累增加,并能抑制 H460 肿瘤的生长。
4、纳米凝胶
纳米凝胶是由明胶、胶原蛋白(基于蛋白质)、淀粉、透明质酸、壳聚糖、海藻酸盐和纤维素(基于多糖)等水凝胶材料交联而成的三维聚合物网络结构。纳米凝胶具有广泛的应用,从成像到治疗。通过酸性肿瘤环境激活的可自组装成物理交联纳米凝胶(pNG)的合成改性透明质酸实现了抗癌蛋白的递送。用于皮肤感染应用的纳米凝胶通常以树突状形式配制。这些纳米凝胶负载有针对伤口中金黄色葡萄球菌引起的皮肤感染的肽,并对其疗效进行了评估。Fmoc-FF,已知能形成自组装β-折叠片,是一种低分子量水凝胶剂,在生理pH值下形成水凝胶,并在乳腺癌细胞上进行了评估。芳香族基团连接到短肽的N端时,能够形成超分子水凝胶,可自组装以捕获类似于细胞外基质的水分子。这在生物医学工程领域有着广泛的应用。一种二肽叶酸受体配体,这些配体的N端分别用萘普生(一种非甾体抗炎药)和3-丙酸(一种抗生素)封端,能够形成超分子水凝胶结构。
5、金属纳米粒子
当精氨酸-甘氨酸-天冬氨酸(RGD)肽涂覆在金属离子上时,实现了光动力疗法与肝细胞癌(HCC)化疗的结合。在纳米级,使用锆卟啉金属框架作为载体骨架,将10-羟基喜树碱(HCPT)组装到涂覆有RGD肽的载体骨架的孔隙中,以实现对HCC的靶向治疗。金属纳米粒子被定义为由金属或金属合金组成的纳米级结构,它们具有与大块材料不同的显著物理、化学和生物特性。这些是用于蛋白质货物靶向递送的最兼容和高效的载体之一,其大的表面积与体积比能够实现高效的药物负载、治疗有效载荷递送以及与生物实体的靶向相互作用。同样,对于脑肿瘤的治疗,也开发了一种基于纳米技术的方法。金纳米粒子(AuNPs)被修饰了一种类似精氨酸-甘氨酸-天冬氨酸的肽,这种肽具有识别αvβ3整合素的能力,并且在成功穿过血脑屏障后,在颅内肿瘤模型中表现出更高的皮下摄取率。在Ren等人的另一项研究中,使用了过渡金属Mn2+、Fe2+、Co2+、Ni2+、Cu2+和Zn2+来制备配位聚合物,然后将其接枝到基于三联吡啶的配位树状大分子上,用于细胞质肽的递送。其中,Mn2+-三联吡啶配合物显示出更高的递送效率。开发了一种仿生纳米粒子用于蛋白质的全身和细胞内递送。蛋白质被封装在金属有机框架中,并用细胞外囊泡膜进行修饰。
6、脂质基纳米粒子
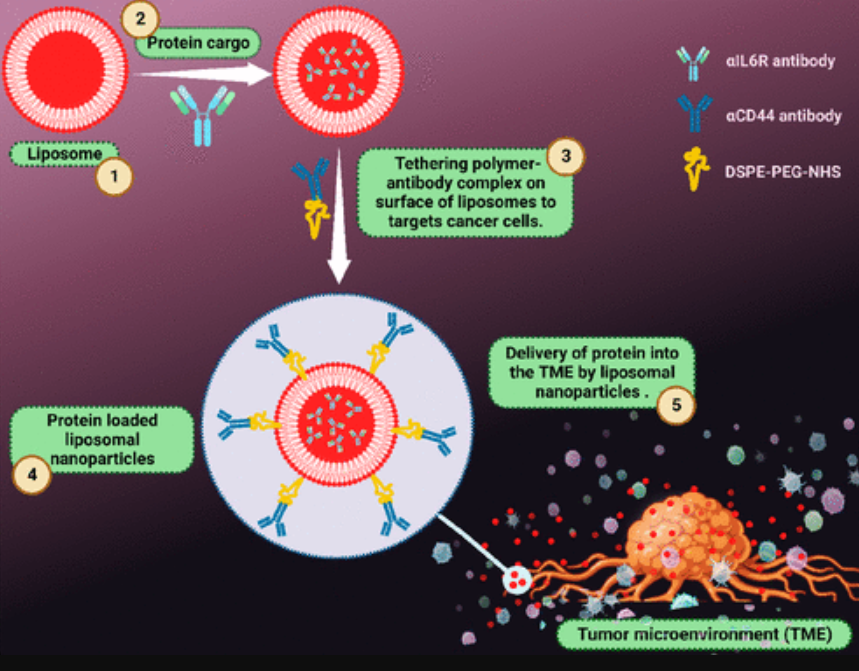
由于成本低、易于扩大规模以及出色的生物相容性,脂质基系统引起了研究人员的极大兴趣。脂质体是由磷脂双层构成的球形囊泡,内部为水相核心,大小从纳米到微米不等。它们被广泛用于药物输送,并在化妆品和制药领域有着广泛的应用。脂质体可以有一层或多层双层结构,为疏水性和亲水性药物的封装提供了场所。通过使用固体脂质纳米粒和纳米结构脂质载体等纳米系统,已经实现了两亲性和亲脂性肽的输送。图2展示了装载蛋白质的脂质体,其进一步用抗体修饰以实现靶向输送。研究了封装肽Endostatin的脂质体制剂对细胞活力的提高情况。当肽被封装在脂质体中时,其稳定性和血浆半衰期的增加增强了其膜渗透性,最终提高了对血管生成和肿瘤生长的抑制作用。通过脂质体纳米载体将Ran-RCC1抑制肽(RAN-IP)和阿霉素(DOX)共同递送至乳腺癌细胞,以克服耐药机制,同时为了实现两种功能蛋白的细胞内递送,使用了脂质体制剂,即β-半乳糖苷酶酶和抗细胞角蛋白8抗体。在Riaz等人的研究中,槲皮素负载脂质体的表面用T7肽进行功能化,用于肺部递送至肺癌治疗中的靶向转铁蛋白受体。细胞穿透肽TAT与封装氟比洛芬的脂质体进行功能化,以穿过眼睛的防御屏障,并在临床眼科中评估了经角膜的递送。
图2 纳米载体(脂质体)负载蛋白质的示意图,通过在脂质体表面装饰抗体复合物,进一步增强其向肿瘤微环境(TME)的靶向递送。
7、碳纳米管
碳纳米管是中空的、细长的碳圆柱体。它们重量极轻,长径比极佳,且具有活性表面。它们具有独特的形态特征,例如尺寸和几何形状以及物理特性。它们可以被比作一张卷成圆柱体的石墨纸,并以六边形碳六边形晶格排列。这些可以被转化为智能纳米级药物输送系统,有或没有诊断剂,具有生物相容性、无免疫原性和光致发光性。使用分子动力学(MD)模拟研究了用抗癌药物紫杉醇封装的单壁碳纳米管,并用PW3肽以及(-OH)和(-COOH)进行功能化,以研究药物在碳纳米管上的结合情况。Nef-M1肽通过诱导细胞凋亡和抑制转移对人类癌细胞具有细胞毒性。由该肽制成的纳米结构将是增强肽功能特性的有效策略。这种Nef-M1肽与单壁碳纳米管结合,并用于治疗乳腺癌和结直肠癌的三维肿瘤球。法里亚等人开发了负载NY-ESO-1(一种癌睾丸抗原)以及Toll样受体激动剂的碳纳米管(CNTs)。观察到这些CNTs能够触发强烈的CD4+和CD8+T细胞介导的免疫反应。为了实现高效的抗癌疫苗递送,将卵清蛋白(OVA)肽表面功能化到多壁碳纳米管上,同时结合其他成分,如抗原NY-ESO-1和TLR9激动剂CpG寡核苷酸(CpG-ODNs)。这些纳米颗粒成功地内化到树突状细胞中,进一步抑制了肿瘤的发展,并提高了小鼠的存活率。
参考文献:doi.org/10.1021/acsabm.3c00711