1 骨吸收面靶向
骨由50%-70%的无机矿物质、20%-40%的有机基质、5%-10%的水以及少于3%的脂肪组成。值得注意的是,羟基磷灰石(HA)是骨组织中无机矿物质的主要成分,因此成为骨靶向的理想目标。骨吸收面被破骨细胞覆盖,主要为高结晶度的HA。骨靶向通常通过阴离子配体与吸收面表面的钙离子螯合来实现。富含磷酸盐和羧酸盐的阴离子配体被设计用于骨靶向。这些配体与小分子药物、荧光染料、环糊精、大环螯合剂、富勒烯C60、蛋白质、核酸、聚合物、纳米材料和细胞结合,赋予这些分子和物种骨归巢特性。
双膦酸盐(BPs)及其类似物:双膦酸盐(1)是应用最广泛的骨靶向配体(图1a)。两个膦酸盐基团对于在羟基磷灰石(HA)上形成二齿配位的钙离子结合至关重要。双膦酸盐上的R1基团显著影响其与骨的结合亲和力。对于大多数双膦酸盐而言,R1是羟基。羟基使得双膦酸盐具有更高的骨结合亲和力,因为其能形成三齿配位。迄今为止,已有三代双膦酸盐获批用于临床,以抑制破骨细胞生成或骨转移。第一代双膦酸盐不含氮,如依替膦酸盐(2)、氯膦酸盐(3)和替鲁膦酸盐(4);第二代双膦酸盐含氮,如阿仑膦酸盐(ALN,5)、帕米膦酸盐(6)和伊班膦酸盐(7);而第三代双膦酸盐含氮杂环,如唑来膦酸盐(ZOL,8)和利塞膦酸盐(9)。R2位的氮基团可通过氢键与羟基磷灰石上的羟基相互作用。
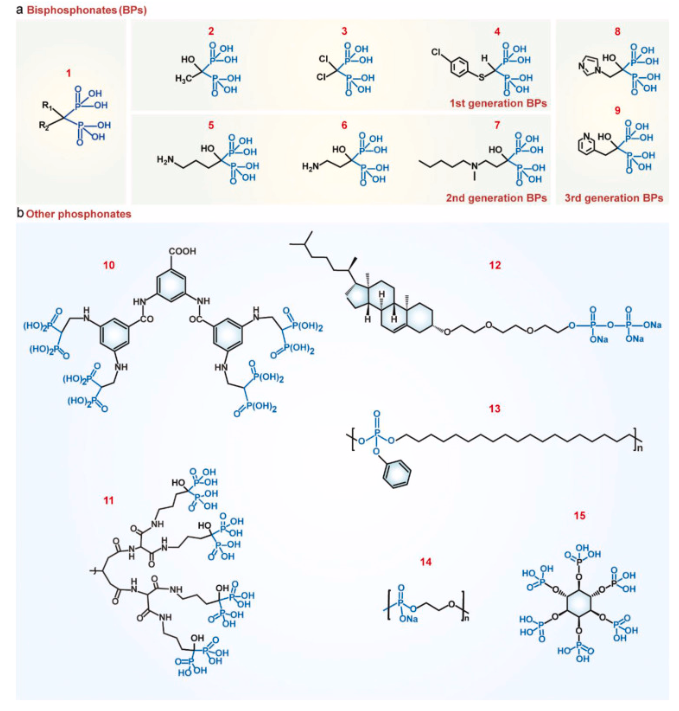
图1.骨靶向双膦酸盐及膦酸盐类似物的分子结构。(1)双膦酸盐,(2)依替膦酸盐,(3)氯膦酸盐,(4)替鲁膦酸盐,(5)阿仑膦酸盐,(6)帕米膦酸盐,(7)伊班膦酸盐,(8)唑来膦酸盐,(9)利塞膦酸盐,(10)具有四个双膦酸盐单元的树枝状配体,(11)具有四个阿仑膦酸盐部分的树枝状分子,(12)焦磷酸化胆固醇,(13)聚(磷酸酯),(14)聚(乙二醇钠磷酸盐),(15)植酸。
通常,不同双膦酸盐(BPs)与羟基磷灰石(HA)的结合亲和力顺序为:氯膦酸盐<依替膦酸盐<利塞膦酸盐<伊班膦酸盐<阿仑膦酸盐<唑来膦酸盐。阿仑膦酸盐是用于设计骨靶向纳米粒子的双膦酸盐中研究最多的。阿仑膦酸盐与纳米粒子的结合在体外使羟基磷灰石结合增加了2.5至10倍,在体内使骨组织积累增加。唑来膦酸盐的骨结合能力甚至比阿仑膦酸盐更强,与纳米粒子结合后,纳米粒子在骨组织中的积累增加了多达50倍。其他双膦酸盐,如帕米膦酸盐、尼尔膦酸盐、利塞膦酸盐和美膦酸盐也被结合到纳米粒子上用于骨靶向药物输送。双膦酸盐可以通过简单的化学方法结合到纳米粒子上。大多数双膦酸盐的骨结合能力在化学修饰后得以保持。此外,结合到纳米粒子上的双膦酸盐能够保持其固有的生物活性。例如,阿仑膦酸盐结合的纳米粒子抑制破骨细胞分化和骨吸收。唑来膦酸盐纳米粒子对癌细胞表现出抗增殖和抗血管生成活性。
除了双膦酸盐(BPs),富含磷的合成化学物质和聚合物也被用作骨靶向配体(图1b)。例如,具有四个双膦酸盐单元的树状配体(10)与单膦酸盐基团相比,对羟基磷灰石(HA)的结合能力显著增强。这些树状膦酸盐(11)能够将抗癌药物和纳米颗粒特异性地递送至骨组织。尽管单膦酸盐材料的骨结合亲和力相对较低,但在纳米颗粒上以高密度修饰单膦酸盐基团也能实现有效的骨靶向。此外,焦磷酸化胆固醇(12)被用于制备治疗骨病的骨靶向脂质体。由磷酸酯单体构建的聚合物,如聚(磷酸酯)(13)和聚(乙二醇钠磷酸酯)(14),据报道具有固有的骨粘附特性。除了合成膦酸盐,天然存在的化合物如植酸(15)也被提议作为骨靶向基团。
富含羧酸根的肽和材料:非胶原蛋白,如骨钙素和骨桥蛋白,由于蛋白质中富含天冬氨酸(Asp,D),因而与骨组织具有很高的亲和力。受此启发,富含天冬氨酸的肽(16)被提出作为骨靶向的有前景的候选物(图2a)。八肽D8是骨靶向药物递送中使用最广泛的序列。经D8改性后,纳米颗粒与羟基磷灰石或骨组织的结合量增加了3至14倍。其他寡聚天冬氨酸,如D7、D6和树状D3(17)也表现出类似的骨靶向特性。富含天冬氨酸的肽的结合亲和力很大程度上取决于重复天冬氨酸单元的数量以及纳米颗粒表面的肽密度。如果肽接枝密度低,则需要更长的肽,相反,单个天冬氨酸修饰也能实现有效的骨结合。
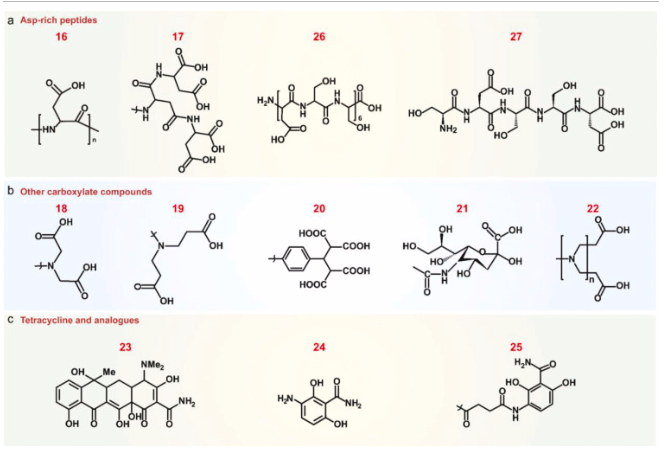
图2.富天冬氨酸肽和其他骨靶向配体的分子结构。(16)富天冬氨酸肽,(17)树状D3,(18)腈基苯甲酸,(19)腈基苯丙酸,(20)聚丙二酸,(21)寡聚唾液酸,(22)羧基封端树状大分子,(23)四环素,(24)3-氨基-2,6-二羟基苯甲酰胺,(25)带有琥珀酸连接基的3-氨基-2,6-二羟基苯甲酰胺,(26)(DSS)6,(27)SDSSD。
尽管富含天冬氨酸的肽与羟基磷灰石(HA)的骨结合强度不如双膦酸盐(BPs),但它们具有合成方便、易于化学修饰、血液循环良好以及易于将响应基序和其他靶向基团整合到肽中的优点。与天冬氨酸相比,另一种阴离子氨基酸谷氨酸(Glu,E)的两个羧基之间的空间距离更长,这降低了与羟基磷灰石的结合亲和力。尽管有少数使用谷氨酸或聚谷氨酸作为骨靶向配体的例子,但富含天冬氨酸的肽在设计骨靶向递送系统方面更具优势。
除了氨基酸和肽类,其他含羧酸根的配体和聚合物,如氰基乙二酸(18)、氰基丙二酸(19)、聚丙二酸(20)和寡聚唾液酸(21)也被提议作为骨靶向基团(图2b)。氰基乙二酸修饰的纳米颗粒显示出对骨裂纹的选择性结合。氰基乙二酸中两个羧酸根之间的空间距离对于有效结合至关重要。与氰基丙二酸相比,氰基乙二酸与荧光探针的结合物对骨的结合能力高出3倍。树状大分子是一类结构明确的聚合物,其表面具有高密度的功能基团。羧酸根封端的树状大分子(22)可用作具有固有骨靶向能力的载体。树状大分子表面高密度的羧酸根提供了更多与羟基磷灰石结合的机会。对于具有不同表面功能基团的树状大分子,天冬氨酸修饰的树状大分子对骨的结合亲和力远高于谷氨酸、琥珀酸和乌头酸修饰的树状大分子。
四环素:四环素(23)是一种含酚和羟基的抗生素(图2c)。由于其对透明质酸(HA)的高亲和力可能会抑制儿童骨骼生长,四环素在儿科医学中的使用已被停止。四环素偶联显著增加了纳米颗粒和病毒载体在骨骼中的生物分布。为了减少四环素的副作用,设计了一种源自四环素的最小化化学结构(3-氨基-2,6-二羟基苯甲酰胺)(24)用于骨靶向。该分子的不良反应有限,但仍保留了天然四环素50%的骨结合能力。当在3-氨基-2,6-二羟基苯甲酰胺(25)上引入琥珀酸连接体时,其骨结合亲和力甚至超过了四环素。
抗酒石酸酸性磷酸酶(TRAP)靶向:TRAP是破骨细胞在骨吸收表面沉积的一种蛋白质。这种分泌蛋白可被识别为骨吸收表面靶向的靶点。已鉴定出一种与TRAP具有高亲和力的肽TPLSYLKGLVTVG,并将其与聚合物结合用于骨靶向。在体内,靶向材料在骨折部位的积累显著增加。
2 骨形成表面靶向
覆盖有成骨细胞的骨形成表面主要是低结晶度的羟基磷灰石和无定形磷酸钙。为了实现向骨形成表面的靶向递送,通常会在天冬氨酸丰富的肽中加入丝氨酸(Ser,S)。例如,设计了一种十八肽(DSS)6(26)以靶向骨形成表面。该设计灵感来源于一种与骨形成表面具有相似物理化学性质的、能特异性结合牙本质的肽。它显示出对表面小而随机排列的晶体的优先结合。除了靶向骨矿物质外,在细胞水平上靶向成骨细胞也是一种替代选择。通过筛选鉴定出一种具有高成骨细胞选择性的适配体CH6,用于将基因药物靶向递送至骨形成表面。同样,通过噬菌体展示技术鉴定出一种五肽SDSSD(27),可特异性靶向成骨细胞,且该肽对成骨细胞的靶向能力更强,毒性更低,优于十八肽(DSS)6。
3. 骨髓靶向
骨髓也是开发骨靶向给药系统的一个潜在靶点。表面电荷呈中性且尺寸较小的纳米颗粒有很高的骨髓积聚倾向。此外,据报道,血管内皮细胞(EC)分泌的外泌体具有很高的骨结合活性。妊娠区蛋白(PZP)在这些内皮细胞分泌的外泌体上高度表达,这种蛋白质能够主动与骨髓中的相关受体结合。因此,PZP 可用作治疗恶性骨肿瘤的骨靶向配体。E-选择素是一种表达在骨髓内皮细胞上的细胞黏附分子。其表达仅限于与肿瘤归巢位点共定位的特殊微域。因此,E-选择素适配体被开发为一种有吸引力的靶向配体,用于将药物递送至骨髓内皮细胞。骨髓巨噬细胞也是骨髓靶向的一个目标。通过用阴离子两亲性分子对脂质体纳米颗粒进行表面修饰,可使其通过清道夫受体介导的机制被巨噬细胞选择性摄取。经修饰的两亲性分子上的亲水性头部基团能够被骨髓巨噬细胞表达的清道夫受体识别。这些纳米材料在向骨髓输送治疗剂方面具有潜在的应用价值。
4. 肿瘤细胞靶向
纳米颗粒可以直接递送至原位或转移性骨肿瘤以治疗疾病。这可以通过使用高亲和力配体(如适配体、抗体和肽)靶向肿瘤细胞上的特定生物标志物来实现。前列腺癌和乳腺癌是最常被诊断出的骨转移性癌症。这些转移性肿瘤细胞上的生物标志物被广泛选作靶点来设计靶向纳米治疗药物。前列腺特异性膜抗原(PSMA)在大多数前列腺癌细胞上过度表达,特异性靶向 PSMA 的适配体可用于靶向骨转移性前列腺癌。同样,人表皮生长因子受体 2(HER2)是一种原癌基因,在多达 30% 的乳腺癌中过度表达。这些骨转移性乳腺癌可以通过使用抗 HER2 的单克隆抗体曲妥珠单抗来靶向。整合素αvβ3 在大多数癌细胞上过度表达。三肽精氨酸 - 甘氨酸 - 天冬氨酸(RGD)和环状 RGD(cRGD)是强效的整合素结合配体。整合素β3 在骨转移性癌细胞中高度表达,但在原发性肿瘤和内脏转移中不表达。因此,整合素β3 可被视为骨转移性乳腺肿瘤的特异性生物标志物。喹诺酮,一种与整合素β3 特异性结合的配体,被用于将纳米颗粒递送至转移性骨肿瘤。
对于原位骨肿瘤(如骨肉瘤),可将过度表达的生物标志物(如活化白细胞黏附分子(ALCAM)、分化簇 44(CD44)、Ephrinα2 受体(EphA2)、唾液酸、雌激素受体)作为靶点。例如,抗 ALCAM 被用于将载有抗癌药物的纳米颗粒递送至骨肉瘤。透明质酸(CD44 的配体)被用于将药物靶向递送至骨肉瘤。尽管 CD44 也在正常上皮细胞中表达,但纳米载体通过利用实体瘤的渗漏血管而优先运输到肿瘤中。一种与 EphA2 特异性结合的十二肽 YSAYPDSVPMMS 被用于骨肉瘤治疗。同样,雌激素和刀豆蛋白 A 装饰的纳米颗粒被合成以将治疗药物递送至骨肉瘤细胞。骨肉瘤干细胞导致骨肉瘤的转移和复发,因此有效清除骨肉瘤干细胞对于骨肉瘤治疗至关重要。分化簇 133(CD133)是骨肉瘤干细胞上过度表达的特异性生物标志物。一种经 CD133 适配体修饰的纳米药物成功地将治疗药物递送至骨肉瘤干细胞并抑制其增殖。骨肉瘤中的循环肿瘤细胞表现出类似癌症干细胞的表型,这是导致化疗耐药性和肿瘤转移的原因。CXCR1 在循环肿瘤细胞衍生细胞中高表达,因此设计了一种靶向 CXCR1 的肽 SAKELRCQCIKTYSKPFHPK,用于在体内将顺铂递送至循环肿瘤细胞。
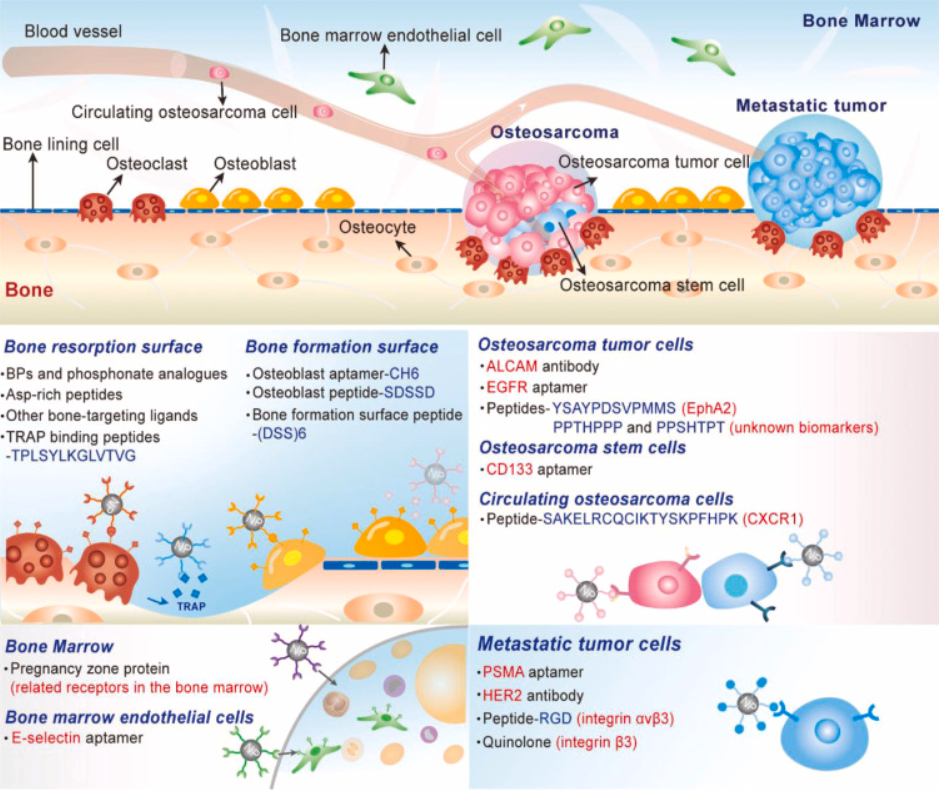
图3.骨原位肿瘤和骨转移瘤治疗的靶向机制。利用包括骨桥蛋白(BPs)、肽、抗体、适配体以及许多其他合成化学物质在内的各种靶向配体,靶向纳米颗粒能够被特异性地递送至骨基质、骨髓、骨肉瘤细胞和转移性肿瘤细胞。
对于那些生物标志物未知的肿瘤细胞,可以通过指数富集配体系统进化(SELEX)和噬菌体展示技术分别识别出针对这些细胞的适配体和肽。体内 SELEX 被用于识别针对骨转移性癌症的适配体。将适配体文库静脉注射到携带骨转移性 PC3 前列腺癌的裸鼠体内。经过十轮 SELEX 后,确定了在肿瘤部位具有最高结合点的适配体用于癌症靶向。噬菌体展示是另一种高效的生物技术,用于识别靶向配体。通过噬菌体展示技术可以发现针对目标细胞的肽,而无需事先了解目标细胞的分子特征。为了筛选出特异性靶向骨肉瘤细胞的肽,将噬菌体文库与骨肉瘤细胞一起孵育进行正向选择,然后扩增结合的噬菌体用于下一轮选择。经过三轮筛选后,对单个噬菌体克隆进行 DNA 测序,从而鉴定出两个靶向骨肉瘤细胞的肽 PPTHPPP 和 PPSHTPT。靶向配体及其靶点则在图3中进行了描述。
参考文献:doi.org/10.1016/j.biomaterials.2020.120404