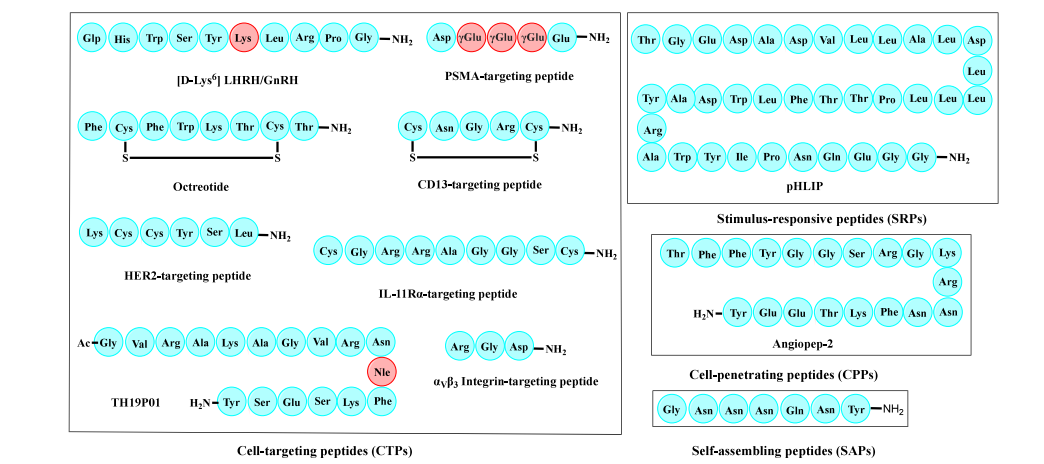
针对特定靶点或疾病的肽类或小分子有效载荷的识别是设计肽偶联药物(PDC)的合理起点。将有效载荷有效递送至靶点是一项具有挑战性的任务。PDC 中的肽部分主要驱动靶向特异性,实现位点特异性有效载荷递送,同时降低其毒性。在过去十年中,PDC 肽(图 3)方面的创新,例如新型细胞穿透肽(CTPs)、细胞穿透肽(CPPs)、自组装肽(SAPs)和刺激响应肽(SRPs),极大地提高了有效载荷的治疗效果。
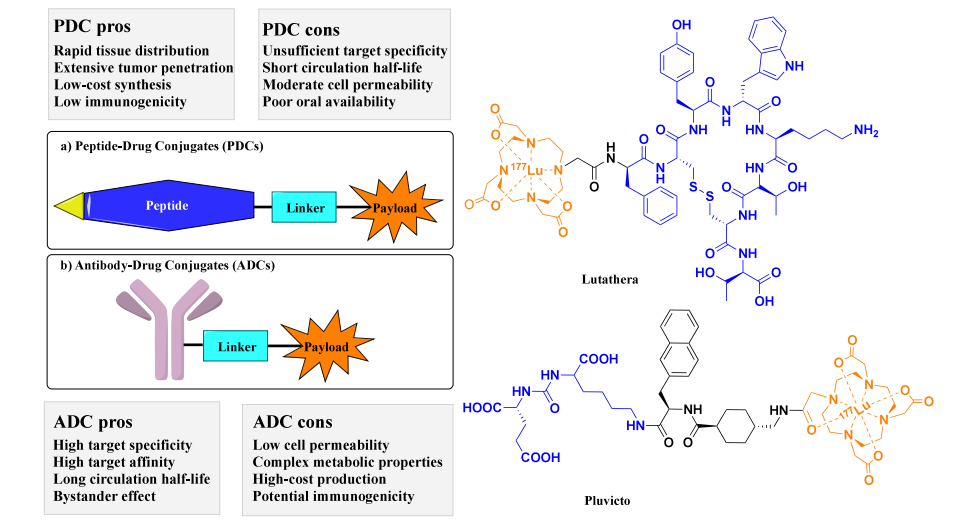
图1.肽药物偶联物(PDC)的示意图结构以及已获美国食品药品监督管理局(FDA)批准的PDC的化学结构。(1)Lutathera包含源自含酪氨酸的生长抑素类似物Tyr3-octreotate(TATE)的细胞靶向肽(CTP)、一个酰胺键连接子以及由与β射线发射核素镥-177(177Lu)结合的环状螯合剂四氮杂环十二烷四乙酸(DOTA)组成的有效载荷。(2)Pluvicto包含具有PSMA结合基序Glu-NH-CO-NH-Lys的CTP、一个包含2-萘基-L-丙氨酸和氨甲环酸的连接子,以及与Lutathera相同的有效载荷。(3)CTP以蓝色显示,有效载荷以橙色显示,连接子以黑色显示

图2.药物偶联物(PDCs)的作用机制。PDCs可通过细胞膜转运蛋白(CTPs)介导的内吞作用或小分子有效载荷进入细胞。或者,它们也可以通过细胞穿透肽(CPPs)穿过细胞膜。内体或溶酶体内的低酸度和高酶浓度有助于有效载荷释放到细胞质、细胞核或其他细胞器中以发挥其功能。
大多数肽类药物是激素模拟物或源自天然产物。设计针对受体配体结合域的强效且具有选择性的肽类药物仍然具有挑战性。各种编码和展示技术被用于识别针对目标蛋白的高活性肽序列。核苷酸编码的质谱库筛选技术引入非天然基团或非蛋白生成氨基酸,以应对难以触及的药物靶点,包括噬菌体展示筛选、肽和蛋白质的分裂-内肽酶环化连接、mRNA 展示以及一珠一化合物或分裂-合并策略。通过这些方法筛选出的肽通常对目标蛋白具有高亲和力。
图3.用于肽导向载体的代表性肽。左侧方框中展示了某些典型CTP的氨基酸序列,其中红色的氨基酸为非天然氨基酸。右侧的方框分别为SRP、CPP和SAP的示例。
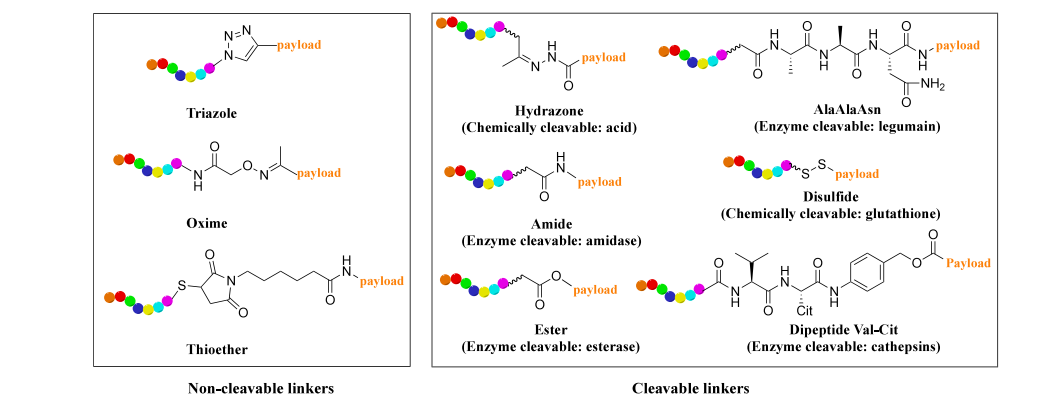
连接子在肽偶联药物(PDC)的设计中起着重要作用,因为它强烈影响PDC的安全性和效力。根据其可裂解性,已开发出两大类连接子(图4)。可裂解连接子对pH值、谷胱甘肽或蛋白酶(如二肽连接子对组织蛋白酶B)敏感。不可裂解连接子,如噻唑、肟或硫醚,可增强PDC在人体内的循环稳定性。
图 4. PDCs 中不同连接体的化学结构。肽段以彩虹色显示,连接体以黑色显示。
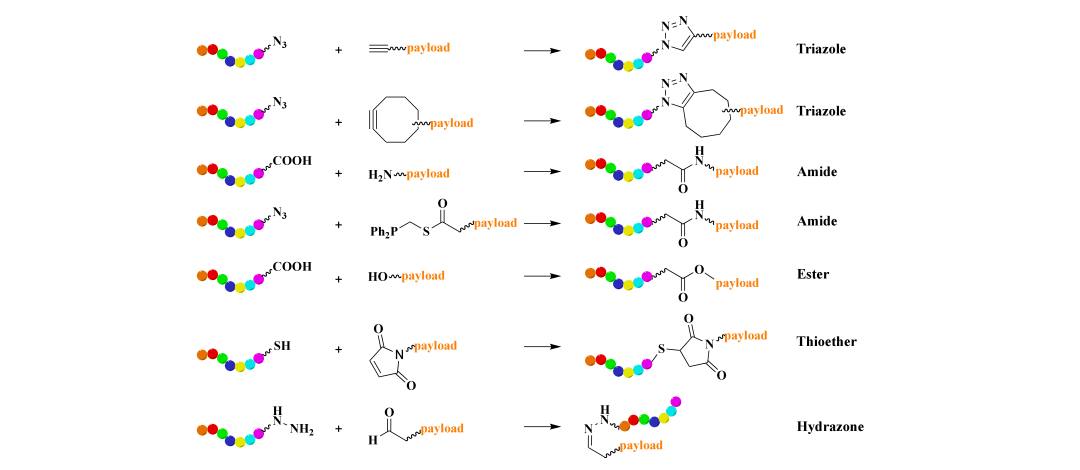
在PDC合成中,最终的缩合步骤至关重要。酰胺或酯的形成已被证明对于将肽与有效载荷或连接子连接起来是有用且高效的。最近,点击反应因其高效率、快速性和温和的反应条件而备受关注(图5)。其中,叠氮化物-炔烃Huisgen环加成反应被广泛使用,在水相和有机溶剂中都能形成三唑单元。这种反应已成为ADC或PDC合成的有用工具,尤其是多聚体PDC的合成。为了解决Huisgen环加成反应中金属催化剂带来的安全问题,开发了应变促进叠氮化物-炔烃环加成反应(SPAAC),无需金属催化剂。然而,SPAAC的高反应性可能导致区域选择性和化学选择性不佳。Staudinger缩合反应在水溶液中无需金属催化剂即可在膦化合物和叠氮化物之间形成酰胺键,提供了一种替代方案。传统的一级或二级胺与羧酸的偶联也有助于酰胺的形成。通过叠氮化物-炔烃点击反应,将识别αVβ6整合素的小环肽c(AmpLRGDL)与用于特发性肺纤维化治疗的酪氨酸激酶抑制剂(尼达尼布)连接,合成了一种新型的前药偶联物(PDC)。另一个例子是通过叠氮化物-炔烃点击反应将靶向EphA2的肽与叠氮己酰紫杉醇(PTX)基团偶联,生成了另一种靶向EphA2的PDC。
图 5. 常用于肽偶联药物(PDCs)的最常见共轭反应示意图。肽部分以彩虹色突出显示。
半胱氨酸常存在于肽序列中,可用于硫醇-烯烃共轭反应。这种硫醇介导的迈克尔加成通常需要烯烃连接一个吸电子基团,并且在有机和水性溶剂中均有效。另一种共轭策略是羰基与肟基缩合形成肟,或与肼缩合生成腙化合物。酯和氨基甲酸酯常用于PDC合成。例如,疏水性药物紫杉醇(PTX)通过与载体肽(CPP)经琥珀酸作为pH可裂解连接子的酯键成功共轭。酯键在PDC被内化到癌细胞之前保持稳定,而癌细胞内的酸性环境会诱导酯键水解,释放出PTX药物载荷。
简而言之,由于最终连接化学的选择,合成 PDC 可能具有挑战性。应根据 PDC 结构从各个方面审慎评估共轭反应的选择。