1 pH响应肽的设计
肽在药物化学和生物工程领域得到了广泛的研究。有21种常用的氨基酸作为肽的主要成分,我们在下面的介绍之后通篇用单字母代码来指代它们。21种典型氨基酸通过它们的侧链来区分,可以分为五类:
具有带电荷侧链的氨基酸[精氨酸(R)、组氨酸(H)、赖氨酸(K)、天冬氨酸(D)和谷氨酸(E)];
具有极性不带电荷侧链的氨基酸[丝氨酸(S)、苏氨酸(T)、天冬酰胺(N)和谷氨酰胺(Q)];
具有疏水侧链的氨基酸[丙氨酸(A)、缬氨酸(V)、异亮氨酸(I)、亮氨酸(L)、蛋氨酸(M)、苯丙氨酸(F)、酪氨酸(Y)和色氨酸(W)];
以及其他特殊情况[半胱氨酸(C)、硒半胱氨酸(U)、甘氨酸(G)和脯氨酸(P)]。
在所有氨基酸中,带有带电侧链的氨基酸在设计pH响应性肽中至关重要,因为在质子化或去质子化时疏水性/亲水性会发生变化。然而,氨基酸的单一pKa值通常不足以预测形态变化可能发生的pH值。例如,在紧密相邻处掺入不同数量的带相同电荷的氨基酸会影响它们的pKa值。Williams等人在一系列短肽中证明了这种影响,这些短肽中带负电荷的D残基的数量不断增加,其中整体pKa随着D残基数量的增加而降低。在更复杂的体系中,如果多个氨基酸具有相同类型的电荷,但pKa值不同,则根据亨德森-哈塞尔巴尔赫方程估算,整体pKa值也会有所不同。此外,对于同时含有碱性和酸性残基的肽,其pH响应性也会受到影响。
由于细胞和组织活动异常的变化会引发周围微环境pH值的变化(图1),pH响应肽可用于设计用于特定病症和靶向治疗。因此,在本节中,我们将讨论pH响应肽的设计,重点关注:(1)氨基酸选择;(2)通过pH敏感键连接可裂解的功能基团。
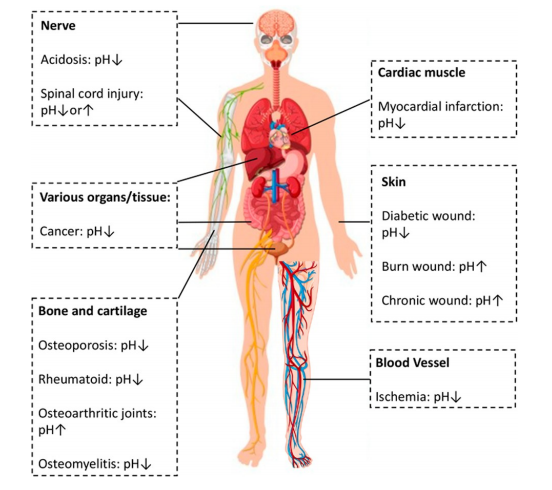
图 1. 常见疾病和功能紊乱时人体 pH 值的变化
1.1. 氨基酸对pH的响应
带电氨基酸可分为碱性氨基酸(带正电荷)和酸性氨基酸(带负电荷)。碱性氨基酸(R、H和K)常被掺入pH响应的自组装肽基体系中(图2A),酸性微环境导致侧链质子化,进一步引发结构、形态和药物释放速率的变化。例如,徐建军等人设计了一个pH响应体系,其中KKGRGDS作为亲水且酸响应的头部,VVVVVV作为疏水尾部。该两亲性肽在中性pH(pH7.0)下自组装形成胶束,但在pH5.0下,由于大部分质子化的K残基之间相互排斥的静电相互作用,胶束解体。将抗肿瘤药物阿霉素(Dox)负载于pH7.0的两亲性肽胶束中后,在pH5.0下观察到药物持续快速释放,从而抑制肿瘤生长。另一种基本氨基酸H广泛用于设计pH响应性细胞穿透肽(CPP),CPP已用于各种用于肿瘤靶向的pH依赖性肽。H残基上的咪唑侧链的pKa接近6,使其电荷状态在生理相关pH值下发生变化。例如,Lei等人最近设计了一种pH响应的自组装木质素-H纳米颗粒,其中负载了药物10-羟基喜树碱(HCPT)。30-40纳米纳米粒子是穿过细胞膜的理想尺寸,并且在肿瘤微环境的酸性条件下,咪唑基团发生质子化后,纳米粒子分解,释放出药物(图3)这两个例子凸显了如何通过合理使用碱性氨基酸将pH响应性融入基于肽的药物输送系统中,用于癌症治疗。
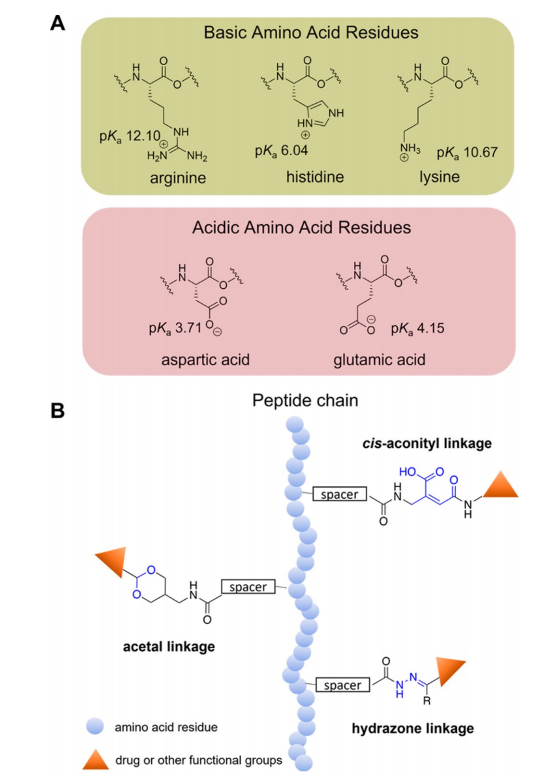
图2.(A)带电侧链氨基酸残基的化学结构和pKa值(25°C下)。(B)常见pH敏感键的结构。
除了碱性氨基酸外,酸性氨基酸也是pH响应性自组装材料设计中的常用材料。此外,酸性氨基酸与碱性氨基酸常组合用于电荷转换体系的设计。例如,Kim及其同事利用结构为聚(乙烯亚胺)(PEI)–Kn–Em(PKE聚合物)的ABC三嵌段共聚物进行基因传递。作为一种pH响应性电荷转换聚合物,Em嵌段有助于缓冲弱酸性内体pH值。因此,他们设计并合成了具有不同数量E残基(7、9或13个单元)的PKE,以研究它们的自组装和缓冲能力。结果表明,与单纯的PEI相比,PK5E9自组装成纳米颗粒并提高了肿瘤环境中的转染效率。体外和转染实验表明,由于pH响应性电荷转换,这些PK5E9多聚复合物有效地逃离了内体,并且在pH6.0下使细胞摄取量提高了1.5-2.5倍,转染效率比pH7.4下提高了50倍,突出了如何利用pH响应性来设计基因递送系统。
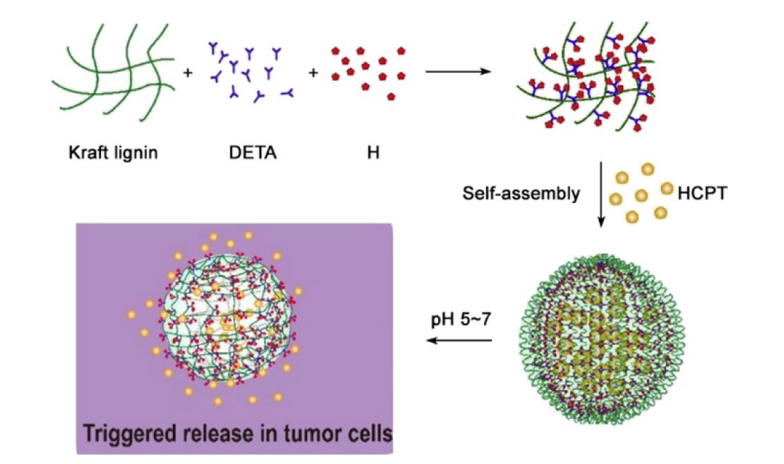
图3.自组装构建AL-His/HCPT纳米粒子示意图。DETA:二乙三胺;H:组氨酸;HCPT:10-羟基喜树碱。
1.2. 功能团对pH的响应
除了通过精心选择氨基酸来调节pH响应性之外,引入具有pH可裂解键的功能基团也能提供额外的设计空间。这些键在正常生理pH下稳定,但在酸性或碱性条件下会发生裂解或结构变化。这种方法最近已广泛应用于pH响应性自组装肽基生物材料领域,因为当pH值发生变化时,非功能性分子会变得具有功能性,从而提供一种特异性的“智能”靶向治疗方案。各种pH不稳定键,例如腙、顺式-乌头酯,二甲基马来酰胺,和缩醛(图2B)常用于pH响应体系。例如,Balci和Top设计了一种pH响应性药物递送系统,将mPEG-肽与Dox通过酸可裂解的腙键偶联,以评估其在常温及酸性条件下的药物释放。偶联肽AT1包含pH响应性的H6结构域。他们比较了通过腙直接与Dox偶联的mPEG(mPEG-HYD-Dox)和通过腙连接的mPEG-肽偶联物(mPEG-AT1-Dox)的药物释放和细胞活力。结果表明,mPEG-AT1-Dox在pH5.0下72小时释放的Dox量约为mPEG-HYD-Dox的3倍,且细胞毒性高于mPEG-HYD-Dox。本例表明,pH响应性的腙键虽然有助于触发药物释放,但可以通过在递送系统设计中加入其他pH响应性的肽来增强其效果。
最近,Weil及其同事将pH敏感的硼酸-水杨酰羟肟酸(SHA)基团融入一种新型肽复合物中,旨在在细胞内进行多阶段转化。该设计包括一个可穿透细胞的TAT肽,该肽与修饰的缩酚酸肽结合,由于其对酸敏感的SHA基团,缩酚酸肽在酸性环境下易水解。随后,产生的硼酸头基被癌细胞内的过氧化氢裂解,导致随后的O→N酰基转移,进一步形成肽,这些肽在A549细胞内共组装成纤维网络(图4)。癌细胞内酸性微环境诱导的新型多阶段转化为精准编程细胞死亡提供了平台。此外,这项研究还提出了该方法的未来发展方向,重点是将其他具有pH响应性和对代谢物特异性响应的功能基团整合到自组装纳米结构中,从而实现定制化医疗。
图4. (A) 肽在细胞内共组装的总体示意图。在最后一步中形成了可见的纤维网络,并通过透射电子显微镜(TEM,比例尺500纳米)观察到。(B) 细胞内发生的化学反应示意图。
2. 响应机制
在pH响应性肽中,肽侧链的电离状态通常决定了片段的亲水性或疏水性,从而决定了体系的化学和/或形态响应。但重要的是要考虑到肽侧链并非一次性全部电离。假设肽侧链官能团的酸碱性彼此独立,则可以根据亨德森-哈塞尔巴尔赫方程估算总体pKa。在这种情况下,当足够多的侧链官能团电离或去离子时,可能会发生自组装形态变化,这取决于不仅pH响应片段的两亲性,而且整个肽的两亲性。当具有可电离侧链的氨基酸具有相互依赖的pKa时,预测形态变化可能发生在什么pH值下变得更加困难值,即当它们在一级序列中彼此接近时。然而,在药物递送和组织工程中的大多数pH响应肽应用中,当pH发生变化时肽的电荷会减少,从而导致自组装。当pH发生变化时,肽的电荷也会增加,导致自组装形态的扩展或完全解体。最后,pH变化还会引起多个自组装纳米结构之间的形态转换。在这三种响应机制(自组装、扩展/解体和形态转换)中,pH触发的自组装机制最为直接─肽最初是分子溶解的,然后pH变化导致电离状态和亲水/疏水平衡发生变化,诱导自组装成纳米结构。扩展/解体和形态转换机制可能更复杂。通常,基于肽的pH响应系统在最低带电状态下自组装成纳米结构。随着环境pH值的变化,基于肽的pH响应系统中的某些片段可能会获得正电荷或负电荷,从而变得更加亲水。这种转变会因电荷排斥而导致膨胀,并最终导致分解成分子溶解的组分。或者,肽可以设计为自组装,但其片段会在pH值变化时失去电荷,从而变得更加疏水;这些系统通常会经历形态转换响应机制。无论pH响应肽经历的是分解还是形态转换,如果电离状态是唯一的变化,那么这些pH响应系统可以表现出可逆的转换行为,尽管可能存在较大的滞后现象。但是,如果形态转换是由化学变化(例如键断裂)触发的,则该转换通常是不可逆的。考虑到在药物输送和组织工程中的大多数应用中不需要可逆性,我们在此重点关注这三种类型的切换机制,而不讨论它们的(潜在)可逆性。
2.1 pH 触发的自组装
在pH触发的自组装机制中,肽分子通常会在侧链上带有部分电荷的情况下发生溶解。pH值的变化会触发质子化或去质子化,从而减少肽链上正负电荷的总量,进而降低肽链间的静电排斥力。最终,氢键、芳香环堆积和其他分子间相互作用促成自组装。例如,张教授及其同事最近报道了一个肽序列KRRFFRRK,它经历了pH触发的自组装机制。在pH 7.4下,该肽保持单聚状态或形成小的、形状不规则的聚集体,其中K和R残基大部分质子化。当pH升高至9.4时,K和R残基部分去质子化,在静电排斥力降低和疏水相互作用增强的驱动下,诱导自组装成纳米纤维。另一个例子是由Montenegro、Granja及其同事报道的,他们设计了一种环状肽(CP1),在加入碱(图5A)。该环肽的关键成分是两个H残基和一个K残基。当溶于酸性水介质中时,CP1上带正电荷的H和K侧链由于阳离子静电排斥作用而阻止了聚集。将水介质中和至pH值> 8后,H侧链发生去质子化,从而引发CP1自组装成肽纳米管(图5B). 进一步添加碱导致更多H和K侧链去质子化,诱导自组装成分级纳米管网络,最终形成由H残基氢键稳定的大纤维。
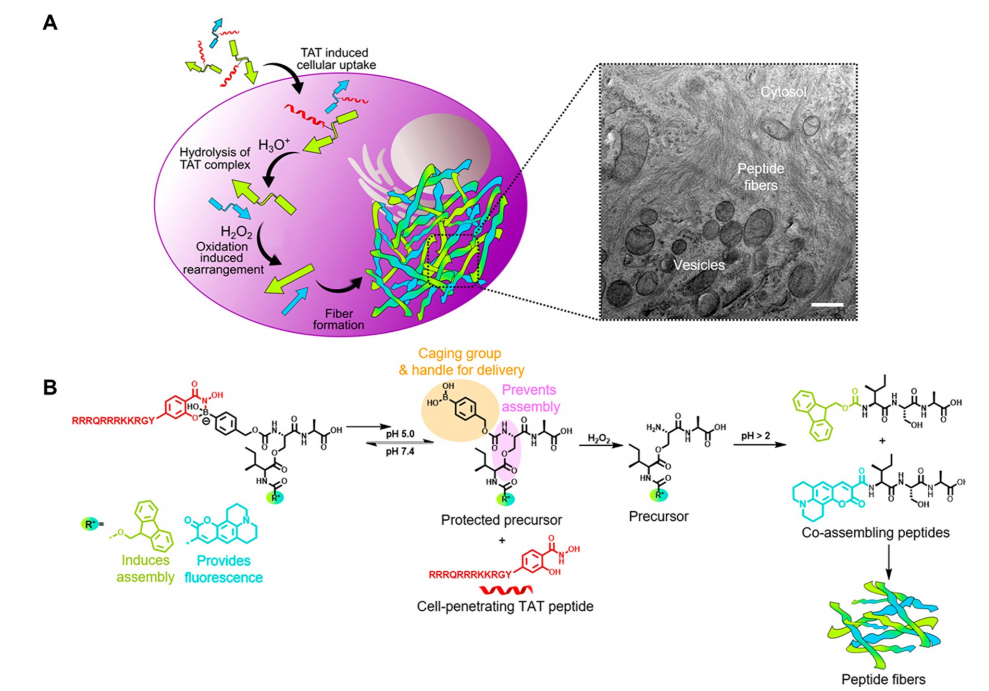
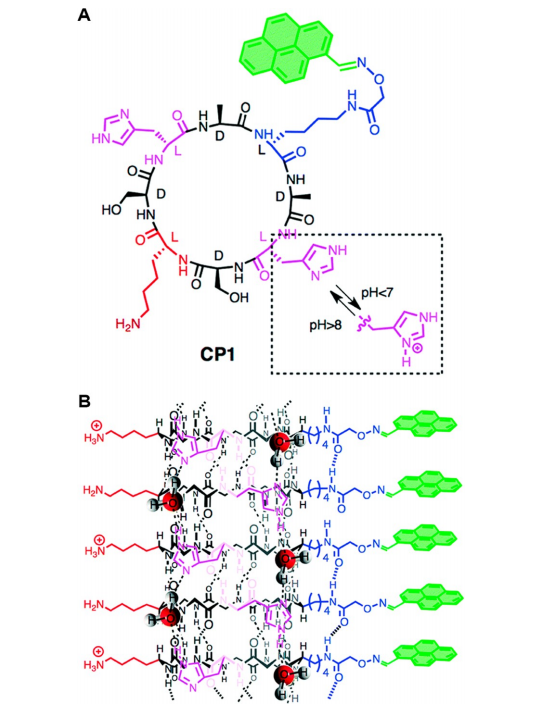
图5. (A) CP1环肽的结构。B) CP1自组装成单个肽纳米管。
2.2 pH 引发的膨胀和分解
随着 pH 值的变化,自组装肽形态可以膨胀(膨胀)或分解(图6A)。在这些情况下,随着pH值的变化,由于质子化或去质子化,电荷总量会增加,从而增强分子间的排斥相互作用,导致膨胀和解体。Kim及其同事报道了一系列可形成胶束的pH响应性合成共聚物,其由聚合度(DP)为55的聚(N-异丙基丙烯酰胺)嵌段和不同聚合度(n =50、75、100、125)的H n嵌段组成。在酸性pH下, Hn嵌段发生质子化,静电斥力增强,导致胶束结构膨胀。不同共聚物的动态光散射数据显示,在pH值6.5至10的范围内,溶液中的胶束尺寸保持不变。然而,当溶液pH值降至5.6时,胶束尺寸急剧增大。随着溶液pH值持续降低至pH 2,观察到更大的胶束。无论H n嵌段尺寸如何,胶束尺寸随pH值的降低以相似的速率增长,这归因于随着pH值的降低,质子化的H残基的百分比水平相似。
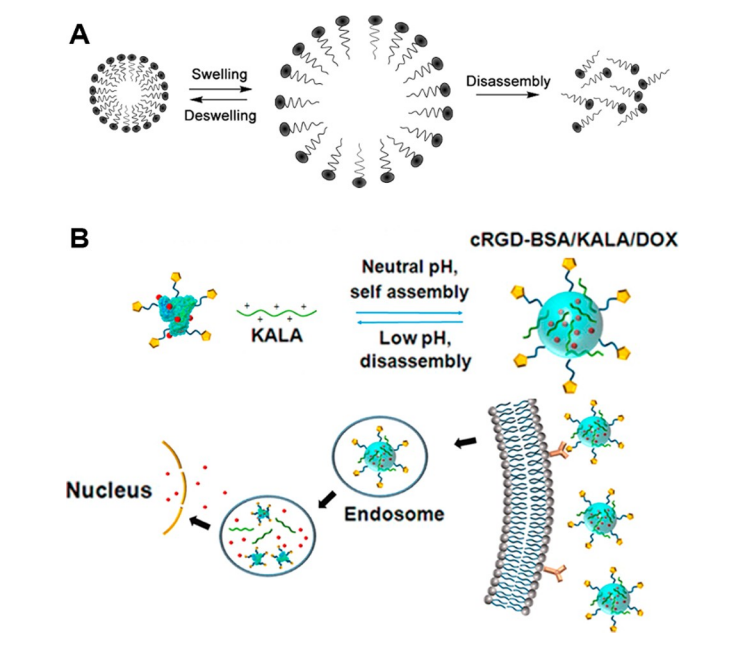
图6.(A)pH变化引发的纳米粒子扩张和解体响应机制示意图。(B)cRGD-BSA/KALA/Dox纳米粒子的自组装/解体行为以及Dox向癌细胞核的药物递送途径。
自组装肽已被设计成能够在不同的pH值下,通过电离或pH敏感键断裂,一步或多步分解。Cheng等人设计了一个电离诱导分解的例子。他们报道了一种双层纳米颗粒药物递送系统,其中带正电荷的KALA肽自组装形成外层,环状Arg-Gly-Asp(cRGD)肽与带负电荷的牛血清白蛋白(BSA)结合并负载Dox形成小纳米颗粒核作为核心(图6B). 随着pH值的降低,BSA和KALA之间的静电相互作用减弱,导致纳米颗粒外层膨胀和解体。此外,随着cRGD-BSA核心中更多基团在低pH值下质子化,它们与带正电荷的阿霉素分子的相互作用减弱,导致核心解体并释放阿霉素。Kataoka等人设计的聚乙二醇-嵌段-聚天冬氨酸-腙-阿霉素嵌段共聚物(PEG-PAHD)就是一个由pH值触发、键断裂诱导解体的例子。该嵌段共聚物形成球形核壳结构,直径约为65纳米。PEG-PAHD共聚物在生理pH值下稳定,而在pH 4-6时由于腙键断裂和疏水性Dox单元释放而迅速分解。
2.3 pH引发的形态转变
两种或多种不同的自组装形貌之间的转变可能是另一种响应机制。近年来,科学家在合成纳米材料方面取得了许多进展,这些纳米材料的形貌可随pH值的变化而变化,从而导致材料性能的变化。例如,Zhang等人合成了三种柔性肽[P1:(硬脂酰-GRGDG)2KG;P2:(Fmoc-GRGDG)2KG;和P3:(乙酰基-GRGDG)2KG],它们在不同的pH值下自组装成各种形貌,包括纳米纤维、纳米球和层状结构。RGD序列作为亲水骨架引入,也是最简单的肽段之一,既有碱性残基,也有酸性残基,能够响应pH的变化。P1在pH3.0时聚集形成纳米纤维,在pH6.0时自组装形成纳米球,当pH值进一步升高至10.0时,进一步转变为层状结构(图7A).P2在pH3.0时自组装成缠绕网络结构,随着pH值的升高,逐渐转变为纳米球、层状结构和囊泡。与P1和P2相比,P3上缺乏较大的疏水基团,导致该特定肽无法形成清晰的纳米结构。
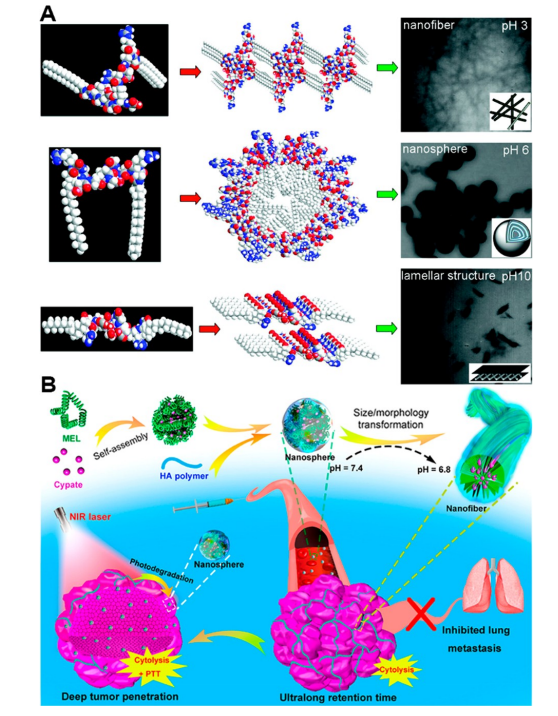
图7.(A)P1肽在不同pH值下的自组装示意图及TEM图像。(B)MEL/Cypate@HA复合物的制备示意图,以及其在弱酸性肿瘤微环境和近红外激光照射下持续的尺寸/形态转变。
Wu等人报告了一个近期的案例,重点关注了形态学的转变。在这项研究中,作者利用溶细胞肽蜂毒肽(MEL)、近红外吸收分子环磷酰胺(cypate)和透明质酸(HA)的组合,制备了一种肿瘤酸响应纳米剂。MEL/Cypate@HA结构在物理上自组装成纳米球,并在pH降低的情况下进一步转变为纳米纤维,然后在NIR处理下变回纳米球(图7B).这些例子凸显了pH响应性如何超越组装/拆卸,实现自组装纳米结构的复杂变化,这一特性在未来可广泛应用于生物医学应用。
参考文献:doi.org/10.1021/acsabm.2c00188