革兰氏阴性菌(包括大肠杆菌)中抗菌素耐药性的上升对公共健康构成了重大威胁。本研究旨在通过设计具有增强靶向性和抗菌效力的杂交肽来解决现有抗菌肽的局限性。通过噬菌体展示筛选确定了八种七肽序列,并将其与对革兰氏阴性菌表现出较弱抗菌活性的WP(WKKIWKPGIKKWIK)肽进行杂交。对杂交肽的抗菌活性、特异性和生物相容性进行了系统评估。
杂交肽SWP表现出卓越的抗菌活性,尤其是对大肠杆菌K88(TI=2.378),并且显示出与细菌关键酶胸苷酸激酶(TMK)的特异性结合。在小鼠腹膜炎模型中的体内研究证实,SWP能够降低细菌载量,减轻组织损伤,同时保持出色的生物相容性。这些发现表明SWP是开发针对革兰氏阴性病原体的具有增强特异性和稳定性的靶向抗菌剂的有希望的候选者。
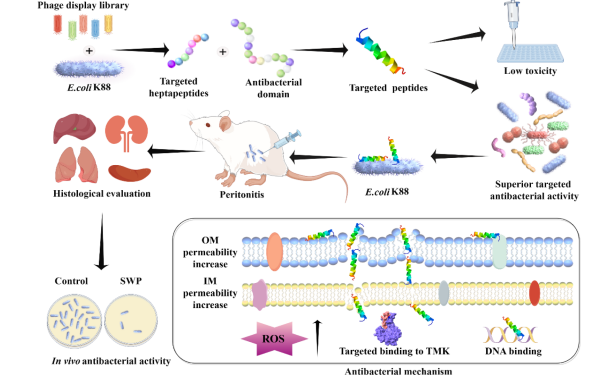
针对大肠杆菌感染开发的靶向抗菌肽 SWP 的设计、筛选和评估过程示意图
胸苷酸激酶(TMK)是抗菌治疗的一个极具吸引力的靶点。TMK在细菌DNA合成和复制中起着至关重要的作用,是细菌生存的关键酶。抑制TMK会破坏细菌的生长和复制,为对抗耐药菌株提供了一种强有力的策略。迄今为止,TMK主要在针对病毒和革兰氏阳性菌的研究中被作为靶点。然而,设计出对细菌胸苷激酶(TMK)具有高特异性且不会对宿主细胞或革兰氏阳性菌产生不良影响的抗菌剂仍是一项重大挑战。
为解决上述难题,本研究利用噬菌体展示技术筛选出对大肠杆菌K88具有高亲和力的七肽。随后将这些七肽与抗菌肽WP进行杂交,生成一系列杂交肽。WP来源于合成肽Ac-WKKIWKDPGIKKWIK-NH2。对这些杂交肽的抗菌效果进行了系统评估,评估对象包括8种革兰氏阴性菌和8种革兰氏阳性菌,重点考察其对大肠杆菌K88的靶向指数(TI)。此外,还对其溶血活性和细胞毒性进行了评估。利用生物层干涉技术(BLI)分析了大肠杆菌K88蛋白与SWP的相互作用,并使用AlphaFold3预测了SWP目标结构域SGNLTKY的特异性结合伙伴。为验证结合特异性,还测试了胸苷激酶(TMK)与SWP和WP的相互作用。此外,还对SWP的稳定性、耐药性发展、二级结构和抗菌机制进行了全面评估。最后,在小鼠腹膜炎模型中的体内研究证实了SWP的安全性和治疗效果(方案1)。本研究为开发高效特异的抗菌剂提供了一个有前景的框架。
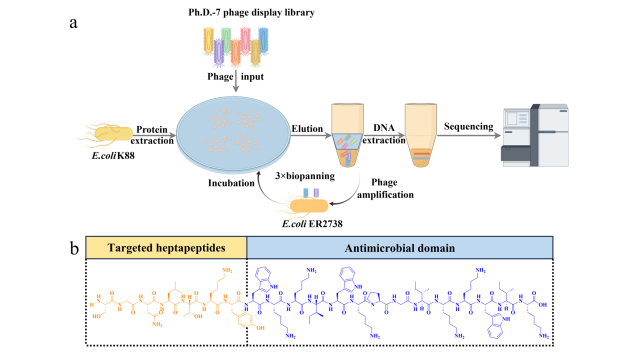
图 1. 利用噬菌体展示技术设计靶向肽。 (a) 噬菌体展示技术概述。 (b) 靶向肽的化学结构。
基于这些发现,文章选择WP(WKKIWKPGIKKWIK)作为抗菌结构域来构建杂交肽(图S2b)。之所以选择WP,是因为其类似物此前已被证明对革兰氏阴性菌具有较弱的抗菌活性。然而,WP类似物中存在D型氨基酸,这在生产过程中是一个重大障碍。尽管D型氨基酸抗蛋白水解,但在用于大规模肽合成的基因工程细菌系统中,这一问题尤为突出。由于用天然氨基酸替代D型PG角对整体肽活性影响极小,文章采取了这一方法来简化生产过程,同时不损害肽的生物活性。
为了进一步增强WP对大肠杆菌K88的特异性,文章将鉴定出的七肽序列与WP杂交,生成了具有双重功能的新型杂交抗菌肽:靶向结合和抗菌活性(图1b和S3)。这种杂交方法利用了七肽对大肠杆菌K88的强结合能力,同时增强了WP的抗菌效力。通过MALDI-TOFMS成功合成了这些杂交肽,观察到的分子量与预测值相符,验证了肽形成的准确性。通过RP-HPLC验证了纯度,所有合成的肽纯度均超过95%,确保了其适用于后续的生物学实验。
为了更好地理解所设计的抗菌肽的构效关系,文章分析了它们的关键理化性质,总结在表1中。疏水性和净电荷是影响肽与带负电荷的细菌膜相互作用的关键决定因素。在杂交肽的N端区域进行的修饰改变了它们的两亲性、疏水性和抗菌潜力,与基础肽WP相比。值得注意的是,SWP、RWP和CWP具有更高的净电荷和良好的疏水性平衡,使其成为进一步开发的有前景的候选物。这些修改预计会提高细菌的特异性并降低细胞毒性。
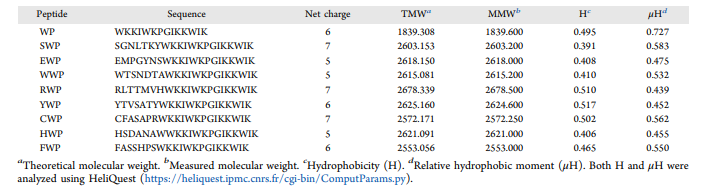
表 1. 设计肽的氨基酸序列及主要理化参数
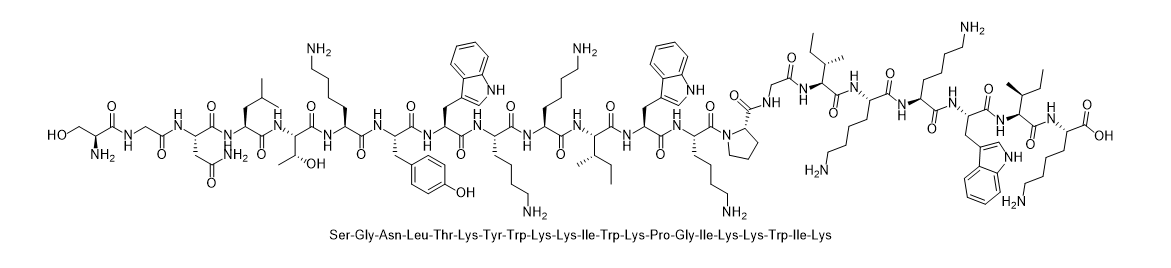
单字母 H2N-SGNLTKYWKKIWKPGIKKWIK-OH
多字母 H2N-Ser-Gly-Asn-Leu-Thr-Lys-Tyr-Trp-Lys-Lys-Ile-Trp-Lys-Pro-Gly-Ile-Lys-Lys-Trp-Ile-Lys-OH
氨基酸个数 21
分子式 C128H200N32O26
平均分子量(MW) 2603.16
在本研究中,文章通过噬菌体展示技术成功鉴定了八种针对大肠杆菌K88的高亲和力七肽。文章将这八种肽与窄谱肽WP结合,构建了八种杂交抗菌肽。其中,SWP表现出强大的抗菌活性,尤其是对大肠杆菌K88(最小抑菌浓度=2微摩尔),具有高度特异性(治疗指数=2.378),出色的生物相容性,并通过多种机制增强了抗菌效果,包括破坏膜完整性。值得注意的是,SWP与TMK之间存在强烈的相互作用,这种相互作用由SWP中SGNLTKY七肽序列内的一个苏氨酸残基与TMK第49位的谷氨酰胺残基之间的一个氢键介导。这种相互作用进一步增强了SWP的抗菌效力,为其对革兰氏阴性菌的广谱活性提供了机制基础。体内研究表明,SWP显著降低了小鼠腹膜炎模型中的细菌载量和炎症。总之,SWP的抗菌活性、特异性、稳定性以及良好的安全性特征凸显了其作为治疗革兰氏阴性菌感染的新型药物的潜力,这在应对日益严重的抗菌素耐药性问题、满足对抗新抗生素的迫切需求方面具有重要意义。
参考文献:doi.org/10.1021/acs.jmedchem.4c02666