现代多肽的合成基础
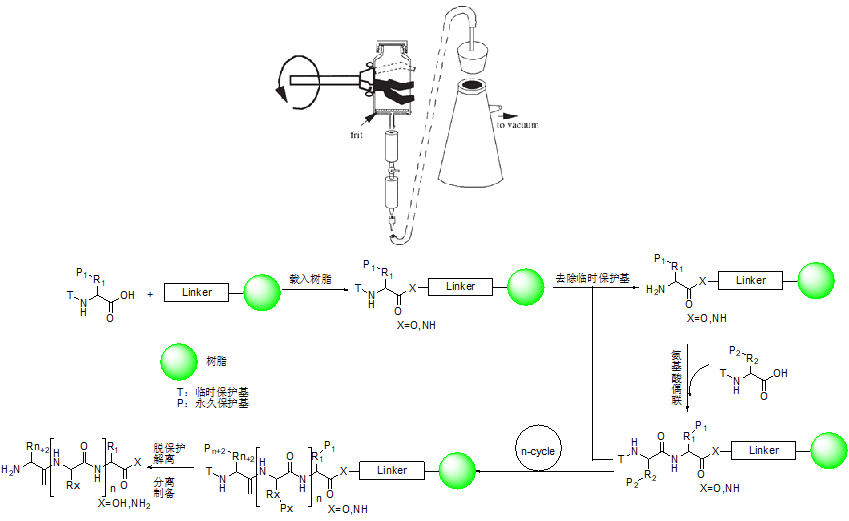
“肽合成”技术涵盖从基础的小分子肽至大分子蛋白质等多种物质的合成,Bruce Merrifield 的开创性地引入了固相肽合成(SPPS),彻底改变了多肽合成的策略,简化了传统液相法合成多肽(LPPS)中繁琐且要求很高的纯化步骤。
SPPS 的基本原理
多肽合成涉及大量的重复步骤,使用固定载体具有显著优势。在这样的体系中,高浓度的过量试剂可以驱动偶联反应的进行而使反应完全,而多余的反应试剂和副产物仅需通过过滤和洗涤,即可与不溶性增长肽链分离(树脂)。所有的操作均在同一个溶剂中完成,无需转移物料。
固相合成中 Fmoc/t-Bu 策略
固相合成主要采用两种保护基策略:Boc/Bzl 和 Fmoc/t-Bu。前者需要较强的酸性条件下进行脱除,如 TFA,主要用于侧链的保护;强酸条件下往往会破坏敏感的氨基酸序列,因此对于氨基酸的保护,通常采用 Fmoc/t-Bu,其中 Fmoc 对碱敏感,t-Bu 对弱酸敏感。Fmoc 包含基的固相合成方法已成为常规多肽的合成的首选方法。
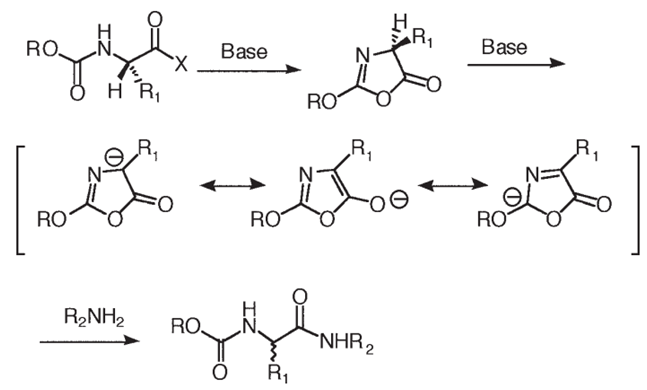
图:多肽恶唑烷酮异构化消旋
固相载体
固相载体可由“基质聚合物”和“连接分子”共同表征,树脂一词常被误用代替整个系统。在固相化学中,基质聚合物与液相环境同等重要。目前市售的树脂多大上百种,其中部分产品搭载了相同的连接分子,因此在合成时,必须谨慎选择最合适的连接分子。
交联聚苯乙烯(PS)基树脂是常规用于 SPPS 的常用固相载体,粒径分布在 200~400 目(直径约 50μm),载量为 0.50.8 mmol/g 的树脂微球在 DMF 和 DCM 中表现出良好的溶胀性能,能促进反应物向聚合物基质内扩散,并确保埋藏在微球中的链接位点可被充分接触。
对于较长肽链(超过 25 个 AA)或合成难度较高的序列,需选用更低载量的 0.1~0.2 mmol/g 的树脂。
交联聚酰胺(PA)基树脂和聚苯乙烯-聚乙二醇(PS-PEG)复合树脂是亲水性更强的固相载体,其微观和宏观物理性质不同于 PS 树脂,这些载体的载量通常较低,可用作替代 PS 用于合成复杂序列和大分子肽。
树脂在使用前为什么要处理?这类似衣服染整一样,由于棉纤维是不规则椭圆形截面,在染色前,需要对棉纤维进行溶胀,增大表面积,处理后才能通过染料进行染色。树脂是一种高分子聚合物,链比较长,存在缠绕、结构塌陷,且反应位点位于树脂内部,因此在使用前必须进行溶胀处理,且需要考虑反应的情况。
反应器的选择
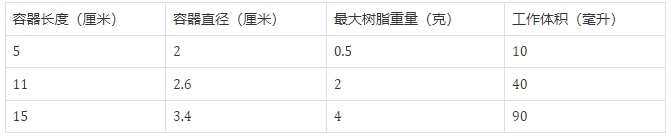
SPPS 反应容器:反应器材质一般为玻璃反应器,配备 PTFE 或玻璃砂芯注射器。反应器的大小需根据树脂用量进行选择。
SPP 反应器类型
溶剂的选择
99% 的偶联位点并非位于树脂微球表面,而是存在于树脂内部,因此携带增长肽链的树脂微球必须充分溶胀,以确保受保护的活化氨基酸能够最优地渗透值聚合物基质内部,从而提高偶联效率。
基本的溶胀程序是:在开始固相合成前,将树脂置于适当的溶剂中,如 DMF 或 DCM 溶胀 20~30 分钟。对于交联聚苯乙烯(PS)基树脂微球,DCM 具有最佳的溶胀特性,在偶联步骤中,更推荐使用 DMF 或 NMP,因溶剂对产物有较好的溶解性。
醇类和水不适用于交联聚苯乙烯(PS)基树脂,不过在后续洗涤步骤,可以使用甲醇或异丙醇对树脂微球进行收缩,挤出包裹的过量反应物。此处理后,还需使用 DCM 和 DMF 对微球进行再次溶胀。
树脂的溶胀方式:将树脂放入合适的反应器中,加入 DCM,完全浸没树脂微球,用聚四氟乙烯(PTEE)搅拌棒轻柔混匀树脂悬浮液,直径溶胀 20~30 分钟,真空抽滤除去溶剂。
在 SPPS 过程中,反应动力学主要由扩散现象决定的,因此无需剧烈搅拌反应容器。此外大多数用于多肽合成的树脂微球均比较脆弱,强力搅拌容易损伤或破碎树脂。可使用旋转蒸发仪的转子进行温和搅拌,或采用能够通过摇摆或涡旋等方式实现轻柔混合的装置。
洗涤
洗涤用于除去偶联和脱保护过程中产生的可溶性副产物及过量的反应物。基本的洗涤方式是,向反应器内注入溶剂,通过抽真空排空溶剂,必要时可用搅拌棒在洗涤溶剂中轻柔搅拌树脂。
标准洗涤及再次溶胀程序:向反应容器中加入 DMF,静置 10s 后真空抽滤除去溶剂,用 DMF 仔细洗涤反应器所有位置。真空抽滤除去溶剂,然后再次加入溶剂洗涤,反复操作 1~2 次。洗涤完成后,使用甲醇洗涤树脂,过程类似 DMF 的洗涤步骤,反复操作 1~2 次。
换用 DCM 洗涤 1~2 次,再用 DMF 洗涤 1~2 次。
SPPS 的第一步是将 C 端氨基酸(N 端被保护)残基,通过通过酯键或酰胺键锚定在固相载体上,具体取决于合成的目标肽的 C 端是羧酸还是酰胺基团。目前大多数连接分子都已商业化,并预先锚定在不同的基质上,包括聚苯乙烯(PS)、聚酰胺(PA)和聚苯乙烯-聚乙二醇(PS-PEG)复合基质。
羧酸端肽段形成酯键,酰胺段肽形成酰胺键,这些预载连接分子可简化实验准备,并确保批次一致性。不同的基质具有不同的特性,PS 基质疏水性强,适合常规肽段合成;PS-PEG 基质亲水性好,有利于长肽的合成;而聚酰胺(PA)则适用于特殊应用场景。
在 C 端肽酰胺的合成中,常用以下树脂。这些树脂与首个氨基酸的结合与 Fmoc 合成策略基本一致,且这类树脂在 TFA 的作用下,留下酰胺键完成切割(树脂类似保护基)。这类树脂由于裸露氨基,因此通常会采用 Fmoc 进行保护,使用前先进行脱保护。需要注意的是,对于 C 端空间位阻较大的氨基酸与树脂结合时,反应可能转化不完全,可能需要二次偶联步骤。
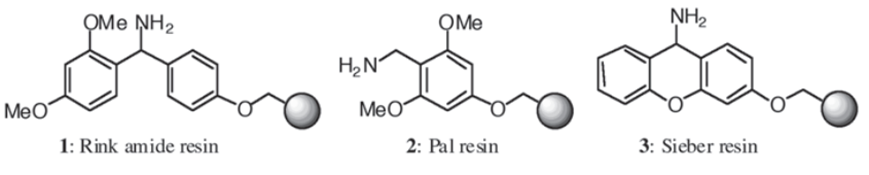 肽酸
肽酸
相比氨基的亲核性,羟基的亲核性较弱,因此将氨基以酯基的形式锚定在在固相载体上的挑战性比较大。建议直接采购已装载 C 端授课氨基酸保护的树脂,以避免出现的差向异构化、二肽以及取代度的问题。
采用 Fmoc/tBu 策略合成 C 端肽酸时,锚定反应必须在无水条件下进行,含水的氨基酸需要提前干燥。
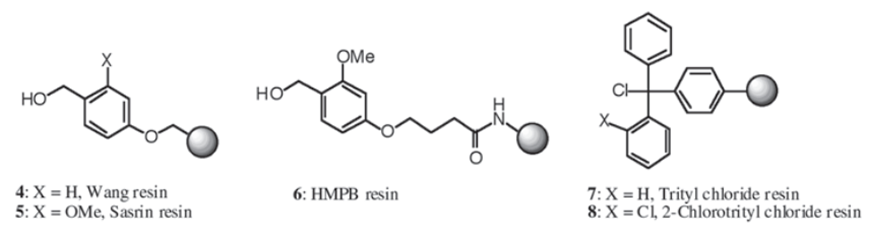
羟基树脂
羟基树脂中,位阻较小的 Wang 树脂更容易形成酯键,常用的方法为堆成酸酐法。若锚定困难,可通过新鲜的反应物重复酯化步骤,如济南算衍生物可能需要三次酯化才能达到理想的效果。在锚定完成后,建议用苯甲酸酐或乙酸酐对树脂上未反应的羟基进行封端处理。
羟基树脂的标准化操作程序:首先将树脂放入反应器中,用合适的溶剂进行溶胀;同时将目标 Fmoc 保护的氨基酸(10.0 eq.)在 0℃ 下溶于 DCM,加入 DIC(5.0 eq.)等活化 10 分钟,必要时加入 DMF 助溶。将活化液转移至树脂后,加入 DMAP/DMF 催化反应,搅拌 1 小时,一次用 DMF、DCM 洗涤;真空干燥 18 小时候检测载量(Fmoc 释放法),若低于 70% 需要重复酯化步骤。
达标后使用苯甲酸酐/乙酸酐(5 当量)和吡啶 1 当量的 DMF 封闭残余羟基 30 分钟,最后经洗涤和 Fmoc 脱保护,即可开始肽链延伸。
该流程通过低温活化、严格当量控制和载量验证,确保连接效率,关键步骤包括活化检测、催化增强和羟基封端等避免副产物发生。
这类树脂具有高度的酸性不稳定性,其连接基团的空间位阻可显著抑制二酮哌嗪(DKP)的形成,特别推荐用于 C 端为脯氨酸(Pro)或甘氨酸(Gly)的肽段的合成。这类树脂能在极温和的酸性条件下实现切割,保护肽段和树脂。市售的通常以氯化三苯基树脂或三苯甲醇前体形式提供。
三苯基树脂的典型程序:去 1g 三苯基树脂(载量 1.0~2.0 mmom 氯化物/g)置于 SPPS 反应器中,先溶胀,加入 3 当量的 Fmoc 氨基酸和 7.5 当量的 DIPEA,在无水 DCM 下室温搅拌 30~60 分钟;依次用 DMF 洗涤树脂 2~3 次,加入 DCM/MeOH/DIPEA 混合液 10 ml 封闭残余氯基团,反应 15 分钟后过程。最后用 DMF、DCM 各洗涤三次,真空干燥后通过 Fmoc 释放法测定载量。
通过该流程,精确控制氨基酸和 DIPEA 的比例,及甲醇淬灭,确保单一位点连接。注意的是,在无水条件下保持三苯甲基氯的活性。