与传统化疗相比,特异性靶向肿瘤相关巨噬细胞(TAMs)而非广泛靶向所有巨噬细胞,具有提升治疗效力并减少治疗相关副作用的潜力。目前已有多种TAM特异性肽正在研究中。本文整理了有明确文献出处的十种巨噬细胞靶向肽及其具体靶点功能,以期给与相关研究提供支持。
1、M2pep
Cieslewicz 等人通过使用噬菌体肽展示文库 PhD C7 和 PhD12 鉴定出一种名为 M2pep 的肽,该肽能够在体外和体内特异性结合小鼠肿瘤相关巨噬细胞(TAMs,表型为 CD45+F4/80+CD301+)。M2pep 成功将促凋亡肽递送至 CT-26 结肠癌小鼠模型中的 TAMs,从而有效减少 TAM 数量并显著提高小鼠的生存率。目前,M2pep 已成为巨噬细胞靶向治疗领域中研究活跃的一种靶向肽,广泛用于开发多种纳米载体系统,以递送如 CSF-1/CSF-1R 抑制剂(PLX3397)、CSF-1R siRNA 以及促凋亡肽(如 KLA 肽)等治疗性分子。
单字母 H2N-YEQDPWGVKWWY-OH
多字母 H2N-Tyr-Glu-Gln-Asp-Pro-Trp-Gly-Val-Lys-Trp-Trp-Tyr-OH
氨基酸个数 12
分子式 C83H101N17O20
平均分子量(MW) 1656.79
参考文献:Doi:10.1073/pnas.1312197110
2、Cyclic M2pep(RY)
M2pep(RY)中的氨基酸取代和通过半胱氨酸进行的环化显著增强了结合亲和力和提高了血清稳定性。
文章展示了对一种 M2“抗炎”巨噬细胞结合肽(M2pep)进行环化优化,使优化后的类似物对 M2 巨噬细胞的结合亲和力显著提高,同时与 M1“促炎”巨噬细胞相比保持结合选择性。
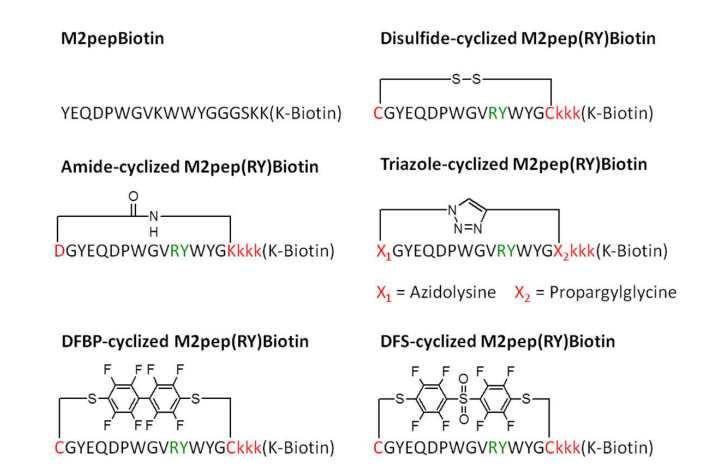
图2 M2pep 及其环状 M2pep(RY) 类似物的结构示意图。为提高亲和力在原始 M2pep 序列中引入的 RY 替代部分以绿色显示。27 用于环化及提高血清稳定性的修饰氨基酸以红色显示。
肽环化是一种用于提高肽稳定性和/或活性的策略。最常用的环化方法是含半胱氨酸肽的二硫键形成,这在自然界中很常见。多年来,已有越来越多的替代化学方法用于肽环化,这些方法在效率、动力学、正交性和稳定性方面都有所改进。然而,人们较少关注通过不同环化策略在连接位点引入的多种化学实体来微调肽活性的机会。在此,文章展示了对一种 M2“抗炎”巨噬细胞结合肽(M2pep)进行环化优化,使优化后的类似物对 M2 巨噬细胞的结合亲和力显著提高,同时与 M1“促炎”巨噬细胞相比保持结合选择性。在本研究中,文章报告了四种采用不同环化策略的环状 M2pep(RY) 类似物的合成和评估;1)天冬氨酸-[酰胺]-赖氨酸,2)叠氮基-赖氨酸-[三唑(铜(I)催化炔烃-叠氮环加成(CuAAC))]-炔丙基-甘氨酸,3)半胱氨酸-[十氟联苯(DFBP)]-半胱氨酸,以及 4)半胱氨酸-[十氟联苯砜(DFS)]-半胱氨酸,其中方括号内的化学实体/连接体位于连接位点,位于参与环化的残基之间。这些肽与文章先前报道的二硫键环化的 M2pep(RY) 进行了比较,该二硫键环化的 M2pep(RY) 是原始线性 M2pep 的血清稳定且亲和力增强的类似物。DFBP 环化的 M2pep(RY) 对 M2 巨噬细胞的结合活性最高,其表观解离常数(KD)约为 2.03 微摩尔,而原始二硫键环化的 M2pep(RY) 为 36.3 微摩尔,原始线性肽为 220 微摩尔。DFS 环化的 M2pep(RY) 的结合强度也高于原始环化类似物,而酰胺和三唑环化的 M2pep(RY) 类似物的结合强度较低。文章证实,单独的 DFBP 对 M2 巨噬细胞的结合活性可忽略不计,将二苯丙氨酸引入原始序列可提高结合活性,但会降低溶解度并增加毒性。总之,文章报告了采用多种环化策略开发的环化 M2pep(RY) 类似物。从而发现了环化 DFBP-M2pep(RY),其 M2 巨噬细胞结合活性得到增强。
另一项研究通过使用 3,5-二碘酪氨酸取代酪氨酸对 M2pep(RY) 进行化学修饰,获得了具有 pH 响应特性的 M2pep(RY)肽。与未修饰的 M2pep(RY) 相比,该修饰肽在体外 pH 6 条件下对 IL-4 极化(M2)巨噬细胞表现出更高的选择性,相较于 IFN-γ 和 LPS 极化(M1)巨噬细胞具有更强的识别能力。尽管已有大量研究致力于利用 M2pep 递送抗癌药物以及优化其靶向性能,但目前尚未明确 M2pep 所结合的巨噬细胞具体分子靶点。
参考文献:【1】doi: 10.1021/acs.bioconjchem.6b00502
【2】doi: 10.7150/thno.15394
3、蜂毒肽(Melittin)
蜂毒中的主要成分蜂毒肽以其溶血和细胞毒性而闻名。李等人发现,非细胞毒性剂量的蜂毒肽对CD206+(M2)肿瘤相关巨噬细胞具有选择性,而不会抑制CD86+(M1)巨噬细胞群或其他白细胞。体内研究也证实了这一发现,即接种小鼠Lewis肺癌并用蜂毒肽和促凋亡肽(KLAKLA)2治疗的小鼠,其CD206+(M2)肿瘤相关巨噬细胞肿瘤浸润减少,肿瘤生长和血管生成也低于对照组小鼠。
肿瘤相关巨噬细胞(TAM)是肿瘤基质的主要成分。已有报道表明,TAM具有M2样表型,并通过促进血管生成和免疫抑制来促进肿瘤进展。蜂毒中的主要多肽成分蜂毒肽因其对恶性细胞的细胞毒性而被广泛研究作为抗癌药物。然而,关于蜂毒肽对肿瘤微环境中免疫细胞的影响知之甚少。本研究重点关注蜂毒肽对Lewis肺癌小鼠模型中TAM的影响。与对照组相比,蜂毒肽在体内抑制了肿瘤的快速生长。蜂毒肽通过选择性减少CD206+M2样TAM的数量,同时不改变CD86+M1样TAM的数量,从而增加了TAM的M1/M2比率。蜂毒肽还优先与M2巨噬细胞结合,且这种结合与吞噬作用无关。蜂毒肽处理降低了M2样骨髓来源巨噬细胞中血管内皮生长因子(Vegf)和甘露糖受体C型1(Mrc1/CD206)的基因和蛋白表达,但Vegf的基因水平无显著变化。此外,在体外实验中,蜂毒肽还能抑制肿瘤细胞中的血管内皮生长因子(VEGF)及其受体FMS样酪氨酸激酶1(Flt1/VEGFR1)。另外,在肿瘤组织中,蜂毒肽处理显著降低了血管生成标志物VEGF和CD31的水平。这项研究揭示了蜂毒肽在肿瘤治疗中的新作用,并表明蜂毒肽可能是靶向M2样肿瘤相关巨噬细胞的一种有前景的治疗药物。
单字母 H2N-GIGAVLKVLTTGLPALISWIKRKRQQ-NH2
多字母 H2N-Gly-Ile-Gly-Ala-Val-Leu-Lys-Val-Leu-Thr-Thr-Gly-Leu-Pro-Ala-Leu-Ile-Ser-Trp-Ile-Lys-Arg-Lys-Arg-Gln-Gln-NH2
氨基酸个数 26
分子式 C131H229N39O31
平均分子量(MW) 2846.46
参考文献:doi: 10.18632/oncotarget.18627
4、UNO Peptide
文章描述了一种能选择性靶向表达MRC1的TAMs(MEMs)的肽。文章在携带4T1转移性乳腺肿瘤的小鼠体内进行了肽噬菌体展示筛选,以识别靶向腹膜巨噬细胞的肽。对所选噬菌体池中编码肽的插入片段进行深度测序,发现肽CSPGAKVRC(代号“UNO”)富集。静脉注射的FAM标记UNO(FAM-UNO)在不同癌症模型的肿瘤和前哨淋巴结MEMs中聚集:4T1和MCF-7乳腺癌、B16F10黑色素瘤、WT-GBM胶质瘤和MKN45-P胃癌。荧光各向异性测定表明,在还原条件下,FAM-UNO与重组CD206相互作用。有趣的是,GSPGAK基序存在于所有与CD206结合的胶原蛋白中。FAM-UNO能够将载药纳米颗粒运输到MEMs中,而没有该肽的颗粒则不会被MEMs摄取。在体外器官成像中,FAM-UNOUNO肽在前哨淋巴结中的积累显著高于对照肽。该研究表明,UNO肽在实体瘤中对肿瘤相关巨噬细胞的诊断成像和治疗靶向方面具有应用前景。
虽然“UNO”肽是环状的,但与CD206的结合需要肽线性,这是由TME中发现的还原条件实现的。
单字母 H2N-CSPGAKVRC-OH
多字母 H2N-Cys-Ser-Pro-Gly-Ala-Lys-Val-Arg-Cys-OH
氨基酸个数 9
分子式 C36H65N13O11S2
平均分子量(MW) 920.11
参考文献:doi: 10.1038/s41598-017-14709-x
5、RP-182 peptide
通过计算机筛选宿主防御肽,研究人员鉴定出肽RP-182。研究发现,RP-182可结合人和小鼠CD206+(M2)肿瘤相关巨噬细胞(TAMs),并诱导其发生凋亡或复极化,转化为具有促炎和抗癌功能的CD86+M1样表型。基于计算机模拟的预测结果还表明,RP-182可能与受体转谷氨酰胺酶2(TGM2)、RelB(NF-κB家族成员)、SIRPα以及CD47相互作用。
单字母 H2N-KFRKAFKRFF-OH
多字母 H2N-Lys-Phe-Arg-Lys-Ala-Phe-Lys-Arg-Phe-Phe-OH
氨基酸个数 10
分子式 C69H103N19O11
平均分子量(MW) 1374.68
参考文献:doi:10.1126/scitranslmed.aax6337
6、T4
表达单核细胞和巨噬细胞(TEMs)的酪氨酸蛋白激酶受体(Tie2)参与肿瘤血管生成并促进肿瘤侵袭性。除了TEMs外,内皮细胞上也发现了Tie2受体,通过与Ang1和Ang2相互作用,该途径在新血管的形成中起着重要作用。靶向肿瘤tie2介导的血管生成是一种潜在的治疗策略,可以阻止肿瘤获得营养和氧气。
Tie2 是一种内皮细胞特异性受体激酶,在肿瘤血管生成中具有重要作用。为了鉴定能特异性与 Tie2 相互作用并阻断 Tie2 通路的肽段,研究人员在重组 Tie2 受体上筛选了噬菌体展示肽库。其中一种肽段 NLLMAAS 完全消除了血管生成素 2 和血管生成素 1(Ang1)与 Tie2 的结合。文章进一步证明,NLLMAAS 特异性抑制了人脐静脉内皮细胞中 Ang1 诱导的 ERK 活性和迁移。此外,在体内实验中,该肽段在鸡胚绒毛尿囊膜血管生成实验中抑制了血管生成。NLLMAAS 是首个被描述与 Tie2 相互作用的肽段。文章的研究结果表明,它是一种高效且特异性的 Tie2 配体结合拮抗剂,并提示该肽段或其衍生物可能在血管生成疾病的治疗中具有潜在应用价值。它还为剖析 Tie2 相关的分子机制提供了有力工具。
在 4T1 乳腺癌细胞小鼠模型中,研究旨在探索靶向肿瘤内皮细胞和肿瘤相关巨噬细胞(TAMs)的 T4 肽在预防乳腺癌复发中的作用。为此,构建了一种双响应性(pH 敏感和酶可切割)纳米制剂(mPEG1000-K(DEAP)-AAN-NLLMAAS),以保护 T4 肽免受蛋白酶降解;该纳米载体在进入肿瘤微环境(TME)后可释放活性 T4 肽。动物实验结果显示,该 T4 纳米制剂能够有效抑制血管生成,并显著延缓肿瘤的复发与转移。此外,已有文献报道另外两种肽段 GA5(NSLSNASEFRAPY)和 T7(HHHRHSF)也可结合 Tie2 受体,但其是否能够与肿瘤内皮细胞(TEMs)结合仍有待进一步研究。
单字母 H2N-NLLMAAS-OH
多字母 H2N-Asn-Leu-Leu-Met-Ala-Ala-Ser-OH
氨基酸个数 7
分子式 C30H54N8O10S1
平均分子量(MW) 718.86
参考文献:doi: 10.1038/sj.embor.7400100
7、IL4RPep-1
肿瘤与M2极化的肿瘤相关巨噬细胞(TAMs)之间的细胞间通讯有利于肿瘤进展。在多种肿瘤和TAMs中观察到白细胞介素4受体(IL4R)的上调。文章测试了一种针对IL4R的促凋亡肽是否能抑制肿瘤进展。IL4R结合肽(IL4RPep-1)在体外和体内4T1乳腺肿瘤中均优先与表达IL4R的肿瘤细胞和M2极化的巨噬细胞结合。为了选择性地杀死表达IL4R的细胞,文章在IL4RPep-1的末端添加了促凋亡肽(KLAKLAK)2,设计出了IL4R靶向促凋亡肽IL4RPep-1-K。IL4RPep-1-K对多种表达IL4R的肿瘤细胞和M2极化的巨噬细胞表现出选择性细胞毒性。全身性给予IL4RPep-1-K可抑制4T1乳腺肿瘤荷瘤小鼠的肿瘤生长和转移。有趣的是,IL4RPep-1-K治疗增加了活化的细胞毒性CD8+T细胞的数量,同时减少了免疫抑制性调节性T细胞和M2极化的TAMs的数量。未观察到明显的全身性副作用。这些结果表明,针对白介素4受体的促凋亡肽在治疗多种表达白介素4受体的癌症方面具有潜力。
单字母 H2N-CRKRLDRNC-OH
多字母 H2N-Cys-Arg-Lys-Arg-Leu-Asp-Arg-Asn-Cys-OH
氨基酸个数 9
分子式 C44H82N20O13S2
平均分子量(MW) 1163.38
参考文献:doi: 10.1158/1535-7163.MCT-17-0339
8、Pep-20 peptide
Wang 等人发现 Pep-20 肽(AWSATWSNYWRH)可通过与 CD47 结合,阻断 CD47/SIRPα 信号通路。一项体外研究表明,Pep-20 能够增强巨噬细胞对多种小鼠和人类癌细胞系的吞噬能力,并促进巨噬细胞介导的抗肿瘤 CD8+ T 细胞的分化。在 CT26 肿瘤小鼠模型中也观察到了 Pep-20 的抗肿瘤活性,结果显示,Pep-20 治疗组小鼠的肿瘤生长受到显著抑制,总体生存率明显提高。
单字母 H2N-AWSATWSNYWRH-NH2
多字母 H2N-Ala-Trp-Ser-Ala-Thr-Trp-Ser-Asn-Tyr-Trp-Arg-His-NH2
氨基酸个数 12
分子式 C74H94N22O17
平均分子量(MW) 1563.68
参考文献:doi: 10.1136/jitc-2020-000905
9、Pep-20-D12
通过将某些L-氨基酸残基替换为D-氨基酸残基来修饰Pep-20,试图使肽在蛋白水解方面更加稳定,称为Pep-20-d12。这些修饰不仅改善了血清稳定性,而且提高了肽对MC38肿瘤的体内抗肿瘤活性。
单字母 H2N-awsATWSNYwrh-NH2
多字母 H2N-DAla-DTrp-DSer-Ala-Thr-Trp-Ser-Asn-Tyr-DTrp-DArg-DHis-NH2
氨基酸个数 12
分子式 C74H94N22O17
平均分子量(MW) 1563.68
参考文献:doi: 10.1136/jitc-2020-000905
10、CRV
文章之前鉴定出一种巨噬细胞结合肽,称为CRV。在此,文章表明,当全身给药于荷瘤小鼠时,CRV会选择性地迁移到肿瘤中,渗出血管,并优先与肿瘤内的巨噬细胞结合。CRV对肿瘤巨噬细胞的亲和力高于肿瘤中的其他细胞或体内其他部位的巨噬细胞类型。文章进一步鉴定并验证了维甲酸X受体β(RXRB)为CRV的受体。有趣的是,尽管它是一种核受体,但RXRB在细胞表面有显著定位,且主要局限于肿瘤巨噬细胞。全身给药抗RXRB抗体也会导致肿瘤特异性选择性结合巨噬细胞,类似于CRV。最后,文章证明了CRV能够改善纳米级货物载体向实体瘤及瘤内巨噬细胞的递送。
单字母 H2N-CRVLRSGSC-OH(Disulfide Bridge:C1-C9)
多字母 H2N-Cys-Arg-Val-Leu-Arg-Ser-Gly-Ser-Cys-OH(Disulfide Bridge:Cys1-Cys9)
氨基酸个数 9
分子式 C37H67N15O12S2
平均分子量(MW) 978.15
参考文献:doi: 10.1016/j.jconrel.2019.03.009
TAM 靶向肽在癌症治疗中展现出令人鼓舞的应用前景,其可通过特异性地将治疗性有效成分递送至肿瘤部位,从而增强治疗效果。尽管仍需进一步研究以全面评估其安全性与疗效,但已有临床前研究表明,TAM 靶向肽制剂在某些方面可能优于传统治疗手段。其优势在于能够实现肿瘤微环境的“归一化”调控,并在少数肽序列中同时具备特异性靶向能力和内在治疗活性。这些肽既可作为单一治疗剂使用,也可与所携带的治疗货物协同发挥作用,提升整体治疗效能。