细胞穿透肽(CPPs)是一类短小、无毒且具有阳离子和/或两亲性特征的肽,能够穿过细胞膜。CPPs用于递送多种货物,如蛋白质、寡核苷酸和治疗分子。本研究旨在基于Szeto-Schiller肽(SS-31)合成针对线粒体的新型超小型CPPs,以影响线粒体内的过程并提高生物效应。所用的所有肽均采用9-芴甲氧羰基化学法手工合成。在研究的第一部分,使用HeLa705、U87和bEnd.3细胞作为体外递送模型。将细胞在37°C和5%CO2条件下与不同浓度的肽孵育24小时。通过细胞增殖测定评估细胞活力。评估了诸如线粒体膜电位和抗氧化活性等生物效应。H2O2作为阳性对照。使用与5(6)-羧基荧光素(FAM)偶联的肽进行摄取研究。采用荧光显微镜确定肽在细胞内的存在和定位。从预处理过的细胞中分离出的线粒体以及分离后处理的线粒体被用于确认肽的靶向能力。单独的FAM摄取被用作阴性对照。显微镜研究证实了肽穿透细胞的能力。定位分析显示,与SS-31相比,摄取量增加了35%。线粒体细胞穿透肽1(mtCPP-1)对线粒体膜电位没有影响,并且与SS-31相比,能将bEnd.3细胞中活性氧的形成减少两倍。即使在高浓度(100μM)下也未观察到细胞毒性。这些数据表明,mtCPP-1是一种线粒体细胞穿透肽,并且由于其自身的抗氧化活性,能够保护线粒体免受氧化损伤。
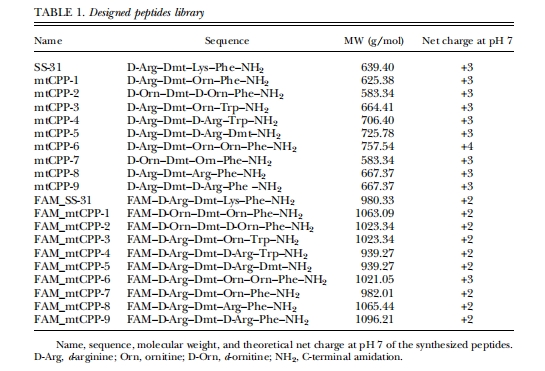
采用先前描述的固相合成方案合成了一个新的系列靶向线粒体的短肽。正电荷和亲脂性是设计这些肽的两个主要特性。这两个特性已知对于穿过质膜和线粒体膜都非常重要。mtCPP-1是一种四肽,其序列设计旨在至少具备3个已知对靶向线粒体很重要的特性:正电荷、亲脂性和交替出现的芳香族残基和碱性氨基酸。线粒体基质中的质子向内膜空间释放会在线粒体内膜中产生负电位(2150/2180毫伏)。这种负电位可作为吸引点,利用亲脂性阳离子将氧化还原剂递送至线粒体基质。亲脂性是实现肽选择性靶向线粒体以及允许肽通过脂质双层的重要条件。赵及其同事提出,交替出现芳香族残基和阳离子残基有可能获得有效的线粒体递送基序。因此,文章合成了含有阳离子和疏水性残基的肽,这些肽能够通过带电的质膜和线粒体膜提供静电驱动力以促进摄取,同时保持亲脂性以利于穿过线粒体膜。合成了含4个或5个残基的肽,并分别用和不用FAM进行标记(表1)。
所设计肽的合成基于:
在序列的第二位引入Dmt残基以增强抗氧化活性。酪氨酸上的甲基能够轻易地接触、反应并稳定自由基,从而防止其与其他分子发生反应。
选用了L-精氨酸、D-精氨酸、L-鸟氨酸和D-鸟氨酸(o)以提供正电荷;在第一个或第三个位置使用D型氨基酸,以尽量减少氨基肽酶的降解并提高在血清中的稳定性。
苯丙氨酸和色氨酸残基被用于赋予亲脂性。
C末端酰胺化可防止水解。
先前关于基于精氨酸的肽的研究表明,通过引入阳离子残基可以实现较高的细胞摄取水平。当质子化时,碱性氨基酸有助于通过质子梯度驱动的电荷摄取穿过质膜,质膜具有电位梯度,这会导致阳离子物质从细胞外空间向细胞内进行电泳。原则上,序列中的阳离子残基应允许肽通过线粒体膜的双层膜,因为线粒体膜的界面是带电的。然而,将细胞穿透肽(CPP)与脂溶性阳离子(一种小分子线粒体定位剂)结合,并未促进其进入线粒体,这一观察结果被视作此类肽无法穿透线粒体内膜的证据。由于整体脂溶性已被证明是小分子实现选择性线粒体定位的重要因素,因此预计在肽序列中也必须引入高度的脂溶性,以使其能够穿过脂质双层膜。
名称:mtCPP-1
参考文献:doi.org/10.1096/fj.14-269225