众所周知, 细胞膜的基本骨架是由磷脂、胆固醇、糖脂构成的可流动脂质双分子层, 蛋白质呈不对称性镶嵌分布在脂双层中, 细胞膜的表面还有丰富的聚糖链. 如此丰富的体系带来了许多可操作的空间: 膜上存在着广泛的反应性官能团, 包括胺、硫醇和羰基, 为外源分子的共价修饰提供了巨大的机会; 磷脂双分子层的结构允许外源型分子通过疏水作用插入细胞膜上, 或者通过静电相互作用沉积在细胞表面; 特定构象的蛋白和多肽形成的受体和配体也赋予了外源型物质特异结合的能力. 目前, 细胞膜修饰策略主要有化学共价交联、疏水插膜修饰、静电吸附沉积、受体配体结合、基因工程、代谢糖工程等.
1 静电吸附沉积
在生理条件下, 细胞膜表面往往带负电荷, Zeta电位为19~32 mV, 这是由于细胞膜成分中富含一些能够提供净负电荷的基团, 如膜磷脂(磷脂酰丝氨酸)的带负电头部基团、膜糖胺聚糖中的唾液酸等. 在相对高浓度的带正电基质中培养时, 细胞膜表面会吸附带正电基质, 膜表面电荷中和甚至反转, 在离心和洗涤后产生稳定的纳米涂层, 并允许这层新的带正电的分子层吸引负电荷基质来形成第二层分子层. 通过在聚阳离子和聚阴离子溶液中连续培养, 表面电荷不断交替, 形成了纳米涂层的层层自组装(layer-by-layer assembly, LbL)沉积, 其组成、层数和厚度可以根据需要来调整. 此外, 还可以在纳米层的最外层引入各种功能基团以达到功能修饰的目标. 常用的聚电解质有聚赖氨酸(poly-L-lysine, PLL)、聚乙烯亚胺(polyethyleneimine, PEI)和聚二甲基二烯丙基氯化铵(poly dimethyl diallyl ammonium chloride, PDDA)等. 通过静电逐层自组装在细胞表面沉积聚电解质和矿物质是细胞纳米封装最广泛使用的方法之一. 例如, Zhi等人将胰岛素瘤MIN6β细胞自聚集形成假胰岛样细胞团, 然后在带阳离子的壳聚糖和带阴离子的海藻酸盐溶液中交替自组装形成多层纳米膜, 最后在最外层沉积磷酰胆碱(phosphorylcholine, PC)修饰的硫酸化糖胺聚糖以增加生物相容性. 这种包封方法不会损伤细胞结构, 能够有效排斥免疫抗体大分子, 并且允许被包封细胞释放胰岛素而不受影响. Yang等人将带有弱正电荷的A型明胶(gelatin-A, GL-A)与乙二胺偶联制备了阳离子明胶, 与带有负电荷的B型阴离子明胶(gelatin-B, GL-B)通过静电自组装在细胞表面形成了GL-A/GL-B双层纳米膜, 然后在最外层引入GL-B-4臂-PEG-硫醇(polyethylene glycol, PEG), 通过巯基马来酰亚胺点击反应与8臂-PEG-马来酰亚胺交联. 这种方法能够实现包封细胞的长期保存, 有效防止外部实体渗透和抵抗高物理应力, 还可以通过使用谷胱甘肽还原丁二酰亚胺-硫醚键, 脱下PEG外壳, 使明胶纳米层逐渐降解, 实现纳米壳的按需降解.
2 疏水插膜修饰
组成细胞膜的磷脂分子是两亲性的, 它们以疏水性尾部相对, 极性头部朝向水相, 形成磷脂双分子层. 利用疏水相互作用, 一些亲脂分子或两亲性分子如磷脂、胆固醇、烷基链可以很容易地插入到细胞膜内, 将外源性功能基团(荧光分子、抗体、核酸适体、酶、糖链、纳米颗粒等)与疏水端相连, 就可以在细胞膜上实现各种功能性修饰, 具有低毒、锚定迅速、适用范围广等优点. 其不足之处在于插入目标的稳定性较差, 可能被细胞内吞或者从膜上脱落. Ma等人设计了一种两亲性嵌合抗原受体(chimeric antigen receptor, CAR)配体分子: 疏水性的双烷基链与亲水性的PEG以及功能配体分子组成三组分体系. 该分子能够通过疏水作用搭载白蛋白进入淋巴结, 随后插入到淋巴结常驻抗原呈递细胞的膜上, 与天然的细胞因子共刺激分子一起作用于CAR-T细胞, 从而在天然的淋巴结微环境中促进T细胞的活化和扩增. 在多种免疫活性小鼠肿瘤模型中, 两亲性配体增强触发了大量CAR-T细胞扩增, 增加了供体细胞的多功能性, 增强了抗肿瘤效果. 这里展示了两亲性配体的双重性质: 淋巴结靶向性和膜插入修饰(图1).
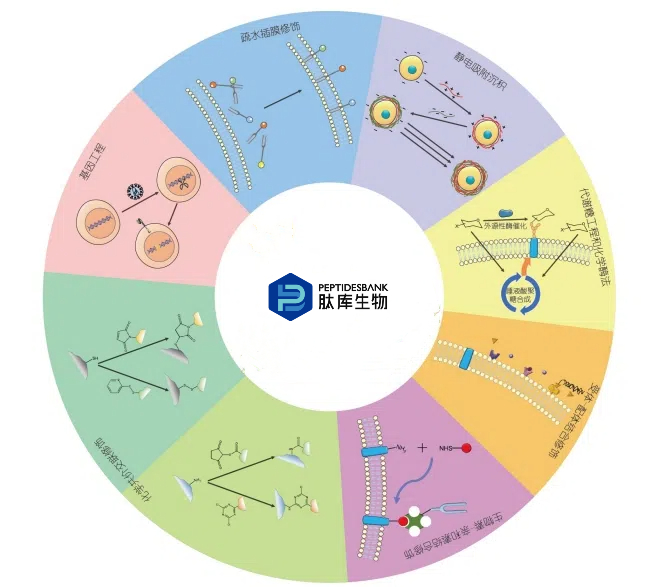
3 化学共价交联修饰
将外源型物质经过化学共价交联的方式与细胞膜上固有的官能团相连也是一种重要的细胞表面工程策略. 相对于物理相互作用, 共价修饰可提供更稳定和持久的结合能力; 与基因工程相比, 其是一种简单直接的细胞膜工程解决方案. 其缺点是一般缺乏特异性, 可能会影响细胞的形态和功能并诱导细胞凋亡. 细胞表面是一个非均质性和动态的环境, 呈现出可用于大分子共轭的不同官能团, 其中最常见的官能团是氨基. 氨基主要存在于赖氨酸残基中, 可以与三聚氯氰基团或者N-羟基琥珀酰亚胺酯(N-hydroxy succinimide, NHS)反应, 从而与外源性的大分子连接. 例如, Lou等人开发了一种含肝素的PEG纳米膜来包裹胰岛, 将肝素与NHS偶联后再与八臂PEG-NH2共价连接形成PEG纳米膜, 再通过NHS与胰岛表面膜的氨基共价结合. 该涂层对培养的胰岛体积影响最小, 不影响胰岛的活力和分泌功能, 减弱了血液介导的炎症反应, 同时促进胰岛在促炎环境下存活. 此外, 巯基也是一个常用于共价修饰的官能团, 主要存在于半胱氨酸的残基中. 巯基最常见的反应是与马来酰亚胺基反应生成硫醚键. 例如, Li等人用温和还原剂三(2-羧乙基)膦(Tris(2-carboxyethyl)phosphine, TCEP)将膜蛋白的二硫化物还原为活性硫醇, 使细胞膜上暴露出更多的巯基反应位点. 然后通过巯基-马来酰亚胺结合引入DNA桥复合物模板银纳米簇(DNA bridge complex-templated silver nanoclusters, DNA bridge-AgNCs)进行信号标记, 通过追踪标记的AgNCs的电化学响应, 可以反映靶细胞的定性和定量信息.
4 基因工程
用编码新蛋白的基因转染细胞是一种直接的细胞表面工程策略, 也可以通过基因敲除的方式消除细胞膜表面特定分子的表达来达到操控细胞行为的目的. 相对于其他几种膜表面修饰策略, 经过基因工程修饰的细胞膜是最为稳定持久的. 其不足之处在于基因转染的复杂性、效率问题及临床安全问题. 在真核细胞中, 可以通过将编码感兴趣的蛋白质表位的基因附加到编码适当的先导序列和跨膜结构域的基因上来完成. 例如, Rieder等人在早期首先利用这种技术在真核细胞表面表达由病毒结合抗体和膜相关分子ICAM-1组成的融合蛋白. 该表位作为一种新的细胞表面受体, 赋予宿主细胞选择性感染口蹄疫病毒的能力. 近年来不断发展的CAR-T细胞过继疗法也是一种典型的利用基因操纵来修饰细胞表面的策略. 来自患者血液的T细胞在体外被工程化, 以表达针对特定肿瘤抗原的人工受体. 利用基因转染使T细胞膜表面表达类似T细胞抗原受体(T cell receptor, TCR)的分子, 即嵌合抗原受体, 能够特异性地识别肿瘤相关抗原如CD19, 经体外扩增后回输到患者体内, 达到靶向杀伤CD19高表达肿瘤细胞的目的. 随着基因编辑技术的不断发展和对CAR分子的不断完善, 近年来CAR分子的结构也不断发展. CAR分子由胞外结构域、跨膜结构域和胞内结构域组成. 胞外结构域由抗体重链可变区和轻链可变区连接而成的单链抗体(single chain antibody fragment, scFv)组成; 胞内结构域由可介导TCR活化信号转导的CD3ζ结构域组成, 并含有1个或2个共刺激结构域如CD28, 4-1BB, CD27等, 可增强细胞的增殖、持久性和有效性. 在这基础之上, 也有将编码免疫调节的细胞因子如白介素12的基因融合到CAR-T细胞之上的第四代CAR. 表达CAR的T细胞的优势在于可以特异性识别抗原分子, 不涉及MHC限制性, 胞内域连接有共刺激分子, 介导T细胞的活化, 促进T细胞的增殖和细胞因子的释放, 能够在宿主体内长期存活并不断发挥作用. 目前, 越来越多的CAR构建方案涌现, 如双特异性CAR、串联CAR、抑制性CAR、通用型CAR、CRISPR编辑CAR等, 为肿瘤患者提供了进一步治疗的希望, 有着广阔的发展空间.
5 代谢糖工程和化学酶法
在细胞膜表面引入非天然的化学反应基团能够达到选择性修饰细胞膜的目的, 是对细胞膜直接共价修饰的极大补充. 利用基因工程可以引入肽和蛋白质表位, 而低聚糖表位的引入则依赖于代谢糖工程和化学酶法. 细胞表面有丰富多样的聚糖链, 唾液酸通常位于聚糖链的最末端, 是代谢糖工程的理想位点. 参与唾液酸聚糖生物合成的酶对于底物具有混杂性, 无法准确区分一些经过细微化学修饰的非天然唾液酸类似物. 利用这种特性, 可以将外源性的功能基团通过糖代谢途径引入细胞表面唾液酸, 该技术被称为代谢低聚糖工程, 并常常与生物正交标记方法联合使用. 生物正交化学报告基团是一种生物惰性的小官能团, 通过代谢糖工程表达在聚糖链末端后, 可以在生物系统中与互补官能团发生选择性反应, 具有高效率和低细胞毒性的特点, 使各种功能(如成像探针和亲和标签的安装)成为可能. 此外, 还可以通过靶向运输非天然糖, 实现对特定细胞的选择性糖代谢工程修饰. 例如, Xie等人利用包封在配体靶向脂质体中的叠氮多糖开发了一种细胞特异性代谢聚糖标记策略. 配体设计用于结合表达特定受体的靶细胞, 介导叠氮多糖的细胞内递送. 靶向递送的叠氮多糖代谢并入细胞表面聚糖链, 然后通过生物正交反应成像.
除了通过代谢糖工程的方法标记细胞表面聚糖外, 还可以利用外源性的糖基转移酶, 将带有功能基团的非天然糖标记到细胞表面的糖链上, 这就是化学酶法标记. 化学酶法可以结合生物正交反应实现多种功能分子的修饰; 也有可能直接引入大分子功能基团. 例如, Li等人发现一种岩藻糖基转移酶具有很强的底物兼容性, 能够将与IgG抗体相连的底物GDP-岩藻糖转移到细胞膜表面的糖链上. 这种方法不需要基因修饰、速度快、生物相容性好、对细胞内源性功能干扰小, 应用这种方法构建的抗体-细胞结合物表现出特异性肿瘤细胞靶向性和更强的杀伤能力.
6 其他非共价连接修饰策略
除了以上几种细胞表面修饰策略, 还有一些常见的非共价连接作用被应用于细胞表面工程. 常见的有生物素-亲合素系统、受体-配体作用、抗原-抗体作用等. 生物素是一种水溶性B族维生素, 与四聚体蛋白亲和素紧密结合, 是目前已知的强度最高的非共价作用, 以生物素和亲合素为末端的连接体被设计用于提供多种可用于功能化的小分子、聚合物或蛋白质. 生物素活化后可与细胞膜上的生物大分子偶联, 随后亲合素偶联物便能引入到细胞膜上.
受体-配体相互作用被广泛用于外源型大分子材料的靶向递送. 例如, 肿瘤细胞上高表达的叶酸受体、转铁蛋白受体、表皮生长因子受体等. 受体靶向递送的分子可能被细胞摄取而内化, 也有可能停留在细胞表面, 这取决于外源性分子的结构性质.
抗原-抗体作用通过抗体分子对特定抗原的特异性亲合力, 可以将抗体-材料复合物定向迁移至靶细胞. 例如, Sakai等人使用抗人CD326抗体结合辣根过氧化物酶(horseradish peroxidase, HRP), 可以将HRP选择性地结合到人肝癌细胞系HepG2细胞膜上, 在HepG2细胞和10T1/2细胞的混合物中选择性地将HepG2细胞包裹在海藻酸钠基水凝胶鞘中; 也可以通过与细胞上的靶点特异性结合来阻断细胞信号通路, 干扰信号转导途径, 调节参与癌细胞增殖的原癌基因, 如临床上广泛使用的曲妥珠单抗(抗ERBB2, 赫赛汀)、贝伐单抗(抗VEGF, 阿瓦斯丁), 在这种情况下, 活性分子同时起着靶向配体和药物的作用; 还可以介导免疫细胞与肿瘤细胞的结合, 如2014年获美国食品药品监督管理局(Food and Drug Administration, FDA)批准上市的博纳吐, 是一种针对CD19/CD3的双特异性抗体, 两条抗原结合臂分别与T细胞上的CD3分子和肿瘤细胞的CD19分子特异性结合, 激活T细胞定向杀伤肿瘤细胞.
参考文献:doi/10.1360/SSV-2022-0067