线粒体靶向递送方法为研究线粒体相关疾病以及简化治疗药物开发提供了一种直接的途径。此前,我们发现了一系列两亲性肽类,它们表现出高效的细胞穿透和线粒体定位。作为继续寻找选择性线粒体转运蛋白的努力,我们设计了具有不同疏水性和净电荷的新类似物。我们观察到,总体疏水性的增加并未导致线粒体定位的增强,同时保持了较高的细胞通透性。此外,一定程度的净正电荷对于线粒体定位至关重要。总之,我们的线粒体靶向肽类化合物为生物活性分子提供了一种高度选择性和稳健的递送系统。
选择性地将蛋白质运输到线粒体是一个艰巨的挑战,因为线粒体具有双层膜结构,其内部基质带负电荷。线粒体膜的电化学梯度受到严格调控,以允许特定分子的选择性渗透。在细胞质中表达的新生蛋白质含有线粒体靶向信号(MTS),这些信号形成阳离子两亲性螺旋,能够轻易地与线粒体膜表面相互作用,从而促进蛋白质通过线粒体转运体的导入.虽然 MTS 有助于细胞质蛋白向线粒体的递送,但它们的序列和大小差异很大,而且细胞外物质的运输效率很低,这凸显了开发可靠且易于获取的线粒体靶向递送方法的必要性。
小分子,如三苯基膦(TPP)和二甲苯基铵基团,常被用作线粒体递送的偶联物。这些支架的阳离子和两亲性性质促进了膜渗透和线粒体特异性积累,从而不仅成功递送了小分子,还递送了包裹药物和DNA序列的囊泡。然而,鉴于这些化合物对线粒体功能的不良影响,其临床应用目前受到限制。肽和肽模拟物被认为是可行的替代品,可轻松修饰以适应各种功能基团以满足特定目的。一个显著的例子是线粒体穿透肽(MPPs),由非天然氨基酸(如环己基丙氨酸和D-精氨酸)组成(图1)。MPPs和环状MPPs已与各种荧光染料、探针和生物活性分子偶联,用于分析与线粒体相关的途径。肽类衍生物最初是作为肽的结构异构体开发的,采用寡N-取代甘氨酸骨架来模拟结构和物理化学特性,同时增强体内稳定性。据报道,模拟聚精氨酸和聚赖氨酸的肽类以及肽-肽类杂合物显示出与细胞穿透肽(CPPs)相当的活性。更重要的是,阳离子两亲性肽类能够有效地穿透细胞膜,且不会产生显著的毒性。因此,通过精心设计,在肽类主链中引入疏水性和阳离子残基可能会产生能够有效定位于线粒体的肽类衍生物。
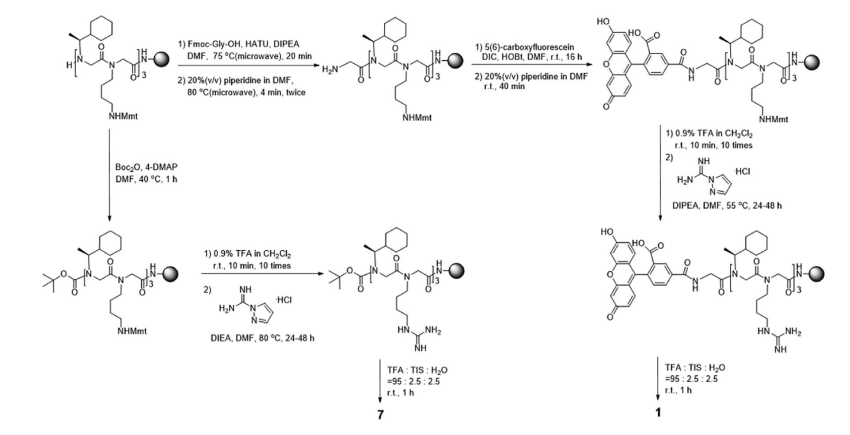
方案 1 线粒体靶向拟肽的代表性合成方案
此前,我们已成功证明,带有正净电荷的两亲性肽类不仅具有类似于聚精氨酸肽的细胞渗透性,而且还具有线粒体特异性定位能力。由一个疏水残基(Nsch)和两个阳离子残基(Nbtg 和 Nlys)组成的三个重复单元的肽类化合物对线粒体靶向最为有效(图 1)。为了继续开发用于线粒体特异性递送的分子转运体,我们进一步设计并合成了具有不同净电荷和疏水残基的肽类化合物,同时简化了重复单元,相较于我们之前的研究。通过评估细胞摄取和线粒体定位来研究我们新生成的两亲性肽类化合物的构效关系。此外,我们还研究了用每种肽类化合物处理后的细胞活力,以评估潜在的毒性。我们的综合发现提供了进一步的见解,应有助于改进两亲性肽类化合物的设计,使其成为有效的线粒体特异性递送载体。
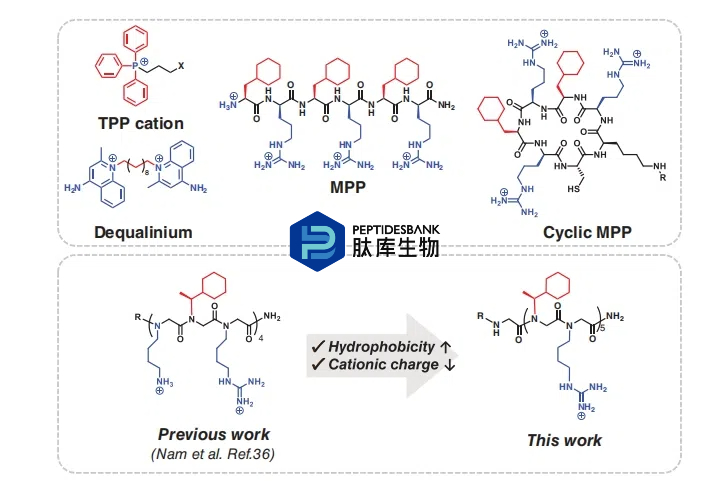
图1 线粒体靶向基团(TPP、二甲苯青、MPP 和环 MPP)和肽素的代表性结构
2 | 结果与讨论
2.1 | 阳离子两亲性肽类的设计与合成
在之前的一项研究中,我们开发了一种由三个残基重复单元组成的肽类化合物库,其中包含一个疏水侧链和两个阳离子侧链。当肽类化合物的长度为12个残基(包含4个重复单元)时,实现了最佳的细胞穿透和线粒体定位效果。我们认为疏水性和阳离子净电荷是设计线粒体特异性分子转运体时需要考虑的最重要特征。因此,在本研究中,我们设计了一系列具有简化重复单元的肽类化合物,以确定其结构-活性关系。如表1所示,我们构建了一个由交替的疏水和阳离子残基组成的肽类化合物库。对于阳离子残基,我们仅使用N-(4-丁基胍基)甘氨酸(Nbtg)来生成富含胍基的肽类化合物。胍基与细胞膜中的磷酸根阴离子形成盐桥,并且在水介质中比铵基的水合程度更低,从而降低了与细胞膜相互作用时的脱水能垒。我们预计,正如凯利及其同事所证明的那样,MPP中胍基含量的增加应能提高细胞对肽类化合物的摄取。为了使整体疏水性多样化,我们选择了三种残基:(S)-N-(1-环己基乙基)甘氨酸(Nsch)、N-(2,2-二苯基乙基)甘氨酸(Ndp)和N-(1-金刚烷甲基)甘氨酸(Nadm)。在我们团队之前的一项研究中,由手性Nsch单体组成的肽类化合物(MTP-1)形成了二级结构,其线粒体靶向效率高于由非手性N-(1-环己基甲基)甘氨酸(Nch)单体组成的无结构肽类化合物。特别是,环己基侧链是实现线粒体定位的首选。

另一种脂肪族侧链Nadm被引入,以确定空间位阻和疏水性增加如何影响细胞摄取和线粒体定位。为了与脂肪族侧链进行比较,使用了Ndp单体。在合成含Nadm的肽类化合物时,我们遇到了一个意想不到的问题。在肽素N端的Nadm上进行初始Gly连接剂偶联的过程如预期般进行(方案1),但将5(6)-羧基荧光素(CF)偶联到Gly连接的肽素时,得到的混合物中包含未知的副产物,其中包括N,N0-二异丙基脲偶联肽素(通过ESI-MS检测到)。当酰胺键的形成极其缓慢时,常常会观察到N,N0-二异丙基脲在N端胺上的封端现象。
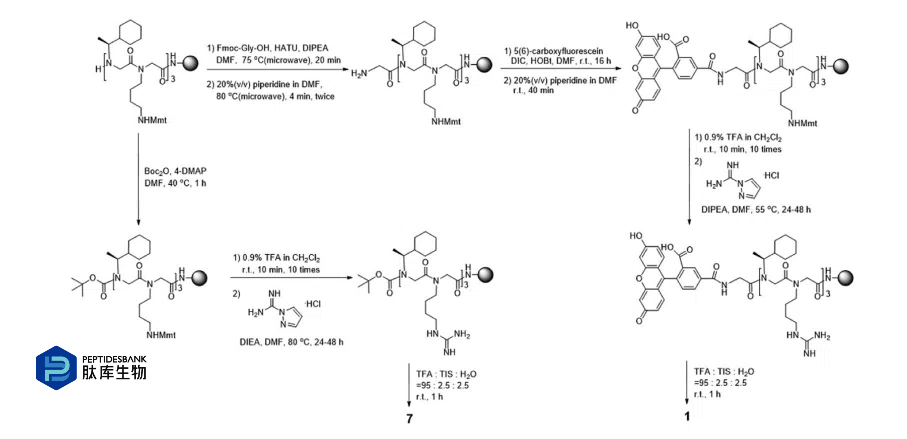
方案1 线粒体靶向拟肽的代表性合成方案
金刚烷基团的位阻效应可能会阻碍CF与Gly连接的肽素之间的共轭作用。因此,我们将疏水性(Nadm)和阳离子(Nbtg)残基的位置进行了调换,将位阻较小的Nbtg放置在N端。通过这种方式,成功合成了相应的肽素(化合物5-6和11-12)。正如预期的那样,新设计的肽素的整体疏水性显著提高(HPLC洗脱在47.7-62.2%乙腈),与先前报道的MTP-1(40.0%乙腈)相比,而每个化合物的净正电荷则有所降低(从+2到+4)。
2.2 | 细胞摄取与线粒体定位
新合成的肽类化合物的细胞摄取情况最初是通过流式细胞术测定的。我们分别用每种化合物处理了三种不同的细胞系,包括HeLa细胞、MRC-5细胞和SK-N-SH细胞,并与CF和MTP-1并行处理以作对比,同时测量了平均荧光强度。我们认为所使用的每个细胞系都具有独特的细胞生理特性,因为它们分别源自不同的原代细胞。
为了确定每种肽类化合物在细胞内的线粒体定位情况,我们使用共聚焦激光扫描显微镜进行了活细胞成像实验。
为评估肽类化合物的细胞毒性,我们使用MRC-5和HeLa细胞进行了MTS检测。
3 | 结论
在本研究中,我们设计了一系列两亲性肽类化合物,并对其细胞摄取和线粒体定位特性进行了评估。与先前报道的MTP-1相比,我们评估了增加疏水性和降低阳离子电荷的影响。我们观察到细胞通透性总体上有所增强,但对线粒体定位产生了不利影响。在化合物1-6中,化合物2展现出最高效的线粒体定位,其r值最高(.45-.71)。所有六聚体(1、3和5)的r值均低于十聚体(2、4和6),这可能归因于细胞内化程度较低。除了物理化学性质外,构象方面也应予以考虑。化合物2含有手性残基(Nsch),可能形成有序结构,而其他化合物则含有非手性残基(Ndp或Nadm),且无序。2的有序构象可能为其与细胞和线粒体膜的相互作用提供了更好的熵优势。
有趣的是,用化合物2和6处理的HeLa细胞的正交投影和三维重建图像显示细胞内分布存在显著差异。化合物2在细胞内各组分中分布均匀,而化合物6则与细胞膜相关联。这一发现与基于Nadm的肽类化合物(11和12)相对较高的细胞毒性相关。极性极低且空间位阻较大的金刚烷基团可能会促进其在膜表面聚集,并阻碍肽类化合物向细胞质扩散,从而导致细胞膜同时受损。因此,有必要进一步开展机制研究,以阐明化合物11和12在细胞膜中的作用模式。
我们的构效关系分析提供了以下信息:(a)增加疏水性和降低 CTLR 可增强整体细胞内化,同时提高细胞毒性;(b)引入手性环己基侧链有利于线粒体定位,这可能是由于其具有最佳的疏水性和构象预组织。使用诸如金刚烷之类的庞大疏水侧链时应谨慎考虑,因为这种极疏水且庞大的侧链可能会在细胞膜界面发生聚集,并导致严重的细胞毒性。
参考文献:DOI: 10.1002/pep2.24239
免责声明:本文为行业交流学习,版权归原作者所有,如有侵权,可联系删除