由于多种原因,外泌体作为下一代药物递送载体在科学研究中备受关注。与合成纳米颗粒相比,外泌体在临床前研究中显示出较低的毒性和免疫原性。这些发现表明,外泌体作为药物递送载体时,引发不良反应或免疫反应的风险可能较低。外泌体源自细胞,由脂质双层构成,类似于细胞膜。这种组成增强了外泌体的生物相容性和稳定性,使其能够保护货物分子免受体内降解和恶劣条件的影响,例如酶降解和低 pH 环境。多位研究人员报告称,外泌体在血液中循环后能够到达目标器官。外泌体甚至可以通过穿透血脑屏障(BBB)递送药物。因此,人们已尝试负载各种治疗材料以及天然负载物质,从而提高这些材料的治疗效果。
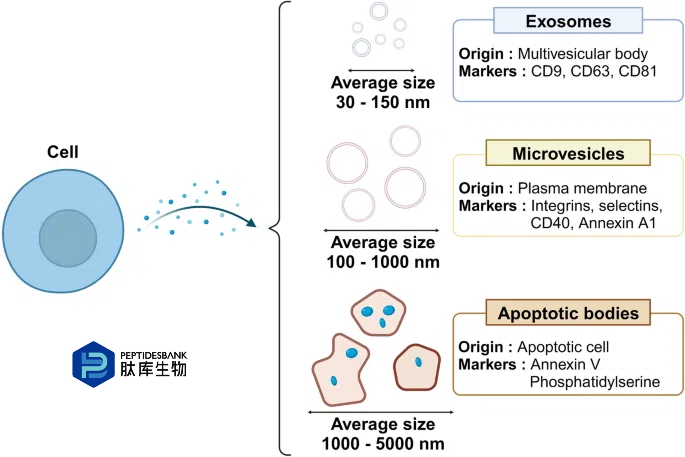
图1 细胞外囊泡的分类
许多正在进行的研究都致力于优化外泌体的货物装载,以充分发挥其作为药物递送载体的潜力。人们开发出了多种方法将治疗剂(如小分子药物和遗传物质)装载到外泌体中。将药物装载到外泌体中的主要方法有两种:被动装载(图 4)和主动装载(图 5)。方法的选择取决于特定药物及其特性,以及期望的释放机制。被动装载是指将感兴趣的药物与细胞一起培养,细胞在形成外泌体的过程中自然将药物纳入其中。细胞摄取药物,将其包装到外泌体中,然后将载药外泌体释放到培养基中。这种方法简单易行,但装载效率低,且难以控制外泌体中装载的药物量。被动装载通常最适合脂溶性药物,这类药物容易穿过细胞和囊泡膜。然而,这种方法可能并不适用于所有类型的药物。另一种方法是主动装载,即将药物直接装载到分离的外泌体中。这一过程通常通过多种增加外泌体膜通透性的技术来实现,例如超声处理、热休克、电穿孔、与去污剂共孵育或使用皂苷。主动加载比被动加载具有更高的加载效率,并且能够更精确地控制药物加载量。然而,这种方法可能复杂且耗时,如果操作不当,还存在损伤外泌体的风险。在两种方法中,加载后通过各种纯化技术(如超速离心、尺寸排阻色谱或超滤)去除未加载的药物至关重要。基因工程也可用于将遗传物质加载到外泌体中。细胞可通过基因工程表达感兴趣的蛋白质或 RNA,然后在形成外泌体时将其纳入其中。这种方法可用于将特定的蛋白质或 RNA 分子加载到外泌体中,但需要复杂的分子生物学技术,并且可能并不适用于所有类型的治疗剂。这些方法各有优缺点,最佳方法可能取决于药物类型、外泌体来源以及预期的药物递送目标等因素。
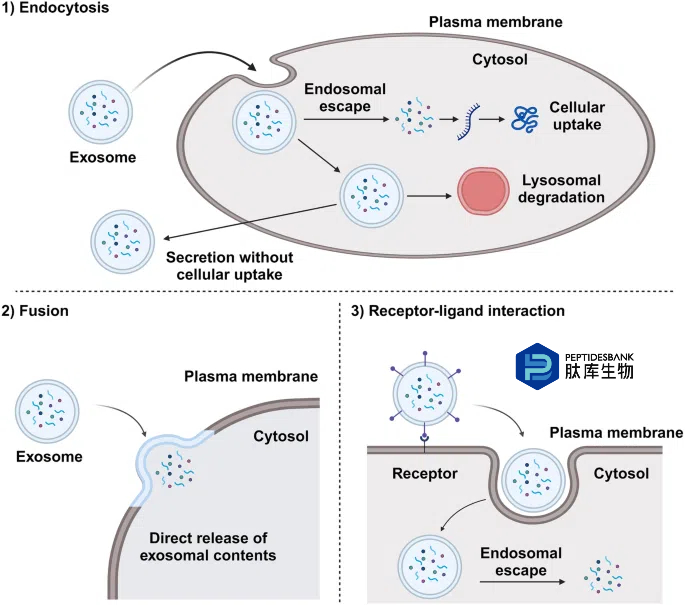
图3 外泌体的细胞摄取途径
外泌体用于治疗药物递送
外泌体作为药物载体的研究兴趣源于其几个关键特性。外泌体在细胞间运输各种生物分子方面发挥着天然作用,并且在治疗药物递送方面具有潜在用途。此外,外泌体具有生物相容性和生物降解性,可将与合成药物递送系统相关的免疫反应或毒性风险降至最低。这些囊泡的微小尺寸使它们能够穿越较大载体无法穿越的生物屏障,其在血液中的稳定性增加了到达目标的可能性。有趣的是,外泌体已显示出针对特定细胞或组织的固有靶向能力,可用于将药物直接递送至病变细胞,从而提高疗效并减少副作用。此外,外泌体具有多功能性,可携带蛋白质、核酸和小分子药物等货物;因此,可以同时递送多种治疗药物,并设计涉及多种分子类型的复杂疗法。本节重点探讨外泌体作为药物递送系统以提高治疗效果的应用,根据所递送物质的类型对相关研究进行分类。讨论了每种物质有效递送对外泌体的需求,并强调了外泌体作为药物递送载体的最新研究进展。此外,本节还重点介绍了对外泌体进行修饰的新兴策略,包括用靶向配体或抗体进行表面功能化,以实现对特定细胞或组织的靶向递送。
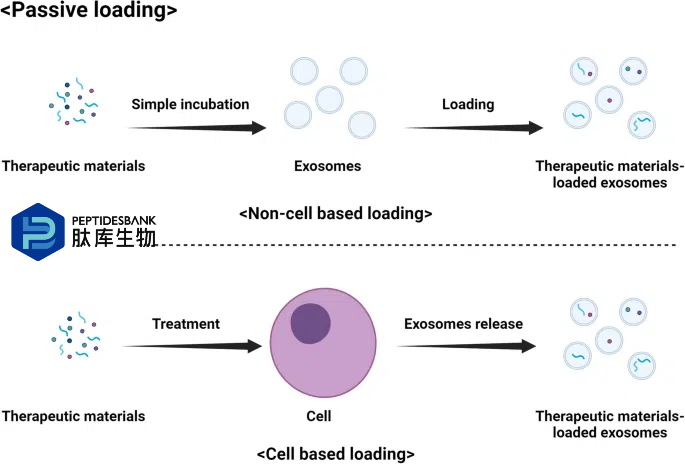
图4 将治疗材料被动加载到外泌体中
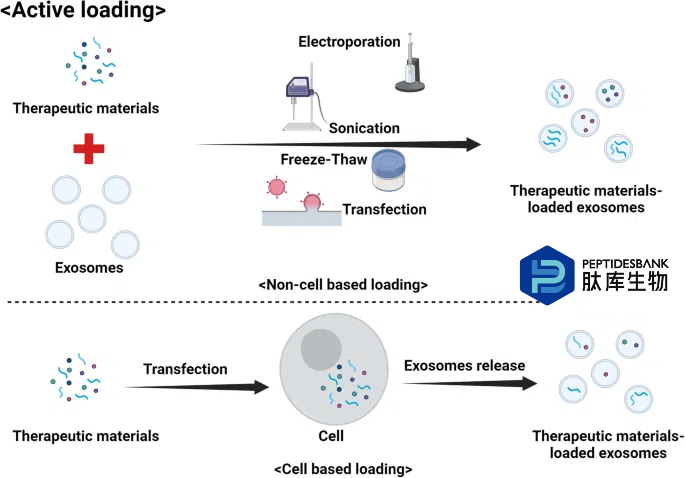
图5 将治疗材料的主动载入外泌体负载
蛋白质
蛋白质药物包括治疗性重组蛋白、单克隆抗体和激素等物质,它们能够与体内的特定靶点相互作用,从而治疗疾病或恢复正常功能。然而,这些药物可能会因免疫反应、从血液中清除、被酶降解或与其他分子结合而失去效力。为了应对这些挑战,可以使用纳米颗粒和外泌体等载体。载体能够提高这些药物的稳定性和生物利用度,控制其释放以实现持续效果,实现靶向递送,促进细胞渗透,增强治疗效果,并防止免疫反应。因此,载体在提高蛋白质递送的有效性和效率方面发挥着不可或缺的作用(表 1)。
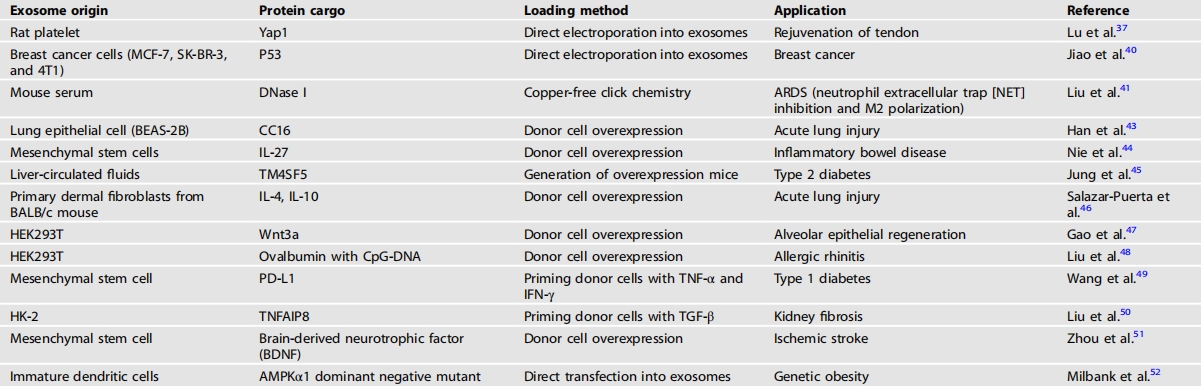
表1将蛋白质货物加载到外泌体中
在一些研究中,研究人员试图间接地将治疗性蛋白质装载到外泌体中。通过用巴弗洛霉素A1处理,使蛋白质错误折叠,从而将其封装在外泌体中,巴弗洛霉素A1可通过损害溶酶体功能产生大量未折叠的蛋白质。因此,大量错误折叠的蛋白质被装载到外泌体中,将其递送至癌细胞后会导致细胞死亡。然而,难以确定哪些蛋白质能够被装载,且装载的蛋白质也无法精确控制;因此,也有尝试直接将所需的蛋白质装载到外泌体中。卢等人通过电穿孔直接将重组Yap1装载到大鼠血小板衍生的外泌体中。Yap1装载的外泌体促进肌腱干细胞/祖细胞的年轻化,从而实现功能性肌腱再生。然而,具有亲水性外表面和疏水性核心的可溶性蛋白质难以轻易穿透外泌体的脂质双层结构。为了提高蛋白质进入外泌体的效率,焦等人通过电穿孔清空了外泌体的原有内容物,从而最大限度地提高了将外源性重组P53蛋白质装载到外泌体中的效率。也有尝试利用蛋白质将药物精准递送至靶细胞或组织。刘等人通过无铜点击化学将脱氧核糖核酸酶I共轭到负载有甲泼尼龙琥珀酸钠(ARDS治疗药物)的外泌体和脂质体杂交颗粒上。通过这种方法,甲泼尼龙琥珀酸钠被有效地递送至巨噬细胞,在那里发挥了增强的治疗效果。
尽管将蛋白质直接加载到外泌体中颇具前景,但蛋白质在溶液中的表面暴露以及在靶细胞中的低重折叠率会降低蛋白质的稳定性和活性,这是重组蛋白递送的重要障碍。此外,通常需要复杂的修饰过程来提高蛋白质加载到外泌体中的效率。因此,许多研究人员正在尝试一种不同的策略,即转染供体细胞以过表达特定的治疗性蛋白质。这种方法允许过表达的蛋白质自然地被整合到外泌体中,从而大大简化了过程。韩等人在BEAS-2B肺上皮细胞中过表达CC16,然后从培养基中分离出外泌体。特别是,CC16负载的外泌体在浓度比重组CC16低1000多倍的情况下对肺损伤具有保护作用。聂等人用慢病毒转染间充质干细胞(MSCs)以过表达IL-27,从而生成了负载IL-27的外泌体。在这项研究中,负载IL-27的外泌体抑制了炎症反应,并修复了肠屏障功能障碍。Jung等人构建了肝TM4SF5过表达(Alb-Tm4sf5TG)小鼠,并从肝循环液中分离出TM4SF5负载的外泌体。将TM4SF5负载的外泌体给予TM4SF5基因敲除小鼠,通过靶向棕色脂肪组织诱导了多余葡萄糖的清除。一些研究人员将多个质粒共同转染以提高治疗效果。Salazar-Puerta等人将IL-4或IL-10与SPA配体共同转染到原代成纤维细胞中,SPA配体能够增强肺内/肺泡的相互作用和滞留,并分离出具有治疗急性肺损伤效果的外泌体(IL-4+SPA外泌体或IL-10+SPA外泌体)。Gao等人将Wnt3a与工程化的稳定锚定蛋白GPC6ΔGPI-C1C2共同转染,并从所得的Wnt3a-GPC6ΔGPI-C1C2细胞中分离出外泌体,其促进上皮再生的效果优于单独转染Wnt3a的细胞所分离出的外泌体。刘等人通过用CpGDNA和卵清蛋白负载的外泌体处理细胞来调节Th1免疫反应,从而缓解过敏症状。王等人试图通过负载另一种已获FDA批准的药物来提高PD-L1蛋白的治疗效果。间充质干细胞(MSCs)用TNF-α和IFN-γ刺激48小时以获得负载PD-L1的外泌体。然后通过电穿孔将六氢5-氨基乙酰丙酸盐酸盐(HAL)负载到PD-L1负载的外泌体中,并用于治疗1型糖尿病,通过防止胰岛β细胞凋亡。与其它研究不同的是,在这项研究中,特定蛋白质是通过刺激供体细胞间接负载的。在这种间接方法中,除了预期的蛋白质外,还可能负载各种意外的蛋白质。这一结果也在刘等人的研究中得到了证实。从TGF-β预处理的肾小管上皮细胞(HK-2细胞)中分离出外泌体。发现肿瘤坏死因子-α诱导蛋白8(TNFAIP8)负载的外泌体在TGF-β预处理的HK-2细胞培养基中富集,并且这些外泌体能有效预防肾纤维化。在这项研究中,TNFAIP8并非通过所用间接方法负载的唯一蛋白质。出于这个原因,除了预期的蛋白质外,还应确定外泌体的货物。此外,还应确认源自意外加载蛋白质的外泌体所产生的任何影响。应仔细审查特定蛋白质的间接加载,以确保外泌体的精确内容和效果。
外泌体能够自然穿过血脑屏障进入大脑,因此成为治疗各种神经系统疾病的药物递送的理想候选者。周等人在间充质干细胞中过表达脑源性神经营养因子(BDNF),以纯化载有 BDNF 的外泌体。随后通过鼻内给药将载有 BDNF 的外泌体给予小鼠,结果表明其能够通过穿透血脑屏障来影响缺血性中风。尽管外泌体能够通过穿透血脑屏障将药物递送至大脑,但其递送效率仍然很低。因此,研究人员尝试通过改造外泌体来提高递送效率。米尔班克等人使用过表达溶酶体相关膜蛋白 2b(Lamp2b)和神经生长狂犬病毒(RVG)的未成熟树突状细胞,通过与烟碱型乙酰胆碱受体(nAChR)结合,使外泌体更有效地穿透血脑屏障。从改造后的未成熟树突状细胞中分离出外泌体后,将转染了 AMPKα1 显性负突变质粒的外泌体递送至下丘脑腹内侧核,促进瘦素受体缺陷型小鼠的体重减轻。
遗传物质
诸如小干扰RNA(siRNA)、微小RNA(miRNA)、信使RNA(mRNA)和DNA等遗传物质在基因治疗中得到了广泛应用。特别是siRNA、miRNA和反义寡核苷酸(ASO)常用于功能缺失研究。然而,细胞具有保护性的脂质双层膜,这成为siRNA、miRNA和ASO等大分子和亲水性分子直接进入细胞的屏障。这些遗传物质带负电荷,难以穿过细胞膜,阻碍了它们进入负责基因调控的细胞内机制。它们还容易受到酶的降解,这阻碍了它们向细胞的有效运输;因此,它们需要载体或递送系统才能有效地进入细胞(表2)。
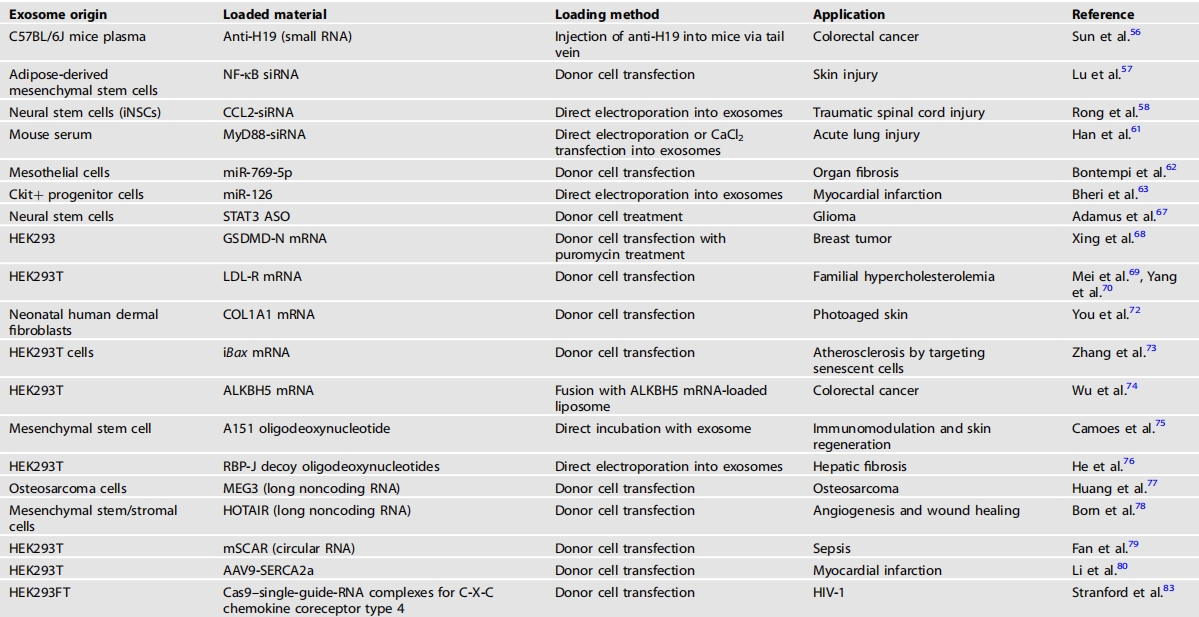 表2将遗传材料加载到外泌体中
表2将遗传材料加载到外泌体中
这些材料在临床广泛应用方面存在若干限制和挑战。尽管聚合物、环糊精和脂质体等各种载体因其在体外具有较高的转染效率而在临床应用中被采用,但大多数递送系统的体内表现却不尽人意,原因在于毒性、非特异性摄取以及不必要的炎症和免疫反应。各种递送系统还存在脱靶效应、组织渗透有限以及快速清除等问题,这些问题会降低治疗效果并导致意外的副作用。因此,将siRNA、miRNA或ASO靶向递送至体内特定组织或细胞仍是一项重大挑战。为克服这些局限性,外泌体作为基因治疗的潜在载体已引起广泛关注。孙等人构建了一种针对H19长链非编码RNA的小RNA——抗H19。他们证实过表达的抗H19可被装载入外泌体。通过注射将抗H19装载入小鼠血浆外泌体,这些外泌体以无毒、无免疫原性和生物相容性的方式改善了结直肠癌。它们的治疗效果优于5-氟尿嘧啶(5-Fu),5-Fu是最常用的抗癌药物之一。卢等人将NF-κBsiRNA装载到脂肪源性间充质干细胞外泌体中,通过抑制NF-κB炎症信号通路来治疗皮肤损伤。由于外泌体是许多细胞类型自然分泌的细胞外囊泡,因此它们比合成纳米颗粒具有更好的生物相容性和更低的免疫原性。此外,外泌体可以通过化学修饰在其表面携带特定的目标分子,从而能够选择性地与特定细胞类型相互作用,并高效地进行细胞内递送,从而减少脱靶效应,脱靶效应通常会引发副作用。在荣等人的研究中,CAQK肽选择性地结合在脊髓损伤后病变中表达上调的硫酸软骨素蛋白聚糖(CSPGs),通过化学修饰锚定在神经干细胞(iNSC)来源的外泌体膜上。然后将CCL2-siRNA装载到外泌体中,用于递送至脊髓以治疗损伤。除了靶向功能外,装载siRNA的外泌体还可以通过诸如雾化器之类的医疗设备进行递送。已有报道指出,雾化器会影响药物稳定性,从而影响分子完整性,导致在最初装入脂质体的过程中药物损失高达88%。然而,在雾化前后装载到外泌体中的siRNA数量没有差异,且装载的siMyD88通过抑制NF-κB炎症信号传导抑制了NF炎症通路。目前,siRNA的开发进展超过了miRNA,已有更多的siRNA候选药物进入临床试验。这一趋势可归因于miRNA复杂的作用和多个靶点。不过,近期针对miRNA的深入研究显著增加,预计其治疗潜力将取得重大进展。Bontempi等人将miR-769-5p装载到间皮细胞来源的外泌体中,通过阻断间皮细胞向间充质细胞的转化来抑制器官纤维化。Bheri等人将miR-126装载到cKit+祖细胞中以改善心肌梗死。此外,提高miRNA传递效率的尝试一直在进行。通过将外泌体与脂质体、水凝胶或肽杂交来对其进行修饰,可以提高其稳定性和靶向能力。与siRNA和miRNA类似,反义寡核苷酸(ASOs)是小的合成核酸片段,通过与mRNA结合来阻断蛋白质的功能,这可能导致mRNA降解,从而改变蛋白质的生成。为了将ASOs传递到细胞内,需要载体。在Adamus等人的研究中,仅当通过外泌体等载体传递时,针对胶质瘤的STAT3-ASOs才能发挥作用。
此外,信使核糖核酸(mRNA)可以被装载到外泌体中。邢等人将参与细胞焦亡的关键因子之一的GSDMD-NmRNA装载入外泌体。简而言之,他们用嘌呤霉素处理将GSDMD-N质粒转染到HEK293细胞中。由于嘌呤霉素会抑制翻译,未翻译的GSDMD-NmRNA可以很容易地被分选到外泌体中。通过这一过程,他们成功地将GSDMD-NmRNA装载到外泌体中。然而,由于mRNA不稳定且体积较大,将其装载到纳米载体中仍然具有挑战性,这使得包装和控制释放变得复杂。即使成功装载和分选,mRNA在靶点的控制释放也颇具挑战性,因为快速释放可能会导致在达到预期效果之前发生降解。因此,杨等人开发了一种“一体化”的外泌体工程和纯化策略,以实现简便包装。简而言之,他们生成了表达Flag-TCS-PTGFRN-CTSL-MCP的HEK-293T细胞,即外泌体分选器和mRNALdlr-MS2。由于MCP在生物发生过程中能够特异性结合含MS2的RNA,治疗性mRNALdlr-MS2被装载到与Flag-TCS-PTGFRN-CTSL-MCP共轭的外泌体中。随后,利用抗Flag磁珠对外泌体进行纯化。纯化后,分别通过凝血酶处理和酸化来切割Flag和MCP69。为了更有效地释放LdlrmRNA,他们引入了Ldlr释放剂,该释放剂可通过与MS2竞争性结合来释放LdlrmRNA从MS2中。通过这一过程,治疗性LdlrmRNA可被递送至细胞内,从而对动脉粥样硬化发挥治疗作用。尽管与其它材料相比,其负载过程较为复杂,但随着脂质纳米颗粒在新冠疫苗中成功用于mRNA递送,这一领域正取得进展。目前,许多研究团队正在努力将外泌体与其它工程技术相结合,并为其负载足够量的mRNA以用于临床应用。多个研究小组尝试将外泌体与其它工程技术相结合。杨等人利用生物芯片产生的电脉冲刺激细胞释放更多负载mRNA的外泌体,从而实现了细胞纳米穿孔。通过这一技术,尤等人将COL1A1mRNA装载到外泌体中,防止了皮肤光老化过程中的皱纹形成。多项研究都试图提高mRNA的功能效力。张等人生成了iBaxmRNA,这是一种经过修饰的BaxmRNA,可靶向肝脏特异性miRNAmiR-122,以调节由iBax过度翻译所导致的肝毒性。然后,将这种mRNA封装到与超顺磁性氧化铁纳米颗粒(SMNs)结合的外泌体中。这种方法能够利用磁场精确地靶向病变部位,从而改善动脉粥样硬化。此外,外泌体和脂质体可以结合形成杂化纳米颗粒,以提高载药效率,同时保持低毒性。吴等人通过冻融法构建了外泌体-脂质体杂化纳米颗粒。将外泌体和ALKBH5mRNA负载的脂质体(1:1)混合物反复冻融三次,以诱导两种颗粒融合。这一过程能够解决将mRNA封装在外泌体中的难题,并改善脂质体的毒性,从而对结直肠癌产生显著的治疗效果。除了这些遗传物质,研究人员还成功地将各种遗传物质加载到外泌体中,包括寡脱氧核苷酸、长链非编码RNA、环状RNA以及腺病毒。特别是,在基因治疗中备受关注的成簇规律间隔短回文重复序列(CRISPR),也正在被深入研究以加载到外泌体中实现靶向递送。斯坦福德等人通过生成基因编程的自组装多功能颗粒,改进了基于外泌体的CRISPR基因递送系统。该系统避免了包括纯化以及化学修饰sgRNA导致的外泌体产量降低在内的诸多挑战。2023年底,针对镰状细胞病的CRISPR基因疗法获得了美国食品药品监督管理局(FDA)的初步批准,预计其未来使用量将大幅增加。
小分子药物的递送
天然囊泡衍生的外泌体具有诸多优势,包括免疫反应降低、毒性减少、生物利用度提高以及潜在的选择性药物递送能力。因此,外泌体能够减少达到相同治疗效果所需的药物剂量,并降低副作用(表3)。雷迪等人将贝伐单抗负载到外泌体中,并观察了其对糖尿病视网膜病变的治疗效果长达2个月。单独使用贝伐单抗仅能观察到1个月的效果。相比之下,负载贝伐单抗的外泌体能持续2个月,这表明外泌体药物递送系统能够延长药物的有效性。周等人将半胱天冬酶-1抑制剂VX-765负载到骨髓树突状细胞衍生的外泌体中。在该研究中,通过外泌体递送VX-765到巨噬细胞,其治疗效果得到了增强。外泌体在克服药物耐药性方面也颇具前景,并且可以进行修饰以实现靶向递送和高负载效率。伊亚斯瓦米等人对外泌体表面进行了修饰,使其表达淀粉样β前体蛋白(APP)结合蛋白Fe65。随后,将corynoxine-B装载到外泌体中以诱导表达APP的神经元细胞发生自噬,用这些外泌体进行治疗可改善阿尔茨海默病小鼠模型的认知衰退和病理状况。由于这些优势,许多研究人员正在研究将抗癌药物装载到外泌体中的潜力,以解决传统抗癌药物存在的不足,包括生物利用度低、由于非特异性靶向而需要高剂量、治疗指数低以及多药耐药性等问题。利用外泌体,Rehman等人最大限度地提高了脑特异性抗癌药物替莫唑胺对替莫唑胺耐药性胶质母细胞瘤的抗癌效果。为了靶向胶质母细胞瘤,他们用短肽HSSP对外泌体进行修饰。HSSP能够特异性地与在替莫唑胺耐药性胶质母细胞瘤中高表达的血红素加氧酶-1(HMOX1)结合。这些外泌体装载了替莫唑胺和siSTAT3的组合,siSTAT3可以抑制癌症进展基因STAT3。这些携带替莫唑胺和siSTAT3的HSSP修饰外泌体比其他实验组有更多数量到达大脑,并表现出最强的抗癌效果。朱等人对外泌体表面进行了修饰,以更有效地靶向大脑。血管肽-2靶向在胶质母细胞瘤细胞中高表达的低密度脂蛋白受体相关蛋白1(LRP1),而TAT肽是一种细胞穿透肽。这两种分子都在HEK293T细胞中过表达,并分离出负载血管肽-2/TAT的外泌体。通过电穿孔将用于治疗多种癌症的化疗药物阿霉素直接加载到这些血管肽-2/TAT负载的外泌体中,在胶质瘤小鼠模型中显著延长了生存时间,且没有严重的副作用。为了提高癌症免疫治疗的效果,金等人将阿霉素加载到信号调节蛋白α(SIPRα)负载的外泌体中。由于SIPRα可以阻断与癌症免疫治疗相关的肿瘤抗原CD47,SIPRα负载的外泌体可以靶向癌细胞进行免疫治疗,而加载的阿霉素增强了抗癌效果。法鲁克等人从人类胰腺癌细胞中分离出外泌体,并将其装载上RGD肽以与在胰腺癌细胞中高表达的αvβ3结合。这些针对胰腺癌细胞的外泌体随后被装载上紫杉醇,并被证实具有良好的抗癌效果。
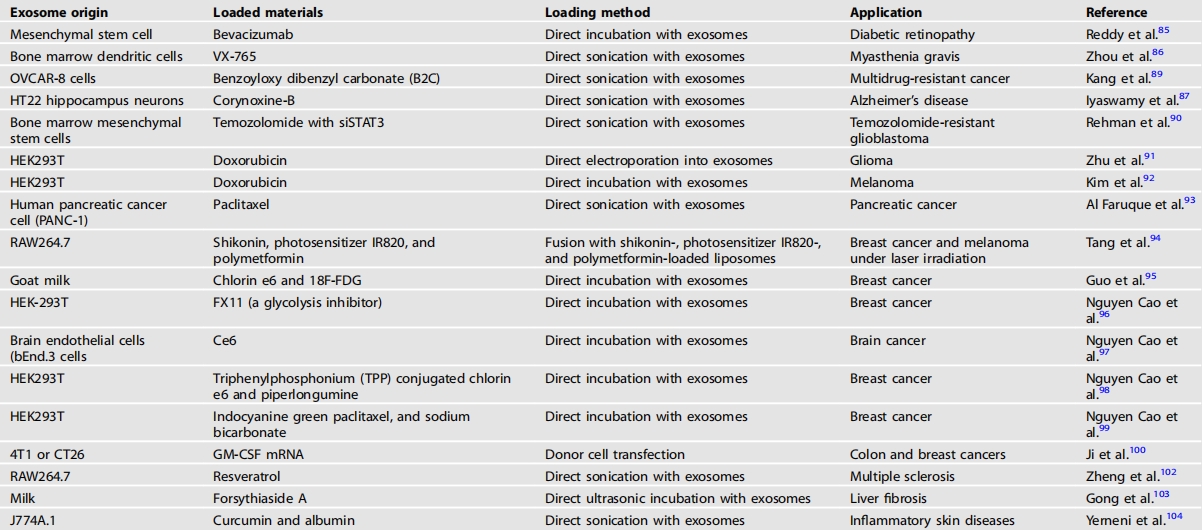 表3将小分子加载到外泌体中
表3将小分子加载到外泌体中
除了对外泌体表面进行修饰外,还有几种工程技术被应用于外泌体。唐等人将靶向CD47的RS17肽插入含有化疗药物紫草素、光敏剂IR820和免疫调节剂聚甲双胍的脂质体中,然后将这些脂质体与外泌体融合,并在激光照射下用于治疗乳腺癌和黑色素瘤。一些研究人员应用了经美国食品药品监督管理局批准的光敏剂血卟啉e6(Ce6)。光动力疗法(PDT)是一种两阶段的癌症治疗方法,利用光能与可被光能激活的光敏剂相结合。郭等人将可对癌细胞发挥光动力作用的Ce6与18F-FDG负载到山羊奶来源的外泌体中,从而用于针对乳腺癌的切伦科夫发光诱导光动力疗法。阮·考等人也将Ce6负载到外泌体中用于声动力疗法,这是一种源自光动力疗法的新型基于超声的非侵入性治疗策略。简而言之,Ce6与三苯基磷(TPP)部分结合以靶向线粒体。随后,该共轭物被装载入脑内皮细胞来源的外泌体中用于治疗脑癌。他们还利用TPP-Ce6工程化外泌体装载癌症特异性化疗药物吡咯替尼(PL)。经过超声辐照后,载有TPP-Ce6-PL的外泌体对乳腺癌表现出最强的抗癌效果。该研究团队还共载入了吲哚菁绿(一种声敏剂和光声剂)、紫杉醇和碳酸氢钠,并证实了其对乳腺癌的抗癌效果。此外,Ji等人还利用Ce6与CCL21a和GM-CSFmRNA来治疗结肠癌和乳腺癌。
天然产物衍生的化学物质也被装载到外泌体中以提高其治疗效果。天然产物衍生的化学物质通常比合成药物的效力低。然而,装载到外泌体中的天然产物衍生的化学物质比单独的天然产物衍生的化学物质表现出更高的治疗效果。例如,装载白藜芦醇的外泌体显示出比单独的白藜芦醇更强的抗炎作用。龚等人将连翘果实衍生的连翘酯苷A装载到透明质酸修饰的外泌体中;由于透明质酸可以与在纤维化组织中过度表达的CD44结合,装载连翘酯苷A的外泌体被靶向到纤维化部位,并显示出调节NLRP3介导的细胞焦亡的能力。此外,通过可溶解的微针阵列给药的姜黄素外泌体进一步扩大了天然产物的应用范围,提高了其治疗功能。许多关于天然产物与遗传物质联合递送的类似研究正在进行中,与本综述中提到的具有高影响力的类似研究正在稳步发表。因此,基于外泌体的方法有望为天然产物研究开启新篇章。
结论与未来方向
由于其生物相容性、深部组织渗透能力和多样的载货能力,外泌体正逐渐成为靶向药物递送的有前景载体。由于其同型靶向效应和自我识别能力,外泌体及其杂交系统正越来越多地被探索为传统药物载体的替代品。这些材料在化疗、基因治疗和光热治疗等多种应用中具有潜力。此外,通过同时装载多种治疗性货物,可以生成多功能外泌体。而且,尽管近年来对哺乳动物来源的外泌体进行了广泛研究,但越来越多的证据表明,植物来源的外泌体样纳米囊泡在结构和功能上与哺乳动物来源的外泌体相似,这表明利用外泌体的潜力还远未被充分了解。然而,外泌体的研究和开发仍面临载货效率、结构稳定性和外泌体来源界定等重大挑战。现有的货物装载策略,如孵育、转染、电穿孔、超声处理和原位合成,在效率、成本、潜在的外泌体损伤以及所载货物的通用性方面存在局限性。此外,在制备修饰后的外泌体或封装药物的过程中可能会出现大量损失,导致产量低且重现性差。为了优化外泌体在靶向递送中的应用,人们开发了多种在外泌体表面组装归巢分子的策略。利用配体 - 受体相互作用的生物策略具有高特异性,但需要更广泛地识别细胞、组织和器官特异性受体。此外,临床应用需要持续的研究、更大规模的动物实验、临床试验以及为实现大规模、质量可控的生产付出巨大努力。尽管存在这些挑战,但外泌体的独特属性,包括高靶向能力、无毒性和生物相容性,突显了其在药物递送方面具有广泛的公共卫生效益的巨大潜力。因此,鼓励在开发高效、稳定且安全的基于外泌体的递送系统方面持续探索和创新。
首先,需要对外泌体生物学有更全面的理解。例如,详细研究以揭示外泌体生物发生、货物分选、释放和摄取的精确机制,对于阐明外泌体在细胞间通讯以及诸如癌症转移和神经退行性疾病等病理条件中的作用至关重要。在外泌体中过表达特定蛋白质和基因可能会意外导致亚结构域蛋白的表达。因此,了解特定刺激如何影响蛋白质进入修饰外泌体的分选过程,对于更详细地阐明治疗机制至关重要。其次,提高外泌体的负载效率和稳定性至关重要。目前的技术,如电穿孔、超声处理或与通透性增强剂孵育,已显示出潜力,但也存在局限性,例如对外泌体完整性的潜在影响。对这些技术的进一步研究或开发新方法将在优化基于外泌体的治疗递送方面发挥重要作用。第三,外泌体生产和纯化的可扩展性是一个巨大的挑战。目前,外泌体通常通过超速离心、超滤或尺寸排阻色谱法从细胞培养基或体液中分离,这些方法往往存在产量低或纯度差的问题。开发能够大规模高效获取高质量外泌体的技术对于未来的临床应用至关重要。张等人开发了一种阳离子脂质-聚合物杂化纳米颗粒,其封装了涉及催化发夹组装和CRISPR-Cas12a的级联系统(CLHN-CCC),能够在三维空间中实现外泌体的富集。通过这种方法富集外泌体对于miRNA检测和早期癌症诊断具有优势。此外,将外泌体研究转化为临床实践需要成功的临床试验。一些基于外泌体的产品,如用于急性呼吸窘迫综合征的ExoFlo和用于黑色素瘤治疗的dexosomes,正处于不同的临床试验阶段。这些试验的继续进行以及新试验的启动对于评估基于外泌体的治疗的安全性、有效性和最佳剂量至关重要。在孟等人的一项研究中,通过可溶解微针进行皮下微注射递送外泌体,其在皮肤内的维持时间延长了两倍多(长达7天),这种方法使外泌体能够有效改善皮肤损伤。然而,微针的制备和储存寿命尚未完全阐明。因此,应开发类似于脂质体的外泌体储存技术,以解决外泌体储存不便的问题。最后,必须彻底研究基于外泌体疗法的潜在脱靶效应和长期安全性。例如,源自肿瘤细胞的外泌体已被证明有可能促进肿瘤生长或转移,这需要在外泌体的治疗应用中谨慎行事。此外,制定标准化的外泌体研究协议对于未来的发展至关重要。目前,外泌体分离、表征和储存技术缺乏统一性,这常常阻碍了不同研究结果之间的比较。为建立共识并规范这些程序所做的努力将造福于研究界。总之,尽管外泌体研究具有巨大的潜力,但要充分实现这一领域的变革性可能,未来的发展道路必须应对这些重要的挑战和机遇。
参考文献:doi.org/10.1038/s12276-024-01201-6
免责声明:本文为行业交流学习,版权归原作者所有,如有侵权,可联系删除