在肿瘤微环境(TME)中,调节性T细胞(Tregs)在抑制抗癌免疫反应方面发挥着关键作用;因此,针对Tregs的各种策略正成为肿瘤治疗的重要手段。为避免非特异性Treg耗竭带来的副作用,如免疫治疗相关不良事件(irAEs),正在研究专门针对TME中Tregs的治疗策略。肿瘤靶向药物偶联物是一种高效的药物,其中细胞毒性有效载荷通过连接子组装到能与Tregs结合的载体上。通过使药物仅对靶细胞起作用,这种方法具有提高治疗效果和减少免疫治疗副作用的优势。抗体药物偶联物、免疫毒素、肽药物偶联物和小干扰RNA偶联物正在被开发为Treg靶向药物偶联物。在这篇综述中,我们讨论了针对TME中Tregs的药物偶联物的关键主题和最新进展,以及未来成功利用药物偶联物进行Treg靶向免疫治疗的设计策略。
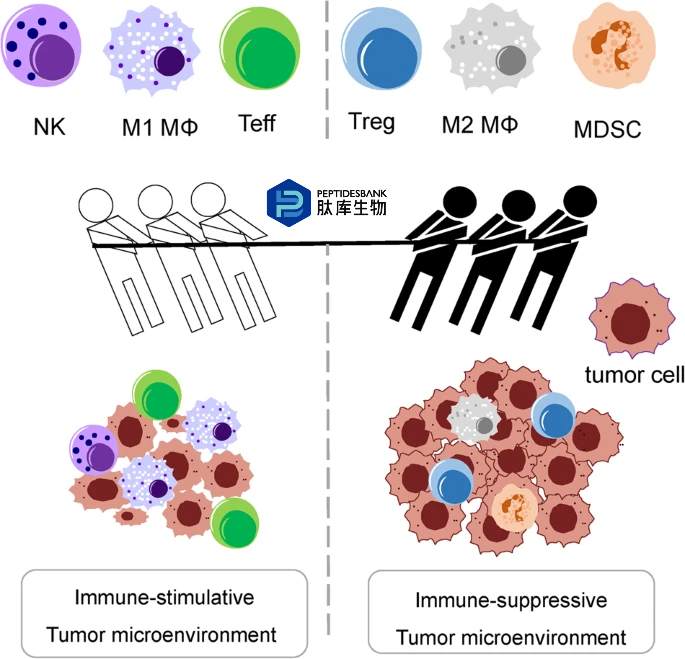
图 1:免疫刺激性和免疫抑制性肿瘤微环境(TME)之间相互作用动态的说明性解释。在肿瘤发展过程中,调节性 T 细胞(Tregs)、M2 型巨噬细胞(MΦ)和髓源性抑制细胞(MDSCs)是免疫抑制性肿瘤微环境中的主要细胞类型。
肿瘤微环境中的调节性T细胞及其特异性标志物
调节性T细胞是具有代表性的免疫抑制细胞,功能上具有两面性。其具有多种积极作用,包括在免疫耐受中的作用、抑制自身免疫性疾病、防止组织损伤以及感染后调节炎症;消极作用包括干扰癌症免疫。肿瘤细胞分泌的趋化因子梯度将调节性T细胞吸引至肿瘤微环境,随后激活它们以抑制抗肿瘤免疫反应,并释放免疫抑制细胞因子,如IL-10、TGF-β和IL-35。此外,调节性T细胞抑制其他免疫细胞,如嗜碱性粒细胞、嗜酸性粒细胞和肥大细胞,并在与靶向效应T细胞和抗原呈递细胞的细胞毒性作用的T细胞受体结合时释放穿孔素和颗粒酶。
坂口研究小组在最近的一篇综述论文中指出:“调节性 T 细胞是肿瘤治疗的重要障碍之一,因此在战胜肿瘤之前有必要将其清除”。针对调节性 T 细胞是癌症治疗的一种有效策略;然而,非特异性的全身性调节性 T 细胞耗竭会导致诸如免疫治疗相关副作用等问题。因此,通过其特异性标志物选择肿瘤中的调节性 T 细胞进行靶向治疗有若干标准。
坂口等人根据CD45RA(一种初始T细胞的细胞表面标志物)的表达以及转录因子FOXP3的表达,将人类的CD4+FOXP3+T细胞分为以下三个亚群:第一组(Fr.1)为初始调节性T细胞(naiveTregs),定义为FOXP3低表达(CD25低表达)且CD45RA+的细胞;第二组(Fr.2)为效应调节性T细胞(eTregs),定义为FOXP3高表达(CD25高表达)且CD45RA-的细胞;第三组(Fr.3)为非调节性T细胞(non-Tregs),定义为FOXP3低表达(CD25低表达)且CD45RA-的细胞。
初始调节性T细胞(Fr.1)是离开胸腺的调节性T细胞,其免疫抑制活性较弱。在受到T细胞受体刺激后,它们会分化为效应调节性T细胞(Fr.2),这种细胞具有很强的免疫抑制活性。在大多数癌症中,外周血中效应调节性T细胞的比例为2%-5%,但在肿瘤组织中则为10%-50%,因此它们主要分布在肿瘤组织中。非调节性T细胞(Fr.3)不具备免疫抑制特性,并且会产生诸如干扰素(IFN)-γ和白细胞介素(IL)-17等炎性细胞因子。
肿瘤微环境中的调节性T细胞(Tregs)具有多个膜靶点,例如CD25、CTLA-4、PD-1、ICOS、GITR、OX40、CCR4和CCR8,这些靶点可用于耗竭这些细胞。针对调节性T细胞的药物偶联物可针对其中的多个标志物(图2)。
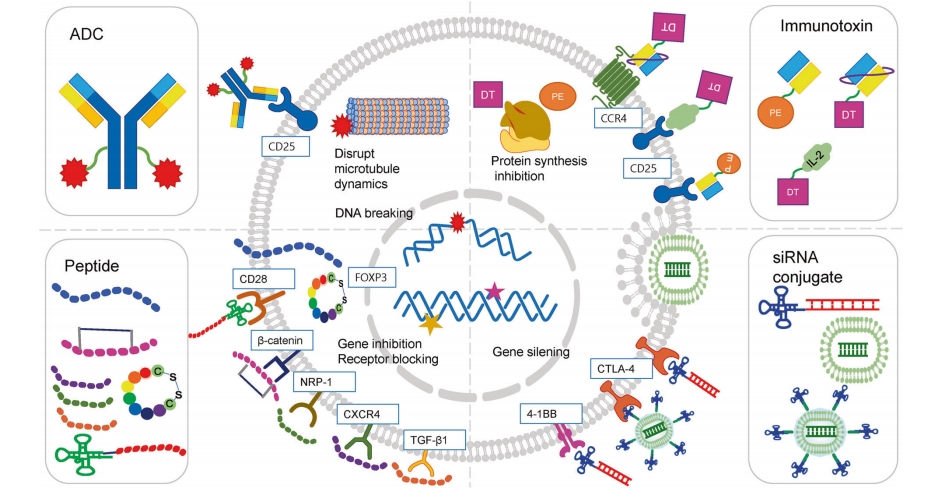
图 2:靶向调节性 T 细胞(Tregs)的药物偶联物作用机制示意图。ADC 抗体药物偶联物,DT 白喉毒素,PE 铜绿假单胞菌外毒素 A,siRNA 小干扰 RNA。
肽-药物偶联物
肽偶联药物(PDCs)是在抗体偶联药物(ADCs)之后开发的下一代靶向疗法。目前,已有两种药物获得美国食品药品监督管理局(FDA)的上市批准。
由于大多数单克隆抗体的分子量约为 150 千道尔顿,所以它们太大而无法渗透到肿瘤组织中。它们可能具有免疫原性,并在排泄器官(如肾脏和肝脏)中聚集。此外,单克隆抗体的生成成本高昂且耗时。
由于肽的分子量低,所以能很好地渗透到固体组织中,而且由于其免疫原性低、代谢产物无毒,所以被认为很安全。此外,肽价格低廉、易于合成且可变性强。
抗体药物偶联物(PDC)由靶向肽、有效载荷和连接子组成。PDC 中的肽对靶细胞具有特异性,并应诱导偶联物的受体介导的内吞作用。有效载荷包括高毒性的美坦新、喜树碱衍生物、奥瑞他汀或阿霉素。连接子的选择应能使偶联物在体内有足够的循环时间以到达靶细胞。
在肽药物载体(PDC)中使用的肽大致可分为两类:细胞穿透肽(CPPs)和细胞靶向肽(CTPs)。细胞穿透肽利用特定的氨基酸序列,将细胞不可渗透的化合物或药物有效地运载穿过细胞膜,以到达其细胞内靶点。细胞靶向肽是一种理想的归巢分子,因为它与单克隆抗体类似,能以高亲和力与靶细胞表面过表达的受体结合。大多数归巢肽是线性的,结合效果良好,但存在一些缺点,包括末端的酶促降解、化学不稳定性和快速的肾清除。为了弥补这些缺陷,已采用线性肽的环化或肽钉合技术,以及与金纳米粒子、抗体 Fc 段或白蛋白的偶联。
肽可以通过筛选肽库来选择,筛选依据是其与目标的结合亲和力。肽库是用于识别癌症治疗中针对基因或细胞的疗法的多种肽的系统组合。根据目标的类型和展示方法,此类库包括核糖体展示、噬菌体展示、信使核糖核酸展示以及蛋白质片段互补分析。
用于靶向肿瘤微环境中调节性 T 细胞的肽类物质
迄今为止,尚未有关于将PDC作为调节性T细胞(Treg)靶点的研究报道,但针对抑制Treg的肽段的研究正在积极进行中。细胞穿透肽(CPPs)可用作药物偶联物中的有效载荷,P60与CD28适配体的偶联就是一个很好的例子。与Treg膜靶点具有高结合亲和力的细胞靶向肽(CTPs)有可能被用作PDC的归巢分子。针对Treg的肽段研究大多处于临床前阶段(表1)。
 表1 肿瘤微环境中针对调节性T细胞的肽类总结。
表1 肿瘤微环境中针对调节性T细胞的肽类总结。
P60是一种与FOXP3结合并阻止其核转位的肽。洛萨诺等人通过噬菌体展示筛选并合成了P60(RDFQSFRKMWPFFAM),这是一种15个氨基酸的序列,能很好地与FOXP3结合。P60能够穿透细胞膜,与FOXP3结合,阻止其核转位,降低FOXP3抑制转录因子NF-κB和NFAT的能力,并削弱调节性T细胞(Treg)的活性。CM-1315是P60的一种高科技产品,通过修改P60的几个碱基序列形成环状结构,从而提高了与FOXP3的结合能力和代谢稳定性。由于肽能够穿透所有细胞,因此需要高剂量才能发挥抗肿瘤作用。洛萨诺等人将CD28适配体与P60偶联以解决这一缺陷。CD28是一种T细胞特异性受体,在调节性T细胞中含量丰富。在体内小鼠实验中,当CD28Apt-P60与AH1疫苗联合给药时,其对CT26的抗肿瘤效果在低于游离P60的剂量下得以展现。
FOXP3 393-403(KCFVRVESEKG)源自FOXP3,负责DNA结合。FOXP3 393-403会破坏FOXP3与NFAT1之间的相互作用,增强促炎细胞因子的表达,并下调免疫抑制分子。
SAH-BCL9B (LSQEQLEHRERSLXTLRXIQRBLF ※ 位置 X 处的氨基酸被连接起来)是一种抑制性肽,可阻断β-连环蛋白/B细胞淋巴瘤9(BCL9)的结合。β-连环蛋白的突变和过度表达与许多癌症相关。川本等人分析了BCL9复合物的晶体结构,并开发了这种源自BCL9的肽。肿瘤特异性Wnt/β-连环蛋白信号传导促进肿瘤细胞的免疫逃逸,增强调节性T细胞(Treg)的生成,抑制CD8+T细胞的活化和浸润,将树突状细胞(DCs)转化为免疫调节表型,并将CD8+T细胞分化为效应细胞。当在体内给予SAH-BCL9B时,肿瘤中的Treg细胞数量减少,而CD8+效应T细胞和CD103+DCs的数量增加。冯等人基于BCL9同源结构域2合成了hsBCL9CT-24以提高SAH-BCL9B的活性。由于hsBCL9CT-24对β-连环蛋白的结合亲和力比BCL9-HD2A更强,因此它能有效减少Tregs并增加DCs,促进细胞毒性T细胞浸润肿瘤,并与抗PD-1显示出强大的协同作用。
P144和P17是作用于转化生长因子-β(TGF-β)信号通路的肽抑制剂。P144(TSLDASIIWAMMQN)具有疏水性,构成了人类Ⅲ型TGF-β1受体(TGFβRIII)的TGF-β1结合区域。P17(KRIWFIPRSSWYERA)是通过噬菌体展示筛选鉴定出的一种TGF-β结合肽。Tregs会大量产生TGF-β,通过下调T细胞和自然杀伤细胞的活性来抑制免疫反应。Llopiz等人发现,将P144和P17与佐剂分子聚(I:C)以及抗CD40激动剂抗体联合给患有T细胞淋巴瘤的小鼠使用,可增强抗肿瘤免疫反应。
Fc-TPP-11 (HTPGNSKPTRTPRR)是通过将NRP-1结合肽与抗血管生成剂的免疫球蛋白Fc区融合而合成的。NRP1是血管内皮生长因子和信号素家族成员的酪氨酸激酶受体的膜结合共受体。Jung等人证明,Fc-TPP-11通过拮抗NRP-1抑制调节性T细胞的增殖和功能。Fc-TPP-11选择性地抑制肿瘤内调节性T细胞的功能,而不影响外周调节性T细胞的功能。
肽R29 (Ac-RA-cyclic[DCRFFC])是一种新型的CXCR4拮抗剂,由肽R衍生而来,具有更高的亲和力和稳定性。桑塔加塔等人证明,CXCR4在调节性T细胞(Tregs)中高度表达,而新型肽拮抗剂肽R29诱导的CXCR4拮抗作用能有效逆转调节性T细胞对效应T细胞增殖的抑制作用。
结论
现有的药物偶联物已被开发出来直接清除癌细胞。然而,由于当前的癌症治疗针对肿瘤微环境中的免疫抑制细胞,药物偶联物也相应地在发展。尽管每个部分的功能是已知的,但当它们组合在一起时,可能会产生超出预期的协同效应,也可能产生意想不到的副作用。
由于先进的合成技术,药物的输送效率和药效得到了提升,还能降低毒性和副作用。与新型药物靶向分子结合的多样化偶联物不断增加,针对免疫抑制细胞的药物偶联物的临床试验正在推动创新治疗方案的设计。这种方法有望成为克服当前抗癌药物局限性、特异性靶向免疫抑制肿瘤微环境的有前景的策略。
参考文献:doi.org/10.1038/s12276-023-01080-3
免责声明:本文为行业交流学习,版权归原作者所有,如有侵权,可联系删除