靶向治疗的优势促使人们努力寻找患病细胞与正常细胞分子细胞表面景观之间的区别特征。这些特征通常是蛋白质、脂质或碳水化合物,但其他方法也在不断涌现。在本次讨论中,我们将探讨利用细胞表面酸性这一特征,通过使用 pH 敏感肽折叠将靶向剂递送至患病细胞表面或细胞质。
简介:将治疗药物靶向递送至病变组织能够显著提高其疗效,同时减少副作用。成功的分子靶向方法通常基于利用细胞表面特征来区分病变组织中的细胞与健康组织中的细胞。靶向治疗的优势促使人们寻找病变细胞与正常细胞分子细胞表面景观之间的区别特征。在本次讨论中,我们强调一种替代的靶向方法:细胞表面酸性。
针对疾病部位靶向诊断和治疗分子的传统方法基于识别在细胞表面或细胞膜内过度表达的受体或特定抗原。然而,这些标志物的表达量变化无常,这带来了诸多难题。例如,在利用分子生物标志物进行传统肿瘤靶向治疗时,由于克隆选择而产生的耐药性常常出现,从而影响治疗效果。此外,健康组织中的细胞通常也会表达相同的蛋白质,这降低了靶向治疗的特异性。
另一种截然不同的靶向方法可能基于对正常组织和病变组织细胞膜其他性质差异的认识。研究表明,癌细胞比正常细胞机械性更软,癌细胞膜的流动性更强。此外,正常细胞和癌细胞的双层膜不对称性也有所不同,磷脂酰乙醇胺在外层单分子层中的含量更高。由于癌细胞分裂速度异常快,它们往往会出现膜成分和不对称性的变化,因为它们必须上调生物合成途径以提供细胞构建模块,如膜成分,而不是依赖循环供应。如果能找到相应的方法,细胞膜的物理特性或许可以用于选择性靶向病变组织和/或各种递送剂的细胞摄取。
除了针对生物标志物或膜特性外,病变组织内的细胞由于其代谢过程会产生明显的表面酸性。这种酸性可以通过 pH 触发的膜相关肽折叠来特异性靶向,这也是本综述的主题。
膜相关折叠
肽插入膜的过程在进化中具有根本性的意义。它还启发了我们对脂质界面区域与它们所遇到的分子相互作用方式的思考。在体内,膜蛋白的插入和折叠是由复杂的分子机器(如转位酶)协助完成的,这些机器有助于将跨膜序列置于双层膜中。一些中等极性的跨膜结构域可以在翻译后自行转移到膜中。例如,C 端锚定蛋白(如凋亡抑制剂 Bcl-xL)可以将其 C 端插入膜中。另一个例子是白喉毒素在低 pH 值条件下自发插入膜中。对自发插入和折叠实例的研究激发了设计在水溶液中可溶且能自发插入膜中的合成肽,并成为生物物理研究的主题。能够自发地插入并折叠穿过膜的肽在低 pH 值条件下会作出反应,这一发现加快了这些肽在医疗应用方面的开发进程,因为人们发现细胞表面的低 pH 值(或高酸度)与多种重要的病理状况有关。
病变组织中的酸性
在诸如癌症、炎症(包括神经炎症)、关节炎、中风、缺血等病理状态下,组织中的细胞外酸性水平升高。在缺血和中风的情况下,病理主要与缺氧和血液供应受损有关;这些病变组织中的细胞代谢部分变为无氧代谢,导致糖酵解产生酸(即巴斯德效应)。在恶性肿瘤和活化的巨噬细胞中还存在另一种效应,即使在正常氧供应的情况下,这些细胞对葡萄糖的摄取也增加,这被称为“有氧糖酵解”或瓦伯格效应。这些细胞即使有线粒体氧化途径可用,仍以高频率进行糖酵解,从而导致酸化,这会加剧任何因缺氧造成的酸化。此外,快速代谢的细胞产生的二氧化碳会导致癌细胞表面碳酸酐酶的表达,促进细胞外环境的进一步酸化,因为细胞会排出二氧化碳,而碳酸酐酶会将其转化为碳酸氢根离子和质子。最后,细胞膜两侧的电化学势在细胞外侧为正,这会促使水合质子和其他阳离子在膜表面附近聚集。
细胞质中酸性的产生是有害的,因此细胞具有将酸性物质排出细胞外环境从而调节细胞质 pH 值的机制。pH 值的调节由跨膜蛋白完成,这些蛋白将质子从细胞质泵过质膜到细胞外空间或各种细胞器的腔室。排出的酸性物质的流量会降低患病细胞周围的 pH 值,而质子浓度在细胞表面附近因流量和膜电化学势而进一步增加。结果,患病细胞表面的细胞外 pH 值最低,显著低于正常生理 pH 值和细胞外液的 pH 值。即使在患病组织内灌注良好的区域,细胞表面的低 pH 值区域也会持续存在。细胞表面的酸性是一个可靶向的特征,不受克隆选择的影响,酸性水平是疾病进展的预测指标。
pHLIP® 技术
pH 触发的膜插入与折叠
pH(低)插入肽(pHLIPs)利用pH触发的膜插入和折叠来靶向酸性病变组织。这种插入可用于选择性地递送治疗和成像剂。pHLIPs 是一大类中等疏水性的膜肽,在正常和高pH值的水溶液中可溶。这些肽主要由非极性残基和带负电荷、可质子化的残基(如天冬氨酸和谷氨酸及其类似物)的组合构成。疏水残基的存在促进了其在大多数类型细胞膜双层表面的吸附,这种吸附与能量释放有关,主要来自疏水相互作用。含疏水残基较少的pHLIPs对膜的亲和力较低,且血液清除速度更快。此外,肽对膜的吸附还受到膜成分和局部离子环境的调节。人们对pHLIPs被膜吸附后的构象状态给予了极大关注。此类研究面临的一个挑战在于,pHLIP 在膜表面不会形成独特的结构,其可能呈现出多种构象,且取决于具体的 pHLIP 序列或脂质组成。当 pHLIP 以非螺旋无序形式插入双层膜的外层时,不会造成显著的膜变形,这与两亲性穿孔肽形成对比,后者以刚性的α-螺旋形式插入双层膜的一层,从而引起显著的膜张力并促进膜的不稳定。
当细胞外 pH 值较低时,关键的天冬氨酸/谷氨酸残基会被质子化,肽的整体疏水性(LogP)也会增强。由于介电环境会影响质子化和去质子化的速率,膜表面环境会使羧基的 pKa 值升高,从而有效地将其调整到接近 6.0 的生理相关值。质子化会改变平衡,促进肽更深入地插入双层膜,这反过来又会触发肽链在介电常数更低的环境中发生卷曲-螺旋转变(折叠),有利于系统性形成螺旋内的氢键和螺旋构象。这一过程是可逆的:如果 pH 值升高,肽从膜中退出会引发解折叠。在膜表面形成螺旋结构会导致膜双层的扰动,从而促进跨膜插入,当肽采取稳定的跨膜螺旋取向时,这种张力会得到缓解。动力学研究和恒 pH 分子动力学模拟为肽的插入和退出途径提供了见解。因此,pH 感知和插入机制背后有一套合理的概念。
尽管对于上述讨论的整体概念可能存在一些共识,但在文献中对于质子化事件、多肽在膜中的分配和折叠以及在生物系统中的靶向和细胞内递送的解读方面,我们认为存在一个重要的概念性误解。我们断言:
靶向和细胞外递送货物分子
pHLIP 家族的肽是膜插入肽类的成员:它们穿过脂质双层插入,将一端留在细胞外空间,而将另一端转运到细胞质中。各种货物分子可以连接到不插入膜的一端,以将它们靶向酸性细胞表面(图 1)。正如预期的那样,通过这种方式靶向的货物种类几乎没有限制。有用的货物示例包括成像和免疫刺激剂。除了递送小分子外,pHLIP 还可以将各种纳米颗粒和纳米材料导向疾病部位,这已在众多出版物中有所报道,包括综述文章,但超出了本综述的范围。
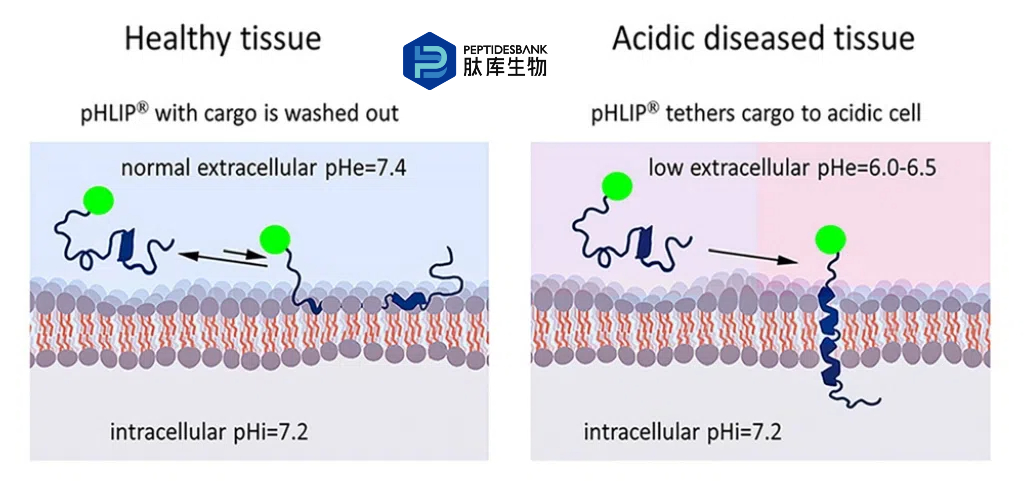 图 1. 靶向 pHLIP 将货物递送至酸性细胞表面。在正常细胞表面 pH 值(pH = 7.4)的健康组织细胞中,货物 - pHLIP 结构不会积累(左),因为 pHLIP 不会插入。疾病细胞表面的低 pH 值(6.0 - 6.5)导致 pHLIP 穿过脂质双层插入形成稳定的跨膜螺旋,将货物定位在细胞表面(右)。有用的货物示例包括成像和免疫刺激剂,例如荧光染料或抗原。
图 1. 靶向 pHLIP 将货物递送至酸性细胞表面。在正常细胞表面 pH 值(pH = 7.4)的健康组织细胞中,货物 - pHLIP 结构不会积累(左),因为 pHLIP 不会插入。疾病细胞表面的低 pH 值(6.0 - 6.5)导致 pHLIP 穿过脂质双层插入形成稳定的跨膜螺旋,将货物定位在细胞表面(右)。有用的货物示例包括成像和免疫刺激剂,例如荧光染料或抗原。
与 pHLIP 蛋白偶联的成像剂已在动物模型中用于标记原发性肿瘤、转移病灶及其他酸性病理状态。基于 pHLIP 的正电子发射断层扫描(PET)和荧光成像剂即将进入人体临床试验阶段。18F-NO2A-pHLIP 是一种用于成像组织酸性的 PET 试剂(Demoin 等人,2016 年),将在一期临床试验中用于乳腺癌患者,如果需要更长的半衰期,可能会使用其他 PET 同位素,如 64Cu 和 89Zr。PET-pHLIP 试剂有望在多种肿瘤成像中得到应用,也可能对脑肿瘤的诊断有用,因为 FDG 在正常脑组织中葡萄糖摄取量高,使用起来颇具挑战性。在其他酸性病理状态的成像方面,如严重炎症、动脉粥样硬化斑块或关节炎,也可能开发出相关应用。PET-pHLIP 试剂在临床上可能用于招募患者接受治疗,并监测癌症治疗(尤其是免疫治疗)的效果。例如,T 细胞的功能会受到低 pH 值的抑制,而且有可能利用 PET-pHLIP 成像剂来预测、模拟和监测免疫治疗的结果。
在另一项成像应用中,研究人员开发了一种使用吲哚菁绿(ICG)的荧光剂,这是一种广泛用于循环成像的近红外(NIR)荧光染料。ICG-pHLIP有望通过单次静脉注射实现肿瘤靶向,并识别原发肿瘤附近的边缘和微转移灶,从而改善手术切除效果。为了靶向并可视化肿瘤,将在静脉注射 ICG-pHLIP 后 24 小时进行成像,以确保未与肿瘤结合的药物在血液和组织中清除,从而优化标记癌性病变的对比度。值得注意的是,当 pHLIP 将 ICG 定位在膜脂质双层附近时,其荧光强度比溶液中的发射增强约 15 至 16 倍,从而进一步提高了肿瘤与背景的对比度。由于许多用于记录 ICG 荧光的临床成像系统已开发完成并正在医院中使用,因此 ICG-pHLIP 可以很容易地应用于临床实践。
由于 ICG-pHLIP 在血液中可存留数小时,因此用于血管造影的成像应用也可能有用。ICG-pHLIP 与血液蛋白相互作用,并在血液中持续循环,与单独使用 ICG 只能维持数分钟相比,能很好地对血管进行长达 1 至 2 小时的可视化成像。血流成像在各种外科手术中有着广泛的应用,并推动了上述成像系统的开发。
一种不同的、前景可观的成像剂是 QC1-pHLIP,其中 QC1 是一种猝灭分子(与 ICG 不同,ICG 是一种发射分子)。QC1 被设计成能有效吸收光并将其转化为热能,这使其成为光声成像的出色试剂。光声成像是一种迅速发展的成像方式,QC1-pHLIP 可能是术前成像临床转化的一个很有前景的候选者。
动物研究也表明,将 pHLIP 与顺磁性和超顺磁性氧化铁纳米粒子连接起来用于磁共振成像、壳聚糖封端的介孔二氧化硅包覆的金纳米棒和金纳米星用于计算机断层扫描、光声成像和光热治疗具有潜在的实用性。
重要的是,除了细胞外成像剂的递送外,还可以将多种其他货物(如免疫刺激分子,包括蛋白质(细胞因子)、碳水化合物、肽(如 HA 肽)或小分子抗原[如 2,4-二硝基苯(DNP)等])特异性地靶向递送至肿瘤细胞表面,以诱导生物反应。通过 pHLIP 可以将激活内源性或外源性抗体的特定抗原定位在肿瘤细胞表面,从而无需识别用于靶向的分子生物标志物。可以通过免疫接种来开发针对靶向抗原的内源性抗体。或者,可以给药外源性抗体或抗体药物偶联物(ADCs)以靶向由 pHLIP 递送至肿瘤细胞的特定抗原。
货物分子的靶向及细胞内递送
pHLIP 技术还可通过将分子连接到肽的插入端来实现分子的靶向细胞内递送,连接方式为可在细胞质中裂解的连接子,例如 S-S 连接子(图 2)。如果货物需要以原始未修饰的形式在细胞质中释放(例如某些小分子),以防止其与细胞内靶点的亲和力降低,则可使用自消解连接子。自消解消除是指多组分化合物通过一系列电子消除过程自发且不可逆地分解为其组成片段。如果货物可以在细胞质中以稍有修饰的形式释放(例如 PNA 或鹅膏蕈碱货物),则可以使用简单的 S-S 连接子(例如 SPDP 交联剂)。需要注意的是,连接子或附加调节剂可通过降低有效膜屏障来促进货物的细胞内递送。如果货物是极性的,疏水性连接子/调节剂可能会增加货物-调节剂的 LogP 值。如果货物具有疏水性,极性连接剂/调节剂可能会降低货物调节剂的 LogP 值,从而限制脱靶插入。
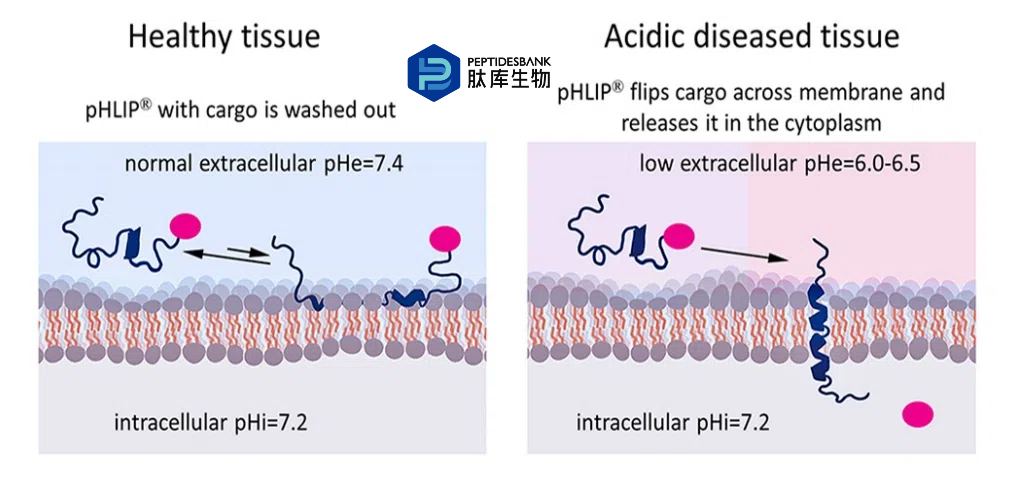 图 2. 针对性 pHLIP 将货物递送至细胞质。pHLIP-货物构建体不会插入表面 pH 值正常的细胞(pH = 7.4),而是进行短暂结合以检测表面 pH 值,然后被冲洗掉(左)。如果细胞表面 pH 值较低(pH 约为 6.0 - 6.5),pHLIP 会检测 pH 值并穿过脂质双层插入,将货物直接转运至细胞质(右)。通过使用在血液中稳定但在细胞质中可被切割的连接,货物可在细胞内释放。
图 2. 针对性 pHLIP 将货物递送至细胞质。pHLIP-货物构建体不会插入表面 pH 值正常的细胞(pH = 7.4),而是进行短暂结合以检测表面 pH 值,然后被冲洗掉(左)。如果细胞表面 pH 值较低(pH 约为 6.0 - 6.5),pHLIP 会检测 pH 值并穿过脂质双层插入,将货物直接转运至细胞质(右)。通过使用在血液中稳定但在细胞质中可被切割的连接,货物可在细胞内释放。
膜相关折叠有助于货物分子协同跨膜双层直接进入细胞质,从而绕过内吞作用摄取。这一途径显著扩大了可用于药物分子的分子性质的实际范围。图 3 总结了最适合 pHLIP 细胞内递送的货物分子的特性。这些特性涵盖了从极性或带负电荷的细胞不可渗透分子到中等疏水性分子,包括从几百道尔顿到几千道尔顿的分子量。极性治疗货物的可能使用为减少脱靶和毒性提供了显著优势,因为此类分子自身无法进入细胞,一旦递送,也不会轻易从目标细胞中逸出。
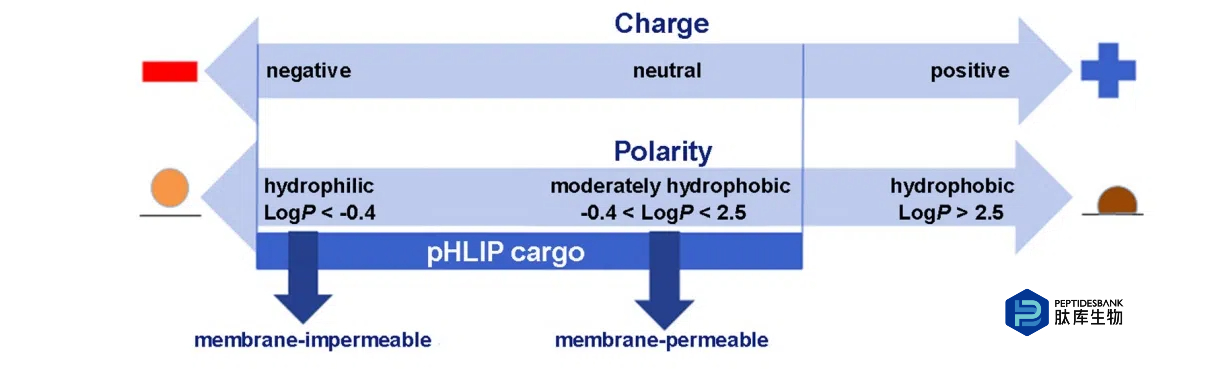
图 3. 可通过 pHLIP 被靶向并递送入细胞的货物分子的一些化学性质。图中展示了两个尺度,一个代表货物分子的电荷,另一个代表辛醇 - 水分配系数的对数(LogP)。对于那些自身无法进入细胞的大极性分子,通过 pHLIP 进行递送是可行的,这将药物的药理学范围扩展到了通常预期的药物范围之外,并且在货物释放后减少了其从细胞中的泄漏。少量负电荷是可以接受的,但正电荷会显著减缓动力学。中等极性的药物也可以被靶向,但非常疏水的分子会通过增加疏水膜相互作用并促进在较不酸性的 pH 值下插入,从而干扰 pHLIP 的插入选择性。
肽核酸(PNA)属于一类有用的、不渗透细胞的极性分子,可通过靶向编码和非编码 RNA 以及 DNA 来激活免疫反应并调节细胞功能。PNA 是最早通过 pHLIP 转运入细胞的极性分子之一,随后有实例表明其在体内可靶向 miRNA、长链非编码 RNA 和 mRNA。一个特别有吸引力的想法是将 PNA 递送至细胞内以下调 miR-21,miR-21 是实体瘤中最常上调的 miRNA,且在肿瘤发生的所有阶段都与肿瘤发病机制相关。在癌细胞和肿瘤相关巨噬细胞(TAMs)中,通过 pHLIP 介导的细胞内靶向递送针对 miR-21 的 PNA 可促进抗肿瘤免疫反应,其特征在于通过诱导包括 IL12 和 CXCL10 在内的细胞因子和趋化因子,巨噬细胞介导的细胞毒性 T 细胞反应得到改善。因此,pHLIP-PNA 的免疫刺激作用能够将“冷”肿瘤转化为“热”肿瘤,这种刺激可能会增强已开发的免疫疗法的治疗效果。除了肽核酸(PNAs)之外,多种免疫刺激分子,尤其是极性分子,比如 STING 激动剂,可能是通过 pHLIP 进行细胞内递送的极佳候选者。在另一项应用中,通过 pHLIP 介导将 PNA 递送至靶向 miR-33,阻止了肾脏纤维化的形成。
靶向 pHLIP 介导的中等疏水性小分子药物的递送也已被证明是成功的。已递送的药物包括微管蛋白的强效抑制剂,如单甲基奥瑞他汀 E、聚(ADP 核糖)聚合酶抑制剂(PARPi),包括鲁卡帕利和他拉唑帕利,以及其他分子。一个显著的特点是,pHLIP 递送已被证明可以减少骨髓蓄积和毒性,这是许多强效细胞毒性分子使用中的一个重要问题。因此,pHLIP 递送似乎能够减少脱靶效应、拓宽治疗窗口并提高治疗指数,这为重新考虑使用非常强效的活性药物成分治疗侵袭性和转移性癌症提供了机会。
其他一些强效治疗性小分子药物,比如广泛用于治疗严重炎症和感染的皮质类固醇,或许可以通过靶向给药来限制其作用范围,使其仅作用于病变部位。皮质类固醇是具有免疫抑制特性的非常有效的药物。地塞米松就是一种具有重要临床应用价值的强效类固醇,但全身给药及其伴随的全身免疫抑制会带来严重的副作用,从而限制了其使用剂量和疗程。如果能通过靶向给药来治疗发炎组织,这些局限性可能会显著降低。pHLIPs 能够靶向发炎组织和纤维化部位,这很可能是通过靶向活化的巨噬细胞来实现的。
pHLIP 技术的特点
简而言之,pHLIP 肽会与肿瘤细胞或炎症组织细胞的表面结合,这些地方的酸性最为显著,随后折叠并以螺旋状穿过细胞膜插入。利用 pHLIP 的插入特性,如果货物连接在非插入端(细胞外递送),则货物可以定位在酸性细胞表面;如果货物通过在细胞质中不稳定的键连接在膜插入端,则货物可以直接递送并释放到细胞质中(细胞内递送)。与 pHLIP 靶向递送相关的优点如下:
细胞表面酸性和 pHLIP 定向不受克隆选择的影响。