本文综述了肽作为纳米载体在癌症治疗中的应用进展,包括作为自组装纳米颗粒的纳米载体基质、作为纳米载体表面修饰部分以实现靶向和/或穿透功能,以及作为纳米颗粒的酶响应连接子以触发药物释放。
作者:Guoqing Wei, Yi Wang, Xuehui Huang, Huabo Hou, and Shaobing Zhou*
1 引言
如今,癌症仍然是一种威胁人类健康的重要疾病。因此,癌症治疗研究越来越受到关注,纳米颗粒(NPs)作为一种递送系统也备受关注,因为它们可以通过增强渗透和滞留(EPR)效应在肿瘤部位富集。同时,纳米颗粒递送系统可以有效解决抗癌药物的溶解性问题,并增加抗癌药物的剂量。然而,仅仅依靠EPR效应远远不足以有效治疗癌症。为了进一步提高纳米颗粒的药物递送效率和相应的治疗效果,通过受体-配体结合增加肿瘤细胞对纳米颗粒的摄取的方法逐渐被引入,特别是对于靶向肽,如图1所示。
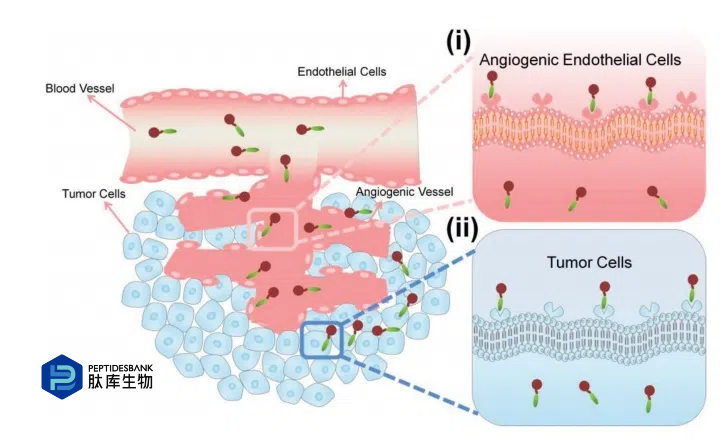
图 1 基于肽的纳米药物的两种主动靶向策略:i)靶向于血管生成内皮细胞,ii)靶向于肿瘤细胞。
主动靶向可以通过对纳米颗粒进行活性靶向配体的修饰,来有效增加癌细胞对纳米颗粒的摄取,并增强药物的治疗效果。这种配体能够特异性地识别肿瘤细胞表面或周围过度表达的受体。随着纳米医学的发展,纳米颗粒的单一靶向功能已无法满足纳米治疗的需求,肿瘤微环境触发的药物释放已成为肿瘤治疗的重点。同时,细胞器的靶向治疗以及各种治疗的组合逐渐进入纳米医学领域。由于巨大的生物学构象、合成技术的成熟以及特定酶、肽的响应逐渐开始在纳米颗粒的制备中得到应用。在此,我们总结了肽在生物医学应用方面的进展,例如自组装纳米颗粒的纳米载体基质、作为纳米载体表面修饰部分以实现靶向和/或穿透功能,以及作为纳米颗粒中酶响应连接子以触发药物释放(图2)。
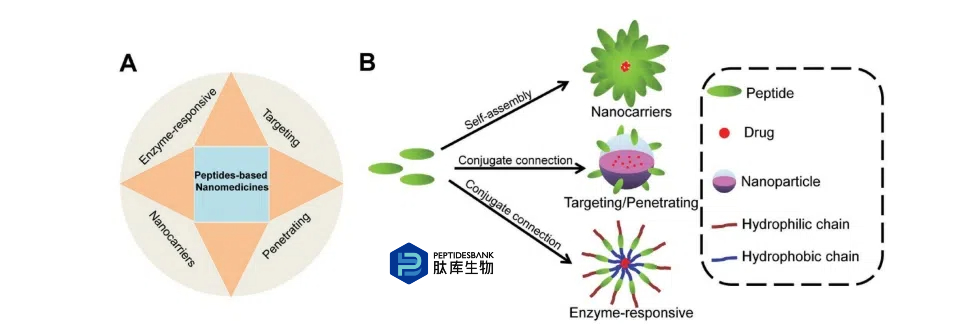
图 2. (A)用于生物医学应用的基于肽的纳米载体。(B)基于肽的纳米载体的各种功能。
2. 自组装肽纳米载体
肽或多肽本质上是生物大分子,由通过肽键连接的氨基酸单体组成。它们可以形成各种二级结构,包括β-转角、无规卷曲、β-折叠和α-螺旋。此外,它们还可以通过非共价超分子相互作用(范德华相互作用、静电力、氢键、亲水性和疏水性、π-π堆叠等)自组装成多种结构(胶束、纤维、带状物等)。因此,肽的自组装结构取决于肽中氨基酸的数量和序列,而肽的结构和性质为制备具有可控特性的纳米材料提供了可能性。到目前为止,已经开发出几种类型的肽基块(环肽),如芳香二肽、两亲性肽和多肽,用于构建基于肽的纳米材料。此外,与其他自组装两亲性分子相比,自组装肽基纳米颗粒在生物医学领域受到了更多的关注,因为它们具有许多优势,包括生物相容性、生物利用性、抗酶降解稳定性、生物安全性,以及封装亲水性药物,具有高载药量和低药物泄漏率。因此,近年来,一系列用于生物医学应用的自组装肽基纳米载体,特别是在癌症治疗领域,已经出现。
2.1. 基于肽的化疗纳米载体
化疗是癌症治疗的主要手段之一。由于其减轻药物副作用和提高治疗效果的能力,基于纳米粒子的药物递送系统在这一领域发挥了重要作用。由于 EPR 效应,自组装的基于肽的纳米粒子能够穿透肿瘤的漏血血管,通过内吞作用增强细胞内积累药物,并最终在不损害正常组织的情况下将其排出体外。因此,各种基于肽的纳米载体已被广泛报道,它们被用于携带化疗药物。
基于肽的杂化水凝胶通常用于药物输送。黄等人利用 Fmoc-二苯丙氨酸(Fmoc-FF)肽和魔芋葡甘聚糖(KGM)设计了一种新型肽-多糖杂化水凝胶,其性能优异(高水分含量、刚性和纳米纤维凝胶网络),作为水不溶性药物持续输送的载体具有特定性能。水不溶性药物释放的体外行为结果表明,通过改变 KGM 浓度、分子量、老化时间或β-甘露聚糖酶浓度,可以实现多西他赛的持续和可控释放。这项工作为制造 Fmoc-FF-KGM 杂化水凝胶作为持续释放药物的载体提供了新策略。
此外,可以从 PA 中制备肽水凝胶用于药物递送。Shirazi 等人利用与不同链长的脂肪酰基结合的精氨酸和赖氨酸合成了四种 PA 衍生物,其中只有 PA4 [K(C16)-R-K(C16)]在 2 小时孵育后能够增强抗 HIV 药物 2',3'-二脱氧-3'-硫代胞苷和磷酸肽(PEpYLGLD)在人白血病细胞或人卵巢细胞中的细胞摄取,其效果优于单独使用药物。同样,Li 及其同事利用一种表皮生长因子受体(EGFR)结合的 PA 构建了超稳定的自组装肽纳米囊泡(SPVs)。所得的 EGFR 靶向的 SPVs 不仅能有效封装治疗货物,还能向肿瘤部位递送更多的药物或质粒 DNA。因此,这种肽两亲体可能是癌症治疗领域中抗癌药物递送的多功能工具。
此外,PA 可以制备成肽水凝胶以实现药物的频繁递送。韦伯等人设计了一种肽水凝胶,然后将阿霉素递送至癌细胞,该水凝胶由 PA 组装而成,并通过可逆的蛋白激酶 A(一种细胞外癌症生物标志物)酶解离。肽两亲体 KRRASVAGK[C12]-NH2 的特定共识基序(RRXSO,X:任何残基,O:疏水)是形成原纤维结构的关键因素。这种负载药物的肽两亲体能够在 7 小时内以 40%的释放率释放阿霉素,导致所有乳腺癌细胞系 MDA-MB-231 死亡。结果表明,这种动态组装递送药物是一种很有前景的靶向药物递送方法。
海恩斯-巴特里克等人设计了一种姜黄素递送肽水凝胶(VKVKVKVKVDPLPT-KVKVKVKV-NH2),它能够响应介质离子强度的增加而凝胶化。在低强度离子缓冲液中,pH 值为 7.4 时,可以防止肽的折叠,由于带电赖氨酸残基之间的侧向和面部静电排斥作用,该肽可以通过自组装形成β-折叠发夹结构。这种肽水凝胶能够在两周内持续释放姜黄素(4×10−3 m) )。这种肽水凝胶具有剪切稀化特性,能够在生理条件下增加药物稳定性,并保持其生物活性。同样,刘等人将姜黄素封装在一种肿瘤靶向的自组装肽纳米纤维中,该纳米纤维由 Nap-GFFYGRGD 形成,封装效率为 32%(在 5 毫克/毫升的浓度下,0.5×10−3 毫克的姜黄素被该肽封装)。该递送系统能够在 2 天内持续释放 60%的姜黄素,并且在αvβ3整合素阳性 HepG2 肝癌细胞中有很高的细胞摄取率。在小鼠模型中进行注射后,发现该肽纳米纤维能够聚集在肿瘤组织中。
为了增强治疗药物在肿瘤部位的特定积累并提高抗癌药物的治疗效果,丁等人设计并制备了一种基于多功能多嵌段聚氨酯(MMPU)的新型智能纳米载体。体内结果显示,智能纳米载体能够选择性地将紫杉醇运载到肿瘤组织中,然后由于肿瘤组织内部的细胞酸性环境而可控地释放紫杉醇。因此,它能够改善药物的生物分布,并产生优异的抗肿瘤活性(图3)。
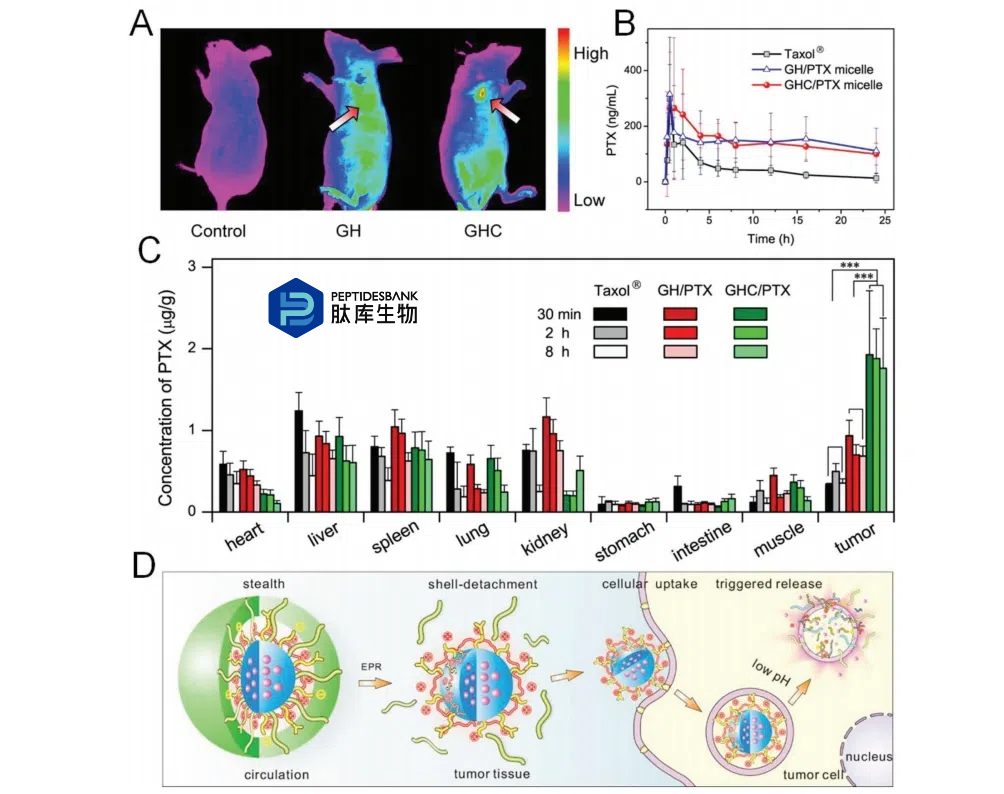
图 3 。A) 荷瘤小鼠的荧光图像,显示荧光标记的MMPU纳米体在体内的分布。B) 不同组大鼠的药代动力学参数。C) 不同组在不同时间点静脉注射后组织中总PTX的分布情况。D) 药物负载的MMPU纳米载体的靶向细胞内递送示意图。
阿拉姆等人报道了基于肽的纳米粒子,它们可以通过二肽甲硫氨酸脱氢苯丙氨酸(MΔF)在水相和有机相混合物中的自组装形成。亲脂性姜黄素可以负载在这种纳米粒子中,并有效释放。此外,姜黄素负载在MΔF纳米粒子[(Cm)NPs]中后,其水溶性不仅增强,而且对各种癌细胞系的细胞可用性和细胞毒性也增加。体内结果表明,这种纳米药物可以延缓B6F10黑色素瘤小鼠模型的肿瘤生长,并延长生存时间。
2.2. 基于肽的光疗纳米载体
光疗是治疗癌症的极具吸引力的非侵入性技术,包括光动力疗法(PDT)和光热疗法(PTT)。与化疗和放疗相比,光疗具有更好的空间选择性和侵袭性,因为它没有显著的全身性毒性副作用。要实现光疗,必须有两个过程:(i)尽可能多的光疗剂转移到肿瘤部位;(ii)光疗剂必须通过用特定光线照射肿瘤部位而被激活。肽与光吸收分子之间的相互作用为调整光敏剂和光热剂的物理化学性质提供了机会。因此,为了提高光疗的治疗效果,由于其出色的生物相容性和生物降解性,自组装肽纳米结构在光疗中具有很高的潜力。
Hell 等人设计并制备了由短肽自组装的体积极体,短肽的序列为 Ac-Ala-Ala-Val-Val-Leu-Leu-Leu-Trp-Glu-Glu,并在短肽摩尔过量十倍的情况下成功负载了疏水性光敏剂——锌卟啉。在光照射下,负载锌卟啉的肽体对 COS-7 细胞显示出显著的光细胞毒性。相比之下,对照组中的游离锌卟啉组和不含锌卟啉的肽体组均未显示出显著的细胞毒性,这表明肽体通过增强光敏剂的细胞内化增加了光动力疗法(PDT)。Zhang 及其同事设计了一种两亲性的线粒体靶向嵌合肽基药物递送系统(DDS)。由于引入了(KLAKLAKK)2,该 DDS 能够在线粒体中实现原位 PDT,并且产生的活性氧物质(ROS)显著破坏了线粒体,从而显著降低了细胞内腺苷三磷酸(ATP)的含量,以克服耐药性。
肽序列可以根据不同的功能进行定制,这是基于短肽的纳米材料的优势。李等人报道了光敏剂-肽偶联的自组装纳米颗粒,可作为靶向光动力治疗(PDT)的药物递送系统。偶联物PpIX-R9GPLGLAGE8由光敏剂卟啉(PpIX)、细胞穿透肽R9、基质金属蛋白酶-2(MMP-2)敏感肽GPLGLAG和掩蔽肽E8组成。在正常组织中,R9会被E8通过静电吸引力阻断。然而,在肿瘤部位,由于MMP-2蛋白的过度表达,GPLGLAG会解离抑制多阴离子,并释放细胞穿透肽(CPP)-PpIX用于PDT(图4)。体内结果表明,可激活的细胞穿透肽(ACPP)-PpIX偶联物能够有效地聚集在肿瘤部位。
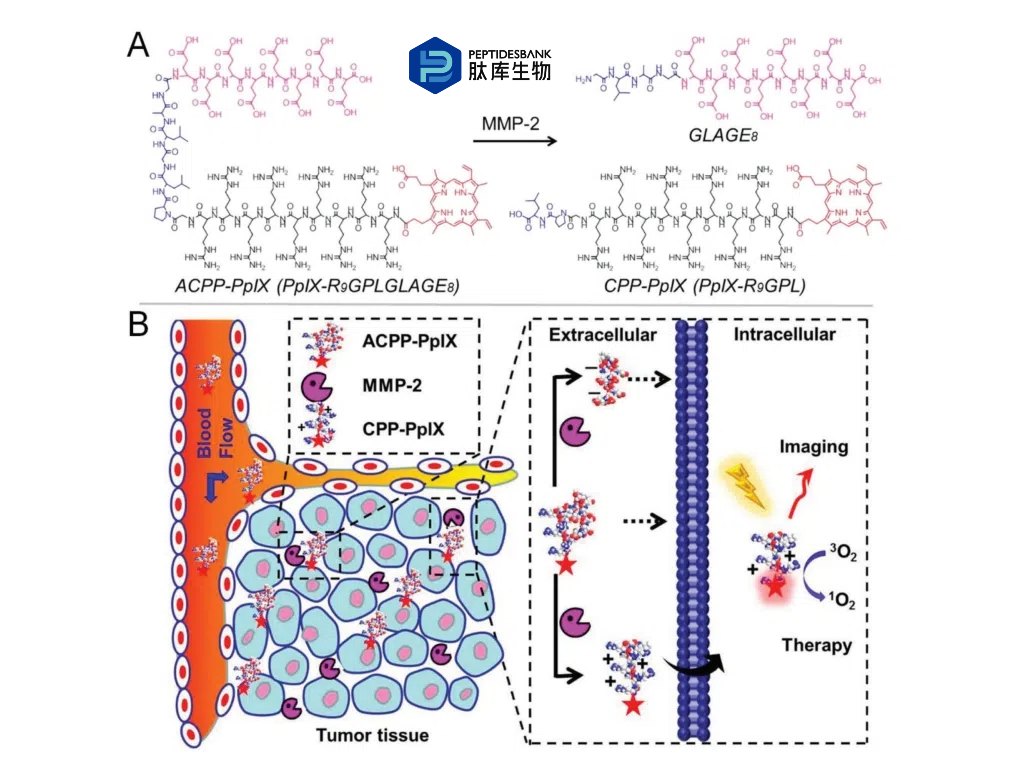
图4. A) 基质金属蛋白酶-2(MMP-2)触发可激活细胞穿透肽-卟啉(ACPP-PpIX)的结构转化。B) ACPP-PpIX的示意图。阳离子细胞穿透肽(CPP)的细胞穿透功能被通过蛋白酶裂解连接器连接的阴离子肽通过分子内静电相互作用所阻断。一旦ACPP-PpIX缀合物到达肿瘤组织,它会被过表达的细胞外MMP-2激活。阳离子CPP可以自由地将PpIX带入细胞,用于诊断成像和光动力治疗(PDT),在照射下进行。
由于疏水和亲水基团的存在,二苯丙氨酸(FF)具有多种纳米结构。作为一种共组装肽,与其他自组装肽相比,FF可以调节各种功能分子的自组装。最近,Yan及其同事设计并制备了一种基于光敏剂的肽调节自组装,并证明这是一种增强光敏剂光动力治疗(PDT)的有效策略。他们还证明,两亲性二肽、阳离子二苯丙氨酸(H-Phe-Phe-NH2·HCl)甚至一种氨基酸(9-芴基甲氧羰基-L-赖氨酸)都可以基于多种弱分子间相互作用(静电力、π-π堆叠和疏水相互作用)来诱导基于Chlorin-e6(Ce6)的纳米工程(图5A)。重要的是,这些纳米颗粒不仅可以提高光敏剂的负载效率,还能对肿瘤微环境(pH、洗涤剂和酶)有显著响应,促进光敏剂的选择性释放。体外实验结果显示,对于多种肿瘤细胞,纳米颗粒表现出更好的内化(图5B)。与 Ce6 组相比,这种纳米粒子能使 Ce6 的光细胞毒性增强四倍(图 5C)。体内荧光图像证实(图 5D),在注射后 24 小时,它能够选择性地在荧光甲氧羰基-L-赖氨酸(Fmoc-L-Lys)/Ce6 纳米颗粒(FCNPs)和阳离子二苯丙氨酸(CDP)/Ce6 纳米颗粒(CCNPs)的肿瘤中聚集。此外,在对小鼠进行 PDT 治疗后,没有出现明显的器官损伤,体重也没有变化,这进一步表明这是一种具有高度生物相容性的纳米材料,即由肽调节的 Ce6 纳米结构。
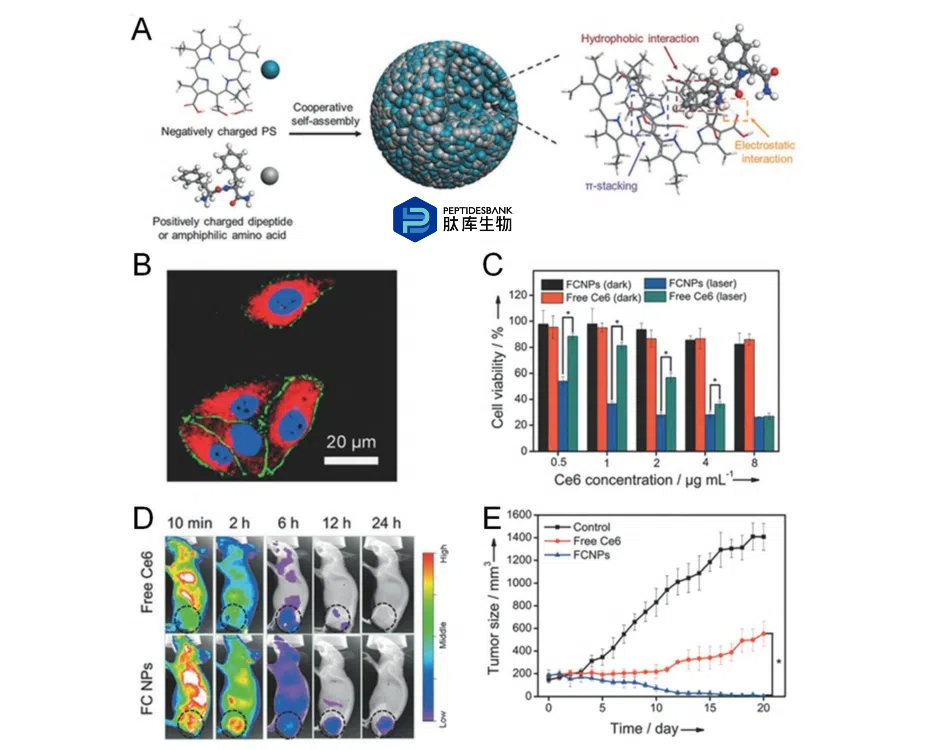
图 5 。A) 通过两亲性二肽调节或氨基酸调节的自组装来制造光敏纳米粒子。B) 在体外对组装好的纳米粒子进行细胞内化。蓝色细胞核通过 Hoechst 33342 染色。绿色细胞膜通过 Alexa 488 染色。红色染色表明是功能化碳纳米粒子。C) 在不同浓度(有或无照射)下,功能化碳纳米粒子和游离的 Ce6 的细胞毒性。D) 在不同时间点,通过尾静脉静脉注射功能化碳纳米粒子和游离的 Ce6 到荷 MCF7 肿瘤的裸鼠的荧光图像。黑色圆圈表示肿瘤部位。E) 不同组小鼠的肿瘤生长曲线。
王及其同事报道了一种响应性小分子P18-PLGVRGRGD(1),它由三部分组成,包括功能分子紫精18(P18)、酶响应肽连接子Pro-Leu-Gly-Val-Arg-Gly(PLGVRG)和靶向配体Arg-Gly-Asp(RGD)(图6A)。由于在肿瘤部位通过自组装形成纳米纤维的组装诱导保留效应,P18-PLGVRGRGD能够增强成像信号和治疗效果。在体内条件下,P18-PLGVRGRGD被动扩散在生物系统中,并通过RGD配体靶向到在癌细胞膜上过度表达的αvβ3整合素。然后,PLGVRG连接子在肿瘤微环境中被过度表达的明胶酶选择性地切割,分子的疏水性增强,空间位阻降低,这进一步导致在生理条件下自组装形成纳米纤维(图6B)。重要的是,自组装的纳米纤维在原位形成,这种纤维状纳米结构表现出增强的光声信号和PTT疗效。体内实验结果进一步证实,肽类和其他官能团的自组装作为癌症诊断和治疗的新型策略具有巨大潜力。
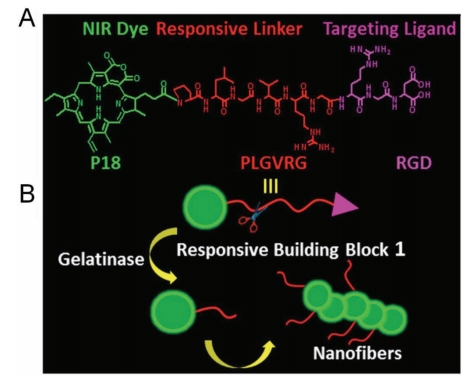
图 6. (A)响应性构建单元的分子结构。(B)明胶诱导自组装的示意图。
多肽作为光敏剂的药物递送载体,因其内在的生物特性而备受关注。卡诺等人证明,通过聚(乙二醇)-接枝聚(L-赖氨酸)(PLL-g-PEG)递送卟啉钠对光敏剂的有效运输和改善其光动力疗法(PDT)具有作用。卟啉钠光敏剂已被证明对各种癌症有效;然而,皮肤的光毒性反应的延长无法有效避免。为了解决这个问题,目前,亲水性肽与疏水性光敏剂结合,形成两种两亲性分子用于光动力疗法。例如,马等人合成了两亲性胶束,其中包含四段 PLL 作为亲水性外壳和疏水性卟啉作为胶束的核心。
此外,吴等人设计了一种两亲性多肽,即聚(乙二醇)-β-聚(L-赖氨酸)-β-聚(L-亮氨酸)(PEG-PLL-PLLeu),通过掺入具有疏水侧链的氨基酸和一种封装吲哚菁绿(ICG)的胶束(PEG-PLL-PLLeu-ICG)。在这些胶束中,PLLeu 形成了疏水核心,而 PEG 形成了亲水外壳。通过疏水相互作用以及亲水头的静电吸引力相互作用,ICG 与疏水核心相关联。与游离 ICG 组相比,PEG-PLL-PLLeu-ICG 胶束组中 ICG 的量子产率和荧光稳定性显著提高。此外,PEG-PLL-PLLeu-ICG 胶束具有高细胞摄取率、出色的被动肿瘤靶向能力和长循环时间,表明 PEG-PLL-PLLeu-ICG 可用于肿瘤诊断、成像和光热治疗等领域。
在体内环境中组装的复合物中,肽与光敏剂之间的非共价相互作用是它们存在的主要形式,这些复合物通常会解离并释放光敏剂。多肽通常会经过多功能基团修饰,以用于药物输送系统。袁等人提出,PLL可以作为构建光动力治疗可追溯探针的聚合物主链。他们使用二异丙基氨基(DPA)、叶绿素A(PheA)和四苯基硅酮(TPS)对PLL进行功能化(图7)。PEG进一步与靶向配体结合。在生理条件下(pH 7.4),该探针显示出低光毒性和弱PheA的红荧光,但TPS的强绿荧光。相比之下,在酸性溶酶体(pH 5.0)中,绿荧光减少,红荧光增加,因为该探针可以被癌细胞选择性地内化和被溶酶体捕获。此外,在光照射下,由PheA诱导产生的活性氧物质可以导致溶酶体膜破坏,并随后导致探针向细胞质泄漏(pH 7.2)。因此,这种探针是可追溯癌症治疗的有力工具。

图 7 。A)PLL-g-PEG/DPA/TPS/PheA(探针 1)的结构组成。B)其对 pH 值的敏感行为。C)探针 1 在癌细胞中的自追踪、癌细胞成像和光毒性恢复过程的示意图。
由于纳米颗粒的几何形状在细胞内化中起着重要作用,通过利用一种对酸度有反应的嵌合肽,Han 等人设计了一种具有几何形状开关的纳米颗粒,能够增强肿瘤内化和光动力疗法。在生理条件下,这种嵌合肽能够自组装成球形纳米颗粒,而在肿瘤细胞外酸性微环境中,由于嵌合肽之间离子互补性的随后恢复,球形纳米颗粒变成了棒状纳米颗粒。体外和体内研究表明,这种酸度触发几何形状转换的嵌合肽能够延长纳米颗粒在肿瘤组织中的积累,并加速肿瘤细胞的内化。此外,它能够极大地增强光动力疗法,且副作用极小。
3. 靶向肽
为了将化疗药物递送至肿瘤部位,同时对正常组织造成最小损伤,有效的方法是找出肿瘤部位与正常组织部位之间的差异。癌细胞及其相应的组织与正常细胞不同,它们在表面上表达一组不同的分子。这一特性使得癌细胞成为药物递送的潜在靶点。在此,我们对近年来发现的针对血管内皮细胞和癌细胞表面受体的肿瘤归巢肽进行了总结。
3.1. 肽类物质向肿瘤血管的靶向
肿瘤血管与正常血管不同。最重要的区别在于肿瘤血管是不完整且漏血的(EPR 效应)。仅仅依靠低水平的 EPR 效应,进入肿瘤部位的药物量非常少,而且总是效果不佳。因此,作为活性靶向配体的功能化多肽变得尤为重要。与其他靶向配体相比,多肽具有出色的生物相容性和多样性。目前,在癌症血管中检测到大量相对于正常细胞特异性表达或过度表达的受体靶点。主要的内皮细胞(EC)归巢肽列于表 1 中。
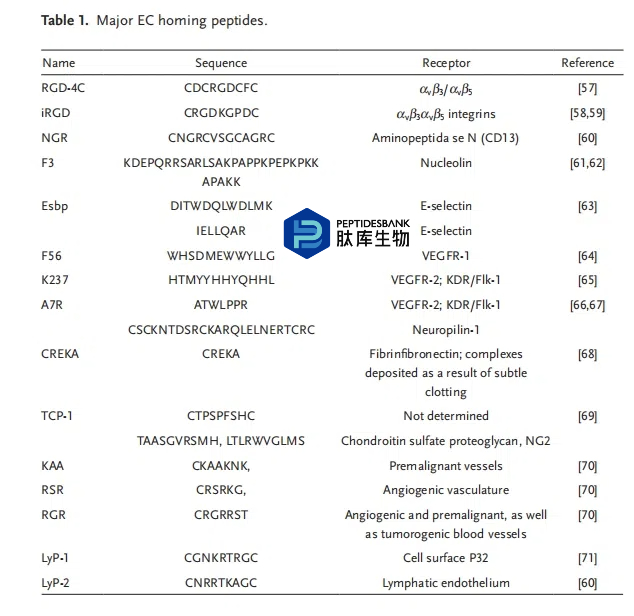
整合素在细胞与细胞外基质之间的黏附相互作用的介导中发挥着重要作用,它们是细胞黏附受体。尽管整合素在各种细胞和癌细胞的表面均有表达,但在大多数肿瘤血管中其表达上调。αVβ3 和αVβ5 整合素是最常见的整合素,被用作抗血管生成的靶点,其他整合素也可作为治疗靶点。
RGD(精氨酸/甘氨酸/天冬氨酸)序列肽是靶向肿瘤血管最广泛使用的靶配体。萨曼塔等人制备了一种仅含RGDGW基序的RGDGWK-脂肽,用于将抗癌p53基因递送至培养细胞,优选通过α5β1整合素。这种脂肽被用于治疗携带侵袭性B16F10肿瘤的C57BL/6 J小鼠。结果显示,RGDGWK-脂肽能够靶向基因至肿瘤血管,并通过肿瘤内皮细胞凋亡明显抑制肿瘤生长。埃尔达尔-布克等人使用一种双环肽E-[c(RGDfK)2]作为血管靶向配体,通过与αVβ3整合素受体结合,选择性地将化疗药物紫杉醇(PTX)递送至肿瘤细胞及其周围的肿瘤内皮细胞。在小鼠的原位研究中,与接受游离PTX治疗的小鼠相比,这种含RGD的缀合物优先聚集在肿瘤部位,并增强了抗肿瘤效果,显著降低了毒性。施费尔勒斯等人将一个环状5个残基的RGD(c(RGDf(ε-S-乙酰硫乙酰基)K)与脂质体偶联。这些经环式 RGD 肽修饰的脂质体通过靶向作用将自身重新导向体外和体内的血管生成内皮细胞,这些细胞在肿瘤血管中过度表达。
CD13 是一种膜结合酶,与肿瘤血管生成有关,在肿瘤血管和血管周围细胞中优先上调。CD13 配体也是一类含天冬酰胺-甘氨酸-精氨酸(NGR)序列的肽,具有靶向血管生成的能力。线性 NGR 肽和环状 NGR 肽都显示出合适的生物分布和疗效。此外,在一些研究中,环状 NGR 肽被报道比线性肽具有更高的亲和力。然而,环状 NGR 通常使用不稳定的二硫键,这可能会对纳米颗粒的靶向造成问题,因为纳米颗粒表面的相邻肽之间会形成二硫键。为了解决这个问题,Negussie 等人设计了一种新型无二硫键的环状 NGR 来修饰脂质体,以靶向血管生成的血管。事实证明,脂质体具有足够的结合亲和力,可用于生物应用。
尽管 NGR 是一种广泛用于纳米材料和药物功能化的肿瘤血管靶向肽基序,但 NGR 具有很强的快速脱氨基倾向,这会导致 CD13 识别受损。
Corti 等人制造了完全修饰为甘氨酸 N-甲基化的 NGR 标记纳米载体,以完全防止天冬氨酸脱氨。这种甲基化的 NGR 可用作有效的肿瘤归巢配体。Wang 等人制造了 NGR 修饰的紫杉醇(DTX)负载的 PEG-b-PLA 聚合物胶束(NGR-PM-DTX)。这些胶束能够促进 CD13 过表达的内皮细胞的摄取。在携带 HT1080 肿瘤异种移植物的 BALB/c 小鼠中,NGR-PM-DTX 组具有更强的抗肿瘤功效,且体重变化较小。Zhou 等人使用 iNGR 修饰脂质体以实现肿瘤血管靶向。体内成像研究和免疫荧光均证明,iNGR 修饰的脂质体能够显著增加在肿瘤组织并穿透到深层肿瘤组织。
由于血管内皮生长因子受体 1(VEGFR-1/Flt-1)和血管内皮生长因子受体 3(VEGFR-3)在各种肿瘤相关血管内皮细胞上均有表达,因此 VEGFR-1 和 VEGFR-3 是抗肿瘤归巢肽合理的肿瘤相关血管内皮细胞靶点。Wang 等人研究了新的肿瘤血管靶向纳米粒子,即负载长春新碱的F56肽偶联纳米粒子(F56-VCR-NP)。F56肽与 VEGFR-1 具有高亲和力和特异性结合,导致高内化率。体内和体外实验表明,F56-VCR-NP 能够准确靶向结直肠癌(CRC)的新生血管,并引发纳米粒子在肿瘤血管内皮细胞内的内化,显著延长小鼠存活期,且无明显毒性。
KDEPQRRSARLSAKPAPPKPEPKPKKA-PAKK 肽(F3)是一种 31 个氨基酸的肽,能够优先靶向肿瘤血管和肿瘤。作为一种肿瘤归巢肽,F3 通常被嫁接到纳米颗粒表面,以靶向肿瘤血管,增加纳米颗粒中的肿瘤血管生成。胡等人通过马来酰亚胺-硫醇偶联反应将 F3 肽连接到功能化纳米颗粒的表面。在与穿透性肽(tLyp-1 肽)共同给药后,F3 纳米颗粒在肿瘤部位显示出增强的积累以及在肿瘤组织中的深度渗透。用双功能纳米颗粒治疗的颅内 C6 神经胶质瘤小鼠存活时间最长,这表明通过联合使用肿瘤归巢和穿透肽与功能化纳米颗粒的策略具有显著的治疗效果。冯等人用 F3 肽对纳米粒子进行功能化处理,使其具有肿瘤归巢能力,并进一步与原卟啉 a(PPa)偶联,用于耐药性癌症的化学光动力联合治疗。这些纳米粒子在肿瘤部位表现出更显著的富集,并延长了荷人结肠腺癌小鼠的存活时间。
Esbp 肽(DITWDQLWDLMK)与 E-选择素具有高亲和力结合,也可用作血管靶向的 E-选择素结合肽。沙梅等人合成了 N-(2-羟丙基)丙烯酰胺共聚物,并将其与 E-选择素结合肽(Esbp,DITWDQLWDLMK)偶联,并使其与化疗药物阿霉素(P-(Esbp)-阿霉素(DOX))或促凋亡肽 D(KLAKLAK)2(P-(Esbp)-KLAK)偶联。这种前药聚合物形成了针对肿瘤血管的载药纳米粒子。与非靶向共聚物或游离的 DOX 相比,这种针对肿瘤血管的纳米颗粒能更显著地降低原发性路易斯肺癌肿瘤的生长率,并延长荷瘤小鼠的存活期(图 8)。

图 8. 不同组别静脉注射后 B16 C57BL/6 小鼠体内肿瘤抑制情况。
3.2. 肽类物质对癌细胞的靶向作用
由于肽类更容易进入血液和淋巴管,因此肿瘤相关血管模态的治疗靶点比肿瘤细胞更容易实现;然而,针对肿瘤细胞的靶向肽类已经被识别和表征。EGFRs(ErbB1)在多种人类癌细胞中过度表达,因此被视为可能的靶点。大多数肿瘤细胞表面靶向肽类列于表2中。
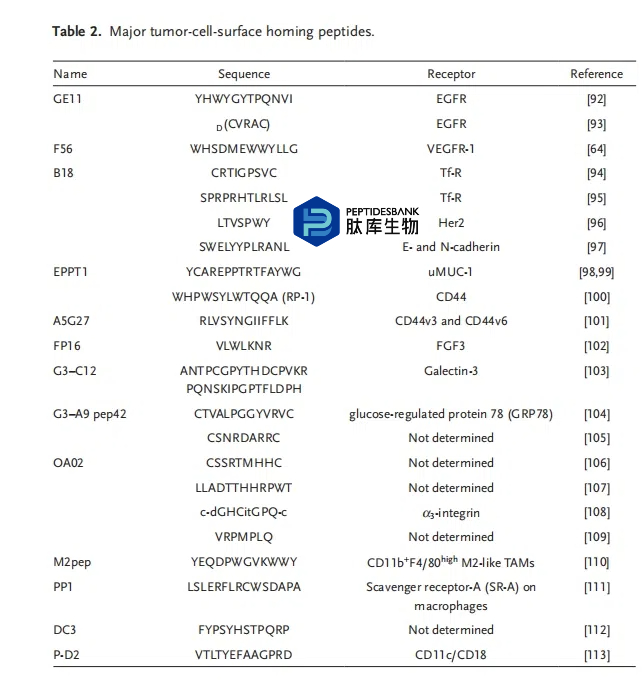
顾及其同事发现了一种名为 GE11(YHW-YGYTPQNVI)的归巢肽序列,它能够选择性地且高效地与其受体结合。GE11 能够被内化进入表达 EGFRs 的肿瘤细胞,其有丝分裂活性比 EGF 低得多,这使其成为药物偶联研究的绝佳肽候选物。
Cardo-Vila 等人设计了一种基于 EGFR相互作用位点 CVRAC(EGFR 283 - 287)的逆转录酶抑制性肽类似物化合物 D(CVRAC),它能被西妥昔单抗识别,并抑制西妥昔单抗的结合。VEGFR-1 和 VEGFR-3 也是抗肿瘤归巢肽的合理靶点,因为它们也在多种人类肿瘤细胞中表达。实际上,开发出了一组带有 CSDxxHxWC 共有序列(其中 x 代表任何氨基酸)的肽家族,用于靶向 VEGFR-3。
转铁蛋白受体(Tf-R)是一种跨膜蛋白,是细胞铁稳态和增殖的关键调节因子。它与铁载转铁蛋白相互作用,将铁导入细胞。转铁蛋白受体在正常细胞中表达水平较低,但在快速增殖的细胞(包括恶性细胞)中表达水平较高,其过度表达与不良预后相关。与正常脑组织相比,转铁蛋白受体(Tf-R)在人类胶质母细胞瘤中的基因表达比率最高。
斯塔奎尼等人证明,环状铁模拟肽 CRTIGPSVC 能够靶向转铁蛋白(Tf)和转铁蛋白受体(Tf-R)的蛋白质复合物。通过一种非经典的别构结合机制,这种功能性蛋白质复合物介导了相应的病毒颗粒进入正常小鼠大脑。通过噬菌体展示鉴定出的B18肽(SPRPRHTL-RLSL)也与 Tf-R 阳性癌细胞结合,并能特异性地靶向 Tf-R1 阳性肿瘤组织(图 9)。
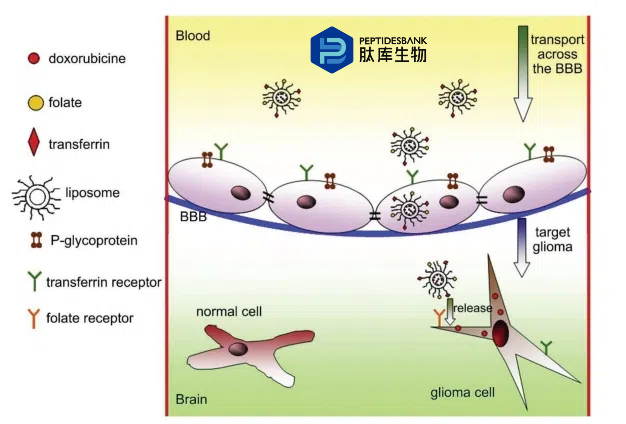
图 9. 经双靶向配体修饰的脂质体向神经胶质瘤递送阿霉素的示意图。
LTVSPWY 是一种通过生物淘盘程序鉴定出的归巢肽,据报道,当与寡核苷酸结合时,它能够选择性地将反义寡核苷酸递送至 HER2 阳性肿瘤细胞。低糖基化黏蛋白-1 抗原(uMUC-1)是肿瘤发生的早期标志物之一,也是良好的肿瘤靶点。在组织中,黏蛋白-1 高度糖基化,而在肿瘤组织中(即几乎所有人类上皮和非上皮癌细胞以及血液恶性肿瘤中),它以糖基化的形式存在,并暴露出在正常细胞中被掩盖的表位。合成肽 EPPT1(YCAREPP-TRTFAYWG)源自针对人类上皮癌细胞制备的单链抗体(ASM2)的互补决定区Ⅲ(CDR3)Vh 区域,对源自 uMUC-1 的肽 PDTRP 的细胞外结构域表现出高结合亲和力。CD44 是一种细胞表面糖蛋白,由许多细胞类型表达,包括白细胞、成纤维细胞、上皮细胞、角质形成细胞以及一些内皮细胞。一种 CD44 特异性肽WHPWSYLWTQQA(RP-1)对胃癌细胞和组织表面的CD44表现出亲和力和特异性。
Pep42 是一种内化的二硫键桥接的 13 个氨基酸的肽(CTVALPGGYVRVC),是从人类黑色素瘤细胞系(Me6652/4)的噬菌体展示筛选中发现的。Pep42 的细胞受体被鉴定为葡萄糖调节蛋白78(GRP78),它是热休克蛋白家族的一员,位于恶性癌症的质膜上。含有组织蛋白酶B裂解连接子的 Pep42 药物偶联物能够实现 PTX、DOX 和 D(KLAKLAK)2 的细胞内递送。钟等人发现,用 cNGQGEQc 肽功能化的可逆交联的嵌合体聚合物体能够介导Polo样激酶1特异性siRNA(siPLK1)的高效靶向递送至裸鼠的局部人类肺癌。
4. 细胞穿透肽
脂质体和蛋白质是细胞膜的两个主要组成部分,细胞膜成为进入细胞的天然屏障。由少于 30 个氨基酸组成的 CPPs 能够穿透细胞膜,并将不同的货物转移到细胞内。精氨酸和赖氨酸等碱性氨基酸在 CPPs 中总是丰富;这使得细胞穿透肽能够很好地穿透细胞膜并进入细胞。大多数肿瘤细胞表面归巢肽列于表 3 中。
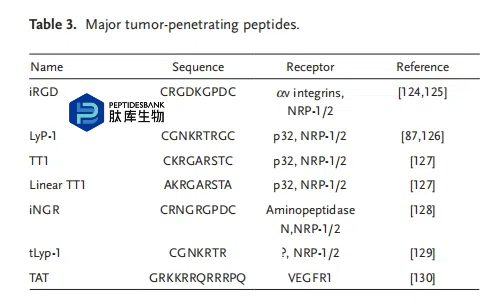
由于 CPPs 能够穿透细胞膜并将物质递送至细胞内,因此 CPPs 常在纳米颗粒表面进行修饰,以增强纳米颗粒进入细胞的效力。Sawant 和 Torchilin将 CPPs(TATp)连接到负载紫杉醇的胶束的亲水端。与未接枝 CPPs 的胶束相比,这些经 TATp 修饰的胶束进入肿瘤细胞更多,对肿瘤细胞的毒性更强。Takara 等人制备了同时包含细胞靶向肽和细胞穿透肽的脂质体。对包裹阿霉素的双配体脂质体的抗肿瘤活性进行了评估。与临床上用于靶向肿瘤细胞的阿霉素(DOX)相比,这种双配体脂质体具有更好的治疗效果。Yoo 等人设计了支化聚 CPP 结构分子,以在癌细胞中实现出色的传递效果和选择性基因释放。与传统的 CPP 相比,这种新型聚 CPP/pDNA 聚集体具有氧化还原裂解性和高转染效率。体外实验结果表明,这种聚集体能够更好地聚集到肿瘤部位,对肿瘤具有更好的抑制作用。
5. 酶响应肽
迄今为止,刺激响应型纳米粒子一直是改善药物递送最有用的手段之一,并且能够对内部或外部的肿瘤刺激做出反应。据我们所知,有许多酶在肿瘤组织或细胞中过度表达(例如,凝集素、基质金属蛋白酶),因此近年来,设计酶激活型靶向纳米粒子已成为癌症治疗研究的热门话题。
Han 等人报道了双酶敏感的吉西他滨(GEM)纳米载体,其由基质金属蛋白酶-9(MMP-9)可拆卸的 PEG、组织蛋白酶 B 可裂解的 GEM 以及靶向配体 CycloRGD 与 CdSe/ZnS 量子点偶联而成(图 10)。在通过 EPR 效应使 GEM 纳米载体在肿瘤组织中积累后,肿瘤组织中过度表达的 MMP-9 能够使 PEG 的保护层破裂,从而暴露 cRGD 以增加细胞内化。一旦内化在胰腺癌细胞中,溶酶体组织蛋白酶 B 能够进一步促进吉西他滨(GEM)的释放。因此,双重酶促反应不仅能够延长吉西他滨纳米载体的循环时间,还能增强细胞内化和有效药物释放。为了证实双重酶促反应辅助吉西他滨递送系统的机制,进行了全面的体外和体内测试。实验结果表明,吉西他滨纳米载体向无活性的 2',2'-二氟脱氧尿苷的脱氨作用受到的抑制比游离吉西他滨更显著。同时,肿瘤组织中吉西他滨的浓度显著增加,显示出优越的肿瘤抑制活性,且副作用最小。

图10. 双酶反应辅助的GEM纳米载体用于实现多阶段肿瘤细胞靶向和在GEM运输过程中的有效药物释放。A) 纳米载体的制备和响应过程的示意图。B) 负载药物的纳米载体在胰腺癌细胞中的药物释放过程的示意图。
为了实现吡非尼酮(PFD)在肿瘤基质中的特异性释放,Nie 及其同事构建了一种基质金属蛋白酶-2(MMP-2)响应型肽偶联脂质体(MRPL),它由一种精心设计的 MMP-2 响应型两亲性肽和一种磷脂(L-α-磷脂酰胆碱)组成。首先,通过利用富含 MMP-2 的病理环境,PFD 可以从负载 PFD 的 MRPL(MRPL-PFD)中特异性地在胰腺肿瘤部位释放。其次,药物的释放可以下调由胰腺星状细胞表达的细胞外基质(ECM)的多个成分。最后,上述结果能够促进化疗药物进入深层肿瘤组织。这种巧妙的设计可能为构建功能性脂质体以调节基质 ECM 提供一种实用的方法,因为其操作简便且具有肿瘤特异性药物递送能力。
这种对 MMP-2 敏感的肽在设计用于联合光动力疗法(PDT)和基因治疗的药物递送系统以及用于聚集诱导发光引导的光动力疗法方面也被发现是有效的。
张及其同事设计了一种 pH 敏感型嵌合肽,即 Fmoc-12-氨基十二烷酸-H8R8-PLGVR-PEG8(简称为 Fmoc-ADDA-H8R8-PLGVR-PEG8 嵌合肽),用于同时递送光敏剂原卟啉 IX(PpIX)和 DNA 以进行癌症治疗。如图 11 所示,在这种两亲性嵌合肽中,Fmoc-ADDA-H8 序列在生理 pH 值下为疏水基团,能够负载 PpIX,而 CPP 序列 R8 则用于结合 DNA。此外,该嵌合肽通过基质金属蛋白酶 2(MMP-2)底物肽(PLGVR)连接子,在肿瘤部位可被切割,并且能够去除外层的聚乙二醇(PEG),从而暴露阳离子 CPP 序列,这进一步增加了肿瘤细胞对纳米颗粒的特异性摄取。此外,纳米颗粒可通过 H8 序列的质子化从内体/溶酶体中逃逸,同时加速 PpIX 的释放。
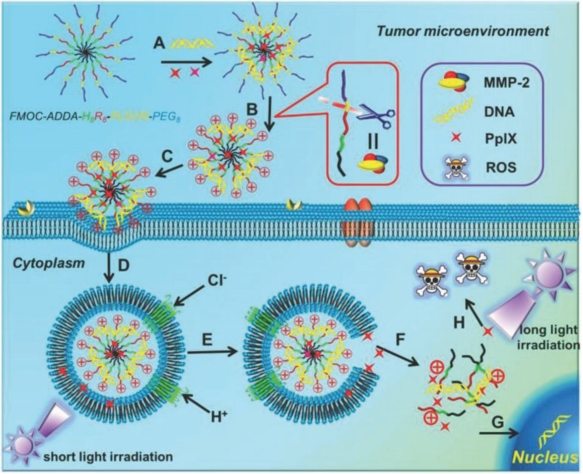
图 11. 嵌合肽/PpIX/p53 系统向癌细胞递送 DNA 和 PpIX 的示意图。
同样,周等人利用基质金属蛋白酶-2 敏感肽设计了一种编程酶、光和温度多敏感的脂质体(ELTSL)囊泡,以克服连续障碍,增强三阴性乳腺癌(TNBC)的治疗效果。这种新型脂质体纳米平台由酶可裂解的 PEG 冠层、光响应性 PPa 和 TSL 组成。此外,奥沙利铂的亲脂性前药和水溶性药物阿霉素可以以预定的摩尔比同时负载其中(图 12A)。图 12B 展示了联合癌症治疗。首先,ELTSL 可以通过 EPR 效应特异性地聚集在肿瘤部位,然后 PEG 外壳随后通过 MMP-2 介导的对肽间隔子的裂解而分离,以深入肿瘤间质。其次,无 PEG 的 ELTSL 可以有效地内化到肿瘤细胞中。最后,在近红外(NIR)激光照射下,PPA 可以产生荧光信号和温和的温热效应,可用于实现肿瘤细胞中图像引导的药物释放;同时,诱导活性氧的产生以进行光动力治疗。因此,这项工作为光动力治疗和三阴性乳腺癌的化疗联合提供了一种新颖且有效的策略。

图 12. A)基质金属蛋白酶 - 2(MMP - 2)可释放的 ELTSL 的化学结构,其与亲脂性奥沙利铂前药 HOC 和亲水性药物 DOX 共负载。B)用于癌症联合治疗的智能且通用的 ELTSL 的示意图。
酶触发敏感纳米探针的原位形成在生物成像和疾病诊断中也显示出高效率。王等人报道了一种新的光声纳米探针,它由三个关键成分组成:疏水卟啉-18(P18)、一种肽(GKGSFGFTG)和一种聚酰胺胺树枝状聚合物。其中,响应性肽(GKGSFGFTG)可以被自噬标志物酶(即ATG4B)裂解;之后,疏水P18残基可以自聚集,最终形成纳米纤维结构,以增强PA信号。因此,可以通过测量PA信号的强度来定量评估ATG4B活性和自噬水平。此外,这种纳米探针可用于评估化疗期间肿瘤的自噬情况,这有助于优化治疗方案并改善患者的医疗保健。
除了上述应用外,酶响应肽还与其他环境响应因子结合,用于药物的递送。顾及其同事设计了肿瘤特异性两亲性多刺激激活树枝状聚合物前体药物(DPs),以触发多种途径来抑制化疗耐药的多个细胞因子。其中,肿瘤微环境基质金属蛋白酶敏感肽(GPLGLAG 序列)旨在加深肿瘤渗透并促进细胞摄取,细胞质可还原裂解二硫键用于充分释放封装药物,亚细胞溶酶体酸不稳定酰胺键用于动态偶联亲水性抗肿瘤药物。由于其独特的设计,这些两亲性 DPs 能够自组装成树枝状纳米组装体,并产生足够的空隙空间用于药物封装以及位点特异性控释。
6. 结论
在此,我们总结了基于肽的纳米载体在生物医学应用中的先进应用,包括:(i)通过自组装作为纳米载体进行药物递送;(ii)作为肿瘤内皮细胞或肿瘤细胞的靶向配体,以提高肿瘤组织中药物的浓度或实现细胞内化;(iii)作为渗透功能,增强载药纳米颗粒到达肿瘤组织时的穿透能力;以及(iv)作为酶响应基团通过触发肿瘤微环境来控制纳米颗粒的降解。在当前基于纳米颗粒的药物递送系统中,药物递送效率低、纳米颗粒在组织中的积累和渗透性差仍然限制了纳米药物在癌症治疗中的应用。自组装肽和肽修饰的药物递送系统可以通过规避巨噬细胞识别、跨越生物屏障和促进进入靶细胞来解决部分问题。尽管在利用肽部分在药物递送领域取得了巨大进展,但在临床应用前仍有很长的路要走。对疾病部位的特异性靶向、克服多药耐药以及治疗剂的控释是纳米医学发展中的瓶颈。此外,大多数报道的基于肽的纳米载体仅指利用其单一功能,这很难在到达肿瘤部位之前克服所有生物屏障。因此,我们期待未来设计新的多功能基于肽的纳米载体能够彻底战胜恶性肿瘤。
免责声明:本文为行业交流学习,版权归原作者所有,如有侵权,可联系删除