
摘要:
蛋白−蛋白相互作用 (PPIs) 在调节机体生命活动中起着决定性的作用, 是体内众多信号传导通路的关键机制, 其中很多关键蛋白质是可以利用的潜在药物靶点。探索有效调控蛋白−蛋白相互作用的方法, 将对生理学以及药物研究大有裨益。绝大多数蛋白−蛋白相互作用以相对较大且较浅的作用面模式进行, 小分子难以形成有效结合或调控。将蛋白−蛋白相互作用中以多肽二级结构为支撑骨架的折叠亚结构域中的 α-螺旋肽单独提取出来, 通过化学合成的方法加以构建将有可能得到选择性作用于靶标蛋白的活性多肽药物先导物。然而大部分多肽片段在离开蛋白质整体结构后将无法稳定形成结合所需的二级结构, 而易于形成无规则卷曲构象从而导致结合活性下降, 并且更易受肽酶的降解, 无法直接成药。应用全碳骨架形成侧链环合结构改造多肽来稳定 α-螺旋肽的活性构象, 即订书肽 (stapled peptide), 成为克服这一缺陷的最直接最有效方法。该方法不仅可以提高其原本的蛋白结合活性, 而且具有较高的代谢稳定性和细胞膜通透性。基于这些显著的优势, 订书肽已经成为一类重要的活性多肽结构改造方式, 也必将由此形成更多的以蛋白−蛋白相互作用为靶点的新型多肽药物。本文将着重综述并讨论通过化学手段合成订书肽的方法及其药理活性研究进展。
蛋白−蛋白相互作用 (PPIs) 是体内众多信号传导通路的关键机制之一, 也是近年来药物研究的热点, 有研究估算人体内自身体细胞中有与疾病相关的 PPI 作用在 13 万到 65 万个之间[1], 这无疑为研发治疗诸如癌症、免疫疾病、炎症、感染等疾病的新型药物提供了一个巨大的靶点库。通过对蛋白复合物的结构研究表明, 大部分 PPI 是以蛋白质间多个多肽二级结构单元以一种多位点的大面积结合方式 (平均作用面积为 1 500~3 000 Å2) 发生结合[2], 往往不具有特定的结合口袋。这显著增加了以 PPI 为靶点开发常规的小分子药物难度[3]。随着单克隆抗体技术的发展而产生的治疗性单抗药物有能力以 PPI 为靶点, 并已在抗肿瘤、免疫调节、抗感染等方面取得了巨大的成功。但目前单抗药物成本高、技术难度大、药品价格高的特点, 极大的限制了其广泛应用; 此外单抗作为大分子蛋白很难进入细胞, 很多疾病相关的细胞内蛋白的调控靠单抗药物难以实现[4, 5]。
在蛋白质中, α-螺旋是最为普遍的二级结构单位, 并且在蛋白−蛋白、蛋白-DNA 的相互作用中发挥极其重要的作用。很多蛋白−蛋白相互作用通过以二级结构为支撑骨架的折叠亚结构域实现, 而 α-螺旋二级结构的肽链是其中最为普遍的作用片段[6]。这些 α-螺旋肽的平均长度较短, 因此单独构建这类 α-螺旋肽并通过化学合成得到可与靶标蛋白发生选择性作用的活性多肽药物是可行的。α-螺旋是氨基酸通过肽键形成的具有右手螺旋二级结构的多肽, 螺旋每周包含 3.6 个氨基酸残基, 螺距为 0.54 nm。该结构由第i 个氨基酸肽键的 N-H 与第 i+4 个氨基酸肽键的羰基氧形成氢键而构成的十三元“环”所稳定[7]。由于肽链骨架以螺旋的方式绕轴伸展, 其主链自由旋转被限制, 但多肽侧链可以在外部伸展从而表现出独特的拓扑结构, 这样的特性使得 α-螺旋多肽可以在 PPI过程中精确契合所对应的三维结构域。统计表明参与PPIs 的 α-螺旋片段平均长度较短, 平均为 2 至 3 个螺旋长度 (或 8~12 个氨基酸残基)[8]。然而如果从蛋白质结构中截取该 α-螺旋片段, 直接合成的短肽片段在水溶液中不能保持稳定的 α-螺旋二级结构并倾向于形成无规则卷曲[9]。无规则卷曲构象的多肽在与靶标结合时需转变为 α-螺旋构象, 根据结合自由能计算公式:
其中熵变(ΔS=ΔSW+ΔSvib−ΔSrt−ΔSint,DSW为水熵,ΔSvib为振动熵,ΔSrt为配体的平动转动熵,ΔSint为配体的单键旋转熵)。对于多肽这种主链为柔性结构的大分子化合物而言,在与受体结合前后的单键旋转熵ΔSint和平动转动熵ΔSrt的变化是巨大的,所以如果活性多肽不能保持其在与靶标的结合前后的构象以及分子内氢键的稳定,其结合过程将引起很大的熵损失(ΔS负值增大),从而导致结合能ΔG下降幅度变小,生物活性降低。此外这种舒展的构象充分暴露肽的酶解位点, 增加了肽酶的水解几率, 导致多肽极易被降解, 生物稳定性低, 且不易于穿过细胞膜[10]。
因此, 探索各种有效的方式稳定多肽的 α-螺旋构象, 或者以非天然的骨架结构构建 α-螺旋肽的模拟物成为化学生物学以及多肽药物化学研究的热点[11]。根据 α-螺旋的特点, 肽链 i, i+4, i+7, i+11 位点上的侧链处于螺旋结构同侧, 在 i 和 i+4 或 i 和 i+7 之间的侧链基团上通过交叉偶联形成连接桥来稳定 α-螺旋的构象是一种行之有效的方法, 该方法由于连接桥类似订书钉将 α-螺旋结构加以固定, 故称之为订书肽 (stapled peptide)。Verdine 实验室报道了将 BCL-2 蛋白设计改造为具有订书肽结构的活性片段的研究, 改造后的BCL-2订书肽片段能参与细胞内的 PPI并且表现出了一定的体内生物学活性[12], 一举打破了一些科学家提出的“非成药性蛋白 (undruggable proteins)”的思维禁锢。随后国内外的课题组也都陆续开展了订书肽在癌症、艾滋病以及细胞信号通路方面的研究, 由此 可见, 订书肽这一新型多肽结构改造方法将对多肽药物的研发以及相关基础理论的研究提供一条新颖、便捷、可行的解决方案。为此, 本文综述了该领域近年来报道的订书肽改造的方法、成功实例以及相关研究进展, 以期为该领域的研究提供参考和借鉴。
目前订书肽按照桥连结构 (订书桥) 的类型不同可分为两大类, 其一为以碳−碳偶联反应形成的全碳链订书桥订书肽, 另一类为以杂原子作为连接反应中心的含杂原子链订书桥订书肽, 下面将对该两者分别进行介绍。
1 全碳氢链订书肽的合成及活性改构物
1.1 全碳链订书肽的合成及结构要素
碳链订书桥特别是烯基订书桥是合成订书肽的经典方法, 1994 年由 Grubbs 小组报道了利用其发现的烯烃关环复分解反应 (RCM 反应) 进行多肽的结构改造[13], 该方法主要在合成多肽后通过对肽链 i 和i+4 位的丝氨酸进行侧链烯丙基醚化衍生再通过RCM 反应得到由环烯基桥稳定的a-螺旋肽 (图 1A)。Verdine 及其团队在此之后发展出利用具有末端烯烃侧链的非天然氨基酸替换天然多肽中的氨基酸残基并通过 RCM 反应形成环烯桥 (图 1B)。该方法解决了 Grubbs 方法中由于在合成多肽后再进行烯丙基取代所带来的对于多肽侧链结构的限制要求以及液相环合合成的不便, 并首次提出了“订书肽改造(peptide stapling)”的概念[11], 并经过不断的发展和改进成为了一种经典的普适性多肽改造策略和方法。

1.1.1 环烯订书肽及结构要素 如前所述单订书桥
环烯订书肽是一种经典的订书肽形式, 也是对于订书肽的合成、结构以及活性报道最多的研究方向。目前较为成熟的方法是以钌催化剂, 利用烯烃复分解的关环反应完成 staple 的构建。研究表明, RCM 反应能与固相合成多肽策略相匹配, 在室温下, 数小时便可以实现完全转化, 优于很多需要长时间加热且转化率低下的碳−碳偶联反应[13, 14]。Staple 的构建首先需要在多肽序列中引入两个或者两个以上具有 α-双取 代 的非 天 然氨 基酸 作为环合所 需 的关 键砌 块(building block)。这些非天然氨基酸的特点在于 α-位的取代基中一般一个为甲基, 另一个为链烯基 (戊烯基、辛烯基等)。经过固相肽合成手段将所需氨基酸进行逐一缩合得到目标多肽链后, 特定位置上相适应的两个非天然氨基酸残基的侧链 (链烯基) 通过 RCM 反应发生分子内的烯烃复分解反应脱去一分子乙烯形成大环烯桥, 由于该环烯桥像订书钉一样锁住原本构象易变的螺旋肽, 所以形象的称之为订书肽 (stapled peptide), 而相应的该环烯桥可称之为订书桥 (staple)。由于非天然氨基酸的 α-双取代以及订书桥的形成, 大幅度提高了 α-螺旋构象多肽的稳固性[15]。并且一些两亲螺旋多肽分子的穿膜能力也得到了提升, 同时很大程度上克服了舒张伸展状态下的多肽链易受到肽酶水解破坏的弱点[16]。
1.1.2 关键“砌块”的构建
合成订书肽的关键砌块一般是具有α-烯烃侧链的非天然氨基酸 (图2A), 目前的研究主要采用 α-C 的绝对构型为 S 或 R 的手性烯基非天然氨基酸, 简称为 Sn 或 Rn (n 为侧链烯基中碳的个数)。此外, 还有用于缝合肽改造的 α-双烯基取代氨基酸, 如 B5[4]。通过高效、低耗、简便的有机合成方法制备上述的关键砌块是订书肽合成的必要条件。国内外许多课题组以不同策略建立了不对称合成手性氨基酸方法, 目前效果较好的方法包括: 以噁嗪酮 (oxazinone) 为手性配体, 通过不对称烷基化反应合成目标化合物[17−19]; 通过手性配体 BPB (benzylprolylaminobenzophenone) 与金属镍、丙氨酸 (甘氨酸) 反应生成复合底物, 经过手性诱导合成高对映选择性的手性氨基酸[20−22]。由于 B5 是非手性氨基酸,合成相对较为简便, 可采用 N-二苯亚甲基甘氨酸酯为起始物, 再进行甘氨酸酯 α-位两次烷基化反应, 最后经过酸解、去保护便可得到相应的 α-双取代氨基酸(图 2B)。通过上述方法合成得到的游离状态 Sn、Rn 和B5 与 Fmoc-OSu 或 Fmoc-Cl 反应生成相应的 Fmoc 保护的氨基酸后即可参与常规的 Fmoc 策略多肽合成。
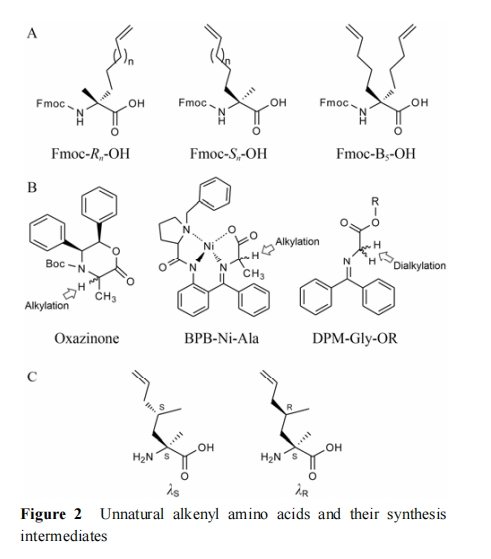
1.1.3 关键“砌块”的嵌入位点的选择方法
由于插入的非天然氨基酸使改造后的订书肽性质与天然肽有所差异, 在参与 PPIs 时所表现出的活性也有不同。为了筛选出理想的高活性订书肽, Sn、Rn 和 B5 残基嵌入到多肽序列的位点尤为关键。根据已报道的策略, 有两种方法较为成熟。第一种策略是通过分析目标蛋白的三维结构数据, 通过计算机辅助模拟优化α-螺旋肽片段在 PPIs 中的构象, 选择不参与 PPIs 的氨基酸残基位作为非天然氨基酸的嵌入位点, 而已知的或者是被推测可能与靶标相结合的氨基酸残基应保持完整, 使构建后的订书桥远离结合面, 以避免在作用表面形成干扰[23]。另一种策略是针对目标肽, 对其所有能够改动的序列位点进行非天然氨基酸的替换, 合成一系列具有不同订书桥插入位点的订书肽, 最后通过活性筛选的方法确定最佳的嵌入位点[24]。值得指出的是虽然在一般情况下应避免在多肽和受体的作用面处构建订书桥, 但在一些以 α-螺旋中的疏水氨基酸 (如 Val、Leu、Ile) 介导与受体相互作用的情况下, 在作用面侧构建全碳氢链订书桥可以代替疏水氨基酸嵌入受体的疏水槽中从而使订书桥发挥稳定螺旋和参与结合的双重功能[25−30]。Speltz 等[31]更进一步通过向桥头氨基酸的烯基侧链中引入甲基取代基模拟疏水氨基酸 (图 2C), 通过对甲基取代基构型的优选使得其与受体的结合能力进一步提高。
根据 α-螺旋结构的特点, 完整的螺旋一周有 3.6个氨基酸残基, 在此结构中, i, i+4, i+7 和 i+11 位点的侧链处于螺旋的同侧 (图 3A)。订书肽改造策略利用这一特点, 通过位于同侧的 α-C 侧链进行 RCM 反应形成环烯桥。目前, 经典的改造方法是在 i, i+4 位点分别以两个 S 构型戊烯基丙氨酸 (S5) 替换原有氨基酸残基并形成 staple, 从而实现固定 α-螺旋一周[11](图 3B); 如用相似的方法在 i, i+7 处形成 staple 则可以固定螺旋两周, 相应两位点处则需要侧链更长的R8 和 S5 或 S8 和 R5 的组合 (图 3C)。除了上述两种经典方法外, i, i+3 位点也可适用订书肽改造, 但需要注意的是 staple 的长度具有一定的灵活性: 当其为 8 个碳原子时, 需要 R5 与 S5 的结合 (图 3D); 当其为 6 个碳原子时, 则需要 R5与 S3或者 R3与 S5的组合才可以维持合适的多肽构象[32, 33]。
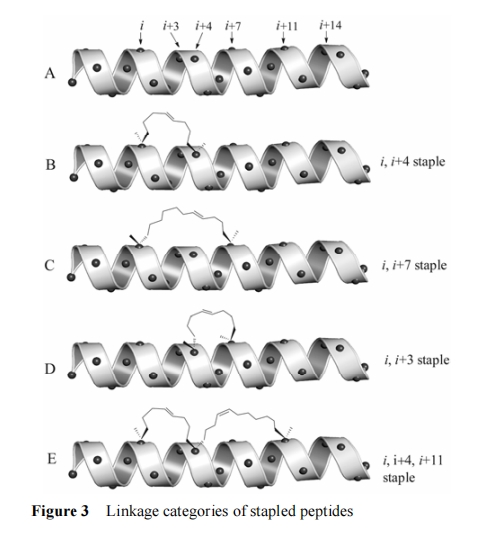
2014 年 Verdine 课题组又报道了令人耳目一新的“缝合肽”(stitched peptides), 巧妙地升级了原有的订书肽改造方法。通过将 α 位双戊烯基取代的非手性氨基酸 B5 引入多肽序列, 其两侧再各引入一个偶联反应相适应的 Sn 和 Rn (如 S5+B5+R5、S5+B5+S8、R8+B5+S8等), 从而在 i, i+4, i+8或 i, i+4, i+11 或 i, i+7, i+14 处以一个共用中间桥头的方式形成双重订书桥, 犹如穿针引线一般将螺旋肽链缝合起来, 从而可以大幅度地提高了订书肽 α-螺旋性 (图 3E)[4]。
目前在 i, i+4 位点以 S5+S5 为嵌入砌块的订书肽改造方法在国内外课题组中应用最为广泛。对于短 肽来讲, 可以通过一个订书桥完成 α-螺旋的固定, 如果先导物为长肽, 则可以通过两个或者两个以上的独立 staple 进行结构固定 (双订书肽, 不同于 stitched peptides)[34]。但是需要注意的是, 以 R5+R5 代替 S5+S5在 i, i+4 位点上进行改造的研究则非常少见, 主要因为通过 R5+R5 的改造不但不能够提高目标肽的 α-螺旋性, 反而会使其有明显的下降, 细胞摄取目标肽的能力也随之减弱[35]。
1.1.4 全碳链订书肽的固相合成
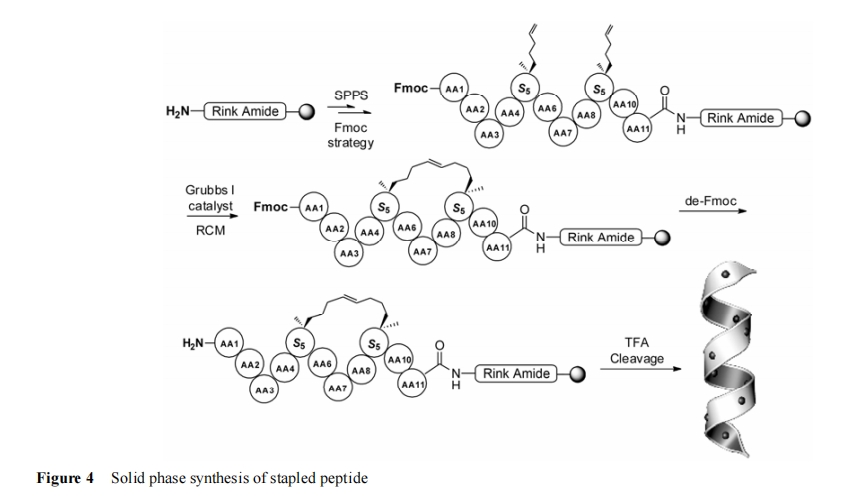
订书肽的合成与一般的多肽固相合成基本一致, 较为特别的是 Sn 或Rn 在引入时, 由于位阻较大需要如 PyAOP 等较为高效的缩合剂确保缩合反应的链接效率。由于该 α-双取代氨基酸的游离氨基无法通过常规的 Kaiser 茚三酮方法进行监测, 可在相应位置的氨基酸缩合完成后取少量进行裂解并采用 LC/MS 方法进行确证。为确保RCM 反应在单条多肽分子内发生, 环合反应需要利用固相合成的假稀释效应[36]在固相树脂上进行。整个订书肽的合成制备过程大致分为肽链的合成、侧链的 RCM 反应、N-端的修饰、载体的切除、订书肽的纯化等几个步骤 (图 4), 已经成为较为成熟的方法[37]。
1.2 全碳氢链订书肽的活性改造物研究进展
1.2.1 P53-MDM2/MDMX 相互作用抑制剂
p53基因是一种重要的抑癌基因,与DNA的修复、细胞分化、细胞周期的调控等生命过程息息相关。p53的缺失和突变及相关蛋白酶体的降解会导致肿瘤细胞的产生。MDM2及MDMX是p53的主要抑制因子,两者相互协同并通过不同的信号途径抑制p53的活性。E3泛素连接酶MDM2可与p53蛋白的反激活域结合,介导p53的泛素化从而降低p53的稳定性。MDMX则主要通过与p53的转录活性区结合,抑制p53对其下游基因的转录活性,从而产生抑制作用[38,39]。研究发现,p53-MDM2蛋白间的相互作用时,一段位于p53N端蛋白反激活域的长15个氨基酸残基的α-螺旋(LSQETFSDLWKLLPEN)与MDM2的疏水凹槽结合并调控其相互作用[40],其中Phe19、Trp23和Leu26是与MDM2相结合所必须的[30,41]。Verdine课题组[42]利用全碳氢侧链的staple改造策略,通过对化合物烯基氨基酸引入位置的筛选,结合对酸性及碱性氨基酸残基的替换改变多肽净电荷以增加穿膜性等策略,合成并筛选出了具有高亲和力、高α-螺旋性以及穿膜能力的订书肽SAH-p53-8(Ac-QSQQTF[R8NLWRLLS5]-QN-NH2(本文为准确表述订书肽的改造结构位置,用黑体标出替换的非天然烯基氨基酸并用“[…]”表示位于订书桥大环内的氨基酸序列),其α-螺旋性达到85%、KD值达到55nmol·L−1,并可以透过细胞膜引起肿瘤细胞凋亡。随后Verdine课题组[43]深入研究发现SAH-p53-8还可以有效地抑制MDMX,对于MDMX的亲和力比MDM2高25倍。因此SAH-p53-8有希望作为抑制肿瘤的双靶向抑制剂进行成药性研究。在随后的进一步优化研究中[44],通过噬菌体展示技术对该SAH-p53-8先导物序列氨基酸位点突变得到了一条新的具有更高MDMX/MDM2亲和力的多肽Ac-LTFEHYWAQLTS-NH2,经过对Glu4和Thr11分别采用 R8 和 S5 替换并形成订书肽以及对 Asn5、Leu10 的残基位点替换和 C 端结构优化得到了订书肽候选物 ATSP-7041 (Ac-LTF[R8EYWAQCbaS5]SAANH2), 对 MDM2 和 MDMX 与 p53 的结合抑制常数(Ki) 分别达到 0.9 nmol·L−1 和 6.8 nmol·L−1 水平, 在体内外均显示了显著的肿瘤抑制活性且药代性质良好, 通过对候选物进一步优化得到的订书肽 ALRN- 6924 目前已进入 II 期临床研究阶段 (FDA 临床研究编号 NCT02264613), 有望上市成为首个订书肽治疗药物。
1.2.2 BCL-2 蛋白家族的调控
细胞凋亡相关 BCL-2蛋白家族分为两大类, 一类具有抑制细胞调亡作用, 如 BCL-2、BCL-XL、BCL-1、MCL-1 等; 另一类可促进细胞凋亡, 如 BAX、BCL-XS、BAK、BID 等[45]。大量研究发现 BCL-2 的同源结构域 BH3 中的两亲 α-螺旋片段能结合到由 BH1、BH2 和 BH3 共同形成的抗凋亡结构域的疏水区中, 从而发挥促进细胞凋亡的作用[46]。Walensky 等[12]通过模拟 BID 的 BH3 区域 α-螺旋片段 (EDIIRNIARHLAQVGDSNLDRSIW), 设计合成了一组具有稳定 α-螺旋结构的订书肽 SAHBs, 其中筛选出了在穿膜能力、结合能力和激活细胞凋 亡活性中具有开发潜力的订书肽 SAHBA (EDIIRNIARHLA[S5VGDS5]NLDRSIW)。其 KD 值由原形的 269 nmol·L−1 提高至 38.8 nmol·L−1, α-螺旋性为 87.5%; SAHBA 在体外血清中的半衰期由原形的 3.1 h 提高至 29.4 h。随后 Stewart 等[47]又筛选了 BCL-2 结构域中的一系列具有 α-螺旋结构的片段并改构成为订书肽, 发现 MCL-1 中的 BH3 片段螺旋本身 (KALETLRRVGDGVQRNHETAF) 为单一的 MCL-1 抑制剂。经过改构的订书肽 MCL-1 SAHBX 中, MCL-1 SAHBD(KALETLRRVGDGV[S5RNHS5]TAF) 为理想的抑制剂, 其 KD值为 10±3 nmol·L−1 (原形为 245 ±29 nmol·L−1)。目前以该蛋白为靶点的订书肽类先导化合物处在临床前研究阶段。
1.2.3 其他碳氢链订书肽的研究情况
除了上述研究较早并即将成药的订书肽类化合物以外, 随着订书肽成为多肽药物研究的热点, 研究发现了多种调节疾病相关 PPIs 的订书肽药物先导物。表 1 总结了目前已报道的与靶蛋白相互作用确切、具有显著药理活性的订书肽改构物的研究情况。
2 其他类订书肽的合成设计及应用
在上述采用 RCM 反应稳定 α-螺旋的订书肽策略问世之前, 通过侧链间的偶连稳定多肽 α-螺旋构象的工作已有很多报道, 例如在侧链间形成酰胺键[101]、偶氮苯[102]、腙[103]、二硫键[104]等, 但这些方法改造后的多肽却并不能称之为订书肽, 主要由于它们在药代学性质上不如全碳氢链订书肽稳定[105]。近年来也出现了一些新的改造策略, 虽然它们的链接环也有杂原子参与, 但其在稳定构象、提高活性和药代稳定性方面与经典全碳氢链订书肽有异曲同工之处, 可以将其归为广义的订书肽改造方法。下文将按照连接桥环的结构对其进行分类说明。
2.1 三唑桥环
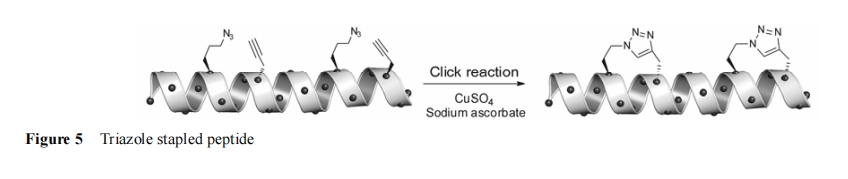
点击化学 (click chemistry) 中的 Huisgen-1,3 偶极环加成[106]反应是在铜催化下, 炔基与叠氮基反应生成区域选择性的 1,4-取代三唑。由于 Click 反应具有高反应性、选择性和生物相容性[107−111], 其环加成产物具有对蛋白水解酶的稳定性[112]等优点, Cantel等[113]便率先尝试将该环加成反应应用到多肽侧链的偶联并取得了令人满意的结果。该方法在肽链的 i, i+4 位点处分别引入了 α-位末端具有炔基和叠氮基的非天然氨基酸, 最后纯化的肽链在液相中通过 CuSO4与抗坏血酸的催化发生 click反应形成“三唑桥”(图5)。利用 click 反应改造的 PTHrP 肽比其原形肽活性提高了 5~10 倍, 并与酰胺桥改造后的 PTHrP 肽有着相似的生物活性[114]。随后 Kawamoto 等[115]在设计合成 BCL-9 订书肽时也应用 click 反应来构建三唑桥, 通过嵌入位点的筛选以及三唑桥长度的变换优化出理想的订书肽。特别是在该肽链上引入的双三唑桥环使得改造后的订书肽 α-螺旋含量大于 90%, 最高甚至达到 99%, 其亲和力以及代谢稳定性与野生型 BCL9相比都有很大的提高。
相比全碳氢链订书肽, 三唑订书肽的形成所需要的铜催化剂非常廉价且毒性较低, 是一种可行性较高的订书肽构建方法, 但目前对于它在 α-螺旋性以及酶解稳定性上改善作用仍需深入研究。
2.2 硫代桥环
在多肽或者蛋白质的修饰改造中,半胱氨酸的衍生化已成为一种必不可少的构建方式,也是化学生物学研究的重要方法。虽然目前改造半胱氨酸的方法有烷基化、共轭加成、氧化和还原等方法[116,117],在肽链上通过侧链巯基之间偶连构建桥环来稳定 α-螺旋的方法大多局限于形成二硫键。然而当二硫键处于氧化或还原条件时其性质不够稳定。利用其活性巯基与其他代谢相对稳定的连接结构反应得到的桥环比二硫键的稳定性强, 由此也衍生出下述多种新型订书肽构建方法。
2.2.1 硫代甲基联苯桥环
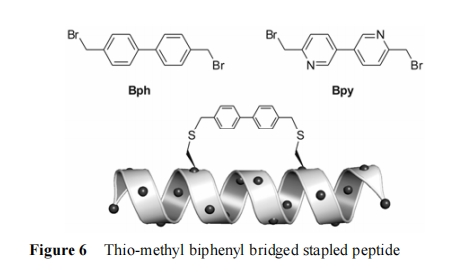
Muppidi 等[118]报道了利用 4,4'-二溴甲基联苯 (Bph) 或 6,6'-二溴甲基-2,2'-联吡啶 (Bpy) 作为连接臂, 通过与 i, i+7 位的半胱氨酸侧链反应形成硫代甲基联苯或联吡啶桥环 (图 6)。他们随后将该改造策略运用到具有 p53-MDM2/MDMX 相互作用双重抑制作用的多肽序列 (LTFEHYWAQLTS) 改造中。由于这段序列中不含有半胱氨酸, 因此将暴露在溶剂侧的 Glu4 和 Thr11替换为半胱氨酸再进行桥环的构建。通过活性筛选显示改构后的订书肽不但 α-螺旋含量和生物活性有改善而且穿膜能力得到了大幅度的提高。
Muppidi 等[119]又运用硫代甲基联苯策略对 Sticht等[61]报道的抑制 HIV-1 病毒衣壳的组装的 CAI 蛋白片段 (ITFEDLLDYYGP) 进行改构, 将溶剂侧的 Glu4和 Gly11 替换为半胱氨酸后进行桥环的构建。对改构物活性测试显示, 其穿膜能力都有极大的提高, 且在细胞水平的病毒感染实验中显示出高抑制活性。尤 其是筛选出一条既能够与 HIV-1 衣壳蛋白碳端结合(KD =17.5 μmol·L−1) 又能与 gp120 蛋白结合 (KD =7.4 μmol·L−1) 的改构订书肽 (ISF[CELLDYYC]ESGS), 说明其具有抑制衣壳组装和抑制 HIV-1 病毒的进入细胞的双重抑制作用。
来自 BH3 蛋白中的多肽 NoxaB-(75−93)-C75A(AAQLLRIGDKVNLRQKLLN) 能够高选择性的与Mcl-1 蛋白结合从而产生抑制 MCL-1 的作用[120]。Muppidi 等[121]为了优化多肽 Noxa BH3 的活性, 通过硫代甲基联苯桥环策略, 将 Gln77与 Lys84替换为半胱氨酸 (AACLLRIGDCVNLRQKLLN) 再进行 staple 构建。随后对系列改构物进行生物活性测试, 结果显示经过改构后的订书肽的 α-螺旋含量、穿膜能力以及酶解稳定性都有大幅度提高, 而且对 MCL-1 过度表达的 U937 细胞有很好的抑制活性。
2.2.2 硫代氟苯桥环
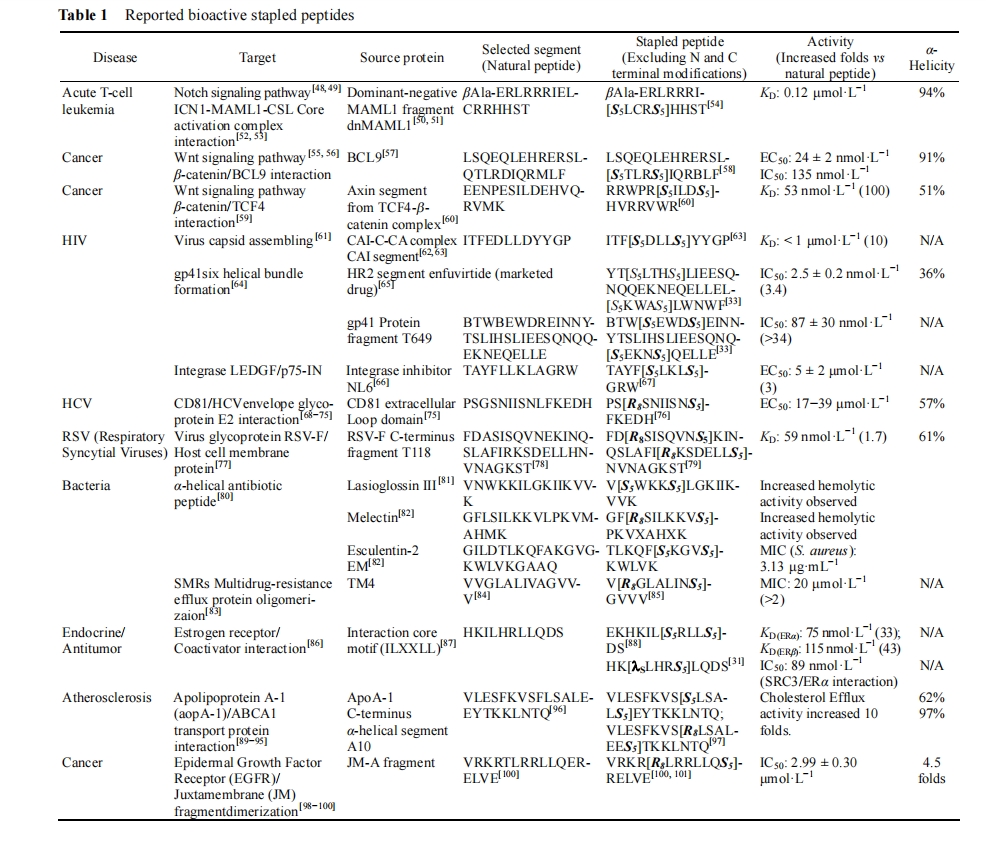
Spokoyny等[122]以全氟苯或全氟联苯为连接结构,立体专一性地串联起i,i+4位的巯基侧链从而形成硫代氟苯桥环。应用此方法进行了HIV-1病毒衣壳CAI蛋白片段的改构设计,该方法得到的订书肽能有效抑制HIV-1病毒的形成,且在结合能力、穿膜能力以及酶解稳定性上都优于未经过改造的原形肽(图7)。该方法在一定程度上是对烯烃复分解法的补充,且在反应的过程中需引入金属催化剂, 同时也不需要非常昂贵的非天然烯基氨基酸, 因而合成成本也大为降低。
2.2.3 硫代四嗪桥环
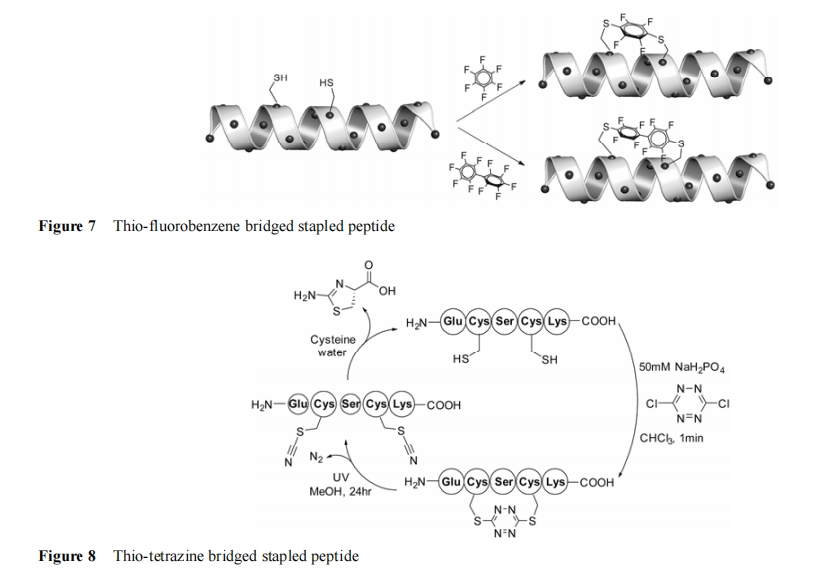
Brown 等[123]在对半胱氨酸残基侧链改造时, 通过 3,6-二氯-1,2,4,5-四嗪与巯基发生取代反应后形成硫代四嗪环来稳定 α-螺旋构象。硫代四嗪桥环在光化学反应下可发生裂解形成硫氰酸酯侧链, 之后可在半胱氨酸的作用下复原成原肽(图 8)。
2.2.4 巯基−烯点击反应
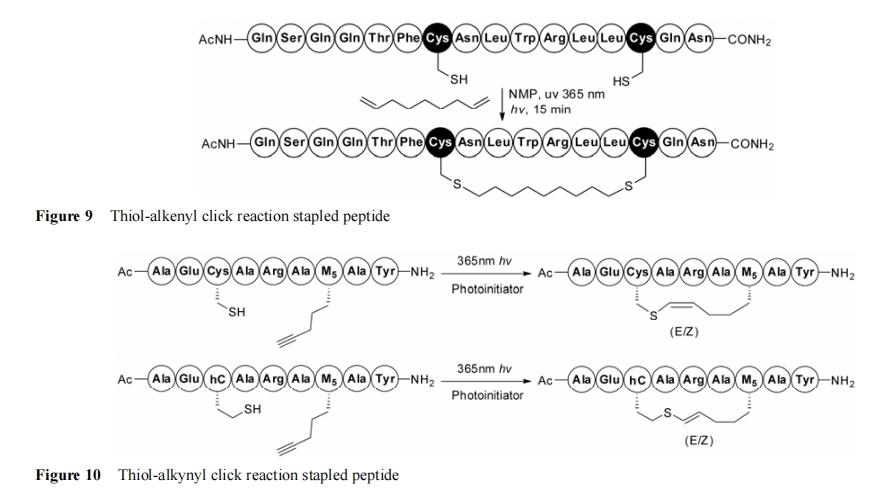
Wang 等[124]报道了利用巯基−烯点击反应构建订书肽以及多肽的大环化。以不同长度的二烯与两个肽链巯基在 365 nm 光照下室温反应, 在 i, i+4 与 i, i+7 位点之间构建硫代桥环的同 时, 对其他官能团有极好的耐受性, 因此可以在氨基酸侧链未经保护的状态下进行反应 (图 9)。随后他 们比较了通过 RCM 反应形成的全碳氢链 Axin 订书肽[60]与应用巯基−烯点击反应改构订书肽的 α-螺旋性, 发现两者在圆二色谱中具有几乎一致的 α-螺旋比例。随后又发现全碳氢链的 p53 订书肽类似物与硫代桥环构建的订书肽在抑制 p53-MDMX 相互作用时表现出了相似的抑制活性, 并可选择性的诱导 p53 野生型细胞的凋亡。该方法能直接用于未保护的多肽, 同时也不需要金属催化剂的使用, 而且这种类似全碳链的链接臂的使用能够避免与大体积的芳香基团发生非特异的反应。
2.2.5 巯基−炔点击反应
Tian 等[125]报道了运用光引发的单组分巯基−炔点击反应, 高效简洁在侧链未经保护的 α-螺旋肽上构建硫−烯桥环。在肽链的 i, i+4位上分别引入戊炔甘氨酸 (M5) 与半胱氨酸, 随后在 365 nm 的光引发条件下完成桥环的构建。用该策略对调节雌激素受体−共同激活剂相互作用的 α-螺旋肽进行改构, 通过与全碳氢链改构后的订书肽的比较, 显示硫−烯桥环订书肽亲脂性变化较大而且细胞膜毒性较低。硫碳双键为进一步的功能化提供了可 能, 同时也丰富了订书肽的改构方法, 将古老的硫与炔自由基加成反应扩展到了化学生物学的研究中来(图 10)。
2.2.6 炔烃复分解反应
Cromm 等[126]报道了将烯烃复分解 (RCM) 与炔烃复分解 (RCAM) 反应以正交的方式联合应用于多肽的结构改造中, 其关键环节在于除了向目标肽中的四个环合位点 (i, i+3, i+4, i+7) 中的两处引入烯基氨基酸 (S5) 以外, 在另外两个位点处需引入侧链为炔基的非天然氨基酸。由于RCM 反应 (钌催化) 和 RCAM 反应 (钼催化) 条件的正交性, 与双订书肽[33]相比, 可以选择性的控制环合的的位置从而实现对环肽拓扑结构的控制。作者将该方法应用于 GTPase 酶抑制剂的环肽改造中并得到了活性改善的抑制剂 StRIP3 (图 11)。需要指出的是虽然作者选取的改构活性肽先导物并非 α-螺旋肽, 但该研究作为经典订书肽方法的延伸值得借鉴。

3 总结与展望
订书肽通过用侧链环合的方法提高了 α-螺旋肽的构象稳定性从而极大的提高与靶蛋白的亲和力、代谢稳定性、穿膜性。订书肽在药效、成本以及技术难度上填补了小分子药物与单克隆抗体在蛋白−蛋白相互作用为靶点的药物研究中各自的不足, 已成为获得以蛋白−蛋白相互作用为靶点的药物先导物的一种有效途径。通过对已有研究的分析可以发现, 目前订书肽的研究主要集中在两个方向, 其一是对分子生物学和结构生物学研究发现的可调控蛋白−蛋白相互作用的活性 α-螺旋肽采用经典的烯基全碳订书桥策略实施改造, 该研究方向起步最早且即将形成首个订书肽新药, 证明了订书肽药物开发的可行性; 另一个方向是在合成方法学方面采用已有或开发新的偶联反应来构建具有新结构的新型订书肽, 该方向也逐渐成为了有机化学与化学生物学的交叉研究热点。但由于活性螺旋肽的获得非常依赖于结构生物学的晶体结构或是分子生物学的发现, 对于单独从事合成方法学研究的课题组而言往往采用已有报道的活性订书肽作为先导物或是采用无生物学活性的模型螺旋肽作为研究对象。订书肽研究已经成为近年来多肽药物研究的热点, 正如订书肽研究领域的领导者Walensky 教授所述[127], 该方法对多肽性质的许多革命性改善将使得多肽药物的研究得到复兴。可以预见, 随着订书肽研究的不断深入, 在订书肽结构设计、合成方法以及新靶点的发现方面将不断有新的研究成果产生, 也必将为抗肿瘤、抗病毒、抗细菌感染、内分泌调控、诊断试剂等方面的药物研究提供新的思路和解决方案。
免责声明:本文为行业交流学习,版权归原作者所有,如有侵权,可联系删除










