本文主要介绍研究人员使用组合库方法发现了可能对癌症靶向有用的细胞表面结合肽。其中噬菌体展示库技术和“一珠一化合物”组合库方法是两种常用的方法。而癌症细胞表面受体或新生血管的内皮细胞表面受体是两种常见的癌症治疗靶点。
组合库方法
在过去10年里,组合化学已成为最重要的药物发现工具之一,几乎所有制药公司都在其药物发现项目中使用它。组合肽库的五个一般方法包括:(a) 生物肽库方法,如噬菌体展示肽、细菌肽展示库系统、FliTrx、多体库或质粒肽;(b) 空间可寻址肽库方法,如多针技术、斑点合成、光刻或多镜光定向合成方法;(c) 迭代合成和去卷积方法,如位置合成;(d) 单珠单化合物(OBOC)组合珠库;(e) 亲和层析法回收的溶液相库。由于生物系统的性质,噬菌体展示、细菌展示或其他重组肽库方法仅限于开发所有L-氨基酸肽。相比之下,其余四种组合库方法基于合成,可应用于含 D-氨基酸、其他非天然氨基酸甚至非氨基酸构建模块的肽库。在过去几年中,噬菌体展示库和其他重组肽库方法在发现针对细胞表面受体特定细胞外结构域(如促红细胞生成素和血小板生成素)的肽类激动剂方面取得了重大进展。这些方法当然也可应用于发现癌症细胞特有的受体配体。虽然大多数研究人员使用噬菌体展示法来发现针对癌细胞的肽,但我们使用了OBOC组合库方法来鉴定与许多不同癌细胞结合的配体。表1总结了用于鉴定肿瘤靶向肽的肽库方法。
通过噬菌体展示文库法发现癌细胞表面或癌症相关靶向肽段
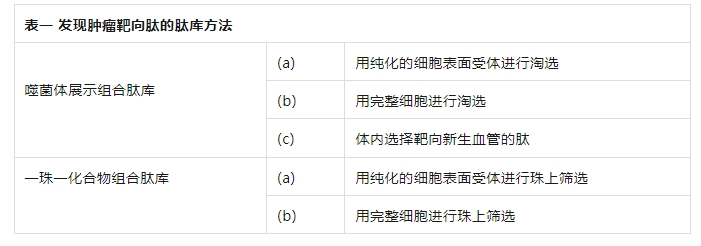
噬菌体展示肽库最早由帕姆利和史密斯于1988年开发。在这种方法中,一段随机的双链DNA(dsDNA)被插入编码pIII蛋白的基因中。这导致随机肽在位于丝状噬菌体(如M13)末端的3-5份pIII蛋白的N末端表达。然后,通过与固定化的靶蛋白或完整细胞进行筛选来筛选噬菌体展示肽库。结合的噬菌体用弱酸洗脱,在大肠杆菌中扩增,然后再次进行筛选。整个筛选过程通常会重复第三次,并且可以通过DNA测序确定每个噬菌体展示肽库克隆所展示的肽的氨基酸序列。噬菌体展示组合肽库在识别细胞表面结合肽方面的应用已被综述。图1展示了用于识别细胞表面结合肽的三种一般筛选方法:(a) 与纯化的细胞表面进行筛选;(b) 与完整细胞进行筛选;(c) 通过静脉注射噬菌体展示库进行体内选择。若要筛选出在结合细胞表面受体后能内化进入细胞的结合肽,可以使用完整细胞对噬菌体展示文库进行筛选。酸洗脱后,裂解细胞并扩增噬菌体,再进行两轮筛选。在癌症的肽靶向治疗的开发中,大多数研究人员专注于识别要么与癌细胞表面受体结合,要么与肿瘤新生血管内皮细胞表面结合的肽。其他人则致力于针对与癌症相关的蛋白质,如基质金属蛋白酶和前列腺特异性抗原(PSA)。表2总结了这些研究中鉴定出的肽的氨基酸序列。
癌细胞表面配体
大多数癌症细胞表面靶向肽是通过用纯化的蛋白质或完整细胞筛选噬菌体展示文库而鉴定出来的。使用人类B细胞淋巴瘤细胞系(SUP-88)的亲和纯化的细胞表面独特型(表面抗体)来筛选噬菌体展示肽文库,鉴定出了一系列线性肽基序:KNGPWYAYTGRO、NWAVWXKR、YXXEDLRRR 和 XXPVDHGL。其中一些肽,以二聚体或四聚体的形式呈现给完整细胞时,可以触发信号转导和细胞凋亡,IC50范围在40 - 200纳摩尔之间。使用从慢性淋巴细胞白血病(CLL)患者的 B 细胞中分离出的克隆性表面免疫球蛋白筛选随机噬菌体展示肽文库,鉴定出了一系列肽序列 LVRSTGQFV、LVSPSGSWT、ALRPSGEWL、AIMASGQWL、QILASGRWL、RRPSHAMAR、DNNRPANSM、LQDRLRFAT 和 PLSGDKSST,这些肽序列是特异性结合到该患者白血病细胞表面以及从这些细胞中分离出的克隆性免疫球蛋白的配体。

噬菌体展示肽技术也被用于确定能识别从多发性骨髓瘤患者中分离出的单个M蛋白的特异性肽模拟物。来自九名患者的 M 蛋白被用于筛选6个和 15 个氨基酸的库。在这九名患者中有六名发现了模拟物。在个体患者中确定了共识基序:例如,一名患者为 FDDARL、FSDARL、FSDMRL、FVDVRL、FTDIRL、FNDYRL 和 FSDTRL;另一名患者为 PIHYIF、YIHYIF 和 RIHYIF。它们还表明,用荧光异硫氰酸荧光素(FITC)标记的 YIHYIF - 牛血清白蛋白偶联物能够对用该 M 蛋白选择该模拟物的患者的骨髓中分离出的骨髓瘤细胞进行染色。
E-selectin 是一种发现于内皮细胞表面的糖类结合蛋白。当用它来筛选噬菌体展示的肽库时,未发现配体。然而,当使用识别E-selectin 糖类或相关糖类(抗Lewis A抗体)的抗糖抗体作为替代靶点时,发现了肽序列IELLQAR。该肽抑制了E-selectin 对表达唾液酰Lewis X的HL-60和B16黑色素瘤细胞的黏附。当将这些肽和癌细胞都静脉注射时,它还抑制了小鼠 B16 黑色素瘤和人类肺癌细胞在肺部的定植。使用前列腺特异性抗原(PSA)来筛选噬菌体展示肽库,并鉴定出了具有以下基序的几种肽配体:CVFXXXYXXC、CXFXXXYXY-LMC、CVXYCXXXXCYVC 和 CVXYCXXXXC-WXC。这些肽能刺激 PSA 对发色底物的酶活性。它们对 PSA 的亲和力随着Zn2⫹(PSA 活性的抑制剂)的增加而增加。由于前列腺癌高度表达 PSA,这些肽有可能被用作癌症靶向剂。
许多研究人员使用完整细胞来筛选细胞表面结合配体或被内化到细胞内部的配体。使用人类前列腺癌细胞系(LNCaP)筛选pVIII外壳蛋白噬菌体展示的八肽库,发现DRPXXXX是主要的结合基序,其中DPRATPGS肽是最强的结合剂。这种肽能阻止LNCaP细胞及其衍生细胞系C4-2和C4-2b的扩散。噬菌体展示的肽库也被用于识别与人类神经母细胞瘤细胞系(WAC2)细胞表面结合的肽。已鉴定出的其中一个肽,HLQIQPWYPQIS,与许多不同的癌细胞系结合,包括神经母细胞瘤、乳腺癌、胶质母细胞瘤和 C 细胞癌,但与正常红细胞、淋巴细胞、单核细胞和上皮细胞不结合。另一种肽,VPWME-PAYQRFL,与许多神经母细胞瘤和乳腺癌细胞系结合,但不与测试的其他细胞系结合。后者这种肽能够进入细胞内部。
另一种新型肽段 TSPLNIHNGQKL 是从M13噬菌体展示肽段文库的筛选中分离出来的,被发现对人类头颈部鳞状细胞癌具有特异性,并且能够被其内化。荧光显微镜数据和细胞亚组分数据均表明,这种肽段主要存在于细胞质中。当注射到携带头颈部鳞状细胞癌衍生异种移植物的裸鼠体内时,它定位于肿瘤异种移植物中。还鉴定出了一些噬菌体展示肽段,它们能够内化进入人类 Hep-2 喉癌细胞系和人类 ECV304 内皮细胞系。这些肽段通过受体介导的内吞作用被有效摄取。其中一种更常被Hep-2 细胞摄取的噬菌体展示肽段是 RLTGGKGVG。
最近有报道称,在使用完整细胞进行噬菌体展示库的生物筛选时,开发出了一种改进的技术。在这种方法中,噬菌体展示库与完整细胞混合,然后通过离心作用分离,这样特定的噬菌体-细胞复合物就能迅速有效地从未结合的噬菌体中分离出来,从而选择出更具特异性的结合肽。
值得注意的是,有许多报告描述了利用噬菌体展示文库通过体内选择来识别针对癌细胞表面抗原或肿瘤血管的单一链抗体。然而,这些单一链抗体的大小(约 24 千道尔顿)比本综述中描述的肽(通常⬍2 千道尔顿)大得多。
肿瘤血管生成配体
肿瘤的生长速度在很大程度上受到血液供应的限制。血管生成不仅使肿瘤能够增大,也是肿瘤转移的手段。因此,人们投入了大量精力来开发抗血管生成的小分子、肽、蛋白质和抗体。实体瘤内血管生成血管中的内皮细胞表达的蛋白质在成熟的血管中不存在或几乎检测不到。基于肿瘤血管独特的组织学外观和特定分子内皮标志物的表达,有可能专门针对肿瘤内皮细胞。将肿瘤血管与正常器官血管区分开来的生化特征包括某些整合素的表达、内皮细胞生长受体、蛋白酶、细胞表面糖胺聚糖和细胞外基质成分。与不断发生突变的肿瘤细胞不同,肿瘤血管在基因上是稳定的。因此,抗血管生成疗法在实验动物中没有导致耐药性。针对血管的抗肿瘤疗法不必摧毁每一个内皮细胞,因为内皮的部分剥落可能导致肿瘤供血血管中形成血栓,从而引起肿瘤消退。
Ruoslahti和他的同事们开创了使用活体动物来筛选器官特异性噬菌体展示肽的技术。在这些实验中,噬菌体展示库通过静脉注射,然后收集并研磨感兴趣的器官。这些器官中存在的噬菌体在大肠杆菌中扩增,整个体内筛选过程再重复两次。使用这种方法,已经分离出了几个器官和肿瘤归巢肽。在这些实验中,丝状噬菌体仍然留在血管空间内。因此,所有在这些研究中识别的肽都针对这些器官或肿瘤内皮细胞上的独特受体。在整个血管系统中与常见受体结合的肽会在三轮选择后被稀释掉。最近,应用这种方法来发现血管靶向肽的方法已经被审查。
通过体内选择方法发现的三个不同的肽基序是RGD、NGR和GSL。D-4C肽CDCRGDCFC是avB3整合素的选择性结合物,RGD-4C和NGR含有的噬菌体对肿瘤的归巢次数比阴性对照噬菌体高出10-20倍。除了肝脏和脾脏(已知它们对噬菌体的非特异性结合)外,这些噬菌体不会在正常组织中积累。除了对乳腺癌、黑色素瘤和卡波西肉瘤的新生血管归巢外,这些噬菌体(RGD-4C、NGR和GSL噬菌体展示肽)还对关节炎滑膜和视网膜的新生血管归巢。RGD-4C有四个半胱氨酸残基,两个二硫键可以形成三种不同的构型。只有两种构型被证明是活跃的:具有1-4、2-3二硫键排列的肽比具有1-3、2-4排列的肽的活性高出10倍。与游离合成肽的竞争归巢研究表明,RGD-4C 和 NGR 肽结合的是不同的受体。
尽管 CD13 存在于各种其他上皮细胞中,但发现 NGR 噬菌体仅与小鼠和人类肿瘤内皮细胞中的氨肽酶 N(CD13)特异性结合。在成年动物中,NG2(人类黑色素瘤蛋白聚糖的大鼠同源物)在肿瘤细胞和肿瘤血管生成中表达。当使用这种蛋白质筛选噬菌体展示肽库时,发现了 TAASGVRSMH 和 LTLRWVGLMS 肽。这两种肽相互抑制对NG2的结合,这意味着它们与相同或重叠的位点结合。当注射到荷瘤小鼠体内时,展示这两种肽的噬菌体在野生型小鼠的肿瘤血管中聚集,但在 NG2 基因敲除小鼠中不聚集。
当使用 IC-12大鼠气管肿瘤荷瘤小鼠来筛选噬菌体展示的线性肽库时,鉴定出了这三个肽:NRSLKRISNKR-IRRK、LRIKRKRRKRKKTRK 和 NRSTHI。这三个肽中有两个具有高碱性。然而,对其他细胞类型的非特异性结合令人担忧。此外,在荷瘤动物中,用[213Bi]DTPA(DTPA:二亚烷基三胺五乙酸)标记的这些肽在肿瘤中的摄取量很低。Arap 等人从前列腺选择的同源噬菌体中分离出了 SMSIARL 和 VSFLEYR 肽。用与促凋亡肽偶联的 SMSIARL 肽对小鼠进行全身性治疗,仅导致前列腺的组织破坏,而其他器官未受影响。这种嵌合肽延缓了易患前列腺癌的转基因小鼠(TRAMP 小鼠)中癌症的发展。
埃斯勒和鲁斯拉蒂最近描述了一种环状九肽的分离,即 CPGPEGAGC,它定位于乳腺组织。除了正常乳腺组织的血管外,这种肽还与转基因乳腺癌小鼠增生性或恶性病变中的血管结合。发现这种肽的受体是氨肽酶P,它在恶性乳腺组织中也广泛表达。
Bine´truy-Tournaire 等人筛选了一个噬菌体展示肽库,以寻找对(a)膜表达的 KDR(一种在肿瘤血管生成中起重要作用的 VEGF 受体)有亲和力的肽,以及(b)抗 VEGF 中和单链抗体。结果发现,其中一个已鉴定出的肽ATWLPPR在体外和体内都是VEGF的有效拮抗剂和血管生成的抑制剂。这不仅作为肿瘤血管生成的强大抑制剂具有重要意义,而且在其他涉及血管生成的疾病中也有重要意义。
Bae 等人从肽库中鉴定出了富含精氨酸的六肽,能够抑制血管内皮生长因子(VEGF)与 VEGF 受体之间的相互作用。这些六肽能够抑制VEGF诱导的人脐静脉内皮细胞增殖以及小鸡绒毛尿囊膜和兔子角膜中的血管生成。已鉴定出的肽RRKRRR能够在裸鼠异种移植模型中抑制人结肠癌细胞(HM7)的生长和转移。该肽能够通过抑制VEGF来阻止正在进行的肿瘤血管生成和肿瘤生长,并阻止肿瘤侵袭。
从鼠肿瘤异种移植物的血管生成血管中分离出了噬菌体展示肽 ASSSYPLIHWRPWAR、DRWRPALPVVLFPLH 和 PRPGAPLAGSW-PGTS。用这些肽修饰的脂质体被证明能与人脐带内皮细胞以及人类胰岛细胞瘤和胶质母细胞瘤中的血管生成血管紧密结合。其中一种分离出的肽 ASSSYPLIHWRPWAR 以及包含WRP的肽片段被证明能显著抑制肿瘤生长以及VEGF刺激的人脐静脉内皮细胞的迁移。这表明 ASSSYPLIHWR-PWAR 肽可能通过抑制血管生成导致肿瘤休眠,而WRP 序列可能是实现这一活性所需的最小且必不可少的序列。
基质金属蛋白酶(MMP)与肿瘤血管生成有关,并且已被证明能介导选择性肽噬菌体归巢。含有HWGF序列的环肽被发现能抑制MMP-2 和 MMP-9,在体外抑制肿瘤细胞和内皮细胞的迁移,在体内归巢至肿瘤血管,并阻止肿瘤生长。
使用小鼠进行人类癌症靶向肽的体内选择的主要缺点是,小鼠和人类肿瘤的新生血管结构可能不同,在小鼠人类移植瘤中非常有效的靶向肽在人类癌症患者中可能无效。直到最近,才首次报道了使用人类患者筛选组织靶向噬菌体展示肽的研究。从该患者的脂肪组织、皮肤、骨髓、骨骼肌、前列腺和肝脏中回收噬菌体。尽管只进行了一轮选择,但分离出了一种模拟白细胞介素-11 并与前列腺中的白细胞介素-11受体结合的肽。
通过OBOC组合肽库法发现癌细胞表面靶向肽段
使用“分裂 - 混合合成”方法(图 2),可以制备出这样的肽珠库:
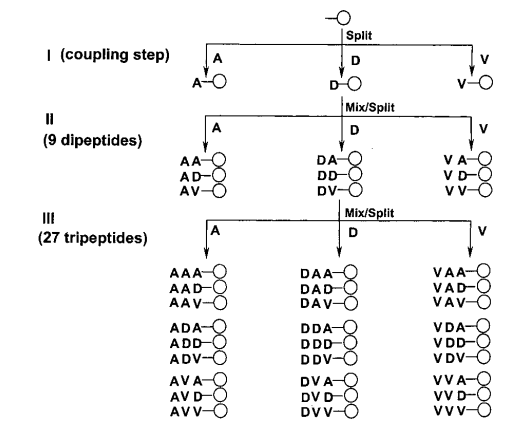
图 2 裂分-混合合成法的合成方案。A⫽丙氨酸,D⫽天冬氨酸,V⫽缬氨酸
每个珠子只展示一种肽实体,尽管在单个直径为80微米的珠子中,同一种肽的副本超过10的13次方个。这样的OBOC库可以通过多种不同的检测方法与不同的生物靶点进行筛选。与生物靶点相互作用的珠子随后会被物理分离出来,以进行结构测定。由于OBOC库是通过合成化学方法制备的,除了L-氨基酸外,还可以使用D-氨基酸、非天然氨基酸、杂环结构和其他非氨基酸部分来构建肽、肽类似物或小分子库。为了鉴定细胞表面的结合配体,可以使用纯化的受体结合酶联比色法,或者使用完整细胞来筛选肽-珠子库(图3)。
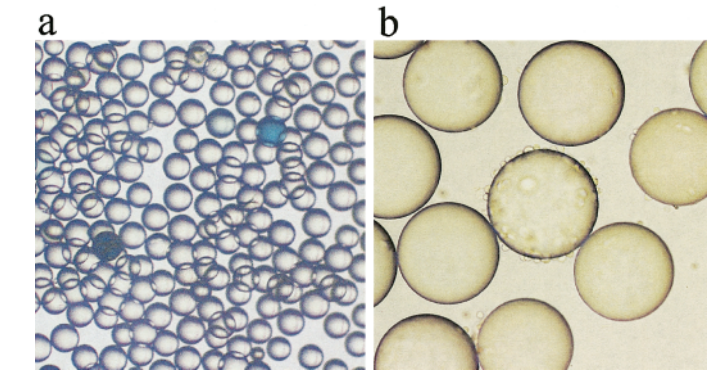
图 3 显微照片展示了使用(a)酶联比色测定法和(b)全细胞结合测定法进行珠上细胞表面配体的筛选。
在第一种方法中,可以克隆、表达、纯化和生物素化特定的细胞表面受体的细胞外结构域。然后将生物素化的受体与随机肽偶联的珠子库混合。孵育后,彻底清洗珠子库,并加入链霉亲和素-碱性磷酸酶偶联物。一小时后,清洗珠子库,并加入溴氯吲哚磷酸(BCIP),一种显色底物。颜色变为蓝绿色的珠子随后被分离出来,因为它们的颜色表明与目标蛋白质或链霉亲和素结合。然后,用二甲基甲酰胺脱色,并再次用链霉亲和素-碱性磷酸酶/BCIP进行染色,但这次没有加入生物素化的受体。在这一步中,颜色变为蓝绿色的珠子是单独与链霉亲和素结合的假阳性珠子。剩余的无色珠子随后用生物素化的受体/链霉亲和素碱性磷酸酶/BCIP进行染色。经过这些步骤后检测到的蓝绿色珠子是真阳性珠子,并被分离出来进行微测序。我们使用这种方法来鉴定与两种小鼠B细胞淋巴瘤细胞系WEHI-231和 WEHI-279的细胞表面独特型结合的具有不同基序的肽配体其中一些肽全是 L-氨基酸,而另一些全是 D-氨基酸。后者尤为重要,因为它们在体内具有蛋白水解稳定性,因此在治疗上更有用。其中一种肽,wGeyidvk(小写字母代表 D-氨基酸),以四聚体的形式,能够诱导信号转导,这通过几种蛋白质的酪氨酸磷酸化增加得以体现。四聚体化通过将生物素化肽与亲和素混合来实现。我们已经通过将这种肽与分子量为20,000的八价胺基聚乙二醇支架结合制备了八聚体形式的肽。这种八聚体肽的浓度为10-100纳摩尔时能够诱导酪氨酸磷酸化。磷酸化模式在定性上与抗IgM多克隆抗体阳性对照相似,但在定量上有所不同(图4)。
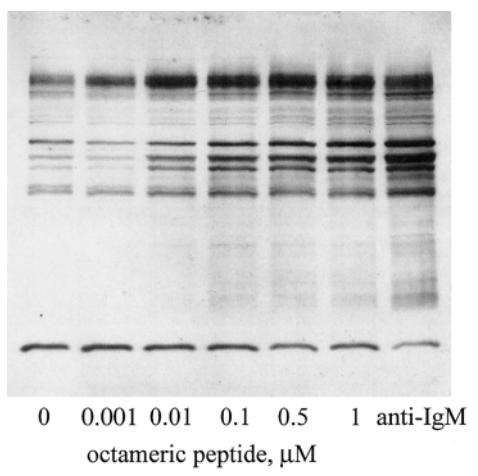
图 4 总细胞裂解物的蛋白质印迹法,展示了八聚体聚乙二醇 wGeyidk或抗小鼠IgM多克隆抗体对酪氨酸磷酸化的影响
我们还用生物素化-wGeyidvk和FITC标记的中亲和素(荧光绿色)的混合物与WEHI-231细胞一起培养。用碘化丙啶短暂染色使细胞核变红(图5)后,我们在共聚焦显微镜下观察细胞。有趣的是,生物素化肽能够在5分钟内进入细胞表面,15分钟后,一部分肽被发现进入细胞质。到30分钟时,观察到细胞核中出现了一些黄色,表明肽已经进入细胞核。到2小时时,发现大部分肽已经进入细胞核。尽管目前尚不清楚这些肽是如何进入细胞核的,这增加了某些细胞表面结合肽可能作为基因靶向剂的可能性。
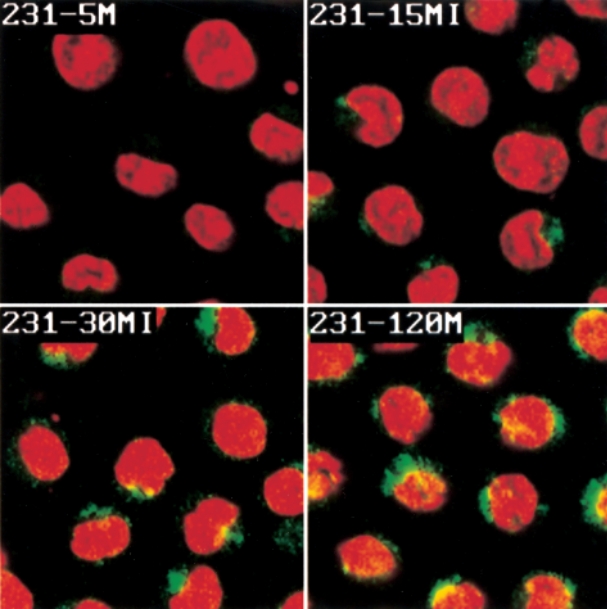
图5 显示WEHI 231小鼠淋巴瘤细胞中肽摄取的时间过程的显微照片。将生物素化的wGeyidk与Bodipy-链霉亲和素偶联物混合,然后添加到活WEHI 231细胞中。在不同时间点,细胞被固定,用碘化丙啶处理以使细胞核呈红色,并在共聚焦显微镜下进行检查。显然,随着时间的推移,四聚体肽(绿色)与细胞表面结合,进入细胞,然后定位于细胞核(黄色)。
对于具有多膜结构域的细胞表面受体,如G蛋白偶联受体,很难以可溶性形式克隆和表达这些蛋白质。因此,酶联比色法无法使用。对于此类情况,我们设计了一种全细胞结合方法,即将完整的癌细胞与珠库一起培养。与细胞表面受体结合的配体珠子会被一层细胞覆盖。这些珠子可以在显微镜下轻松识别,并用手持式微量移液器分离。由于活细胞上存在众多不同的细胞表面受体,因此开发方法以消除与许多不同细胞非特异性结合的肽珠非常重要。为此,我们开发了一种双色细胞结合方法来区分特异性和非特异性结合(图6)。在该实验中,将K562髓系白血病细胞系和Jurkat T细胞淋巴瘤细胞系的混合物用钙黄绿AM(分子探针)标记为绿色,而OC1LY8人类B细胞淋巴瘤细胞未标记。将等数量的绿色细胞和未标记细胞与肽珠库混合。孵育一小时后,轻轻清洗珠库,并在低背景光的荧光显微镜下进行检查,以便能看到无色和绿色细胞。大多数珠子是无细胞的。少数珠子涂有一层绿色细胞,一些涂有一层无色细胞,还有一些涂有绿色和无色细胞的混合物。在图6中,可以看到四个表面有单层细胞的珠子。左边的三个珠子(珠子“a”、“b”、“c”)结合了荧光细胞,而珠子“d”只结合了非荧光细胞。仔细检查,似乎珠子“b”和“c”结合了荧光和非荧光细胞,即结合了不止一种细胞类型。相比之下,珠子“a”只结合了荧光细胞(可能是T细胞特异性的、髓系细胞特异性的,或者两者兼而有之),而珠子“d”只结合了非荧光细胞(可能是B细胞特异性的)。另一种消除非特异性结合珠子的方法是使用特定的阻断抗体来识别特异性结合的珠子(见下文)。在过去的几年里,我们利用全细胞结合测定法来鉴定与许多不同癌细胞系结合的配体。表3总结了其中的一些结果。

图 6 这是一张显微照片,展示了双色在珠上的全细胞筛选测定法,用于区分对两种或更多不同细胞类型的结合特异性。K562 髓系白血病细胞系和 Jurkat T 细胞系用钙黄绿 AM(分子探测公司)标记为绿色,而 OC1LY8 人类 B 淋巴瘤细胞未染色。在珠子“d”上有一层非荧光细胞,表明珠子“d”可能是 B 细胞特异性的。
我们使用完整的DU145细胞(一种细胞表面整合素水平升高的前列腺癌细胞系)对11个氨基酸的随机线性肽库进行了筛选。筛选出的涂有单层细胞的珠子被分离出来,通过用8M胍盐酸处理珠子来去除细胞。然后,这些回收的珠子与DU145细胞在存在功能阻断抗体(GoH3)以阻断整合素的情况下混合。在阻断抗体存在的情况下,不与DU145细胞结合的珠子被分离出来进行微测序。使用这种两步筛选方法,我们鉴定出了两个结合肽:LNIVSVNGRHX(RU-1)和DNRIRLQAKXX(RX-1)。这些肽类似于之前报道的源自天然层粘连蛋白的活性肽序列(GD-2和AG-73)。RU-1肽涂层的塑料表面能够支持细胞附着。我们还使用全D-氨基酸9个氨基酸的肽库对DU145细胞进行了筛选,并鉴定出了几个可以被GoH3抗体阻断的细胞结合配体:例如,kmviywkaG(RZ-3)、kggrhykfG(RZ-6)和yiknrkhhG(RZ-12)。我们还设计了一种基于一些阳性肽重叠序列的混合肽:kikmviswkG(HYD-1)。涂有 RZ-3 或 HYD-1 肽的塑料表面支持 DU145 细胞的黏附,但乱序的 HYD-1 肽序列则不支持。RZ-1 和 HYD-1 肽还阻止了 DU145 细胞与抗β1抗体、纤维连接蛋白、层粘连蛋白 1、层粘连蛋白 5 和 IV 型胶原蛋白的附着。此外,它们还抑制了肿瘤细胞与固定化的真皮成纤维细胞的黏附。
 最近,我们报道了使用全细胞结合测定法筛选四种不同的转角环肽和环肽库(XXXpXXX、xXXXXpXXX、cXXXXc 和 cXXXXXc,其中 p ⫽D-Pro、c ⫽D-Cys、x ⫽D-amino除D-Cys外的氨基酸,X⫽ 除 L-Cys 外的 L-氨基酸),并鉴定出一系列与人类T淋巴瘤细胞系 Jurkat 细胞的α4β1整合素结合的肽。这些肽具有常见的 LDI、LDV 或 LDF 基序。它们优先与 T 淋巴瘤细胞和 B 淋巴瘤细胞结合,但不与髓系白血病细胞系或正常人外周淋巴细胞结合。在这些实验中,故意将D-Pro 引入线性库中以形成转角结构,并且两侧的D-Cys允许肽通过二硫键环化。氨基和羧基的D-半胱氨酸保护肽免受外切肽酶的作用。
最近,我们报道了使用全细胞结合测定法筛选四种不同的转角环肽和环肽库(XXXpXXX、xXXXXpXXX、cXXXXc 和 cXXXXXc,其中 p ⫽D-Pro、c ⫽D-Cys、x ⫽D-amino除D-Cys外的氨基酸,X⫽ 除 L-Cys 外的 L-氨基酸),并鉴定出一系列与人类T淋巴瘤细胞系 Jurkat 细胞的α4β1整合素结合的肽。这些肽具有常见的 LDI、LDV 或 LDF 基序。它们优先与 T 淋巴瘤细胞和 B 淋巴瘤细胞结合,但不与髓系白血病细胞系或正常人外周淋巴细胞结合。在这些实验中,故意将D-Pro 引入线性库中以形成转角结构,并且两侧的D-Cys允许肽通过二硫键环化。氨基和羧基的D-半胱氨酸保护肽免受外切肽酶的作用。
最近,我们描述了一种新颖的细胞生长珠检测法来筛选珠库。在这种筛选检测法中,活细胞与肽珠库在完整的细胞培养基中混合24-48小时。我们观察到一些肽珠促进细胞附着和生长。当使用人类非小细胞肺癌细胞系(A549)筛选环肽库(cXXXXXXc)时,鉴定出了cNGRGEQc 的肽基序。这种肽与另外两种非小细胞肺癌细胞系(Calu-1 和 H178)有很强的结合力,但对非恶性支气管上皮细胞系(HBE-1)的结合力较弱。针对整合素的α链和β链的抗体阻断了A549细胞在 cNGRGEQc 珠上的结合和生长。有趣的是,这种肽序列与 Arap 等人鉴定出的CNGRC肽有一些相似之处。然而,他们的肽靶点似乎是氨肽酶N(CD13),而不是α3β1整合素。(见表2)此外,这两种环肽的环大小差异很大。
癌症靶向治疗方法
在过去二十年中,针对单链抗体的使用作为癌症靶向剂,已经应用了几种方法:单独的裸抗体、放射性标记抗体、抗体-化疗药物偶联物、抗体-小分子毒素、抗体-蛋白质毒素,以及用单链抗体装饰的载药脂质体。类似的方法也可以应用于癌症靶向肽。图7展示了针对癌症的各种肽靶向方法。
癌症靶向肽
由于肽类分子体积小且化学性质相对稳定,因此对肽类分子的衍生化处理比对抗体进行衍生化处理要容易。目前,正在进行临床试验的 (DOTA:1,4,7,10-四亚胺基癸烷-N’,N’‘,N‘’,N‘’‘-四乙酸)生长抑素类似物。Arap 等人将阿霉素与新血管靶向肽 RGD-4C 和 NGR 偶联,并在小鼠异种移植中观察到了体内抗肿瘤效果。86 除了使用阿霉素作为有效载荷外,Ellerby 等人将一个全 D-氨基酸促凋亡肽与 NGR 靶向基序连接,并能够证明这些杂交肽对血管生成内皮细胞具有选择性毒性,在小鼠体内具有抗癌活性。102 本研究中使用的肽具有以下序列:CNGRCGGklaklakklaklakk。Chen 等人将 RGD-肽与 tachyplesin 偶联,并能够显示肿瘤生长抑制。
由于肽类物质体积小且化学性质相对稳定,因此对肽类进行衍生化处理要比对抗体进行衍生化处理容易得多。目前,标记有[90Y]-DOTA(DOTA:1,4,7,10-四氮杂环十二烷-N',N',N'',N'''-四乙酸)的生长抑素类似物正处于临床试验阶段。Arap 等人将阿霉素与靶向新生血管的肽类RGD-4C和 NGR进行偶联,并在小鼠异种移植模型中观察到了体内抗肿瘤效果。除了使用阿霉素作为有效载荷外,Ellerby 等人还将一种全 D-氨基酸促凋亡肽与 NGR 靶向基序相连接,并能够证明这些杂交肽对血管生成内皮细胞具有选择性毒性,并在小鼠体内表现出抗癌活性。该研究中使用的肽具有以下序列:CNGRCGGklaklakklaklakk。Chen 等人将RGD肽与鲎素偶联,并能够证明其具有抑制肿瘤生长的作用。
Curnis 等人报告称,小鼠肿瘤坏死因子(TNF)与CNGRC肽融合(TNF-NGR)对肿瘤中激活血管的靶向作用比小鼠肿瘤坏死因子(TNF)高效12-15 倍。在淋巴瘤和黑色素瘤动物模型中,肿瘤负荷有所减少,尽管其毒性相似。同样,人类肿瘤坏死因子-NGR 比单独的人类肿瘤坏死因子诱导更强的抗肿瘤效果,即使剂量低30倍也是如此。
基因靶向肽
组织靶向肽也可用作基因靶向剂。例如,一种具有NGR基序的肽已被纳入腺相关病毒载体的衣壳中,并用作基因靶向剂。结果表明,含有这种基序(NGR,可结合CD13)的病毒突变体对表达CD13受体的细胞显示出不同的嗜性。类似的工作还报道了将 NGR 肽纳入莫洛尼鼠白血病病毒的包膜蛋白中。结果表明,这些工程化逆转录病毒能够有效地结合并转导人类内皮细胞。
低聚物靶向肽
为了增强对靶细胞的亲和力,靶向肽可以以低聚体的形式制备。除了增加亲和力外,低聚肽还有可能与细胞表面受体交联,并触发细胞信号传导和细胞凋亡。Renschler 等人他们将针对人类淋巴瘤细胞系(SUP-B8)的特异性肽偶联生物素化,并用链霉亲和素进行四聚反应。他们能够证明这些四聚体肽能够在体外刺激酪氨酸磷酸化并触发靶淋巴瘤细胞凋亡。此外,他们还表明这些肽的二聚体和四聚体形式能够导致完整细胞的细胞外酸化速率迅速增加(在刺激后10分钟短暂达到峰值)。如图4上文所述,我们已经表明,一种小鼠B细胞淋巴瘤细胞系特异性肽的八聚体形式触发了信号转导。在我们实验室进行的初步体内研究中,使用小鼠/人类肿瘤异种移植模型表明,聚乙二醇支架上的寡聚肽在肝脏和脾脏的摄取量较低。对于寡聚肽,这些肽可以以同聚体或异聚体的形式制备。异聚体形式特别有趣,因为细胞表面上两种不同受体的交联可能会触发期望的生物反应,如细胞凋亡。
负载阿霉素的非离子体(Doxil)是一种涂有聚乙二醇的脂质体,其中装载了阿霉素,也可用肽-脂质缀合物进行修饰,用于肿瘤靶向治疗。一种或多种肿瘤靶向肽可以掺入此类脂质体中。
观点
在科勒和米尔斯坦发明人类单链抗体25年后,人类癌症的靶向治疗终于在临床上取得了成果。这一成功清楚地表明,癌细胞表面受体是极具前景的治疗靶点。由于其体积小,肽或其他非肽类细胞表面靶向分子可能成为第二代抗癌靶向药物。利用强大的组合库方法,在临床前研究中显示出希望的肽已经被发现。正在开发新的方法,利用这些靶向剂在动物和人类受试者的癌症成像和治疗中进行研究。我们设想,未来人类癌症的肽或肽类似物靶向治疗将完全为个体患者量身定制。新的方法,如化学微阵列、肽组织化学方法和肽流式细胞术方法,将用于为特定患者选择最佳的治疗剂组合。我们预计该领域在未来 5 至 10 年内会迅速发展,由于化学家、生物学家、放射化学家、放射物理学家和医生之间的密切合作,副作用少的、高效的肽类或非肽类癌症靶向药物将会被开发出来。