摘要:卟啉和其他四吡咯大环由于其有趣的光物理和化学特性而受到广泛研究。自1931年汉斯·费舍尔因在血红素合成方面的工作获得诺贝尔奖以来,人们对卟啉衍生物在科学各个领域的合成和应用的兴趣日益浓厚。研究这些大分子的强大驱动力是合成用于生物学研究的催化剂和模型系统,以及用于光动力疗法的对光有反应的敏化剂,其中卟啉的光物理特性被证明特别有用。在自然界中,卟啉大环是一个理想的支架,可以以四齿配位的方式牢固地将金属原子嵌入蛋白质中,构成参与基本生物过程的几种金属蛋白的辅助基团。血红素蛋白家族在这方面是一个引人入胜的例子,其中血红素辅基促进了多种功能,如双氧的储存和运输、电子转移、有机底物的羟基化和氧化以及过氧化氢的分解。对越来越多的血红素蛋白进行的结构性和位点定向诱变研究表明,包围血红素活性位点的蛋白质基质控制着配体基团的内在反应性。因此,在过去 20 年中,大量卟啉-肽缀合物已被合成并作为金属酶和血红素蛋白的模型进行研究,这并不令人惊讶。除了这个重要主题之外,在过去 20 年中,文献中出现了卟啉-肽缀合物的新应用,从医学扩展到材料科学。在此,我们打算对四吡咯-肽缀合物在生物医学应用方面的文献进行综述,超越成像技术。在本综述中介绍的大多数缀合物中,四吡咯大环通过涉及肽N末端氨基或赖氨酸侧链的酰胺键与肽相连。其他缀合策略则利用了半胱氨酸侧链或适当功能化成分的叠氮化物-炔烃环加成反应。关于卟啉及相关大环与肽和蛋白质缀合的合成方法的综述,读者可参考吉恩蒂尼等人的精彩综述。
2 | 抗菌光动力疗法
卟啉及其衍生物在过去几十年中广泛用于光动力疗法(PDT)中作为敏化剂的应用。PDT 是一种用于治疗癌症和其他非恶性病症的局部疗法,它涉及光、氧和一种可见光吸收分子(光敏剂,PS)的组合产生导致细胞死亡的细胞毒性活性氧(ROS)。四吡咯类化合物,如卟啉、酞菁和叶绿素(图1)作为光敏剂(PSs)具有以下有利特性:(a)在红到近红外光谱区域(600-700纳米)有强吸收带,使光能够深入进入组织;(b)具有较高的三重态量子产率,导致在照射下产生大量的ROS;(c)在黑暗中具有最小的毒性,这提供了一定程度的内在选择性,因为ROS的产生发生在光敏剂的照射下。另一方面,已知的缺点是某些分子的不稳定性(例如bacteriochlorins))以及它们的生物利用率差,要么太亲水,要么太疏水,水溶性有限。此外,单线态氧是光动力疗法(PDT)细胞毒性中的一种关键物质,在生物环境中具有短半衰期(<0.04毫秒)和有限的扩散距离(0.01-0.02毫米),这显著抑制了其对中央细胞成分的损伤能力。
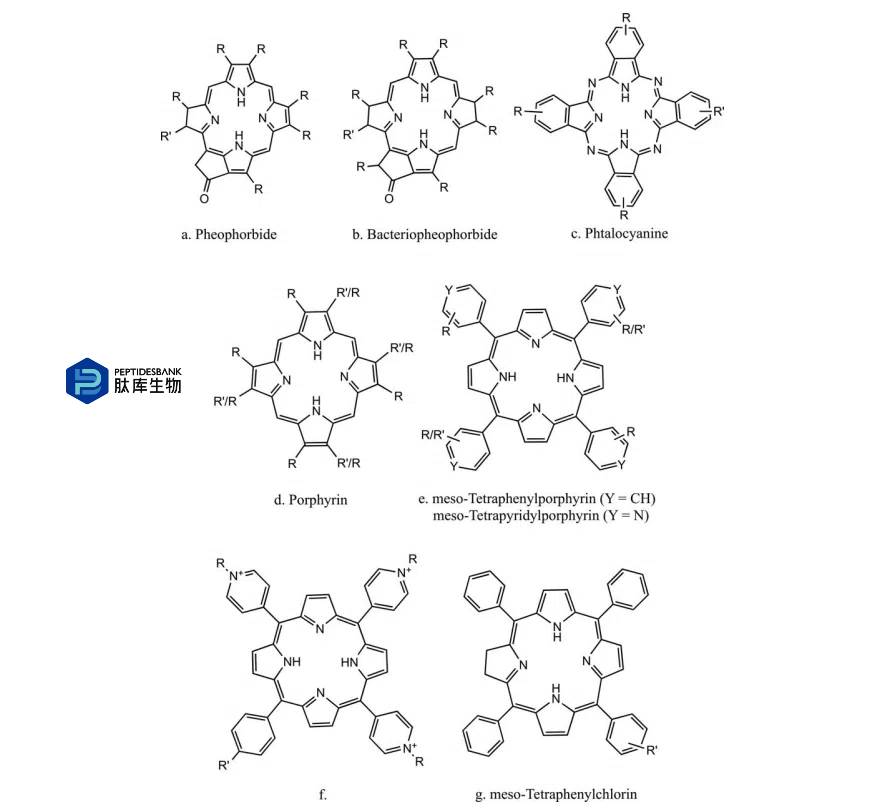
图 1 基于卟啉的 PS 的基本结构。R表示烷基或烯基取代基,R0是与肽链共价键合的功能基团。
通过与某些肽或蛋白质连接来修饰光敏剂(PS)的共轭策略已被用于提高光敏剂的选择性和溶解性。在抗菌光动力疗法(PDT)领域,聚氨基酸和阳离子肽已被与卟啉连接,以增加光敏剂对革兰氏阴性菌表面的亲和力。与革兰氏阳性菌相比,革兰氏阴性菌更复杂的细胞膜形成了一个有效的渗透屏障,往往会限制许多光敏剂结构的结合和渗透。因此,能够渗透这一屏障的策略与非阳离子或阳离子的光敏剂结合使用,对革兰氏阴性菌是有效的。阳离子抗菌肽是大多数生物系统先天免疫系统的关键组成部分。它们的总体正电荷确保在含有酸性聚合物的多阴离子微生物细胞表面聚集,例如革兰氏阴性菌中的脂多糖和革兰氏阳性菌中的壁相关多糖。此外,它们作用于不同的细菌靶点:大多数是膜溶解性的(例如,马盖宁、天蚕素),而其他(例如,阿皮达辛、布弗林)则穿过细菌膜,没有明显的损害,以到达细胞内靶点。多塞利等人制备了许多抗菌肽与疏水或阳离子卟啉的缀合物(表1,条目1-3)。除了改善疏水卟啉的溶解性外,抗菌肽还期望将光活性药物作用于不同的细菌靶点。一种羧基功能化的间苯四苯基卟啉(TPP)通过共价键连接到阿皮达辛、马盖宁或布弗林的N末端,这些缀合物在光照下对革兰氏阴性菌和革兰氏阳性菌表现出高毒性。在革兰氏阴性菌上,TPP-阿皮达辛和TPP-马盖宁的光毒性比单独的卟啉高出几个数量级,但它们与细菌的结合也较松散,并且根据其两亲性,它们在洗涤后更容易或更不容易被去除。因此,不幸的是,阿皮达辛穿透革兰氏阴性菌的能力在与其卟啉结合后丧失了。TPP-布福林对大肠杆菌表现出巨大的光毒性活性,与最活跃的阳离子卟啉相当,即使在大量细胞洗涤后也完全保留。尽管这些阳离子抗菌肽及其卟啉缀合物在黑暗中对细菌细胞表现出选择性毒性,但在光照下,所有测试的缀合物对人类胎儿成纤维细胞的细胞毒性都比相应的游离卟啉更强。最近,一种阳离子卟啉与抗菌脂肽多粘菌素B类似物的缀合物被合成。多粘菌素是革兰氏阴性菌外膜的渗透剂,当与卟啉结合使用时,预计它们会提高光动力效果。在光照射下,该共轭物显示出广谱抗菌活性,并且对革兰氏阴性菌的抗菌效果优于单独的阳离子卟啉。相应地,其对人皮肤成纤维细胞的细胞毒性增强。
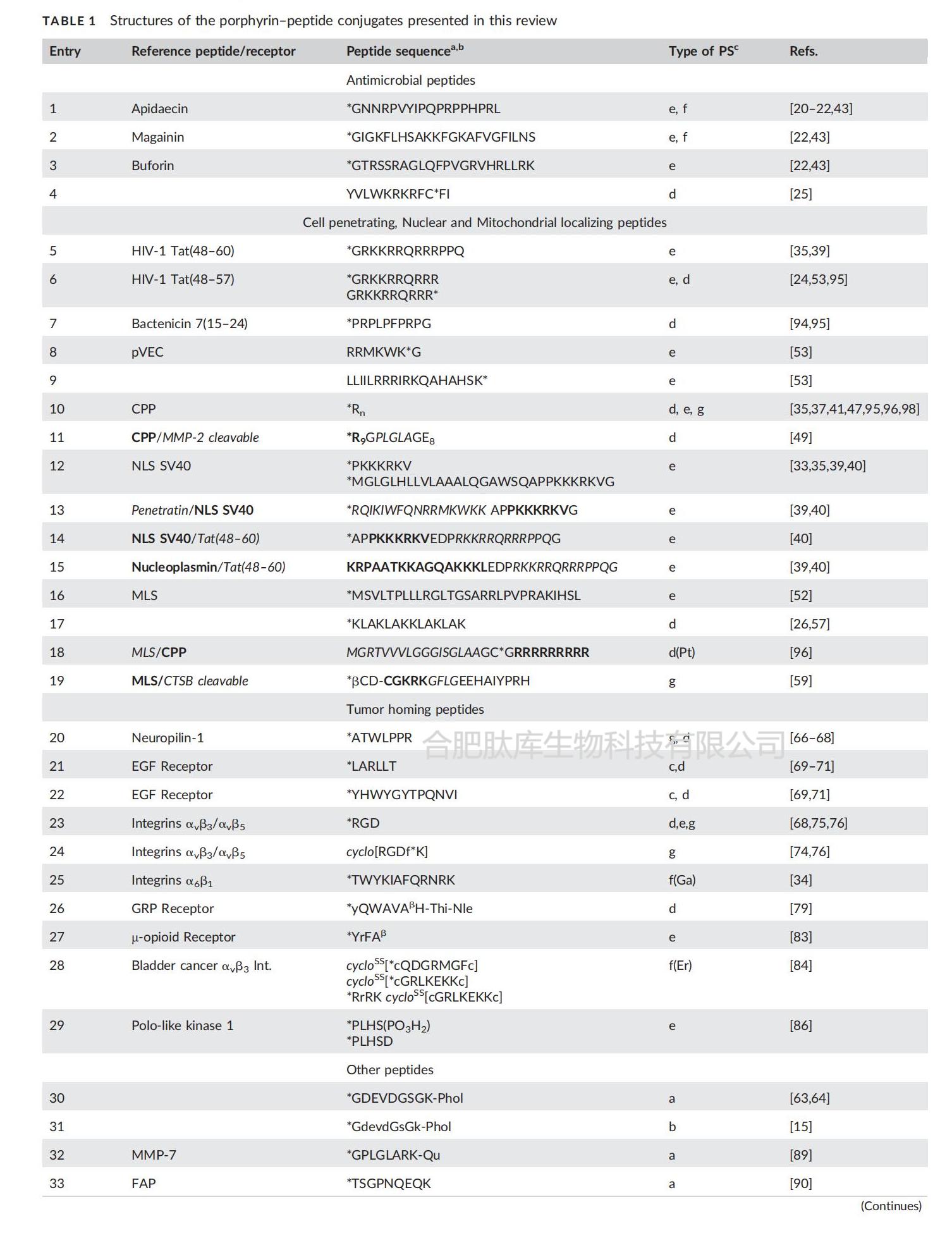

除了天然的抗菌肽外,新设计的阳离子肽也与光敏剂(PS)结合,以提高其与细菌外膜的结合力,从而增强光动力作用。例如,一种与六残基寡精氨酸肽偶联的叶绿素衍生物(卟啉-18)对革兰氏阳性菌具有高毒性,这得益于光敏剂更深入地穿透厚且多孔的肽聚糖层。尽管这种缀合物对哺乳动物细胞也表现出相当大的光溶血活性,但在细菌存在的情况下会大大降低。刘等人报道了另一个例子,他们将一或两份脂多糖结合阳离子肽(表1,第4项)与原卟啉IX(PpIX)衍生物偶联,用于革兰氏阴性菌株的荧光成像和光动力灭活(图2)。无论是单聚体还是二聚体PpIX-肽衍生物,对包括具有耐药性菌株在内的测试菌株都显示出比游离光敏剂更高的光毒性。为了证实 PS 与细菌包膜紧密结合的重要性,二聚体缀合物在细菌细胞上比 PpIX - 肽显示出更强的光毒性,并且在黑暗和光照射下对哺乳动物细胞均无细胞毒性。PS-肽缀合物对哺乳动物细胞毒性的对比结果表明,这些化合物的两亲性在决定它们对细菌细胞的选择性方面起着重要作用,而高度亲脂性的PS可能会削弱肽部分的靶向特异性。
图 2 一种 PpIX-抗菌肽缀合物对革兰氏阴性菌菌株的荧光成像和光动力灭活作用。
3 | 肿瘤光动力疗法
3.1 | 基于四吡咯的光敏剂的肽载体
尽管光动力疗法(PDT)是在微生物学领域发现的,但它主要应用于癌症治疗,尤其是浅表性肿瘤的治疗。自上个世纪末以来,肽类已被与四吡咯衍生物共价连接,以提高它们作为光敏剂(PSs)的生物有效性,特别是为了改善它们的组织穿透性和在癌细胞中的积累。光敏剂的细胞定位对光动力疗法的疗效至关重要,并且已经提出了许多递送系统来增强亚细胞积累。自开始以来,核定位信号(NLS)和细胞穿透肽(CPPs)一直是光敏剂向肿瘤细胞最常用的载体。维森特小组合成了一系列功能化的 TPP 衍生物,它们带有一到四个拷贝的八肽 PKKKRKV,这是猿病毒大T抗原核定位信号的最小序列。核定位信号通过一个短间隔与卟啉大环的一个、两个、三个或四个芳香环共价连接,或者在单个位置连接三个连续拷贝。对人类癌细胞 Hep2 细胞进行的研究表明,肿瘤细胞对缀合物的摄取和光毒性并不取决于每个分子的 NLS 单位数量,而是取决于缀合物两亲性特征。在卟啉周边对称取代的 NLS 导致缀合物摄取和毒性降低,而含有单个肽序列、带有多个 NLS 的两亲性缀合物显示出最强的光毒性。尽管 NLS 被认为将 PS 导向细胞核,但所有缀合物都定位于细胞内的内涵体囊泡和溶酶体中。
PDT 需要高纳摩尔至微摩尔量的 PS,并且其通过细胞穿透肽(CPP)的功能化已被证明能有效将大量 PS 递送至细胞内部。受蛋白质转导结构域启发的天然穿透肽和短寡精氨酸序列已被与疏水卟啉和叶绿素缀合,以增强其在癌症中的摄取。TPP 通过亲水间隔物与 HIV-I 转录激活因子(Tat 肽)的基本结构域序列(48-60)连接(表 1,条目 5),对 PC-3M 人前列腺癌细胞显示出低暗毒性和高光毒性。这种缀合物在体内的生物分布与 FDA 批准的纯化血卟啉的生物分布进行了比较,TPP-Tat 缀合物更具选择性,并且在肿瘤中的积累程度显著更大。与预期相反,含有 CPP 和核定位信号(NLS)混合肽序列的 TPP 缀合物(表 1,条目 13 和 14),其光毒性低于 TPP-Tat 偶联物。李等人最近提出将天然细胞作为“特洛伊木马”来向肿瘤递送光敏剂。卟啉通过富含精氨酸的序列(KRRRR)锚定到载体细胞上,末端为棕榈酸残基以插入膜。载体细胞的肿瘤趋向迁移特性使得卟啉在肿瘤部位积累,并且在光照下只有与载体细胞密切接触的肿瘤细胞才会被光动力疗法破坏。
与 CPP 类似,一些抗菌肽能够以非破坏性的方式穿过生物膜,并且已被用于在哺乳动物细胞中引入荧光探针。在癌细胞中测试了三种抗菌肽作为卟啉载体的性能。相应的 TPP 缀合物(表 1,条目 1 - 3)能有效地被 A549 癌细胞摄取,并且在蓝光照射后,它们在纳摩尔浓度下被证明具有光毒性,而要获得相同的效果则需要微摩尔浓度的游离 PS。所有卟啉-CPP 缀合物细胞内化的主导机制已被证明是内吞作用,但它们的细胞内定位已被报道在不同的亚细胞区室(溶酶体、内质网、高尔基体等)中,这取决于肽序列和缀合物的总体电荷。
尽管CPP中存在几种带电氨基酸,但其与疏水 PS 的共轭物在水性介质中仍能表现出相当大的自聚集,这通常会因在肽和卟啉部分之间插入亲水间隔物而受到阻碍。作为克服溶解性和聚集问题的替代方法,已提出将疏水 PS 封装在β-环糊精衍生物中,并且最近报道了β-环糊精与 TPP-八精氨酸之间的超分子包合物复合物被细胞摄取。在无血清培养基中,由于直接跨膜途径,宿主-客体复合物被 HeLa 细胞有效摄取并分散在胞质溶胶中。然而,在含血清培养基中,复合物迅速解离,共轭物被血清蛋白增溶并积累在细胞的内体中。因此,尽管β-环糊精衍生物能够将大量卟啉-CPP 共轭物携带进入胞质溶胶,但含血清培养基中宿主-客体复合物的稳定性仍需提高。
尽管 CPP 可被视为出色的 PS 载体,但其序列中存在几种带正电荷的氨基酸会导致强烈的非特异性相互作用,使其不适用于许多体内应用。为避免过早捕获缀合物,Li 等人将 PpIX 与一种“可激活”的 CPP 连接(表 1,第 11 项),通过一种特定的蛋白水解可裂解的连接子将带正电荷的 CPP 与中和多阴离子肽序列连接起来。在肿瘤部位积累 PS-中性肽缀合物后,肿瘤细胞外基质中存在的基质金属蛋白酶可以选择性地裂解掉阴离子部分,从而释放出 PS-CPP。在动物模型上的体内研究表明,这种可激活的缀合物在血液中非常稳定,并在肿瘤中广泛积累,用于体内成像。此外,在光照下反复使用该偶联物对动物进行治疗,降低了实体瘤的大小和重量,且对动物的全身毒性较低。
尽管 PS-肽偶联物能够增强肿瘤细胞的细胞摄取,但大多数偶联物主要定位于细胞质膜,而非敏感的细胞内位点(如线粒体、内质网和细胞核),在这些位点,光动力效应产生的活性氧物质可能更有效。考虑到线粒体广泛分布于细胞质中,并且作为细胞的能量中心,它们调节着许多代谢活动,因此它们已成为光动力疗法的重要靶点。已鉴定出几种线粒体靶向序列,并用于药物的特异性递送。Sibrian-Vazquez 等人合成了 TPP 与一个14个残基的线粒体定位序列之间的偶联物(表 1,第 16 项),在两个部分之间插入了一个亲水性间隔物,以增加水溶性并抑制聚集现象。该偶联物在人癌 Hep2 细胞中的摄取非常有效,但它主要定位于细胞溶酶体,导致其光毒性低于仅含胍基的卟啉。
光化学内化(PCI)技术有望显著改善光敏剂(PS)以及一般药物在亚细胞区室中的可用性。PCI 是一种光诱导释放技术,即在通过内吞机制摄取后,将治疗剂隐藏在囊泡中,然后通过光诱导释放。与光动力疗法(PDT)不同,PCI 是一种位点特异性药物递送技术,其治疗作用由药物本身而非 PS 发挥。在 PCI 中,对 PS 施加亚致死剂量的光,PS 定位于内体/溶酶体膜中,这足以导致这些细胞内细胞器的部分破裂(通过单线态氧的产生介导),从而释放捕获的药物。最近,通过各种生物偶联技术将 TPP 或氯素-e 与不同的 CPP 连接起来,已被提议作为 PCI 的活性成分。PCI 的疗效在与一种蛋白质毒素——沙培林(saporin)结合使用时得到了测试,结果表明沙培林与 PS-肽偶联物共定位于溶酶体中。与单独使用溶瘤素或 PS 处理相比,短时间照射触发了毒素的释放,细胞活力显著降低,即使将亚致死剂量的 PS 和药物联合使用时也是如此。
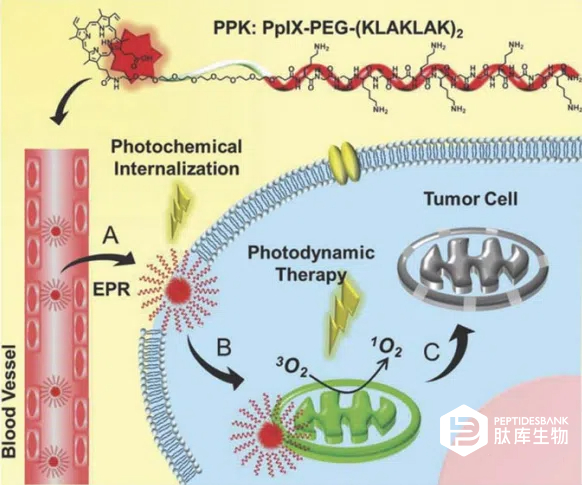
图 3 聚赖氨酸-聚谷氨酸(PPK)缀合物的化学结构以及线粒体靶向自递送过程的示意图。
韩等人应用了一种双阶段光照射策略来减少PpIX与促凋亡肽(KLAKLAK)2的偶联物在内涵体中的滞留(图3)。该策略将PCI和PDT结合起来,使用短光照射通过膜通透性增加偶联物的细胞内化,然后使用长时间光照射在线粒体中产生活性氧物质,从而显著改善PDT。这种双策略的有效性也在体内通过小鼠模型进行了测试,确认其对全身细胞毒性最小化,并有效抑制肿瘤的长期生长。童等人提出了一种将PS有效递送至线粒体的复杂方法。这些作者合成了一种“智能纳米载体”,由三个功能性的肽单元组成:(a)一种具有与转铁蛋白受体特异性结合能力的七肽,在高度增殖的癌细胞系中过度表达;(b)一种组织蛋白酶B裂解序列(GFLG);(c)一种线粒体靶向肽序列(CGKRK),其N末端带有金刚烷残基(表1,第19项)。通过这种残基,该肽与用 PS(氯 e6)功能化的β-环糊精非共价连接,形成一种客体-主体复合物(图 4)。这种纳米载体允许通过三个阶段对线粒体进行编程的 PS 递送:在过表达转铁蛋白受体的细胞中通过受体介导的复合物细胞内积累(MF7);内化后,组织蛋白酶B对GFLG序列的酶切导致线粒体靶向序列的暴露;积累在线粒体中的 PS 中,光辐照引发活性氧物质的产生从而触发细胞凋亡。MF7 细胞中每一步的进展都很容易通过荧光显微镜进行监测,并且在光辐照下,实现了剂量依赖的光动力细胞毒性。
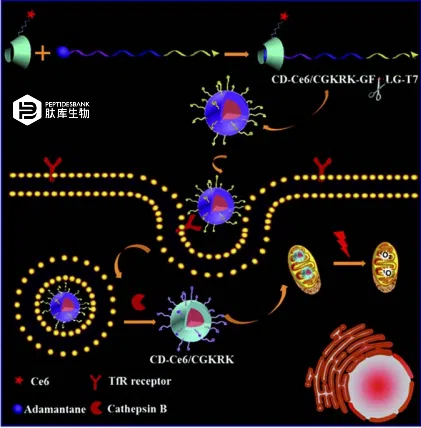
图 4 具有双重靶向能力的编程PS纳米载体的示意图,用于增强光动力疗法。
3.2 | 肿瘤靶向肽
尽管在光动力疗法中发现某些光敏剂(PS)相较于周围健康组织更倾向于被肿瘤细胞保留,但驱动这一过程的确切机制尚未完全明了。通过使用能够将光敏剂从给药部位运输至肿瘤组织的靶向递送剂,可以提高肿瘤的选择性,从而实现光敏剂在肿瘤中的选择性积累,并限制对周围健康组织的损害。肿瘤细胞表面表达了许多分子,使它们有别于正常细胞。传统上,这些分子是通过抗体来检测的,但诸如叶酸、肽和适配体等小靶向配体极大地增加了可用于选择性地与肿瘤细胞结合的工具数量。郑的团队利用叶酸将许多光敏剂-肽偶联物靶向到肿瘤细胞和组织上,这些细胞和组织过度表达叶酸受体(图5)。在这些光敏剂-肽-叶酸加合物中(表1,第30项),肽提高了偶联物的水溶性,使靶向剂更容易与其受体接触,并在体内起到药代调节剂的作用。降低光敏剂(PS)在排泄器官中的滞留,以利于其在肿瘤中的更高积累。使用叶绿素作为光敏剂,一种三组分缀合物(表1,第31项)被用作体内近红外荧光成像和光动力治疗(PDT)的诊断和治疗剂。叶绿素对于荧光成像非常吸引人,因为它在600到900纳米之间有很强的吸收,由于组织吸收低和自发荧光低,提供了更深的组织穿透性。使用吡吩卟啉A作为光敏剂,在相同的肽上,通过稳定螯合卟啉环与64Cu放射性核素,可以将缀合物转化为正电子发射断层扫描(PET)探针,从而提供一种稳定的探针,用于预测和定量测量光敏剂在肿瘤中的积累。

图 5 用于靶向正电子发射断层扫描(PET)成像和光动力疗法(PDT)的PpIX-肽叶酸缀合物的结构。
自90年代以来,随着肽库方法的开发,人们发现肽类化合物作为肿瘤靶向剂具有广泛的应用前景。在光动力疗法中,大多数研究都集中在开发针对肿瘤血管上过度表达的标志物的肿瘤靶向-光敏剂上。针对血管的靶向作用可以克服阻止光敏剂进入肿瘤的生理屏障,循环化合物可以轻易地与肿瘤血管表面的受体接触,并且肿瘤血管对癌症的类型不具有特异性。生长因子是癌症中血管生成的关键介质,这是肿瘤向转移形式转化的关键步骤,能够将其扩散到身体的其他部位。因此,生长因子的受体是特定光敏剂递送系统的理想靶点。Tirand等人将四苯基氯通过一个短间隔与七肽ATWLPRP连接起来,该七肽特异性地与血管内皮生长因子核心受体neuropilin-1结合(表1,第20项)。在体外,与游离光敏剂相比,该缀合物显著增强了细胞摄取和光动力活性,并且在体内,该缀合物表现出良好的药代动力学参数,并在肿瘤中迅速积累。然而,肽成分在网状内皮系统器官(主要是肝脏)中迅速降解,导致肽部分的选择性丧失。通过丙酸侧链与 PpIX 偶联的相同肽对癌细胞系表现出低暗毒性和光毒性。
近年来,另一个备受关注的受体是表皮生长因子受体(EGFR),它在各种上皮源性的人类肿瘤中过度表达。在已报道的用于将细胞毒性药物选择性地递送至肿瘤部位的针对 EGFR 的生物分子中,有两种小肽(表 1,条目 21 和 22)被用于光动力疗法(PDT)和荧光成像以递送 PS.特别是,一种在宏观环上带有一个或多个亲水修饰以提高其水溶性的卟啉,与 LARLLT 肽共轭。该缀合物能有效地靶向EGFR过度表达的细胞,并根据EGFR表达的程度被肿瘤细胞内化。所有这些 PS-肽缀合物在黑暗中基本上无毒,但在光照下,它们对癌细胞显示出低至高程度的光毒性,这取决于光剂量。在体内,24 小时后肿瘤中可检测到来自 PS 的荧光信号,并一直保持一致,直至 48 - 96 小时。总的来说,这些研究表明,只有在亲水性和疏水性之间仔细平衡的情况下,才能实现高肿瘤选择性。
整合素是一类横跨膜的受体家族,介导细胞与周围细胞外基质蛋白的附着。aVb3-和aVb5-Integrins在肿瘤内皮中高度表达,已被开发用于肿瘤成像和治疗的靶点。三肽序列RGD,存在于许多细胞外基质蛋白中,是整合素的非特异性结合物,已被广泛用于向肿瘤递送药物和探针。线性环状RGD肽已与不同类型的PS(表1,条目23和24)结合,以促进在肿瘤细胞中的选择性和PDT。
在aVb3-over-expressing细胞中,与 RGD 缀合物结合的 PS 的摄取量相对于游离的 PS 显著增加。相反,在具有线性或环状、构象受阻的 RGD 基团的缀合物之间,检测到 PS 的细胞内浓度差异不大。不幸的是,由于细胞摄取量的增加,PS-RGD 缀合物对过度表达aVb3-integrins的健康HUVEC细胞产生了光毒性。此外,Li等人合成了一种使用 RGD 序列和PpIX的诊断和治疗探针,用于肿瘤靶向的 PDT。此外,该诊疗探针包含一个连接福斯特共振能量转移(FRET)对的半胱天冬酶 3 响应肽连接子,用于治疗效果的比率成像(图 6)。作者表明,该偶联物能够选择性地在 aVb3 整合素过表达的肿瘤细胞中积累,在光照射下诱导细胞死亡。通过激活半胱天冬酶 3(细胞凋亡的生物标志物)诱导的荧光,可以实时监测光动力治疗的治疗效果,半胱天冬酶 3 的激活中断了 FRET 过程。
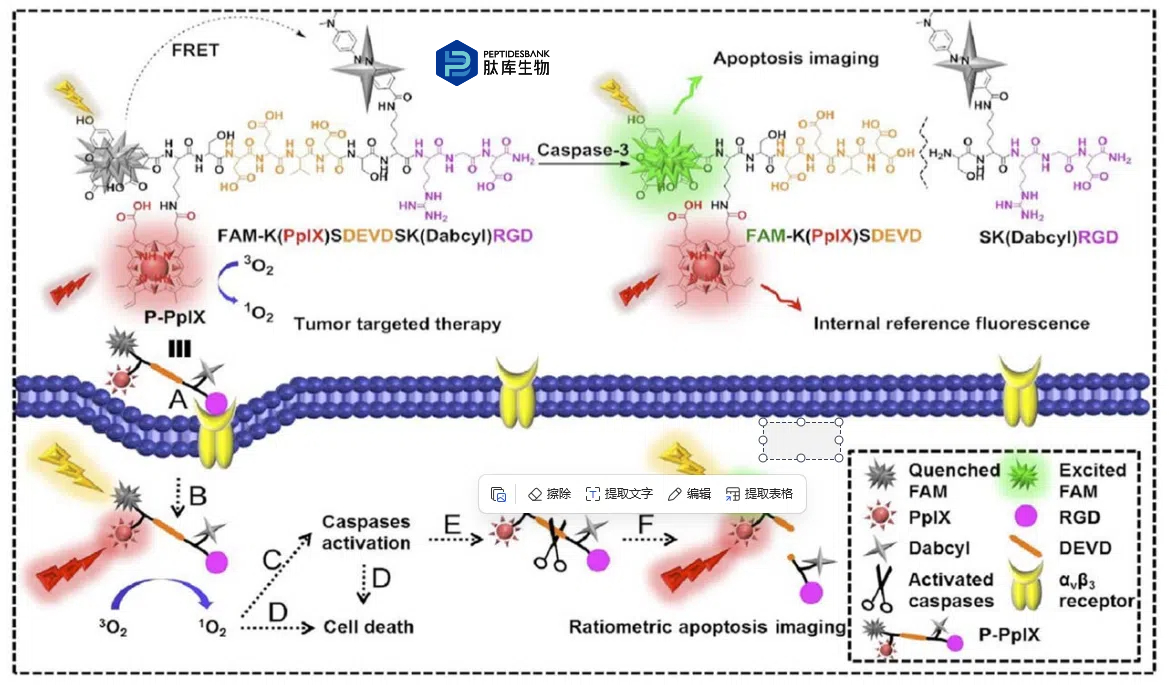
图 6 用于肿瘤靶向光动力治疗和比率细胞凋亡成像的诊断探针(P-PpIX)的化学结构和示意图。
一种十二肽(表1,第25项),对在多种癌症中上调的另一种整合素家族具有良好的亲和力,最近被用作铊(III)卟啉的靶向剂,以寻找一种适合作为PET放射性示踪剂和光动力治疗(PDT)中PS的癌症治疗诊断探针。结果证明,该缀合物对整合素过度表达的细胞具有选择性和光照射下的细胞毒性,表明使用同一缀合物作为PDT和PET剂是可行的。这与Mukai等人之前报道的策略相比有所改进,他们制备了一种肿瘤靶向肽(一种蛙皮素类似物,表1,第26项)与Cu放射性标记卟啉的缀合物作为PET剂,以评估PDT治疗前PS的药代动力学。卟啉与顺磁性同位素(如Cu)的螯合会减弱PS的治疗作用,需要使用未金属化的卟啉作为治疗剂。因此,对于治疗诊断剂,诊断和治疗剂必须分别给药。不幸的是,对用放射性标记的 PS 偶联物或单独用放射性标记卟啉治疗的荷瘤小鼠进行基于 PET 的成像,并未显示出放射性示踪剂生物分布的显著差异,其在肿瘤部位的积累也不足以实现体内靶向。
血脑屏障在很大程度上限制了亲水、高分子量分子在血液和脑间质液之间的移动,这在肿瘤治疗中构成了重大挑战。
最近,一种具有高亲和力于μ-阿片类受体和跨血脑屏障转运能力的类皮肤啡类似物(表1,第27项)通过亲水性间隔物与一种碳硼基卟啉连接,以实现一种用于硼中子俘获疗法(BNCT)的缀合物,这是一种治疗脑瘤和其他癌症的二元治疗方法,涉及用低能热中子或超热中子照射含10B的肿瘤。该缀合物对人类神经胶质瘤T98G细胞无毒,无论是在黑暗中还是在低光照射下,这是硼递送剂的一个重要特性,因为这种疗法需要大量的硼。此外,在体外细胞模型上,它表现出高渗透系数,这是作为脑瘤BNCT有前景的硼递送载体的必要条件。
周等人利用卟啉 - 镥配合物的多模态特性,通过卟啉部分产生的单线态氧来杀灭膀胱癌,同时通过镥的近红外发射实现荧光成像。三个膀胱癌症特异性肽序列(表 1,第 28 项)被证实能使这种双功能的肿瘤成像和光动力治疗(PDT)剂靶向癌细胞。通过体外成像证实了所有缀合物在膀胱癌细胞中的选择性摄取,并且在近红外区域的照明下实现了高光细胞毒性。
Polo-like kinase 1, 是一种关键的非细胞周期蛋白依赖性丝氨酸/苏氨酸蛋白激酶,参与许多核心细胞周期事件,并且在肿瘤中过度表达,已被提议作为癌症治疗的双重靶点。 这种激酶的短链肽抑制剂存在细胞摄取率低的问题,最近有人提出将其与卟啉大环缀合,以提高它们进入癌细胞的能力并监测细胞周期。两种卟啉-肽缀合物(表 1,第 29 项)被证明与该靶点具有高亲和力结合,其中一种在结合时表现出响应式发射增强,从而能够监测细胞分裂。在体外,这些缀合物能够抑制癌细胞的生长,对正常细胞具有良好的选择性(癌细胞中的 IC50 比正常细胞低 10 倍),并且在光照射下,在卟啉浓度比黑暗中使用的浓度低 10 倍的情况下,实现了约 40%的癌细胞死亡。
3.3 | 可激活的光敏剂
增强光动力疗法特异性的另一种策略是使用可激活的光敏剂,即能够被肿瘤环境特有的分子触发物激活的光敏剂。作为分子信标方法的延伸,光动力分子信标由光敏剂、猝灭剂和连接两个部分的疾病特异性连接子组成。在存在目标分子的情况下,猝灭剂会抑制光敏剂的光活性,直到疾病特异性连接子被裂解,从而释放出在光照射下可以被激活的光敏剂(图7)。许多酶在某些类型的癌症中过度表达,由于其良好的催化活性,它们是这类光敏剂的绝佳靶点。郑等人合成了一种光动力分子信标,通过一个短肽序列将一个荧光素类似物与猝灭剂(BHQ-3)连接起来(表1,第32项),该序列能被基质金属蛋白酶-7识别并裂解,基质金属蛋白酶-7是一种在胰腺、结肠、乳腺癌和非小细胞肺癌中过度表达的酶。在体外对癌细胞以及体内患有相同类型肿瘤的小鼠中,证明了该构建体的酶触发光动力细胞毒性。光动力分子信标的光照激活可以通过荧光成像进行监测,因为酶释放卟啉除了在光照下恢复其光动力活性外,还恢复了其荧光。同样的方法后来被用于对过度表达成纤维细胞激活蛋白(FAP)的上皮性癌症的成像和光动力治疗。FAP是一种丝氨酸蛋白酶,在超过90%的人类上皮性肿瘤中高表达,并在肿瘤生长和转移中发挥关键作用。PpIX和猝灭剂通过一种特定的纳米肽序列连接起来,该序列源自A2-antiplasmin(表1,第33项)。作者能够在体外和体内证明酶在裂解分子信标方面的特异性及其释放光敏剂的能力,为上皮性癌症的检测和治疗提供了一种潜在的有用工具。
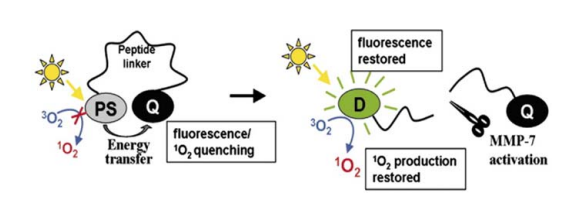
图 7 光动力分子信标概念的示意图。(A)在配体到达肿瘤部位之前,通过猝灭剂使光敏剂的光活性处于沉默状态;(B)在此,肿瘤相关蛋白酶识别并裂解特定的肽连接子,释放出光敏剂,从而产生光动力效应。
利用类似的结构,Ke等人开发了一种化学光动力前药,能够在肿瘤微环境中进行选择性激活。他们通过一个对肿瘤环境中表达的FAP蛋白酶敏感的四肽序列(TSGP)将PS(一种锌卟啉)和药物(阿霉素)连接在一起。前药的单线态氧产生部分被阿霉素的存在所抑制,而药物的细胞毒性则被PS的存在所抑制,这大概阻碍了阿霉素与DNA的结合。在FAP(溶液或HepG2细胞中)存在的情况下,该缀合物释放出自由的PS和药物,导致荧光发射和光细胞毒性的显著增强,表明对HepG2细胞具有协同抗癌效果。通过荧光成像证实了前药在体内的激活,该成像显示携带H22小鼠肝细胞瘤的小鼠体内前药的激活情况。
4 | 生物标志物检测与新兴疗法
卟啉独特的光谱特性使得通过使用多种光谱技术(如紫外 - 可见光谱、圆二色性、核磁共振(NMR)、荧光和拉曼光谱)能够检测到与其他分子相互作用时的小变化。毫不奇怪,卟啉 - 肽缀合物已被用于在传感器设计中利用这些特性。
监测细胞内分子氧水平(O2)为生物系统的活力、代谢状态和生理行为提供了重要信息,因为它是关键代谢物和功能参数之一。细胞内的O2水平调节代谢、基因表达、自由基的形成以及许多其他过程,而异常的O2供应与许多常见的病理状态和疾病有关。
在细胞中直接和间接评估 O2 的几种方法中,基于磷光铂(II)或钯(II)卟啉配合物的微创策略已被提出。 对于这种应用,将卟啉靶向递送至细胞、组织或特定的亚细胞区室是一个基本要求。为了改善金属化卟啉的细胞内递送和分布,帕普科夫斯基等人在大环的外围用不同长度和电荷的细胞穿透肽进行功能化(表 1,条目 10),并比较了它们在活哺乳动物细胞中的细胞分布和氧敏感性。这些研究表明,决定细胞穿透能力的关键因素不是共轭物的总体正电荷,而是其两亲性和分子上正负电荷的空间分布。由八到九个精氨酸残基组成的肽确保了共卟啉共轭物及其线性或四取代衍生物的最佳细胞穿透性,并且在所有测试的细胞系中产生了高负载信号。对于所有这些共轭物,细胞进入的主要机制是内吞作用,对于线性或分支衍生物,细胞分布有所不同。然而,即使将线粒体靶向序列插入肽载体中,也无法到达线粒体。在细胞内O2传感实验中,一些共轭物表现出良好的分析性能,是测量静息条件下和代谢刺激下细胞内氧水平的宝贵工具。
卟啉也是研究最多的DNA结合剂之一。阳离子卟啉衍生物与核酸的结合一直是广泛研究的主题,最近,为了将四吡咯大环用作DNA靶向剂,一些生物活性部分被引入到阳离子卟啉的周边。双嵌入化合物比相应的单体显示出更高的 DNA 结合亲和力和更慢的解离速率,并且已经开发出大量的双聚体形式的 DNA 嵌入剂作为潜在的抗癌药物。为了实现对 DNA 序列的选择性识别,拜伦和沃耶将两个阳离子卟啉连接在α-螺旋肽的不同位置上(表 1,第 34 项),以便在这个肽框架上正确定向两个 DNA 嵌入部分。所有的双卟啉肽缀合物都能够嵌入双链 DNA,对鸟嘌呤-胞嘧啶序列表现出巨大的偏好,而不是腺嘌呤-胸腺嘧啶序列。与预期相反,肽框架的长度和结构特性在与各种 DNA 的相互作用模式中并不起重要作用。另一种提高阳离子卟啉对 DNA 的细胞摄取和结合的方法是在大环的周边引入一到两份支化四肽。通过光谱技术检测到这些缀合物与 DNA 的双重相互作用模式(嵌入和外部结合),并且三阳离子缀合物更易于嵌入结合,特别是在核蛋白复合物上。在体外,二阳离子物种的卟啉 - 四肽缀合物摄取量更高,并且它们的细胞定位已被证实是在细胞质细胞器中,而不是在核区域。
近年来,用于早期疾病诊断的生物标志物研究不断增加,而设计用于靶向活组织中生物标志物的成像探针是一个巨大的挑战。I 型胶原蛋白是皮肤和其他重要器官细胞外基质的主要成分,其类型和数量的变化往往与这些器官的病理生理学有关。Collagelin-a,是一种特定的胶原蛋白结合肽(表1,第35项),通过共价键与TPP连接,作为早期肝纤维化的诊断成像的荧光分子探针。慢性肝病的特征是细胞外基质蛋白的积累,尤其是胶原蛋白,通过形成纤维瘢痕破坏肝脏结构。Chilakamarthi 等人表明,TPP-collagelin 在体外与胶原蛋白有特异性结合,与未结合的肽相比,结合略有减少。在体外和体内条件下,该探针能够区分纤维化和正常肝脏,为慢性肝病的管理提供了良好的机会。
尽管光动力疗法(PDT)主要应用于肿瘤的治疗,但最近有报道称其在降解与阿尔茨海默病相关的淀粉样β-单体和低聚物方面取得了有趣的结果。在光辐照下,TPP 衍生物与五肽 KLVFF(淀粉样β-肽聚集体中 40 和 42 个残基的关键元素)的缀合物降解低聚物比单独的卟啉更有效。在体外,这种缀合物以剂量依赖的方式极大地抑制了淀粉样β-肽对神经元样细胞(PC12)的毒性作用,且对细胞活力没有影响。最近有人提出了一种由锌卟啉-KLVFF 缀合物抑制淀粉样β-肽形成的机制,其包括产生淀粉样β-肽的非途径聚集形式,这些形式不会演变成低聚物或原纤维毒性形式。
5 | 结论
肽通过多种方式促进卟啉及相关四吡咯大环在生物系统中的应用。通过提高疏水卟啉在水性环境中的溶解性,利用特定氨基酸序列的细胞穿透特性促进其进入细胞,并利用肽在识别现象中的特异性,有选择性地将基于四吡咯的卟啉体递送至表达特定标志物的细胞。大多数卟啉-肽缀合物已被应用于光动力疗法(PDT),在体外和体内治疗肿瘤细胞方面取得了显著成果。需要进一步研究解决与卟啉-肽缀合物在内涵体囊泡中捕获相关的问题,以及对于体内研究,解决与阳离子肽缀合物在血液中的不稳定性相关的问题,但已经提出了有趣的解决方案,如可控释放序列(PCI)的使用。将卟啉-肽缀合物作为单一探针在联合疗法(如 PDT/PET、PDT/BNC)中的应用可能性是克服 PDT 某些局限性的重要目标。除了光动力疗法(PDT)外,卟啉 - 肽缀合物在“感知”生物系统中的生理或病理状况的能力是一个非常有前景的研究领域,有助于检测生物标志物以实现早期疾病诊断。
卟啉-肽缀合物方面的研究一直在不断增长,并且在纳米医学领域也在不断扩展。在纳米医学领域,由卟啉 - 肽缀合物的自组装特性所衍生的纳米结构可以通过增强渗透和滞留效应在肿瘤组织中积聚,从而克服传统光动力疗法的某些局限性。此外,这些纳米结构还出现了新的生物医学应用,例如光声成像中的造影剂以及癌细胞热消融中的光热剂。