Linker在构建重组融合蛋白时重要性
连接作用:Linker作为两个融合蛋白间起连接作用的氨基酸链,具有一定的柔性以允许两侧的蛋白完成各自独立的功能。这对于保持融合蛋白的生物活性至关重要。
防止不良结果:如果没有Linker,直接融合的功能区域可能会导致融合蛋白的错误折叠、产量低或生物活性受损等问题。
影响三元复合物的形成:在PROTAC技术中,Linker的长度显著影响POI-PROTAC-E3三元复合物的形成,最佳的Linker长度取决于三元复合物的相互作用模式、距离和空间结构。
影响理化性质和药代动力学:Linker的化学组成直接影响了PROTAC的理化性质,这些性质反过来影响了PROTAC的细胞通透性,从而显著影响了PROTAC的生物降解效率。
提高生物活性:Linker的插入适当改变了不同蛋白结构域间的距离,以减少他们之间的相互影响,恢复或改善折叠,最终提高生物活性。
影响融合蛋白PK:Linker的特性直接影响着偶联药物的治疗指数、疗效、安全性与药代动力学。
设计和优化:Linker的设计需要考虑多个因素以确保其功能性和稳定性,在工艺生产方面同样需要考虑多种要素。
提供额外功能:在蛋白质药物设计中,Linker还能提供许多额外功能,如增加产量、实现可控或靶向给药,以及获得理想的药代动力学结果。
综上所述,Linker在重组蛋白构建中扮演着至关重要的角色,它不仅连接不同的蛋白结构域,还影响着融合蛋白的生物活性、稳定性和药代动力学特性。合理设计Linker对于成功构建重组蛋白和实现其预期功能至关重要。
氨基酸的选择
在选择天然Linker的氨基酸时,应考虑其长度、溶解性、氨基酸组成和二级结构特征。通常,天然Linker中偏好的氨基酸是极性且可带电的残基,它们约占总氨基酸的50%。Pro、Thr和Gln被认为是理想的天然Linker氨基酸。Pro因其环状侧链而独具一格,这使其结构相当受限制。
在天然Linker中,氨基酸的选择非常关键,因为它们直接影响到Linker的功能和融合蛋白的稳定性。以下是一些在选择天然Linker中常用的氨基酸及其特性:
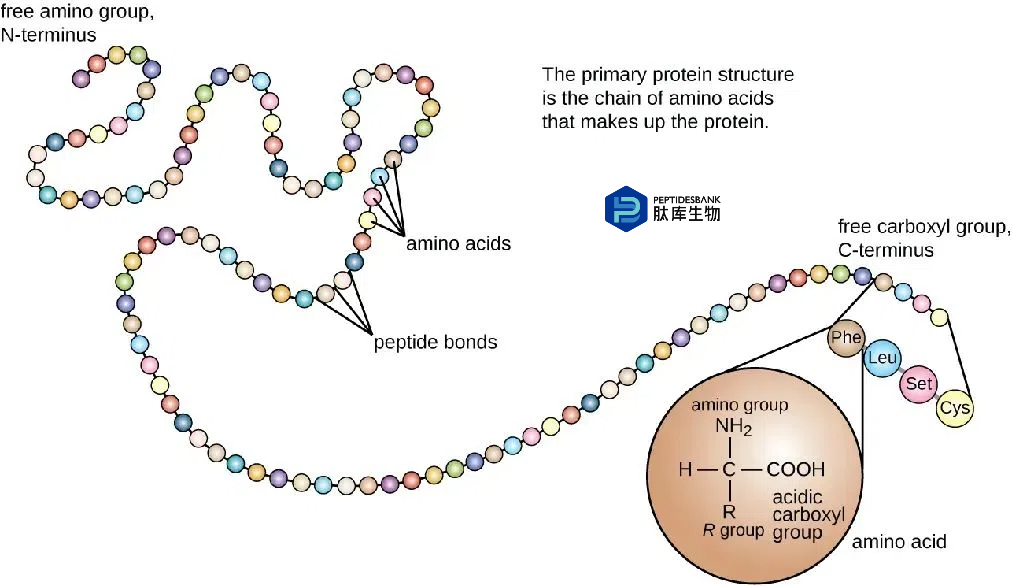
甘氨酸(Gly):甘氨酸是所有氨基酸中最小的,没有手性碳,因此柔性最好。它经常被用作Linker,因为它不会对两侧蛋白的构象和功能产生影响。例如,(GGGGS)序列就是一个常用的Linker,其中包含了多个甘氨酸残基以提供柔性。
丝氨酸(Ser):丝氨酸也是构建柔性Linker的常用氨基酸之一。它提供了柔软度,并且可以通过与水分子形成氢键来保持Linker在水溶液中的稳定性,减少与蛋白功能域之间的不利相互作用。常见的柔性Linker序列如(G4S)n,即甘氨酸和丝氨酸的组合,通过调整序列中甘氨酸和丝氨酸的比例,可以优化Linker的长度,实现蛋白功能域的适当分离或保持必要的域间相互作用。
谷氨酸(Glu)和赖氨酸(Lys):这些氨基酸可以提高水溶性,并且在一些特定的Linker序列中使用,如在单链可变片段(scFv)中连接重链可变区(VH)和轻链可变区(VL)的Linker,通常包含这些氨基酸以提供额外的功能。
脯氨酸(Pro):脯氨酸可以增加Linker的骨架硬度,并且有效分离结构域。富含脯氨酸的序列在机体中广泛存在,例如(Ala-Pro)7的结构。脯氨酸的加入可以使得Linker表现出相对坚硬的结构,有效地将两端的蛋白结构域分开。

在选择Linker中的氨基酸时,研究人员会考虑Linker的长度、氨基酸的化学性质(如疏水性、电荷效应)、以及它们对融合蛋白结构和功能的影响。理想的Linker应该在保持连接蛋白结构域的独立性和功能的同时,减少不利的相互作用。
Linker的构象
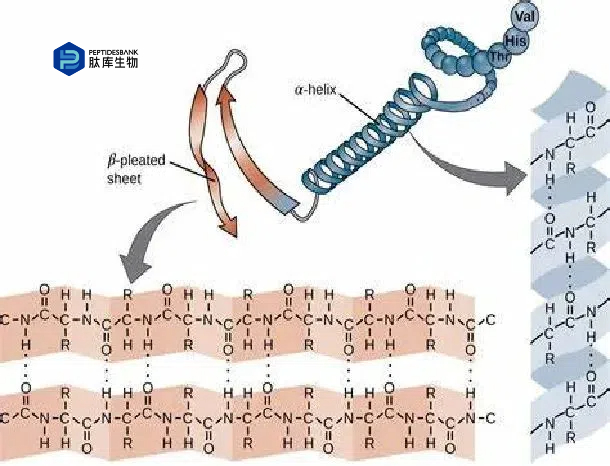
天然Linker在二级结构中通常采用多种构象,包括螺旋β 链、盘绕/弯曲以及转角等,来实现其功能。大多数Linker呈现为α-螺旋或线圈/弯曲的二级结构。
螺旋结构Linker:α-螺旋结构以其稳定性和刚性著称,内部氢键和紧凑的骨架赋予其这些特性。在折叠过程中,某些α-螺旋构象能够迅速形成,帮助连接的蛋白质结构域正确折叠并避免与Linker发生不必要的相互作用。此类Linker还可作为刚性隔板,有效分隔蛋白质结构域,从而减少它们之间的干扰。
非螺旋结构Linker:由于缺乏固有的刚性结构,非螺旋Linker通常富含Pro,这可能增强Linker的刚性。因此,富含Pro的非螺旋Linker可能表现出较为坚硬的特性,有助于减少结构域间的干扰。
扩展构象:天然Linker通常需要采用扩展构象的接头序列,以实现最大的灵活性。这种扩展构象有助于保持连接的蛋白结构域之间的独立性和功能。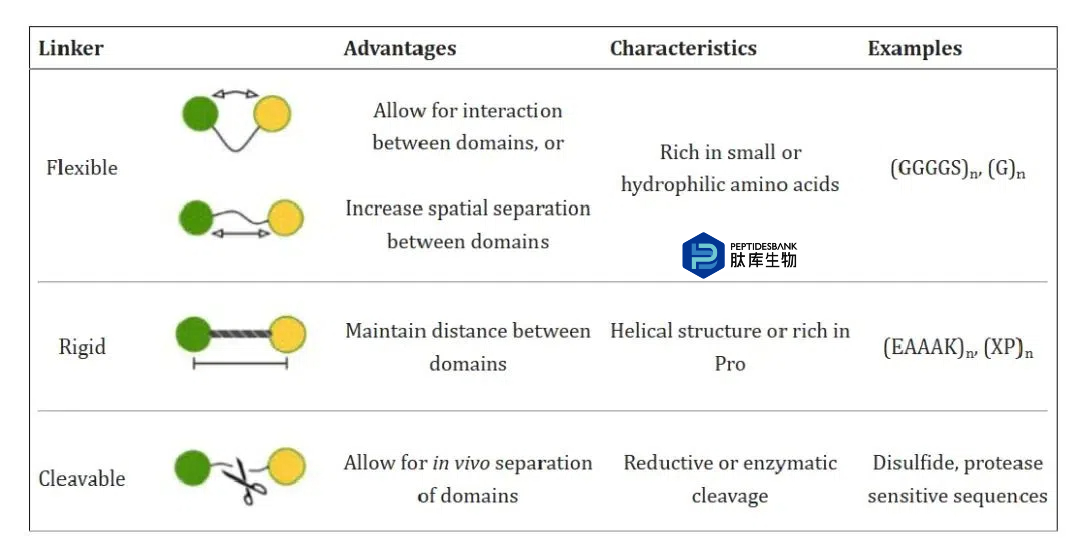
柔性Linker:柔性Linker一般由小的非极性(如Gly)或极性(如Ser或Thr)氨基酸组成。这些氨基酸的小尺寸提供了灵活性,并使连接的蛋白功能域具有一定的移动能力。加入Ser或Thr可以通过与水分子形成氢键来保持连接体在水溶液中的稳定性,从而减少连接体与蛋白功能域之间的不利相互作用。
刚性Linker:与柔性Linker相对的是刚性Linker,它们通常包含脯氨酸等氨基酸,这些氨基酸可以增加Linker的骨架硬度,并且有效分离结构域。
可裂解Linker:某些Linker设计为可裂解的,这意味着它们可以在特定的环境条件下(如在肿瘤细胞内部)被裂解,从而释放出连接的分子。这种类型的Linker在药物设计中尤为重要,例如在抗体偶联药物(ADC)中,Linker需要在肿瘤细胞处可以裂解将毒素释放。
螺旋形式的Linker:有些研究中提到螺旋形式的Linker肽,如[A(EAAAK)nA],这种形式的Linker可以提供一定的结构稳定性,同时允许两个融合蛋白结构域之间有一定的分离。
低疏水性、低电荷效应的氨基酸组成的Linker:这种Linker能够充分伸展以分开两种融合的组分,使之能在互不干扰的情况下充分折叠成各自的天然构象。
Linker长度的影响:Linker的长度对融合蛋白的功能和稳定性有重要影响。过长的Linker可能导致融合蛋白对蛋白酶敏感,而长度不足则可能导致两个融合分子相距太近,影响蛋白功能。
Linker的二级结构:在某些研究中,通过软件分析预测了Linker的二级结构,发现Linker部位具有很低的抗原性,亲水性无改变,Linker部位呈中性且柔性良好,不影响两端蛋白质二级结构和融合蛋白空间构象。
Linker通常采用延伸的构象形式,并保持独立的结构,从而避免与邻近的蛋白质结构域相互作用。其长度、组成、亲水性以及二级结构对于实现预期功能而言都至关重要。
Linker的选择
当连接的结构域需要一定的运动或交互时,柔性Linker是理想的选择。它们通常由小型非极性氨基酸(如Gly)或极性氨基酸(如Ser或Thr)构成。这些氨基酸由于尺寸较小,提供了良好的灵活性,允许连接的功能域间有一定的移动。Ser或Thr能够通过与水分子形成氢键来稳定Linker在水环境中的结构,进而减少Linker和蛋白质分子之间的负面相互作用。
广泛使用的柔性Linker序列通常以甘氨酸和丝氨酸为主(“GS”),例如(Gly-Gly-Gly-Gly-Ser)n。通过调整重复次数“n”,可以优化GS Linker的长度,以确保功能域之间的适当分离或必需的交互。柔性Linker可以包含其它氨基酸(如Thr和Ala)以保持其灵活性,或极性氨基酸(如Lys和Glu)以增强溶解性。

例子包括:
EGKSSGSGSESKST,其中Gly和Ser提供灵活性,Glu和Lys提高溶解性;
(Gly)8可增加表位的抗体可达性或改善蛋白质折叠;
GSAGSAAGSGEF避免了大疏水残基,以保持良好的水溶性;
柔性Linker的长度可根据需要调整,以实现适当的折叠或优化融合蛋白的生物活性。
合肥肽库生物科技专注定制合成多肽、PDC、ADC Linker、分子探针等科研技术服务