多肽偶联药物(Peptide-drug conjugates, PDC)是继抗体药物偶联物(antibody-drug conjugates, ADC)之后靶向治疗的新方式。与ADC相比,PDC的核心优势在于穿透组织能力强、化学合成更容易、生产成本更低。目前有两种PDC药物被FDA批准用于治疗癌症。PDC的治疗效果显著,但作为靶向治疗药物存在稳定性差、血液循环时间短、研发时间长、临床开发过程慢等问题。因此,了解癌细胞靶向PDC的最新研究进展、稳定性问题的解决方案、计算机技术辅助其研发的方案以及未来的发展方向很有必要。本文从PDC的结构和功能出发,从癌细胞靶向肽(cancer cell-targeting peptide, CTP)的选择、药代动力学特性、稳定性调控等方面系统综述了PDCs的最新研究进展,希望能突出当前存在的问题和未来的发展方向。
1. 概述
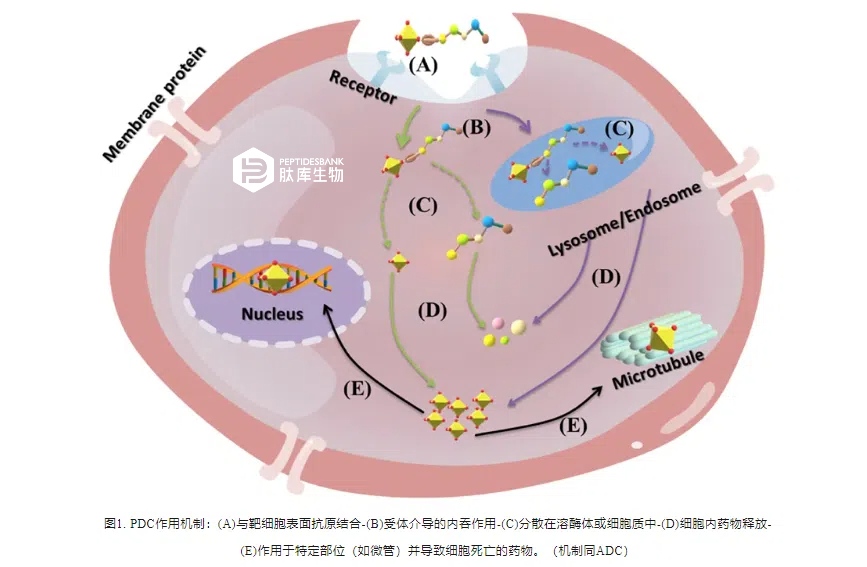
PDC 与ADC相比,Linkers和Drugs部分相似,不同的是Pedtide和mAb。CTP长度较短,可以特异性识别并结合其在癌细胞表面特异性表达的受体,也可以引导药物在表达受体的癌细胞表面蓄积,并且由于其体积较小,更容易通过癌组织。尽管两者概念相似,但结构和性质却有很大差异,表1为PDC 与ADC对比结果。
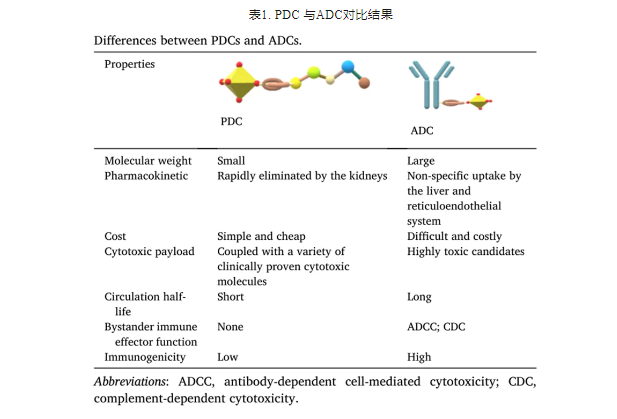
由于ADC和PDC分子量的差异,PDC具有较强的肿瘤穿透性,免疫原性较低。此外,PDC和ADC在体内的代谢方式不同。PDC通过肾脏代谢,而ADC通过肝脏。由于PDC的肽序列较短,其结构更加灵活,这使得引入非天然氨基酸,进一步形成环状肽,以及将肽与其他分子化学偶联更容易。上述因素增强了PDC的靶向性、稳定性和通用性。
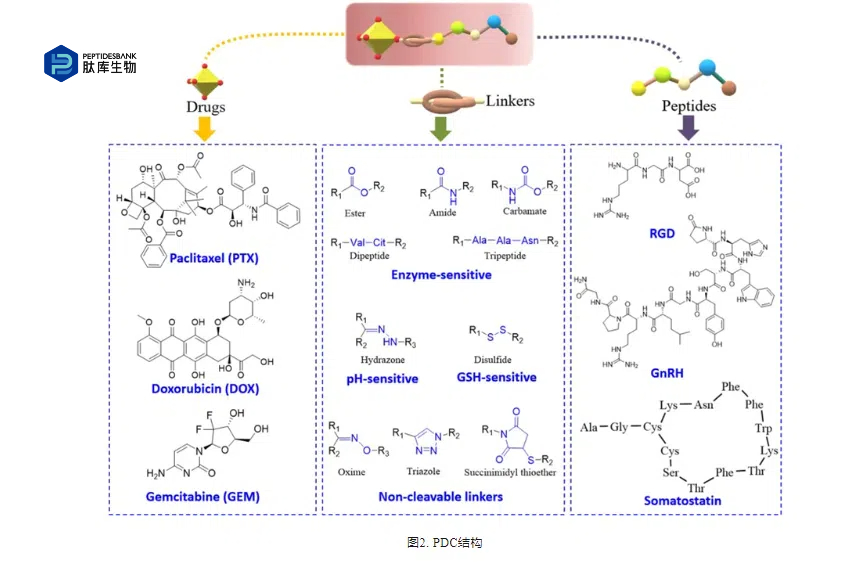
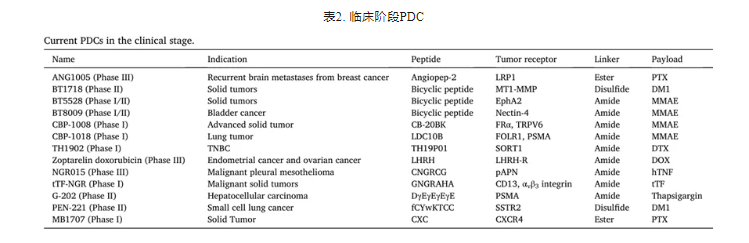
近年来,随着蛋白质组学、噬菌体展示技术、mRNA展示技术、固相肽合成等技术快速发展。越来越多的新的靶向肽被发现或合理设计,这极大地促进了PDC的发展。越来越多的PDC进入临床研究,表2所示。
Lutathera和Pepaxto是目前上市的PDC治疗性药物。Lutathera由诺华公司开发,于2018年获批,使用生长他汀类药物作为靶向肽,放射性核素177 Lu作为有效载荷。放射性同位素可以通过物理辐射杀死癌细胞。该PDC注射到患者体内后,通过特异性受体配体识别捕获肿瘤细胞,然后将放射性核素引入肿瘤组织,177 Lu释放的高能β射线最终杀死肿瘤细胞。Pepaxto由Oncopeptides开发,于2021年初获批,由一种DNA烷基化剂共价连接到靶向氨基肽酶的肽。由于其高亲脂性,Pepaxto进入细胞后被氨基肽酶水解,释放出亲水的DNA烷基化剂,可引起肿瘤细胞DNA损伤,甚至导致细胞死亡。这种PDC可与地塞米松联合用于治疗复发或难治性多发性骨髓瘤的成人患者。不幸的是,在2021年10月22日,Pepaxto因其III期临床失败而退出美国市场。虽然市场上的PDC比ADC少,但基于其结构和性能的差异,为PDC的未来发展提供了无限的可能性。本文综述了PDC的药代动力学和稳定性,并对其应用前景进行了展望,并描述了基于各种靶向肽的PDC的最新研究进展。此外,总结了计算机技术推动PDC开发的最新进展,如分子对接。并介绍了几种新开发的计算机工具在PDC开发中的应用。
2. PDC的最新研究进展
CTP对细胞上的特定受体具有良好的亲和力,该受体的过表达导致CTP大量归巢到癌细胞中, 因此,通过多种策略的组合,CTP可以成为递送药物有效载荷的有效工具,如表3所示。
2.1 靶向整合素的PDC
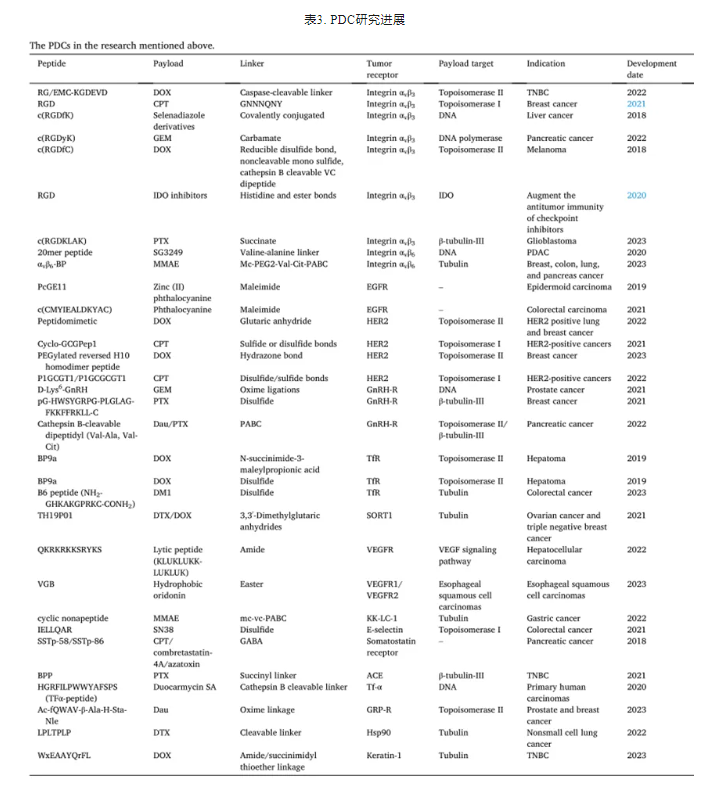
整合素是由α和β亚基组成的异二聚体受体,负责细胞间、细胞内和细胞外基质的粘附。迄今为止,已鉴定出18条α链和8条β链形成24种不同的整合素受体,αvβ3整合素受体的过表达已被证明与许多癌症有关。比如黑色素瘤、胶质母细胞瘤和乳腺癌。RGD肽及其衍生物与αvβ3整合素具有高度特异性结合。表明它们有潜力用于靶向癌症治疗。RGD肽广泛用于靶向给药。Wang等人使用自组装序列(GNNNQNY)将RGD与喜树碱(CPT)结合,形成了PDC分子,可以在原位自发形成纳米团簇。由于RGD的靶向功能,CTS的治疗效果得到增强,药物的最大耐受剂量也大大提高,如图3所示。
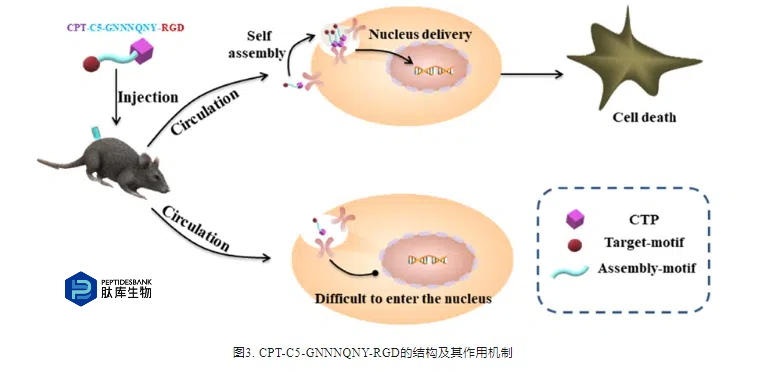
Zeng等利用荧光基团将c(RGDfK)与硒代二唑衍生物共价偶联,得到的RGD-SeD在过表达αvβ3整合素的HepG2细胞中表现出优异的选择性抗癌作用。荧光成像结果进一步证实该PDC可选择性递送至过表达该整合素的癌细胞(图4A)。Chatzisideri等人用氨基甲酸酯将GEM与环化RGD (c(RGDyK)偶联(图4B),在人血浆中表现出稳定性,并逐渐将GEM释放到血液中,在WM266.4和A549细胞中显示出优异效果。为了进一步研究连接体的刺激反应性,Liang等采用可还原二硫键(SS)、不可切割单硫键(S)和组织蛋白酶B可切割缬氨酸-瓜氨酸二肽(VC)作为连接环RGD(c(RGDfC))和DOX的连接物,分别生成c(RGDfC)-SS-DOX、c(RGDfC)-S-DOX和c(RGDfC)(RGDfC)-VC-DOX。体内细胞毒性试验结果显示,c(RGDfC)-s-DOX和c(RGDfC)-vc-DOX的药效是c(RGDfC)-ss-DOX和DOX的1.4-2.0倍,这可能与c(RGDfC)-ss-DOX产生DOX- sh有关。除了化疗药物外,PDC还经常用于免疫治疗药物的开发。Han等人联合吲哚胺2,3-双加氧酶(IDO)抑制剂与RGD通过组氨酸和酯键形成,形成的PDC可以自组装生成纳米药物。这些纳米药物有效抑制肿瘤中的IDO活性。在体内显示出持续抑制癌细胞生长,降低全身毒性,并大大增强程序性细胞死亡配体阻滞剂的治疗效果(图4C)。Rizvi等人开发了一种双靶向肽(c(RGDKLAK)),由RGD和靶向线粒体的促凋亡肽组成(KLA),通过琥珀酸偶联到PTX(图4D)。与游离PTX相比,新型PDC具有更好的溶解度和细胞毒性(EC50= 8.32± 0.09nM),体内实验进一步表明,该PDC的肿瘤生长抑制作用约为PTX的3倍。除了αvβ3整合素外,整合素αvβ6也在大多数胰腺导管腺癌中过表达,因此被认为是一个有希望的治疗靶点。基于此,Moore等人将基于吡咯苯二氮卓类药物的有效载荷SG3249偶联到一个特异性结合αvβ6的20聚肽上,形成共轭SG3299。结果表明,靶向αvβ6的PDC SG3299对αvβ6的毒性更大,在体外表达αvβ 6的PDAC细胞株(为αvβ6阴性PDAC细胞株的78倍),在相同剂量下,其毒性明显高于非靶向PDAC细胞株(高达15倍)。这种新颖的PDC为胰腺癌提供了一种新的特异性治疗选择。Davis等通过组织蛋白酶可切割连接体将整合素αvβ6结合肽和64 Cu复合物杂合子与细胞毒性药物MMAE结合(图4E),获得的[64 Cu]-PDC具有较高的人血清稳定性、整合素αvβ6选择性内化、细胞毒性以及良好的PET显像和体内药动学特性。
2.2 靶向EGFR的PDC
表皮生长因子受体(Epidermal growth factor receptor,EGFR)是一种在多种癌细胞中过表达的跨膜受体,是肿瘤治疗的重要靶点。Yu等使用线性EGFR结合肽(YHWYGYTPEVI)作为肿瘤靶向基团,并与酞菁偶联。与EGFR低表达的人乳腺癌MCF7细胞相比,这种肽-酞菁偶联物在过表达EGFR的表皮样癌A431细胞中表现出更高的细胞摄取和独特的光激活细胞毒性。此外,Chu等人将肽-酞菁偶联物中的线性肽替换为环状EGFR结合肽(CMYIEALDKYAC),由于线性肽稳定性较差,可能影响PDC的药代动力学和生物利用度。与两种EGFR阴性癌细胞(HeLa和HEK293)相比,这种新获得的肽-酞菁偶联物被两种EGFR阳性癌细胞株(HT29和HCT116)优先吸收,并表现出更高的光细胞毒性(图4F)。
2.3 靶向HER2的PDC
除了EGFR,EGFR蛋白家族的另一个成员,HER2在各种类型的癌症中也过表达,如乳腺癌和肺癌。在Sonju的研究中,HER2靶向肽与DOX结合,得到的PDC被包装在pH依赖的脂质体药物递送系统中,与正常生理条件相比,在肿瘤微环境中pH依赖的PDC递送有效,这大大增强了PDC的细胞摄取。此外,与游离DOX相比,他们观察到靶向药物递送增加了抗肿瘤活性,同时降低了毒性。Zhou等人基于曲妥珠单抗-HER2结合模型设计了cyclog-gcgpep1,然后与CPT偶联。构建的PDC在SK-BR-3和NCI-N87细胞中具有较强的抗增殖活性(图5A)。Liu等提出了一种基于HER2靶向肽的新型PDC,利用酸敏感的腙键作为连接剂,可以准确地将DOX输送到HER2阳性SKBR-3细胞,从而增强抗肿瘤疗效,同时降低全身毒性。与游离DOX相比,该PDC的细胞摄取高2.9倍,IC50仅为游离DOX的三分之一。此外,体外实验表明,PDC可显著抑制小鼠HER2阳性乳腺癌异种移植物的生长。为了增强HER2靶向肽与受体之间的亲和力,Zhou等采用计算机模拟的方法设计了双特异性融合肽P1GCGT1和P1GCGCGT1,与单一靶向肽相比,这些新肽与HER2的结合能力显著增强,并且对HER2阳性细胞具有特异性靶向作用,经CPT偶联获得的PDC具有更强的抗肿瘤活性和更好的安全性。
2.4 靶向GnRH-R的PDC
GnRH是一种由下丘脑合成的十肽,其受体在多种实体肿瘤中过表达。Vrettos等人成功将D-Lys6-GnRH与GEM结合,构建了酸响应型GnRH-R靶向PDC(GOXG1)。GOXG1不仅稳定性高,而且被癌细胞高度摄取。药代动力学实验结果显示,GOXG1能显著提高GEM血药浓度。为了进一步提高药物摄取效率,Deng等人将靶向GnRH受体的肽和细胞穿透肽(CPP)与PTX偶联,获得的细胞穿透PDC将PTX智能递送到过表达GnRH受体的MCF-7细胞中。PDC的细胞摄取率是游离PTX的两倍。此外,细胞毒性增强,IC50为3.8 nM (PTX IC50为6.6 nM)。药物在肿瘤细胞内的选择性和控释将直接影响药物的疗效。
2.5 靶向TfR的PDC
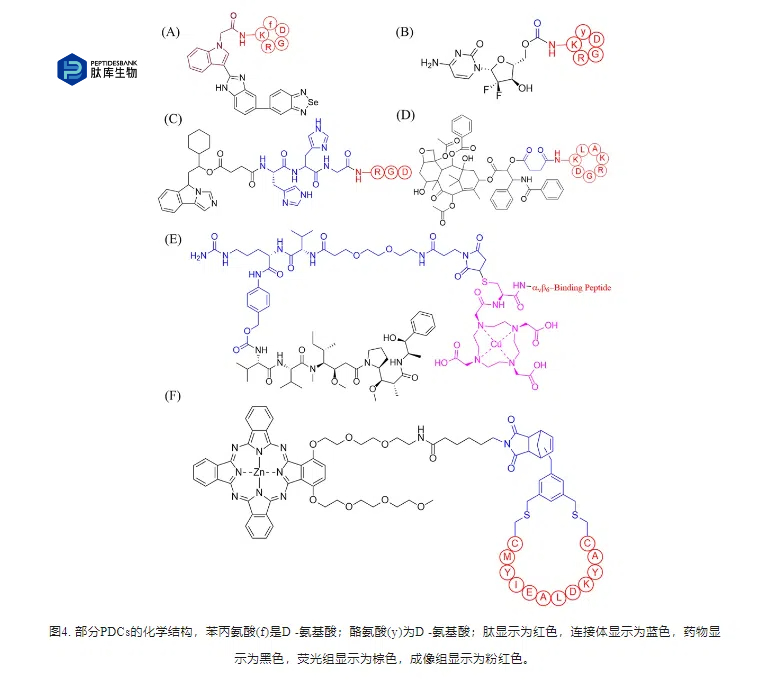
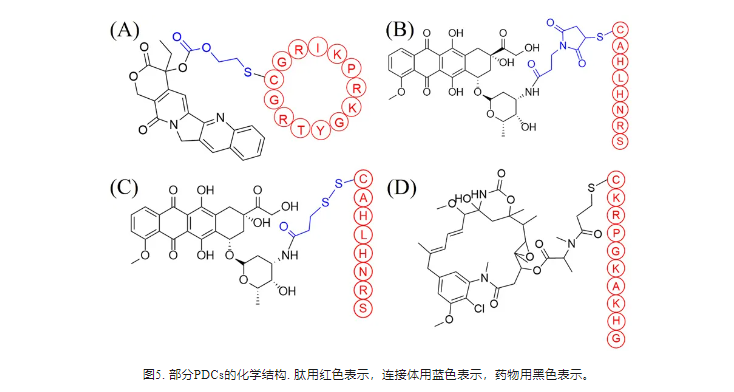
转铁蛋白受体(TfR)是一种II型跨膜糖蛋白,通过相互作用在细胞铁摄取中起关键作用。TfR在肿瘤细胞中过表达,但在正常组织中正常表达,是肿瘤治疗的有效靶点。Li等人利用N-琥珀酰亚胺-3-马来酰亚胺丙酸作为连接剂,将TfR靶向肽BP9a偶联至DOX。与游离DOX不同,合成缀合物通过过表达的TfR被HepG2细胞选择性地吸收。此外,该偶联物对HepG2细胞表现出特异性毒性(图5B)。DOX通过二硫键与BP9a结合,产生BP9a-SS-DOX(图5C),B6肽(NH2-GHKAKGPRKC-CONH2)可靶向CRC细胞表面的TfR。Zhang等人开发了一种名为LWJ-M30的肽-药物偶联物,它由DM1和肽B6组成(图5D)。LWJ-M30通过破坏微管蛋白诱导细胞凋亡,在不影响小鼠体重的情况下抑制HCT116细胞的生长。
2.6 靶向SORT1的PDC
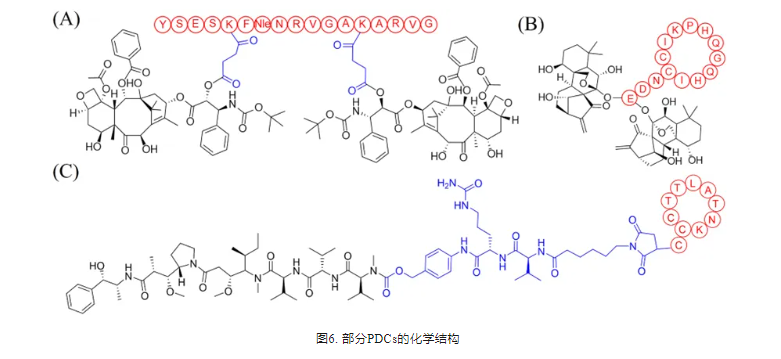
SORT1是一种在多种恶性肿瘤中表达的多功能蛋白。基于SORT1受体,Charfi和Currie等开发了肽-DTX偶联药物TH1902和肽-DOX偶联药物TH1904。在体外,TH1902(图6A)显示对MDA-MB-231细胞有较强的抗增殖和抗迁移作用。在体内,与DTX相比,TH1902在MDA-MB-231和HCC-70小鼠异种移植模型中可导致肿瘤消退,且未引起中性粒细胞减少。这些数据表明TH1902通过SORT1受体介导的机制对TNBC具有较高的体内有效性和安全性。
2.7 靶向VEGFR的PDC
越来越多的证据表明,抗血管生成是一种新兴的、有前途的治疗癌症的策略。血管内皮生长因子(Vascular endothelial growth factor,VEGF)及其受体(VEGFR)是肿瘤血管生成的关键分子驱动因子,尤其是VEGFR1和VEGFR2参与肿瘤细胞和血管系统的调控。Wang等利用VEGFR靶向肽(QKRKRKKSRYKS)与裂解肽(KLUKLUKKLUKLUK)偶联生成PDC,发现PDC对肝癌细胞有潜在毒性。Qi等人将VEGFR1/VEGFR2双特异性肽VGB (CIKPHQGQHICNDE)与疏水分子东凌草素通过酯键结合,得到PDC(图6B),在术后肿瘤复发模型中的抗肿瘤疗效显著增强。
2.8 其他靶点的PDC
北九州肺癌抗原1
(KK-LC-1),只在几种类型的癌症中表达,包括胃癌,这意味着它可能是一个有希望的药物输送靶点。Chen等人首次将KK-LC-1确定为PDC设计的潜在靶点,并最终确定了KK-LC-1靶向PDC (1131-MMAE)(图6C)。1131-MMAE可被KK-LC-1阳性胃癌细胞有效内吞,并通过阻滞G2/M期细胞周期释放药物诱导细胞凋亡。
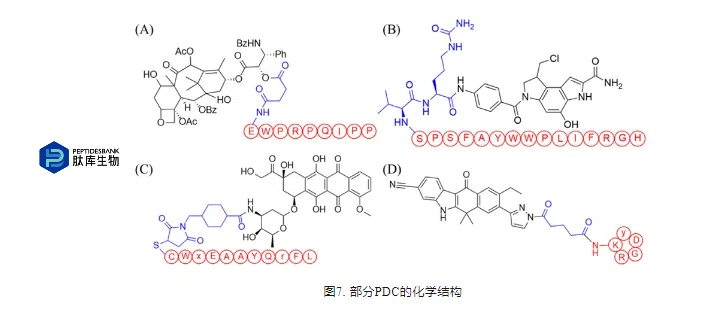
TNBC是一种预后较差的异质性乳腺癌亚型。血管紧张素转换酶(ACE)在TNBC细胞中异位表达,而在受体阳性的乳腺癌细胞或健康肾细胞中不表达。在此基础上,Guo等设计并合成了BPP-PTX共轭物(图7A),通过将缓激肽增强肽(BPP)与琥珀酰连接剂和PTX结合。与游离PTX相比,BPP-PTX对携带MDA-MB-468肿瘤的异种移植雌雄性裸鼠具有更好的肿瘤抑制作用。此外,BPP-PTX在减肥和白细胞减少方面毒性作用较小。综上所述,BPP-PTX是治疗ACE阳性TNBC的一种新颖有效的低毒性治疗方法。Cartwright等人通过固相合成,通过组织蛋白酶B可切割连接物将Thomsen-Friedenreich靶向肽与duocarmycin SA偶联,得到的PDC(图7B)选择性抑制表达Tf- α的肿瘤细胞。胃泌素释放肽受体(GRP-R)在乳腺癌、前列腺癌、胰腺癌和小细胞肺癌等肿瘤组织中均有过表达,是肿瘤成像、诊断和治疗的重要靶点。在此基础上,Gomena等人开发了一种靶向GRP-R的PDC,显示出明显的肿瘤细胞抗增殖活性。WxEAAYQrFL是一个10聚线性角蛋白-1靶向肽叫做18-4。Ziaei和同事设计了一种18-4-Dox偶联物(图7C),对TNBC MDA-MB-231细胞具有高特异性毒性。与用DOX,结合物处理小鼠在肿瘤中积累的DOX明显增加(7倍),治疗效果更好。
3. PDCs的药代动力学特征
一般来说,PDC的大小和分子量介于小分子药物和ADC之间,这使得PDC的渗透性优于ADC,但也低于小分子药物;对PDC的吸收不如小分子药物。此外,肽进入体内后,可以通过各种方式从体内排出。由于口腔和胃肠道中含有许多蛋白酶,如淀粉酶、胰蛋白酶、羧肽酶和糜凝胰蛋白酶,因此PDC通常通过注射而不是口服给药。此外,天然多肽在给药后很快被血液中的蛋白酶识别和清除。例如,第一个经批准上市的PDC melflufen,无论通过中心静脉导管还是外周静脉导管给药,在血浆中都有相似的短暴露。因此,许多研究者在提高多肽的稳定性做出了很大的贡献。在肾脏中,由于它们的低分子量,PDC会很快被过滤掉,然后被消除,除了直接代谢外,细胞内吞作用和快速靶向药物处置也是肽消除的主要途径。PDC的分布受其分子量、疏水性和溶解度的影响。理想情况下,PDC应通过多肽与细胞表面受体的特异性结合,选择性地分布在肿瘤病变区域。PDC可以通过胞吞作用和内化等跨膜作用从细胞外空间转移到细胞内空间。除了肿瘤区域外,PDC还分布在身体的其他组织和器官中。例如,177Lu-DOTATATE在给药后4小时分布于肾脏、肝脏、脾脏、垂体和甲状腺肿瘤病灶。这种分布特征主要是由于PDC相对于携带单克隆抗体的ADC分子量更小,导致PDC与抗原的结合力比单克隆抗体弱,因此PDC的组织靶向性不如ADC, 此外,与ADC不同,177Lu-DOTATATE不被肝脏代谢。177Lu-DOTATATE的消除主要发生在肾脏,在给药5小时内累计排泄44%, 58%在24小时内,65%在48小时内。根据177Lu-DOTATATE的半衰期计算,在14天内,99%以上的Lu-DOTATATE会被消除。PDC的分布有时也受到多肽和小分子药物的构象的影响。Reveret等研究了穿梭细胞穿透肽(S-CPP)的分布,有两种不同结构,L-S-CPP 和 D-S-CPP。在生物体中,他们的研究显示,除了在肝脏和脾脏中显示可预测的积累外,给药1小时后,心脏和肝脏中的D型浓度高于L型对映体,此外,给药5小时后,血浆和肾脏中也发现了相对较高的D型水平。
4. 提高PDC的稳定性
与多肽一样,PDC作为靶向药物的主要缺点是其体内稳定性低、半衰期短,因为多肽在血液中被蛋白酶迅速降解,并被肾脏清除。特别是在实体肿瘤的治疗中,需要延长PDC的循环,使其能够充分穿透肿瘤组织。因此,如何提高PDC的稳定性和半衰期是研究的重点。
4.1 环化
通过环化来增强肽的特异性、安全性和效力是环肽的一个基本优势。FDA批准的肽中有三分之二是环状的,这些环状肽在现代制药工业中发挥着重要作用。环化带来的约束可以使肽链的构象更加稳定,从而提高其与靶蛋白的结合亲和力,减少非特异性结合。同时,环化显著减少了可用构象的数量和进入酶催化位点的可能性,从而增加了蛋白质组学抗性和半衰期。此外,环化可以通过与更大的相互作用表面结合来干扰蛋白质的相互作用,从而增加肽的功效。总的来说,与线性肽相比,环肽不仅可以改善肽链的结构性质,还可以优化其药代动力学性质,如吸收和膜通透性。例如,环状RGD(c(RGDyK))比线性RGD更具选择性和稳定性,被广泛用于增强与整合素的结合。JH-VII-139-1是一种低纳摩尔SRPK1抑制剂。Leonidis等人将JH-VII-139-1与c(RGDyK)偶联,得到的PDC(图7D)对SRPK1激酶保持中等纳摩尔抑制活性。
4.2 形成纳米药物输送系统
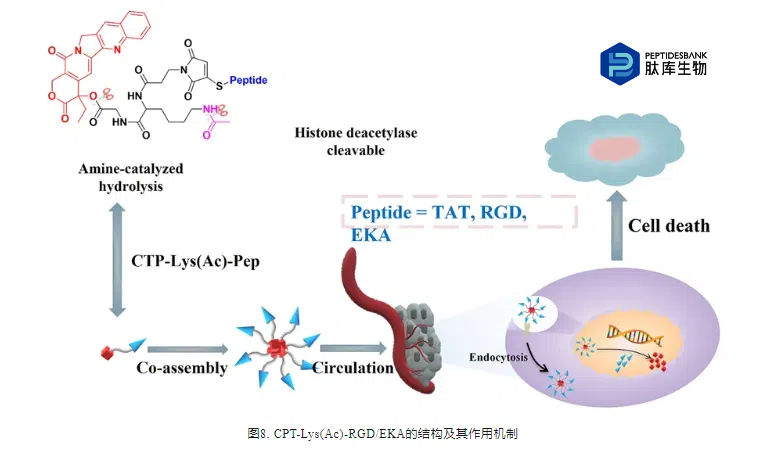
近年来,人们研究了纳米颗粒来提高聚苯乙烯的稳定性。由于纳米颗粒具有理想的物理化学性质、安全性、相对容易合成和较长的半衰期,因此可以提高PDC的整体稳定性。例如,郑等人合成裂解肽PTP7和PTX制备纳米粒子(PPP NPs)。结果表明,PPP NPs的循环半衰期和浓度-时间曲线分别比游离PTX长56.5倍和7.5倍。此外,在给药一段时间后,游离PTX主要积聚在肝脏,而PPP NPs主要分布在脾脏。亲水聚合物的引入使PDC具有两亲性,使其自聚集并形成纳米颗粒,大大提高了PDC在循环中的稳定性。Bai等人构建了CPT-Lys(Ac)-RGD和CPT-Lys(Ac)-EKA共轭物,它们可以自组装(图8)。 使用EKA作为细胞外靶向群,在缺乏组蛋白去乙酰化酶的情况下,它们非常稳定,其自组装可以延长在血液循环中的时间,并通过抑制肿瘤的进展和转移表现出良好的肿瘤蓄积和较强的抗肿瘤活性。
4.3 天然氨基酸的修饰
一般来说,天然L-氨基酸被存在于血液和体内的各种酶所识别。因此,除了环化和纳米颗粒外,另一种常用的提高多肽稳定性的方法是修饰天然氨基酸。修改肽酰胺键上的N原子对改善肽的药物形成和药代动力学性质起着重要作用。其中,N-甲基化因其通用性和可变形性而应用最为广泛。N-甲基化可以有效地形成有组织的氢键网络,从而提高肽的稳定性。在某些情况下,N-甲基化还可以提高靶肽对靶蛋白的亲和力。此外,对肽侧链进行卤化也可以提高稳定性,但这种方法容易增加肽的疏水性,导致其聚集而丧失活性,因此目前对其研究较少。研究人员还添加了一种特殊的肽序列来保护它不被降解。例如,Yang等人在肽RGDWR的N端引入ω -氨基丙烯酸,得到的ω RGDWR可以保护肽不被氨基肽酶识别,从而提高其稳定性。此外,血小板聚集试验表明,修饰肽与以前一样有效。同样,Liu等人对PMAP-36P抗菌肽的N端肉豆酸酯进行修饰,得到了Myr-36PW,与以往的研究相比,Myr-36PW具有更好的抗菌活性和更高的稳定性。除了上述氨基酸的基本修饰外,一些研究人员提出使用含有N-取代甘氨酸(N-Glys)的类肽来合成肽样化合物,由于其骨架不含酰胺键,因此具有更好的酶稳定性。
4.4 引入非天然氨基酸
天然多肽具有未经优化的结构,使其容易被酶降解或消化。许多研究表明,掺入非天然氨基酸可以提高多肽的生物活性和蛋白水解稳定性。此外,据报道,非天然氨基酸具有特殊的结构和物理化学性质(如分子构象柔韧性、结构多样性、螺旋性和两亲性)。因此,含有非天然氨基酸的肽的一级序列可以为肽提供良好的代谢稳定性和整体结构灵活性。许多研究人员都试图用D -氨基酸取代L -氨基酸以提高多肽的酶稳定性。
5. 计算机技术辅助PDC的研制
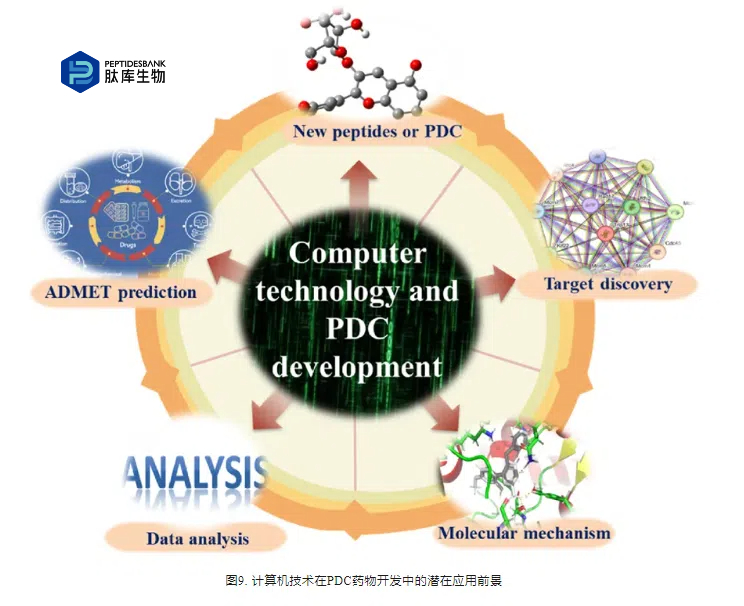
近年来,计算机技术发展迅速,成本不断降低,精度不断提高,应用范围不断扩大,在生物医学领域得到了广泛的应用。基于分子对接、分子动力学模拟和人工智能的计算机技术在PDC的研究和开发的各个方面发挥着越来越重要的作用,如作用机制的研究、新靶点的发现、肽段和药物结构的预测和优化、吸收、分布、代谢、排泄和毒性的预测等(ADMET),并对实验数据进行分析(图9)。
分子动力学模拟和分子对接可以揭示通过研究分子间的相互作用来研究药物分子与靶蛋白的作用机制,并进一步指导药物分子的设计。Park等人通过将组织蛋白酶B特异性肽(RR)与胆汁酸(BA)偶联设计了一种新型PDC (RR-BA)。他们使用分子动力学模拟来解释RR-ba与组织蛋白酶B的稳定性优于游离RR肽。Shokri等人使用肽(天冬氨酸-甘氨酸-精氨酸),选择性靶向肿瘤血管中过表达的氨基肽酶,与非甾体抗炎药(萘普生)结合使用。此外,通过分子对接证实了PDC与氨基肽酶的结合比游离萘普生更强。通过分子对接、分子动力学模拟和人工智能,可以在大量候选化合物中快速发现有希望的药物。此外,它还允许研究人员以不同的方式进行调整,以提高药物的性能。Zhou等人基于抗体与HER2的分子对接和结合方式,设计了一种新的环状肽GCGPep1。实验数据证实了该环肽对HER2具有良好的亲和力,并利用该靶向肽成功设计并制备了新的靶向PDC,计算机技术可以通过人工智能分析大规模的生物信息学数据,识别潜在的疾病相关基因或蛋白质作为潜在的PDC靶点。
利用分子对接和分子动力学模拟对分子结构进行预测和模拟,有助于发现蛋白质的结构特征,确定可能的结合位点和相互作用区域。在药物设计中,人工智能和其他计算机技术也可以在临床前预测它们的ADMET特性。
6. 结论与展望
在癌症的治疗中,传统的化疗由于副作用大,已经不能满足患者的需要,与传统化疗药物相比,PDC作为一种精准的肿瘤靶向治疗,扩大了治疗窗口,提高了治疗效果,改变了人们对癌症药物治疗的认识。但是,PDC也存在稳定性差、半衰期短等问题。虽然目前还没有完美的解决方案,但相信PDC将很快更好地应用于临床实践。
因此,PDC靶向给药系统领域仍有无限的可能性,需要在未来几年进行研究。未来的趋势和研究热点可能包括以下几个方面。
a. 基于人源化抗体的PDC的开发:自单克隆抗体出现以来,最常用的小鼠单克隆抗体在临床诊断和治疗中发挥了巨大的作用。然而,常用的小鼠单克隆抗体具有较强的免疫原性。因此,基于人源化抗体的多肽在开发安全有效的PDC治疗药物中具有重要意义。
b.PDC生物稳定性提高:与小摩尔药物相比,靶向PDC特异性强,但生物稳定性差。为了提高PDC在体内的稳定性,确保其疗效,目前正在研究对靶向肽和连接体的修饰。目前,各种具有特定功能的纳米药物传递系统已被成功开发,并在肿瘤治疗领域发挥了巨大的作用。因此,结合PDC纳米给药系统开发了一种新型的靶向抗体或靶向纳米肽的多功能药物。
c. PDC与计算机辅助药物设计的结合:除了主要依靠生物、化学等技术,在很大程度上可以与计算机辅助药物设计方法相结合开发。通过计算机分析,我们可以更多地了解肽及其配体之间的相互作用。为了了解目标肽是如何设计的以及随后的PDC是如何开发的,对连接方法、分子动力学模拟和人工智能使用特定的算法来预测、计算和评估这种结合受体与配体之间的亲和力。此外,我们可以为目标蛋白设计新的肽,或者通过计算方法预测目标蛋白或蛋白质中某个肽可能结合的位置。
d. PDC与多种受体或抗原结合:已上市的PDC或正在开发的PDC中使用的靶向肽主要与单一受体结合。如果所使用的多肽能够结合同一抗原的不同位点或同一癌细胞表面的不同过表达受体,则会改善受体聚集,加速偶联药物的快速内化。
e. 双重载药PDC的设计:经典的肽偶联药物包括肽、连接剂和有毒药物。因此,PDC单药引起的耐药问题是一个不可回避的问题。随着药物制备技术的迅速发展,双重药物负载使用两种具有不同作用机制的细胞制剂作为有效载荷的PDC有望克服使用单一药物时的潜在耐药性问题。
综上所述,随着PDC靶向给药系统研究的深入,靶向性强、生物相容性好、安全性高的PDC将得到更广泛的开发和应用,为人类的持续健康发展做出重要贡献。