在过去的几十年里,治疗性肽的利用率大幅增加。治疗性肽通常通过肠胃外途径施用,需要水性制剂。不幸的是,肽在水溶液中通常不稳定,影响稳定性和生物活性。尽管可以设计用于重构的稳定且干燥的制剂,但从药物经济和实用便利性的角度来看,优选水性液体形式的肽制剂。设计优化肽稳定性的制剂策略可以提高生物利用度并提高治疗效果。本文献综述概述了稳定水溶液中治疗性肽的各种降解途径和配制策略。首先,我们介绍了液体制剂中主要的肽稳定性问题和降解机制。然后,我们提出了多种已知的抑制或减缓肽降解的策略。总体而言,最实用的肽稳定方法是 pH 优化和选择适当类型的缓冲液。降低溶液中肽降解率的其他实用策略是应用共溶剂、排除空气、增强粘度、聚乙二醇化和使用多元醇赋形剂。
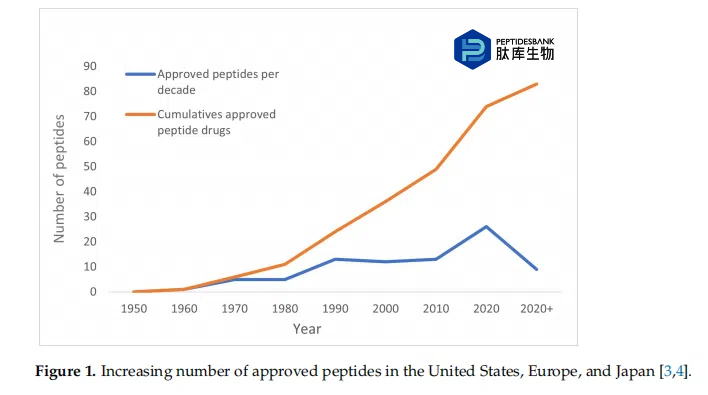
1、简介:生物技术的进步导致越来越多的治疗活性肽进入市场。自1953年du Vigneaud成功合成催产素以来,在接下来的几十年里,在发现肽作为活性药物成分方面取得了重大成就。目前,超过80种肽已在美国、欧洲和日本被批准作为治疗剂,如图1和表1所示。此外,还有超过160种肽正在进行临床试验,超过200种处于临床前阶段。预计这种趋势将在未来持续存在。表2显示了目前处于临床试验阶段的候选肽药物。
肽可以控制各种生理过程,充当生长因子、神经递质以及其他作用位点的内分泌或旁分泌信号。在内分泌学、肿瘤学、血液学和泌尿学等不同疾病领域,肽被用作治疗剂。几种抗生素、抗肿瘤剂、激素和神经递质都是肽。
肽与蛋白质不同。虽然两者都由氨基酸组成,但肽是由两个或多个通过肽键连接的氨基酸组成的较小分子,而蛋白质是长链氨基酸,可能具有更多数量的氨基酸。与具有明确的三级和四级结构的蛋白质不同,肽通常不具有明确的三维结构。尽管肽大多是线性的,并且其结构通常不像蛋白质那么复杂,但由于存在多个二硫桥、氢键和疏水相互作用,有些肽可以具有明确的三维结构。肽中氨基酸的疏水侧埋藏在其结构内部并倾向于形成聚集体。这是因为非极性或弱极性分子之间的疏水性、非共价相互作用导致这些侧链避免与水接触,而是相互作用。 pH、温度、离子强度的变化以及表面活性剂或其他赋形剂的存在也会增加这种聚集倾向。此外,它们在生物体中的功能是不同的。虽然蛋白质通常充当结构和调节分子,但肽调节广泛的生物效应,包括蛋白质 。根据氨基酸数量明确区分肽和蛋白质具有挑战性,并且存在多种定义。首先,美国食品和药物管理局将肽定义为含有少于40个氨基酸残基的短链。 Malavolta 提供了类似的定义,将含有 50 个或更多氨基酸残基的分子定义为蛋白质。它们之间有一类称为多肽的类别,具有40-49个残基。此外,福布斯将肽定义为2至50个氨基酸的短串,其中寡肽含有10至20个氨基酸,多肽含有20多个氨基酸。我们的综述将重点关注由少于 50 个氨基酸组成的治疗性肽。
治疗性肽在配方和给药方面面临许多挑战。肽通常对消化酶敏感,并且渗透肠膜的能力有限,导致口服后生物利用度差。此外,肽容易出现化学和物理不稳定,这可能导致它们在制备、制造和储存过程中降解。
肽的口服生物利用度较差,鼓励探索肽的替代非侵入性递送方法,例如口腔、阴道、眼部、经皮、直肠、鼻腔、经皮给药和肺给药路线。尽管肽的非侵入性递送途径不断被开发,但当需要快速起效时,它们未能产生令人满意的结果。因此,肠胃外途径仍然是施用治疗性肽的主要方法。静脉注射是将肽输送到体循环的最直接途径,可提供即时和完整的生物利用度。有些肽通过肌肉注射,直接注射到肌肉中,吸收到血液中,并分布到全身。肌内和静脉途径均无法自行给药,患者注射后会感到疼痛和不适。皮下途径可在 30 分钟内显示峰值水平。此途径可以采用,更适合自我给药。
由于其潜在的不稳定性,大多数肽药物需要在低温下储存和运输,也称为冷链。治疗性肽的可用性受到这种不稳定性的显着影响,特别是在没有冷链的热带和偏远地区。需要采取紧急策略来解决肽的不稳定性,特别是在注射用水溶液中,与冻干粉末相比,这种溶液更受青睐。尽管使用适当的稳定剂和赋形剂进行冻干似乎是保持肽完整性的理想方法,但不幸的是从经济角度来看,它既耗时又昂贵。此外,冻干产品对于发展中国家来说可能过于昂贵。重构也会带来污染的风险。冻干产品的体积和质量,包括用于冻干粉及其重构液体的小瓶,通常是用于液体制剂的体积和质量的两倍,从而导致包装材料更广泛、储存面积更大和运输成本更高成本。最后,重新配制干燥的产品对于患者来说可能是不方便且困难的。因此,如果液体制剂足够稳定,则优选液体制剂。
在开发肠胃外制剂时,肽在水溶液中的稳定性是一个关键方面,因为肽的效力常常因化学或物理降解途径而受到损害。全面了解特定肽的潜在不稳定机制对于在药物开发过程中优化其在最终制剂中的稳定性至关重要。本综述的目的是探索肽的不同降解途径,并提出几种合理的策略(不包括肽的化学修饰)来提高治疗性肽在水溶液中的稳定性。
2. 肽的不稳定性及降解的可能原因
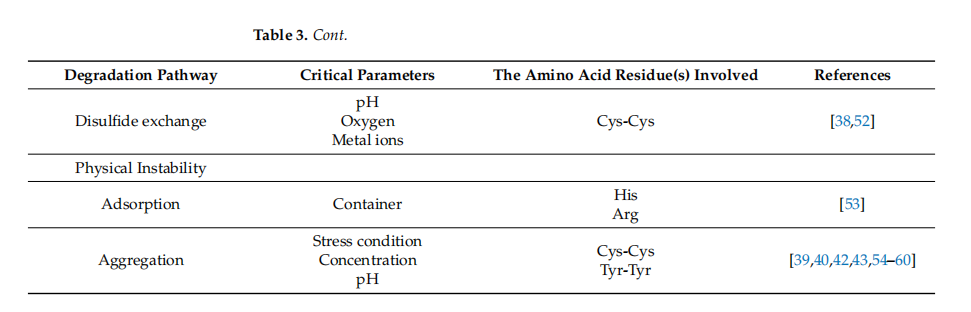
肽可能能够经历多种降解途径。肽降解可以通过化学和物理机制发生。化学不稳定性涉及通过创建或破坏共价键来改变肽的过程,从而导致新化学实体的形成。氧化、水解、β-消除、脱酰胺、外消旋、异构化和二硫键交换是化学不稳定途径的例子。物理不稳定性是指肽非共价相互作用的结构变化,包括二级结构、吸附、聚集和沉淀的变化。表3显示了水溶液中肽的各种降解途径和影响参数。

2.1.水解途径
2.1.1.肽主链的链断裂
水解是肽的主要降解途径之一。一般来说,水解是由Bronsted酸和碱催化的,并且很大程度上取决于 pH 值。戈那瑞林和曲普瑞林肽的这种 pH 依赖性已被广泛研究。这些肽在 pH 1-3 下通过 C 末端酰胺的脱酰胺作用进行酸催化水解。然而,在 pH 5-6 时,肽主链的丝氨酸 (Ser) 残基的 N 端侧可能会发生水解。 Ser 侧链上的羟基可能会促进这一过程,该羟基通过攻击相邻的酰胺键充当亲核试剂。该反应的结果是形成环状中间体,最终导致肽的断裂。当 pH > 7 时,戈那瑞林和曲普瑞林的主要降解途径是碱催化的差向异构化。差向异构化反应很可能通过碳负离子中间体涉及 Ser。戈那瑞林和曲普瑞林能够在相对稳定的六元中间体中形成氢桥,这解释了与其他氨基酸相比,Ser残基外消旋化率相对较高的原因。除了差向异构化外,还检测到戈那瑞林和曲普瑞林在碱催化条件下发生水解。据报道,重组胰高血糖素样肽-1 (r-GLP-1) 也会发生碱催化的外消旋化,因为纯化过程中的极端 pH 值会影响其杂质谱和大量 rGLP-1 的产量。重组人甲状旁腺激素 (rhPTH) 的主要降解途径是在酸性条件下通过天冬氨酸 (Asp) 残基的裂解发生。相反,当pH值高于5时,天冬酰胺(Asn)脱酰胺是主要的降解途径。当胆囊收缩素肽处于非等温条件下时,其主要降解途径往往是 C 端和 N 端裂解。
还观察到生长抑素及其类似物octastatin 在水性制剂中经历酸/碱催化的水解,水解速率受缓冲剂种类的影响。例如,octastatin 在磷酸盐缓冲液中的降解率比在谷氨酸缓冲液中的降解率更高,这可能是由于磷酸盐离子的催化作用。似乎增加磷酸盐浓度会导致octastatin 的降解速度更快。相反,增加缓冲溶液中谷氨酸的浓度可以增强溶液的稳定性,谷氨酸和octastatin 之间的疏水性和离子相互作用证明了这一点。这些发现强调了在配制肽时选择适当的缓冲液种类及其浓度的重要性。
2.1.2. Asn 和 Gln 残基的脱酰胺化
含有谷氨酰胺 (Gln) 和 Asn 残基的肽易于脱酰胺,在生理条件下分别形成 Glu 和 Asp。当pH低于3时,Asn残基脱酰胺主要通过Asn酰胺侧链直接水解生成Asp。同样,Gln 残基经过酸催化直接水解形成Glu。 Asn脱酰胺主要通过环状酰亚胺中间体发生,该中间体通过分子内反应形成,其中 Asn 旁边的氨基酸残基的氮攻击 Asn 残基侧链上的羰基碳。因此,通过该途径的脱酰胺速率取决于羧基侧氨基酸残基的性质。在相似的条件下,Gln残基的脱酰胺化比Asn的脱酰胺化进行得慢得多,因为Asn残基环化成五元环在动力学上比Gln脱酰胺化中六元环中间体的形成更有利。
肽链的灵活性强烈有利于高 Asn 脱酰胺率。肽中的氨基酸序列也会影响脱酰胺的速率。 Asn 之后的氨基酸残基,例如苏氨酸 (Thr)、Ser 和 Asp,可能会显着提高反应速率,因为它们非常容易脱水,形成环状酰亚胺中间体。
在碱性和中性 pH 值下,促肾上腺皮质激素 (ACTH) 通过其单个 Asn 残基的脱酰胺作用而降解。在酸性条件下,还观察到鲑鱼降钙素 (sCT) 发生 Asn 或 Gln 脱酰胺作用。催产素提供了另一种可以通过水解进行 Asn 和 Gln 侧链酰胺脱酰胺作用的肽。此外,据报道,催产素的 C 末端甘氨酸 (Gly)-NH 在 pH 2 时会发生脱酰胺作用。
2.1.3. Asp 残基的异构化
Asp 转化为 isoAsp 遵循 Asn 脱酰胺作用所报道的等效琥珀酰亚胺环中间体(见图2)。此外,L-琥珀酰亚胺外消旋为D-琥珀酰亚胺可以产生D-Asp和D-isoAsp对映体。在生理pH下,Asp和Asn脱酰胺反应异构化的限速步骤是琥珀酰亚胺中间体的形成。据报道,Asp-六肽通过环状酰亚胺中间体异构化为 isoAsp-六肽是 pH 依赖性的。
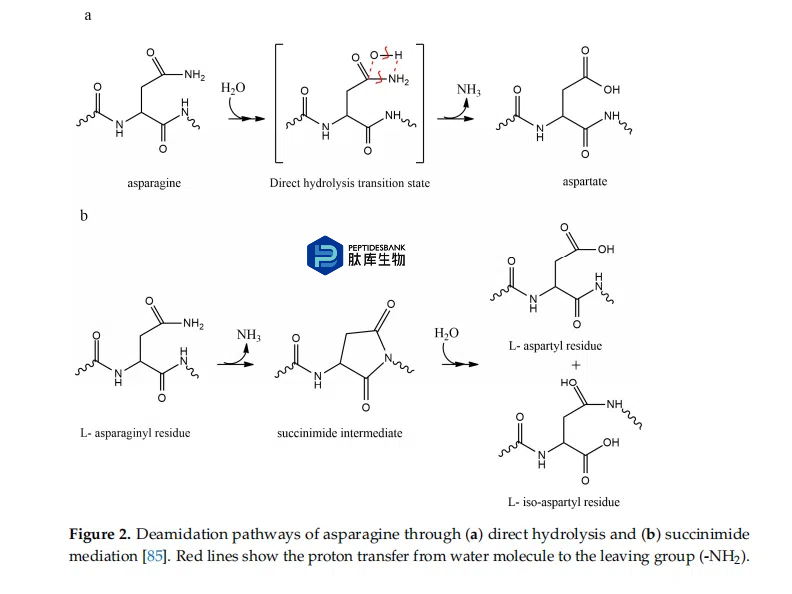
2.2.氧化途径
肽氧化是一种增加肽分子中电负性原子含量的反应,其中氧或卤素通常是电负性杂原子。含硫残基(如 Met 和 Cys)特别容易被氧化,因为硫原子具有高活性,当暴露于活性氧 (ROS) 时很容易失去电子,形成硫自由基。 His、Trp和Tyr等芳香族残基也容易被氧化,因为这些残基中的芳香环含有多个碳碳双键,很容易被各种ROS氧化(见图3)。
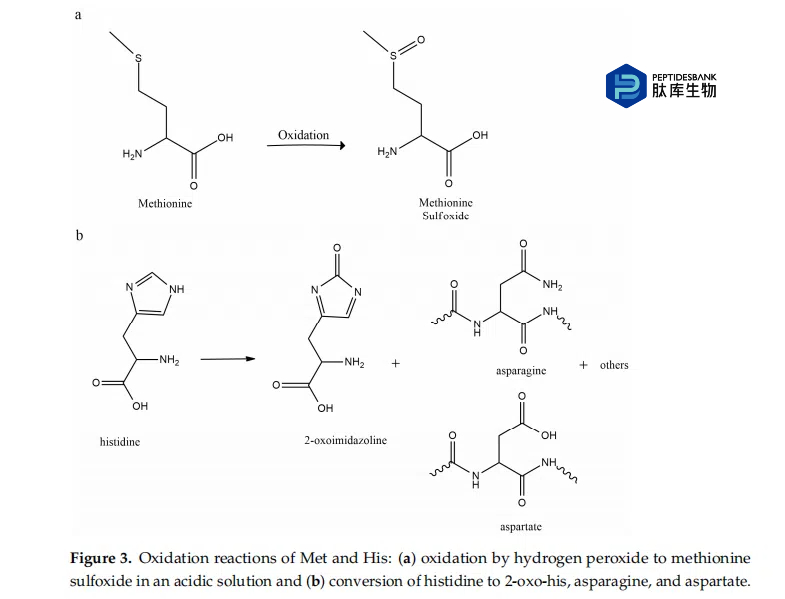
污染的氧化剂、微量的催化氧化还原活性金属和光照射可以诱发氧化。此外,肽氧化可能会受到 pH 值、温度和缓冲液成分的影响。 Cys的巯基和Tyr的苯氧基的去质子化加速了这些残基的氧化。 His 咪唑侧链的去质子化有利于金属结合,并可能有利于氧化。
2.2.1.自氧化
通常,药物的氧化降解被称为“自动氧化”。然而,术语“自动氧化”表示“不需要催化的物质在空气中的自发氧化”。因此,如果肽要自动氧化,则需要氨基酸与分子氧发生反应。一般来说,“闭壳”(即非自由基)有机物质与氧的反应相对缓慢,并且自氧化不太可能对肽氧化产生显着贡献,除了巯基的氧化之外。 Cys基团在可能链式氧化的条件下。二硫醇(即二硫苏糖醇)链式氧化反应的条件已通过辐射化学技术确定。
2.2.2.金属诱导氧化
金属离子催化肽氧化是指金属离子促进肽中特定氨基酸残基氧化的过程。该过程通常需要存在氧化还原活性过渡金属,例如Fe 2+和Cu 2+ ,它们可以进行氧化还原循环反应并产生ROS。在金属离子催化氧化中,金属离子充当催化剂,加速过氧化氢、超氧阴离子自由基和羟基自由基的转化。这些羟基自由基随后可以与肽中的氨基酸残基反应,导致降解。具体来说,金属离子催化的氧化会对组氨酸(His)、半胱氨酸(Cys)和蛋氨酸(Met)等氨基酸残基造成氧化损伤。金属离子催化的氧化通常意味着由金属结合位点络合的过渡金属催化的位点特异性反应。因此,金属离子催化的氧化通常不针对最容易溶剂接近的氨基酸,而是针对金属离子结合位点的一部分或位于金属离子结合位点附近的氨基酸。It was reported that the oxidation of hPTH (1–34) by ferrous ethylenediaminetetraacetic acid (EDTA)/H2O2, found that this system can cause oxidation of the methionine residue at position 8 (Met 8) and the histidine residue at position 9 (His 9) (1–34). 研究发现,hPTH (1-34) 中 Met 8 和 His 9 的氧化分别导致亚砜和咪唑-5-醛产物的形成。发现 Met 8 的氧化具有高度选择性,因为该残基的氧化速度比肽中其他蛋氨酸残基快得多。还发现 His 9 的氧化具有高度选择性,因为肽中的其他组氨酸残基在这些条件下不会被氧化。研究表明,hPTH (1–34) 中的 Met 8 和 His 9 被亚铁EDTA/H2O2氧化可能与该肽的生理和病理作用有关。例如,Met 8 的氧化可能会影响 hPTH (1-34) 的生物活性,因为该残基对于与 PTH 受体的结合非常重要。 His 9 的氧化也可能影响肽的构象,因为该残基位于肽的 N 末端附近,并在稳定肽结构方面发挥作用。
2.2.3.光诱导氧化
光诱导的氧化通常影响含有芳香族氨基酸残基(如色氨酸、酪氨酸和苯丙氨酸)或二硫键的肽。光诱导氧化的机制很复杂且尚未完全了解。虽然人们非常重视色氨酸、酪氨酸、苯丙氨酸和胱氨酸的初级光物理和光化学,但次级反应可以诱导多种产物的形成。色氨酸的光照射可以导致光电离以及单线态氧的形成。光电离与电子的释放有关,电子可以与合适的电子受体发生反应,例如氧(产生超氧化物)或二硫化物(产生硫醇盐和硫基自由基)。 Tyr 和 Phe 也有类似的机制报道,尽管光电离可能是双光子过程而不是单光子过程。双光子过程是由双光子吸收引发的,而单光子过程涉及单个光子。据报道,催产素在 pH 4.0-5.0 和 7.0-8.0 条件下对紫外线敏感。最近,一系列论文重点关注铁缓冲复合物的配体电荷转移(LMCT)途径促进的近紫外和可见光诱导的肽光氧化。这些过程在相对较低的光剂量下产生多种活性物质和肽氧化产物。
2.2.4.过氧化物氧化
过氧化物可导致氨基酸残基(包括 Met、Cys 和 His)氧化,以及在氧化应激过程中在氨基酸和多肽上形成氢过氧化物,这可能导致生物损伤。意外地,由于包含表面活性剂或其他赋形剂,过氧化物可能存在于制剂中。例如,一些表面活性剂,例如polysorbate 20 and polysorbate 80,可以产生过氧化物。因此,表面活性剂或共溶剂如聚乙二醇通常具有与过氧化物含量相关的特定规格。
2.3. β-消除
肽的二硫键可以进行 β-消除,导致 C-S 裂解,产生过硫醇/过硫醇和脱氢丙氨酸。当材料承受高温和高 pH 环境时,经常会观察到这种情况。含 Cys 和 Ser 的肽在碱性 pH 条件下会发生 β-消除反应。即使在中性 pH 值下,当含胱氨酸的肽在 100 °C 下加热时,它们最初会形成全硫醇,然后转化为游离硫醇。 sCT 通过位置 1 和位置 7 的 Cys 残基之间的二硫键进行 β 消除而降解。也有报道称,由于 β 消除反应,插入额外的硫会形成三硫键和四硫键。在暴露于碱性 pH 值的热应激后,催产素中也观察到了这一现象。
2.4.二硫键交换
肽中可能发生二硫键交换反应,导致二硫键扰乱并有助于形成二聚体和更大的聚集体。对 sCT 识别的二硫键交换反应产生的二聚产物降解的研究。然而,与二硫键连接的二聚体可以进行进一步的二硫键反应,最终再生 sCT 单体。在酸性水溶液中,二硫化物交换可以通过形成锍离子继续进行。当二硫键水解时,形成磺酸中间体,它可以进一步与其他半胱氨酸残基或与水反应生成锍离子。然后这些离子可以进行二硫键交换反应,导致半胱氨酸残基之间形成新的二硫键。关于二硫键交换反应和二硫键在维持肽稳定性方面的重要性已经进行了多项研究。多项研究强调了二硫键对肽稳定性的重要性以及二硫键交换反应对肽构象和功能的影响。通过开发稳定二硫键和防止二硫交换反应的策略,研究人员可以提高用作治疗剂的肽的稳定性和生物活性。
2.5.二聚、聚集和沉淀
除了分子间二硫键形成之外,肽还可以通过一系列氧化反应进行二聚/寡聚化。其中一些过程甚至可能导致更大的聚集体。此外,应激条件,例如冷冻、加热或搅动,可能会引起聚集。可以通过共价键形成聚集体;例如二酪氨酸、酯、二硫键或酰胺键;或通过疏水相互作用发生的静电相互作用或非共价键。然而,在样品制备过程中,相对较弱的非共价键可能再次被破坏,导致错误的结果。
肽上聚集体的形成并不限于单一途径。相反,多种机制可以同时发生,导致可溶性和不溶性聚集体的形成。当肽彼此相互作用形成更大的多分子物质时,就会发生聚集,这些物质可能会改变构象、溶解度和生物活性。在较高浓度下,由于分子间力增加,肽更容易相互作用,从而导致更快的聚集。随着聚集的进行,肽会变得更加不溶并最终从溶液中沉淀出来。除了沉淀之外,据报道较高浓度的肽会形成凝胶状聚集体。降钙素、地特瑞克、亮丙瑞林和β-淀粉样肽是在某些条件下能够形成凝胶状聚集体的肽的例子。凝胶状聚集体的形成是因为结构从 α 螺旋或 β 转角结构转变为 β 折叠结构。因此,它们具有可以保持其形状的强度、弹性和可塑性。
3. 优化水性制剂中肽稳定性的策略
由于易于降解、聚集和其他类型的物理和化学不稳定性,肽在水溶液中本质上不稳定。为了提高肽在水溶液中的稳定性,已经开发了各种策略,包括使用缓冲液、有机溶剂、特定金属离子和空气排除/除氧(参见表4)。为了优化稳定注射肽开发的制剂策略的利用,需要深入了解肽结构、理化性质和降解途径。
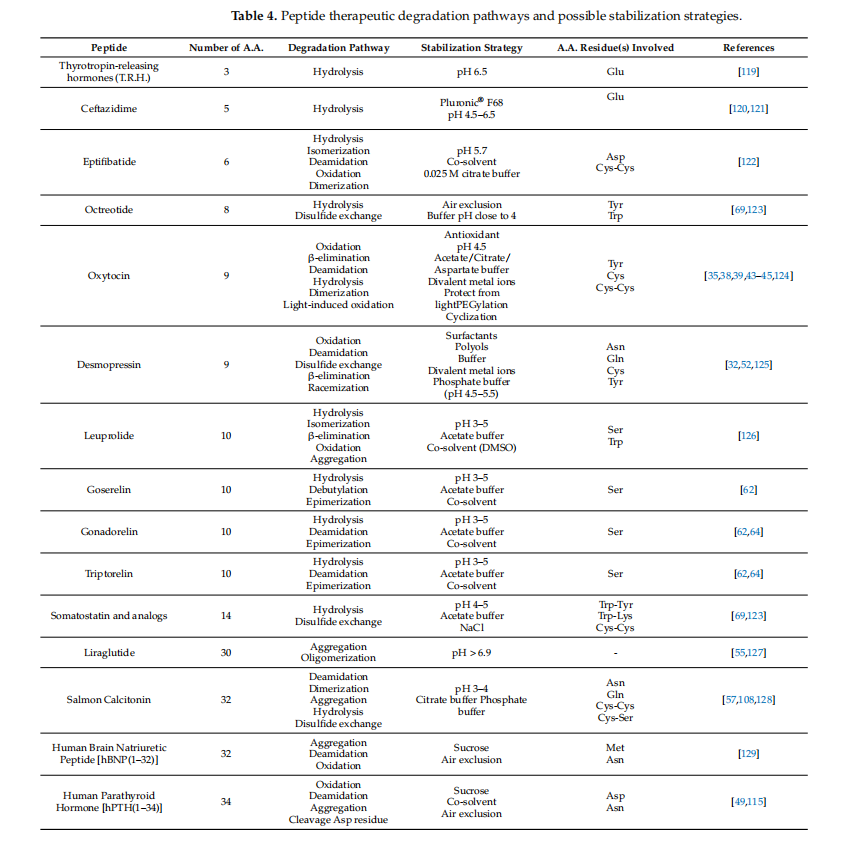
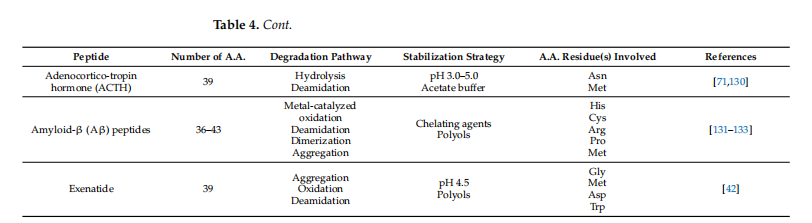
肽与蛋白质的不同之处在于,它们由于长度较短而缺乏三级和四级结构,因此,氨基酸残基的侧链主要暴露于溶剂和溶质。这会将色氨酸、酪氨酸和苯丙氨酸等疏水残基暴露于水环境中,导致降解。通过分析肽的氨基酸序列,科学家可以深入了解其通过各种途径(包括氧化和脱酰胺作用)降解的敏感性,并识别潜在的酶裂解位点。二级结构,例如 α 螺旋和 β 折叠,也有助于肽聚集和沉淀。为了提高肽的稳定性,可以设计适当的制剂策略,例如取代敏感氨基酸或使用稳定剂,基于对氨基酸序列和降解敏感性的理解。图 4总结了增强水性制剂中肽稳定性的各种策略。
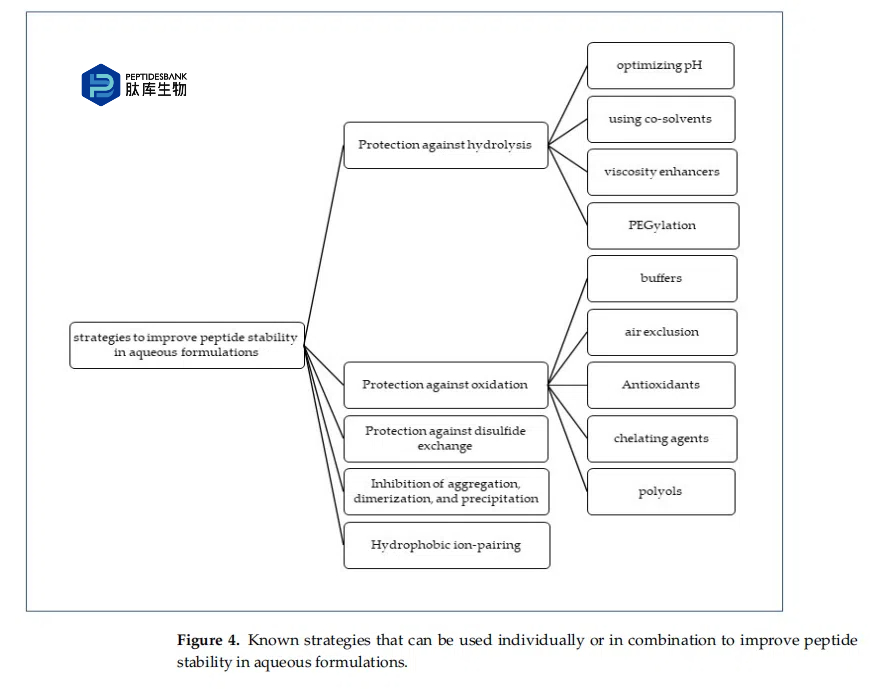
3.1.防止水解
3.1.1. pH值优化
保持水溶液中肽的稳定性通常需要控制 pH 值。使用缓冲液是防止降解的常见策略。为了确保注射期间患者的舒适度,静脉注射可接受的 pH 范围通常为3至10.5,而对于其他给药途径,该范围可能更窄。因此,在配方开发之初,必须评估肽在 pH 范围 3-10 内的 pH 依赖性降解,并用不同浓度的各种类型的缓冲液进行调整。为了最大限度地减少脱酰胺作用,制剂的 pH 值范围优选为 3 至 5。例如,催产素在 pH 4.5 时表现出最高的稳定性。
绝大多数有机化合物可以作为自由基清除剂,特别是羟基自由基。然而,大多数有机化合物可能无法阻止更具选择性的氧化剂,例如过氧自由基。很少有缓冲液可以直接与肽结合,从而提高其构象稳定性。例如,据报道柠檬酸缓冲液可以增加催产素的稳定性。尽管柠檬酸与催产素反应形成 N-cytril 催产素,但观察到在二价金属离子存在下形成的降解产物较少。据报道,天冬氨酸缓冲液的羧基能够中和Cys N端的正电荷,从而促进与Zn 2+ 的相互作用,从而防止二硫桥的二聚化。Octastatin(一种生长抑素类似物)被发现在 pH 4.0 的柠檬酸盐或磷酸盐缓冲液中比在谷氨酸或天冬氨酸缓冲液中降解程度更大。此外,据报道,奥曲肽在 pH 4.0 的醋酸盐缓冲液中具有更好的稳定性。
3.1.2.共溶剂的使用
使用共溶剂可以提高肽在水溶液中的稳定性。通过添加有机溶剂可以降低水溶液的介电常数,从而显着降低异构化和脱酰胺的速率。溶剂的介电常数越低,两个不同电荷的(+,-)分子越容易相互接触。水含量的降低也可能影响脱酰胺的速率。例如,可以通过添加甘油、丙二醇或乙醇来减缓水溶液中的肽脱酰胺作。由乙醇和丙二醇组成的 pH 5.75 水性柠檬酸盐缓冲液中的制剂可增加依替巴肽的稳定性。
3.1.3.粘度增强
在液体制剂中,化学反应速率随着溶液粘度的增加而降低。据报道,glycerol and polyvinylpyrrolidone (PVP) 的组合的各种组成可以对肽的脱酰胺化速率产生影响。这项研究证明,高浓度的 PVP 可以降低六肽的 Asn 脱酰胺化速率。然而,目前仍不确定脱酰胺率的下降是否是由于甘油降低溶液介电常数、粘度增加或两者的组合引起的。不含甘油的 PVP 也已成功用于抑制水溶液中 Asn-六肽脱酰胺的速率。 PVP可以通过氢键、静电相互作用和疏水相互作用与肽相互作用,并充当肽和水分子之间的物理屏障。稳定性的效果随着浓度和分子量的增加而增加,因此粘度也随之增加。聚合物表面活性剂,例如 Pluronic ®F68 可具有作为聚合物表面活性剂和粘度增强剂的双重作用。其表面充当界面保护剂,并已用于提高胃肠外制剂中头孢他啶的稳定性。此外,高浓度的poloxam407减慢了水溶液中模型肽Val-Tyr-Pro-Asn-Gly-Ala中 Asn 残基的脱酰胺速率。降解率的降低归因于改变肽的凝胶水溶液构象的形成以及poloxam407的盐析效应。
3.1.4.聚乙二醇化
水溶性聚合物(例如聚乙二醇(PEG))与肽的共价连接(聚乙二醇化)可以提供许多优点,包括延长保质期、提高水溶性以及在应激条件下的稳定性。 PEG 缀合靶向位点特异性氨基酸,包括赖氨酸 (Lys)、Cys、精氨酸 (Arg) 和 Tyr,可以增加肽的分子大小。据报道,聚乙二醇化可提高催产素在高温下的稳定性,延长人胰多肽(hPP)的生物活性并最大限度地减少抗菌肽LyeTx Ib的副作用。虽然很少见,但已发现患者会对 PEG 产生过敏反应。因此,聚乙二醇化配方虽然具有优势,但仍需要进一步发展。
3.2.防止氧化
氧化机制可能会因多种因素而异,例如 pH 值、氧气、金属离子和/或光的存在,这些因素可能会导致破坏性影响。然而,可以通过调节 pH 值、消除溶液中的氧气、修改初级和次级包装以防止光照以及在配方中使用抗氧化剂或金属螯合剂来减轻此类影响。沃特曼等人。已经制定了使用赋形剂增强活性物质氧化稳定性的综合指南,其中包括推荐浓度。
3.2.1.缓冲器
缓冲溶液可用于帮助防止肽氧化,特别是对于含有 Cys、Met、Trp、Tyr 和 His 侧链的肽。缓冲液的选择会对肽稳定性产生重大影响,在为特定肽选择缓冲液时应考虑几个因素。由于侧链中存在硫原子,Cys 和 Met 残基通常最容易被氧化。半胱氨酸可被氧化为半胱氨酸亚磺酸或半胱氨酸磺酸,而蛋氨酸可形成蛋氨酸亚砜或蛋氨酸砜。 Cys、Tyr 和 His 在中性和碱性 pH 值下由于其侧链的去质子化而更容易被氧化。相反,酸性环境(pH < 5)可能会降低 Cys、Tyr、和他的残基通过质子化它们的侧链并降低它们与活性氧的反应性。然而,与 Cys 和 His 残基相比,Met 和 Trp 残基的氧化受 pH 值的影响较小。 Met 的氧化可以在非常低的、与临床无关的 pH 值(低于 2)下得到促进。
3.2.2.空气排除
在加工过程中需要进行特殊处理,以尽量减少肽药物与氧气和其他可能造成损害的氧化剂的接触。在添加和混合肽之前,应通过用惰性气体(例如氩气、氦气或氮气)吹扫容器来完成制造步骤。填充步骤必须使用预填充惰性气体的气密容器来执行。此外,轻柔地处理肽并避免搅拌或剪切应力至关重要,因为这些可能会导致结构损伤并增加其氧化敏感性。在加工过程中还需要考虑温度对氧溶解度的影响,因为低温下水溶液中的溶解氧浓度较高。
3.2.3.抗氧化剂
抗氧化剂通过清除活性氧来保护肽在加工和储存过程中免受氧化。适当抗氧化剂的选择将取决于几个因素,例如肽中存在的特定氨基酸残基、制剂和肽的预期用途。确保所选抗氧化剂与肽相容并且不会干扰其活性或稳定性至关重要。例如,亚硫酸氢钠对于特定肽可能会产生问题,因为它是亲核试剂,这意味着它可以与二硫键发生反应,可能导致肽聚集体的形成和活性丧失。此外,亚硫酸氢盐可以被氧化形成自由基亚硫酸盐阴离子,它与氧反应生成过氧自由基——一种可以破坏肽的强氧化剂。亚硫酸氢盐还可以与含有硫醇基团的氨基酸(例如半胱氨酸)反应,形成影响稳定性的二硫化物。同样,向被微量金属离子污染的肽溶液中添加抗坏血酸不一定能保护肽免受氧化修饰。在某些情况下,它可能会加速氧化过程,如抗坏血酸在小模型肽中促进 Met 氧化并形成 Met 亚砜的趋势所表明的那样。蛋氨酸是一种含硫氨基酸,可以作为牺牲性抗氧化剂,在大量活性氧的作用下快速氧化形成蛋氨酸亚砜。
3.2.4.螯合剂
螯合剂通过螯合可充当反应催化剂的金属离子来保护肽免遭氧化。In pharmaceutical liquid formulations, various chelating agents are commonly used, including ethylenediaminetetraacetic acid (EDTA), diethylenetriaminepentaacetic acid (DTPA), desferal, ethylenediamine-di-o-hydroxyphenyl ace-tic acid (EDDHA), inositol hexaphosphate, tris(hydroxymethyl)aminomethane (TRIS), tartaric, and citric acid。 EDTA 是一种多功能螯合剂,可以与各种金属离子结合,包括铜、铁和钙。 DTPA 对钙离子和锌离子的结合特别有效。 Desferal 用于治疗铁过载,而 EDDHA 主要用于农业应用中与铁离子结合的能力。肌醇六磷酸,一种天然存在的螯合剂,在与铁离子结合方面特别有效,并且在癌症治疗中具有潜在用途。 TRIS是一种具有一定螯合特性的缓冲剂,而酒石酸常用于食品工业中,以提高产品的稳定性和溶解度。柠檬酸是另一种广泛用于食品工业和药物制剂的螯合剂,在与钙离子和其他金属离子(例如铁和铜)的结合方面特别有效。螯合剂的选择取决于配方中存在的特定金属离子和所需的结果。
然而,添加特定的螯合剂可能会加速肽分子的氧化过程。在一定条件下,螯合剂可以与微量金属离子结合,形成比单独金属离子具有更高氧化还原电位的络合物,从而提高氧化反应速率。此外,一些螯合剂在与金属离子相互作用时也可能产生自由基,从而促进肽的氧化降解。在一个说明性示例中,将 EDTA 添加到含有 Met 和 His 的小肽中改变了氧化选择性,仅针对 His 而不是 Met 。同样重要的是要了解 EDTA/金属络合物并不总是对氧化剂呈惰性。例如,[Fe(II)EDTA]2- reacts rapidly with hydrogen peroxide,最终产生络合羟基自由基和游离羟基自由基,它可以攻击给定肽中的所有氨基酸。最近,triethylenetetramine被证明在保护蛋白质(胰岛素和单克隆 IgG)免受 Cu 2+介导的氧化方面比 EDTA 更有效;然而,它尚未经过肽测试。
3.2.5.多元醇
多元醇已被证明可以通过清除活性氧 (ROS) 来保护治疗性肽免遭氧化。多元醇中的羟基可以向ROS提供氢原子,抑制肽氧化的能力。一些常用于保护治疗性肽免于氧化的多元醇是麦芽糖、蔗糖、海藻糖、棉子糖和甘露醇。例如,甘露醇已被证明可以保护含蛋氨酸的肽免受铁催化氧化,而蔗糖已被证明可以降低人脑利尿钠激素(hBNP)和人甲状旁腺激素(hPTH)的氧化率。高浓度的蔗糖(高达 1 M)也被证明可以提高液体制剂中 hPTH 和 hBNP 的稳定性。蔗糖的稳定作用主要是由于肽的聚集、氧化和脱酰胺作用的延迟。蔗糖诱导 hPTH 结构发生小的构象变化,优先排除肽表面的氧并保持 hBNP 的天然构象,从而形成更紧凑的肽结构。
3.3.防止二硫键交换反应
研究发现,将奥曲肽与药学上可接受的盐和HCl配制在10至60 mM甘氨酸中,将pH值调节在3.0和4.2范围内,可有效保护其二硫桥的裂解。据报道,Octastatin在 pH 4.0 的谷氨酸缓冲液中比在醋酸盐或柠檬酸盐缓冲液中更稳定。具有二价金属离子的组合特异性缓冲液可以保护肽药物免受二硫键交换。我们报道了combining zinc, calcium, and magnesium ions with dicarboxylic and tricarboxylic acids 可以提高催产素的稳定性。
3.4.抑制聚集、二聚和沉淀
肽的聚集和二聚化可以通过形成共价键(例如二硫桥和二酪氨酸)或非共价相互作用(例如疏水力)来发生。这些聚集体可以以可溶和不溶形式存在。优化溶液的pH值和离子强度可以稳定水溶液中的肽聚集]。例如,柠檬酸盐缓冲液和二价金属离子的使用已被证明可以抑制半胱氨酸介导的催产素二聚化。
另一种最小化肽聚集的策略是使用 extremolytes。Extremolytes是由极端微生物产生的有机小分子,可以保护生物大分子和细胞免受包括高温和高盐浓度在内的外部压力造成的损害。一些研究报道,extremolytes可以通过产生溶质水合物簇来稳定肽,由于extremolytes和肽主链之间的排斥相互作用,这些溶质水合物簇被排除在肽水合物壳之外。肽区域附近的水积聚使肽排列成更紧凑的结构,表面积减小。已证明可稳定溶液中肽的一些 extremolytes 实例包括 polyol derivatives: ectoine and hydroxyectoine , trehalose, betaine, amino acids (e.g., proline), and mannosylglycerate。研究表明甘露糖基甘油酸酯可以通过抑制β-淀粉样肽的聚集来稳定它们。
此外,可以优先排除蔗糖、氨基酸和表面活性剂(polysorbate 20 and 80)以防止二聚化。聚乙二醇 (PEG)已被证明可以通过在肽分子周围形成空间屏障来减少肽聚集,从而防止聚集所需的肽分子之间的紧密接触。稳定效果随着浓度和分子量的增加而增加,因此随着粘度的增加而增加。双氧基氨基酸如天冬氨酸(Asp)和谷氨酸(Glu)也可以通过它们作为氢键供体和受体的能力来减少肽聚集,使它们能够与肽中的其他氨基酸残基参与分子间氢键,从而防止不溶性聚集体的形成。据报道, Arg、Gly 和 Lys 也可防止中性 pH 下的聚集,因为在这种条件下,氨基的正电荷会静电阻碍肽的分子间相互作用。Polysorbates 可以减少搅拌引起的肽聚集,这可能是由于肽分子与空气/液体界面的暴露减少所致。然而,一些报告表明这些表面活性剂在减少热诱导聚集方面效果较差。
3.5.疏水离子对 (HIP)
疏水离子对(HIP)是当前用于增强治疗性肽在水溶液中稳定性的策略。该技术涉及在疏水性抗衡离子和肽中带正电的氨基酸残基(通常是组氨酸、赖氨酸或精氨酸)之间形成离子对。这种相互作用有效地保护带电基团免受周围溶剂的影响,减少它们与水的接触和潜在的水解。
HIP 策略的优点之一是它不涉及肽的化学修饰,化学修饰会影响其生物活性,并可能导致不良副作用。此外,HIP 是一种简单而有效的方法,已被证明可以增强多种治疗肽的稳定性,包括胰高血糖素样肽-1 (GLP-1) 和生长抑素类似物。
约根森等人引入可生物降解的精氨酸类固醇表面活性剂作为疏水性离子对的阳离子绿色试剂,证明了它们在各种应激条件下(例如高温和低pH值)稳定模型肽的有效性。此外,该研究强调了在设计离子对剂时使用可持续的、可生物降解的材料作为一种更环保的药物输送方法。
4. 结论
与蛋白质相比,肽由于尺寸较小且结构不太复杂,通常更容易在水溶液中降解。与蛋白质不同,肽不具有明确的 3D 结构,灵活性较差,但由于相互作用较少且可能采用多种构象,因此更加有序。这使大多数氨基酸残基的侧链暴露于溶剂,从而允许与溶剂的最大程度的接触。肽中的氨基酸(例如色氨酸、酪氨酸和苯丙氨酸)的疏水性侧基埋藏在其结构内部,因此不会或很少暴露于水环境。通过了解肽结构和降解途径,人们可以制定充分稳定的策略。
为了保证注射肽的稳定性和有效性,可能需要独特的配方和保存方法。设计治疗性肽制剂首先要知道氨基酸序列,以预测潜在的降解途径和治疗性肽的特性。pH值对肽的稳定性起着至关重要的作用,因此选择一种缓冲液来维持所需的pH值是降低水溶液中降解率的常用策略。pH值在3-5之间的缓冲溶液减少脱胺和氧化,并提供二硫桥保护,防止交换反应。一些肽可能需要辅料,如氨基酸、糖或缓冲系统来减少降解。助溶剂、空气排除、粘度增强、二价阳离子、聚乙二醇化和多元醇辅料是提高多肽在溶液中的稳定性的实用策略。此外,水注射肽通常储存在低温和避光环境中,以尽量减少降解。疏水离子配对(HIP)是提高多肽在水溶液中稳定性的有效方法。该技术涉及引入疏水反离子,该反离子与肽的带正电的氨基酸残基形成稳定的离子对。可生物降解的材料,如精氨酸类类固醇表面活性剂,可以用作HIP的绿色阳离子剂,为药物输送提供了更可持续的方法。评估理想的配方是至关重要的,以保持特定肽的稳定性,防止它可能遇到的每一个不同的压力降解。
现有的改善肽稳定性和递送的策略有局限性和需要解决的挑战。一个限制是这些方法可能不适用于所有肽,或者在某些应激条件下可能无效。此外,用于稳定肽的一些赋形剂可能具有不良影响,例如诱导免疫反应或改变肽的药代动力学。另一个挑战是肽的递送到目标部位。多肽可以在血液中迅速降解,限制了它们的生物利用度和治疗效果。因此,替代递送方法,如口服、透皮或纳米载体,已被探索以改善肽递送。改善肽的稳定性和递送仍然是基于肽的治疗的一个关键挑战。因此,未来的研究应侧重于制定创新和有效的策略来克服这些限制和挑战。
未来的研究方向包括开发改善肽稳定性和递送的新策略,例如使用专门为特定肽设计的稳定剂,开发可以保护肽在血液中降解的递送系统,以及改进纳米载体的设计以更有效地递送肽。此外,探索新的药物输送途径,如口服途径,可能是必要的,因为口服给药肽往往比注射给药对患者更友好,更具成本效益。另一个研究领域是开发新的配方,既能承受消化系统的恶劣条件,又能有效地将肽输送到目标部位。
免责声明:本文为行业交流学习,版权归原作者所有,如有侵权,可联系删除