
摘要:众所周知,线粒体是细胞的动力源,也是一些重要信号通路的启动器。多种疾病被发现与线粒体的异常有关,包括癌症。因此,针对线粒体及其代谢被认为是治疗癌症的有希望的方法。近年来,人们致力于开发针对线粒体的药物,包括小分子药物、肽、蛋白质和基因,已有多种分子药物和肽进入临床试验。随着纳米技术的进步,集生物标志物靶向、刺激反应、自组装和治疗效果于一体的自组装肽纳米材料在生物技术和纳米医学领域引起了越来越多的关注。特别是,原位线粒体靶向自组装肽可以在线粒体表面或内部组装,为线粒体靶向癌症治疗开辟了另一个维度。本文重点介绍线粒体靶向肽纳米材料的最新进展,尤其是线粒体原位自组装系统,以及它们在癌症治疗中的应用。
介绍:线粒体是哺乳动物细胞中的动态亚细胞器,众所周知,它参与三磷酸腺苷 (ATP) 的生成。它们由线粒体膜组成,包括多孔的外膜和具有空间的内膜,以及内部的线粒体基质 。线粒体拥有自己的基因组和裂变特征,还参与体内其他重要的生理功能,如大分子生物合成 和细胞增殖 、分化 (线粒体参与细胞凋亡、信息传递等过程。研究发现,线粒体功能障碍与一系列威胁人类健康的疾病有关,包括神经退行性疾病、心血管疾病和癌症。越来越多的证据揭示了线粒体的能量产生、代谢生物合成和单一途径与癌变之间的相关性。因此,线粒体被认为是改善癌症治疗的一个有希望的靶点。
目前,对线粒体的干预可以通过使用线粒体靶向试剂或调节线粒体内或外的特定靶点、基因转录和激酶活性来进行。特别是随着多种靶向化合物的发现,线粒体靶向方法受到越来越多的关注。例如,首次发现亲脂性阳离子,如三苯基膦 (TPP) 和地喹啉 (dequalinium) 可以靶向线粒体。TPP 含有一个带正电的磷原子,该磷原子离域于三个疏水苯环上。由于TPP具有独特的结构,因此它能够利用负的膜电位和穿过磷脂双层时有利的活化能来靶向线粒体膜,从而使线粒体积累增加数千倍。到目前为止,两种基于TPP的小分子抗氧化剂MitoQ和SkQ1已分别用于治疗帕金森病、慢性肾病和丙型肝炎以及干眼症的临床试验;第二类是线粒体靶向肽,主要包括Szeto-Schiller(SS)肽和线粒体穿透肽(MMPs)。这些肽通常由疏水性和带正电荷的氨基酸组成,它们被认为是通过负膜电位和与线粒体内膜上磷脂的相互作用来靶向线粒体的。SS肽(MTP-131)的一种制剂已在临床试验中用于治疗老年人心脏病发作和骨骼肌线粒体功能障碍。此外,线粒体前体蛋白是一种天然的线粒体靶向物种,它通过线粒体蛋白质进口机制进入线粒体。这些蛋白质含有可切割的N末端靶向序列,一旦进入线粒体,就会被线粒体肽酶切割,近年来,自组装肽纳米材料因其可设计的特点,将靶向性、生物响应性、自组装性和治疗性结合起来,成为一种新型的线粒体靶向材料
本文主要介绍近年来开发的靶向线粒体的自组装肽纳米材料,重点介绍构建靶向线粒体并在线粒体中组装的自组装肽的最新策略和进展,包括靶向线粒体的配体的装备、引入刺激响应机制以原位触发自组装等,并简要讨论了这些纳米材料在癌症治疗中的应用。
自组装肽
用于靶向线粒体的自组装肽纳米材料

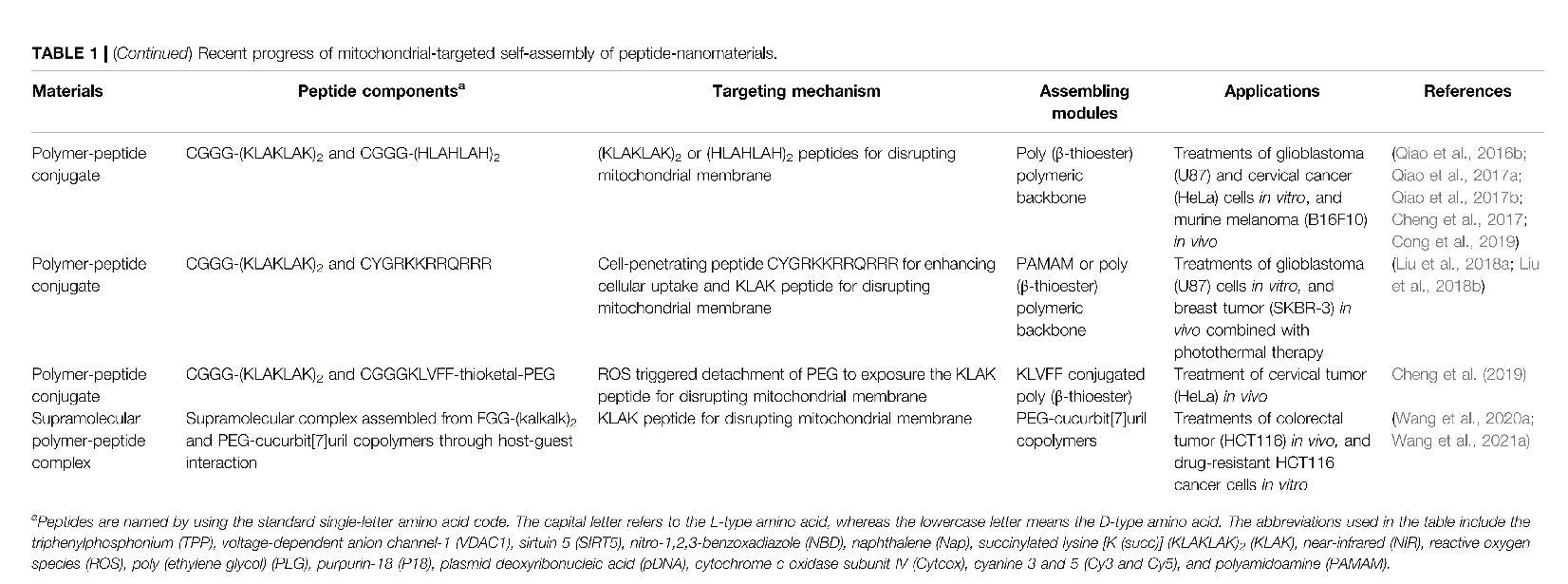
构建线粒体靶向自组装肽的典型方法是将靶向基序装备到自组装肽上。例如,Standley 等人将 α-螺旋 (KLAKLAK) 2 (KLAK) 肽(一种破坏线粒体膜的细胞毒性肽)与疏水烷基尾巴和 β-折叠形成肽相结合,得到线粒体靶向肽两亲物)。这种肽两亲物可以组装成纳米纤维,经证实可进入乳腺癌细胞,然后定位并破坏线粒体膜。为了提高靶向效果,利用内源性酶、氧化还原和酸性环境以及外源性光和超声波等刺激来引导靶向自组装。例如,Wang 等人报道了一种碱性磷酸酶 (ALP) 指导的自组装肽,用于靶向线粒体。该肽由线粒体靶向基序 (TPP)、自组装骨架 (FFYK)、酶反应性磷酸化酪氨酸和荧光团 (NBD) 组成。在癌细胞膜上过表达的 ALP 去磷酸化后,该肽变得更疏水并自组装成纳米纤维。在内吞和内体逃逸后,肽组装体在 TPP 的帮助下积累到线粒体中,导致线粒体功能障碍和细胞死亡。值得注意的是,在实验浓度下,该肽在低 ALP 表达的 HS-5(正常人骨髓基质)细胞中没有形成组装体。
尽管在培养细胞中取得了成功,但自组装肽仍然面临着生理环境中不稳定性的问题,以及在体内应用时存在的一些生理障碍,如血液中的快速清除、不受控制地运输到患病组织、细胞内化不充分和内体逃逸等。为了提高体内的生物学性能,Wang 等人报道了一系列聚合物-肽缀合物(PPC)作为体内自组装纳米药物。例如,Cong 等人报道了一类靶向肿瘤线粒体的PPC,其血液循环时间长。PPC 由聚(β-硫酯)骨架和侧链上用 pH 可裂解的顺乌头酸酐 (CAA) 部分和细胞穿透肽 (TAT: CYGRKKRRQRRR) 修饰的 KLAK 肽组成。全身给药后,亲水性 PPC 仍然可作为单体溶解,从而可以在血流中长时间循环并深入实体肿瘤。到达肿瘤组织后,酸性肿瘤微环境会触发 PPC 上亲水性 CAA 部分的裂解,从而形成装饰有 KLAK 和 TAT 肽的 100 纳米大小的纳米粒子。这些新形成的纳米粒子在 TAT 肽的帮助下进入癌细胞,然后进一步定位线粒体并诱导与 KLAK 肽相关的细胞凋亡。
肽纳米材料在线粒体中的原位自组装
在上一节中,我们讨论了定位线粒体的组装肽纳米材料。最近,原位自组装因其时空精度和可激活的生物效应而备受关注,成为生物医学领域的一个前沿。特异性酶和过表达的ROS可用于原位触发线粒体周围或表面的自组装。如图1B所示,He等报道了一种线粒体肠激酶(ENTK)指导的分支肽,用于在线粒体周围自组装。亲水性 ENTK 可切割的 Flag-tag (DDDDK) 被结合到肽支架上,形成胶束状结构。细胞内化后,由于 ENTK 的酶促切割,胶束主要在线粒体处转化为纳米纤维。这种自组装肽的构建已成功将氯霉素和组蛋白 (H2B) 递送到体外癌细胞的线粒体。此外,为了实现体内的线粒体靶向性,Cheng 等人构建了一种由 ROS 触发的形态可转化的 PPC,由聚乙二醇 (PEG) 链的响应性分离驱动。PPC 由聚乙烯醇骨架组成,侧链修饰有 PEG 化 KLVFF 肽,这些肽由 ROS 可裂解的硫缩酮和 KLAK 肽连接。给药后,胶束状 PPC 在 PEG 链的保护下在血流中运输。一旦靠近线粒体,过量产生的 ROS 会裂解硫缩酮连接基,从而分离 PEG 链,导致胶束转化为纳米纤维,从而使 KLAK 肽暴露,从而破坏线粒体膜。
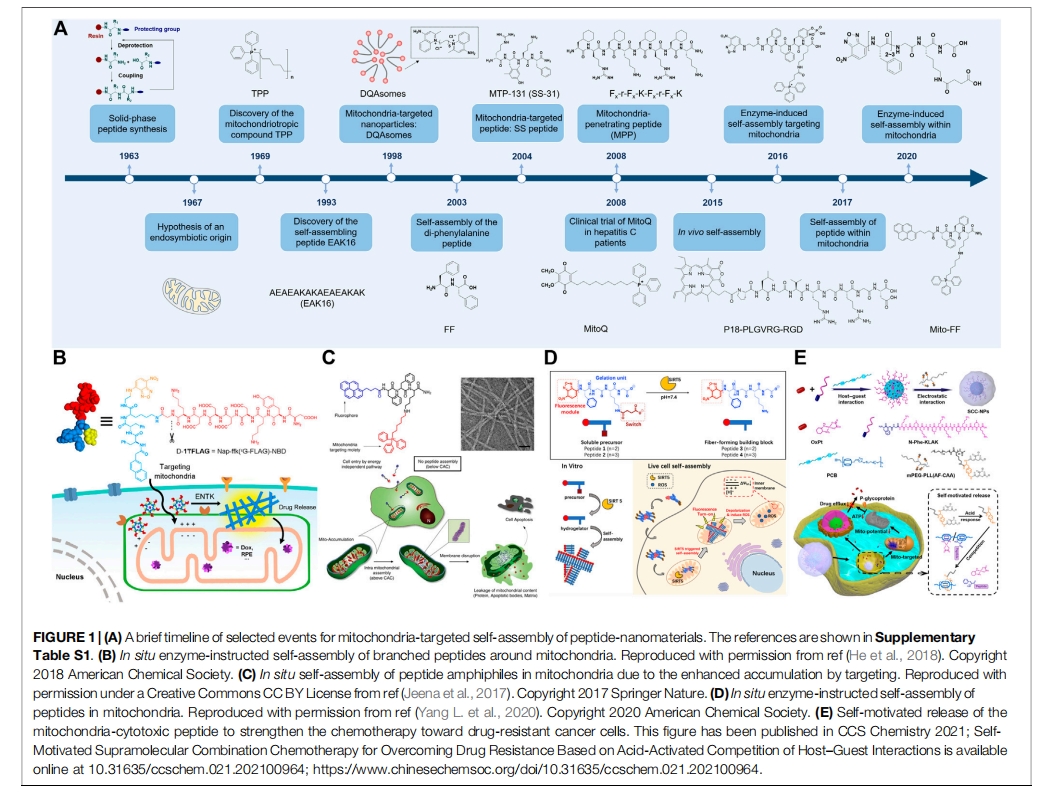
为了进一步实现肽段在线粒体内的精准自组装,靶向聚集诱导组装和线粒体内蛋白酶诱导组装表现出良好的潜力。由于足够浓度高于临界聚集浓度(CAC)是分子组装的基础,因此选择性地制备线粒体中空间浓度高于CAC、细胞质中空间浓度低于CAC的自组装肽段是实现线粒体原位自组装的一种可行方法。例如,Jeena等人报道了一种通过靶向聚集诱导组装在线粒体内进行组装的原位自组装系统(Mito-FF)(图1C)Mito-FF 由 FFK 肽骨架、N 端荧光芘和赖氨酸侧链 TPP 组成,CAC 为 60 µM。使用含有 5 µM 和 10 µM Mito-FF 的培养基,两亲性 Mito-FF 可以有效且选择性地聚集在宫颈癌 (HeLa) 细胞的线粒体内,浓度分别为 3 mM 和 11 mM,从而原位聚集成线粒体内的纳米纤维。除了靶向积累诱导聚集外,Yang 等人最近利用线粒体定位酶 sirtuin 5 (SIRT5)原位诱导线粒体内肽自组装(图 1D)2020该多肽以FFFGKG为骨架,N端带有荧光探针NBD,并带有琥珀酰化的赖氨酸残基,进入线粒体后,被SIRT5去琥珀酰化,疏水性增强,从而导致线粒体内形成纳米纤维。
癌症治疗中的应用
为了实现线粒体细胞毒肽以改善癌症治疗,Qiao 等人开发了一种含有通过 Michael 型加成制备的 KLAK 肽的 PPC。这种合成方法可以将靶向肽和治疗肽与 PEG 链轻松地结合到聚合物骨架上,从而实现了对皮下胶质母细胞瘤 (U87) 小鼠模型的改善的生物稳定性和增强的抗癌功效。然而,这种共价方法存在反应时间长(例如 2 天)和硫醇和胺基竞争反应的问题。为了构建一种快速简便的肽药物全身递送方法,Wang 等人基于非共价超分子化疗的概念,提出了一种超分子肽治疗策略。由于葫芦[7]脲(CB[7])与肽中的N末端苯丙氨酸(N-Phe)残基之间存在强的主客体相互作用(结合常数∼2 × 10 6 M −1),以简单(在水溶液中混合)和快速(几分钟)的方式将含有 N-Phe 的 KLAK 肽负载在 CB[7]-PEG 共聚物上,在 0.5 mM 肽浓度下具有较高的肽包封率 (>97%)。该策略通过延长血液循环时间(静脉注射后 1 小时残留 25%,而单独的肽残留 13%)、增强肿瘤蓄积(增强 2.8 倍)和增强抗癌效果(肿瘤抑制率增强 4 倍)对皮下结肠直肠肿瘤 (HCT116) 小鼠模型静脉注射,血液学、肝脏和肾脏毒性最小。此外,为了克服癌细胞的耐药性,同一研究小组进一步将奥沙利铂与协同破坏 ATP 生成的 KLAK 肽结合,在酸触发的按需药物释放系统中(图 1E),实现了对奥沙利铂耐药 HCT116 细胞的抗癌活性增强,IC 50从 76.5 µM(奥沙利铂)降低到 31.2 µM(Wang H. et al., 2021)除了化疗外,Zhang等人利用近红外光的光热效应,促进含红紫素-18肽的自组装,使自组装速率提高了4倍,在肿瘤中的蓄积提高了2倍。
结论与展望
纳米技术和生物技术的进步见证了自组装肽从简单的水凝胶支架到用于多种生物医学应用的智能纳米材料的巨大进步,弥补了简单的合成分子与体内复杂的生物机械之间的差距。由于具有包括优异的生物相容性和对多种生物和物理化学活性的包容性等优势,自组装肽实现了从组织、细胞到细胞器水平的自组装精度。然而,针对线粒体的自组装肽的进一步发展仍然存在一些挑战。首先是精确的自组装。除了膜电位、酶和ROS之外,其他候选蛋白包括线粒体蛋白质输入机制和核酸,也是有希望的目标。第二个是原位表征。高分辨率、实时、原位技术对于研究细胞器自组装的过程和动力学非常有价值。第三是快速设计和筛选。机器学习技术可以提供一种高通量的方法来开发配备多个生物活性和功能模块的自组装肽。最后但并非最不重要的是,生物安全性应该受到高度关注。由于肽纳米纤维的长期保留特性,仔细研究自组装肽的降解、代谢和长期毒理学对于其进一步的临床应用非常重要。尽管面临挑战,我们相信自组装肽纳米材料,特别是细胞器精确的自组装肽,将有助于生物医学技术和产品的新范式。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。