
摘要:防御素是一类富含精氨酸的阳离子多肽,广泛分布于自然界各种生物体内,是生物体先天性免疫系统的重要组成成分。根据防御素的来源及结构可将其分为脊椎动物防御素(α-防御素、β-防御素和θ-防御素)、植物防御素和昆虫防御素,不同种类的防御素有相同的结构共性,也有其特有的结构特征。目前的研究发现,防御素具有抗菌、抗病毒、抗肿瘤、炎症调节等多种生物学活性,具有很高的临床应用价值,但对其作用机制的研究并不详尽。因此,本文总结了防御素的分类、分布及不同种类防御素特有的结构特点,阐述了防御素主要的生物活性及其不同的作用机制,介绍了目前防御素在临床研究中的方向及进展,并提出防御素未来可以作为新药物设计模板、疾病诊断指标、疫苗佐剂、肿瘤治疗靶标等一系列应用设想。
引言:防御素广泛存在于自然界的各种生物中,是生物免疫防御系统的重要组成部分,具有多种生物学活性,有很大的临床应用价值。然而不同种类的防御素具有不同的结构,有不同于现有药物的作用机制,了解它们的生物学活性及作用机制能够更有效地利用防御素,为其临床应用创造更大的价值。因此,本篇文章综述了目前已发现的防御素的保守结构及不同防御素特有的结构特点,介绍了防御素的常见生物学活性以及作用机制,以期为防御素的临床应用提供参考
1 防御素的分布、分类及结构
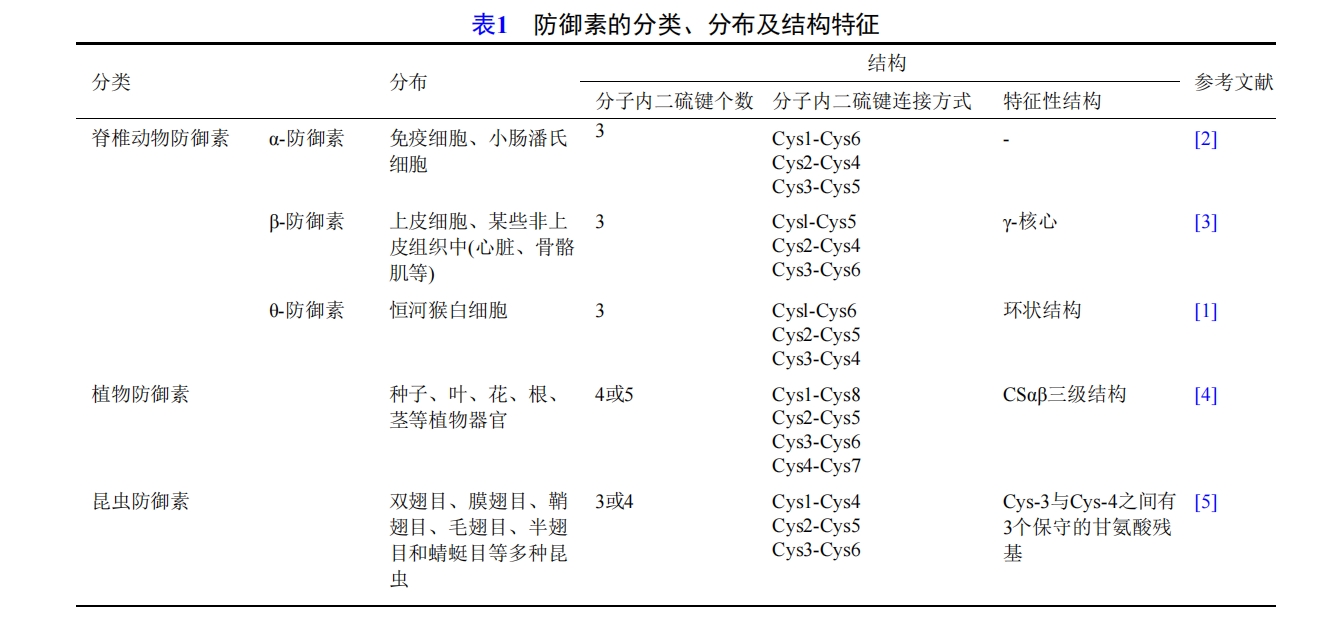
脊椎动物防御素根据二硫键的排列位置不同,可定义为三个子类,即α-防御素、β-防御素和θ-防御素。
α-防御素最早是在兔的肺泡巨噬细胞中发现的,随后在兔、鼠、豚鼠、短尾猿、人等多种哺乳动物的巨噬细胞、中性粒细胞、小肠潘氏细胞中都有发现。人类可表达六种α-防御素,分别称为人防御素1-6(human defensins 1-6,HD1-6),根据其表达形式和组织来源可进一步分为髓系防御素(HD1-4)和肠系防御素(HD5和HD6)。其中,髓系防御素是在中性粒细胞的嗜酸性颗粒中发现的,故也称为人中性粒细胞肽1-4,同时,它们也可在单核/巨噬细胞、自然杀伤细胞、部分T细胞、B细胞和未成熟的树突状细胞中表达。肠系防御素HD5和HD6由小肠隐窝的潘氏细胞产生,其中,HD5也可以在泌尿生殖道上皮细胞中表达 [6] 。
1991年,Diamond等 [7] 从牛的气管黏膜中分离提取出了一种抗菌肽,命名为气管抗菌肽。气管抗菌肽分子内半胱氨酸残基的间距和二硫键的拓扑结构与α-防御素有所不同,因此将该抗菌肽命名为β-防御素。β-防御素在哺乳动物多种器官的上皮细胞内均有表达,如牛、羊、猪、骆驼、驯鹿等动物的胃肠道、呼吸道、生殖道和舌,小鼠及大鼠的肾和肺,人的胃、气管、皮肤及其他黏膜上皮等;在某些非上皮组织中,如心脏、骨骼肌等,也有β-防御素的表达。
成熟β-防御素的二级结构核心与α-防御素一样,是3条反向平行的β-折叠,该结构也通过6个半胱氨酸残基之间形成的3个分子内二硫键稳定。与α-防御素的不同之处在于β-防御素的3对二硫键的连接方式为Cysl-Cys5、Cys2-Cys4、Cys3-Cys6。并且,β-防御素的β-折叠的一侧是由分子的N-末端形成的短α-螺旋,α-螺旋通过二硫键(Cysl-Cys5)固定在β-折叠上,是β-防御素整合到细胞膜上的主要功能区域,也是杀死病原体的主要功能区域。也有研究者认为,所有的β-防御素的形成都是由一个γ-核心开始的,这个γ-核心是整个防御素分子的结构支架,也是防御素分子的主要功能区 [3] 。
θ-防御素最初是从恒河猴白细胞中发现的,是目前在哺乳动物中发现的唯一一种环状肽。因其强大的抗菌抗病毒活性,尤其是抗人免疫缺陷病毒(human immunodeficiency virus,HIV)活性而受到关注 [8] 。
θ-防御素是一种呈环状结构的新型防御素,由18个氨基酸和3对分子内二硫键组成,分子中二硫键的连接方式为Cysl-Cys6、Cys2-Cys5、Cys3-Cys4。θ-防御素以环状胱氨酸阶梯基序为特征,由经过2个旋转连接成的2个反向平行的β链形成高度对称的环状构象,并且3个分子内二硫键都在分子的同一面,而精氨酸的阳离子侧链则暴露在分子的另一面 [1] 。核磁共振弛豫测量和推导的阶数参数表明,环状胱氨酸阶梯赋予θ-防御素骨架更高的稳定性 [1] 。研究者还发现,θ-防御素是由两个独立的θ-防御素基因编码的单体聚合而成的,θ-防御素单体的基因类似截短的α-防御素基因,因此,θ-防御素单体与传统的α-防御素非常相似,不同之处在于该单体被一个“过早”出现的终止密码子缩短,且只包含3个半胱氨酸 [9] 。
植物防御素存在于植物的不同部位,如种子、叶、花、根、茎等植物器官都有防御素的表达。并且,植物防御素常定位于植物细胞的细胞壁和细胞间隙等病原体最先接触的部位,是植物防御系统的重要组成成分 [10] 。
植物防御素一般有45~54个氨基酸残基,它的一级结构中一般包括8个保守的半胱氨酸,4个分子内二硫键。这4个二硫键配对的模式通常是Cys1-Cys8、Cys2-Cys5、Cys3-Cys6和Cys4-Cys7。植物防御素的三级结构一般是CSαβ结构,包括一个突出的α-螺旋和三股反向平行的β-折叠,通过半胱氨酸形成的四对二硫键形成稳定的结构。除此之外,植物防御素中还有一个特殊的亚类在分子内形成了五对二硫键,第五对二硫键赋予了防御素分子额外的热力学稳定性 [4] 。
昆虫对细菌感染具有极强的抵抗力,昆虫防御素作为免疫系统的重要组成部分,对各种革兰氏阳性/阴性细菌和真菌均有广谱抗菌活性。昆虫防御素的分布也非常广泛,现已从双翅目、膜翅目、鞘翅目、毛翅目、半翅目和蜻蜓目等多种昆虫中分离出了昆虫防御素 [5] 。
昆虫防御素大多由29~34个氨基酸残基组成。它有一个独特的分子学特征是在Cys-3与Cys-4之间有3个保守的甘氨酸残基。此外,昆虫防御素分子内二硫键的连接方式也与其他防御素不同,分别为Cys1-Cys4、Cys2-Cys5、Cys3-Cys6。值得一提的是,已从昆虫中分离提取出含有4个二硫键的防御素。
2 防御素的生物活性及其作用机制
防御素能够通过多种机制杀灭细菌或抑制细菌生长。体外实验显示,防御素具有广谱的抗菌活性,对革兰氏阳性菌、革兰氏阴性菌、厌氧菌、某些真菌、梅毒螺旋体、钩端螺旋体和分支杆菌等均具有很强的抗菌活性。昆虫防御素对革兰氏阳性细菌的作用效果较强,但对革兰氏阴性细菌的作用效果较差 [5] 。而植物防御素在抗真菌作用方面更有优势,因为对植物而言,真菌是最常见的微生物威胁 [11] 。防御素的抗菌机制与现有的抗生素的抗菌机制不同,防御素主要通过作用于细菌细胞膜、中和分泌毒素以减少感染、阻断细菌进入细胞以及促进共生菌定植四个方面发挥抗菌作用。
防御素分子在细菌细胞膜上聚集之后,可导致细胞膜破裂、细胞成分泄漏,进而抑制细菌的生命过程,最终导致细菌死亡。目前,至少有四种模型描述防御素破坏细菌细胞膜的过程:“聚集”模型、“环形孔隙”模型、“木桶板”模型和“地毯”模型 [5] 。这四种模型提示,防御素对细菌细胞膜的破坏机制可能因不同的防御素和细菌类型而有所不同。
在研究人类防御素与多种不同细菌产生的细菌毒素相互作用的实验中,Kudryashova等 [14] 发现,不同防御素使细菌毒素失活的机制有明显的相似性,包括多价相互作用、对细菌毒素的非竞争性或竞争性抑制作用,以及去折叠作用。但适用于所有防御素靶向灭活细菌毒素的机制还有待进一步研究。
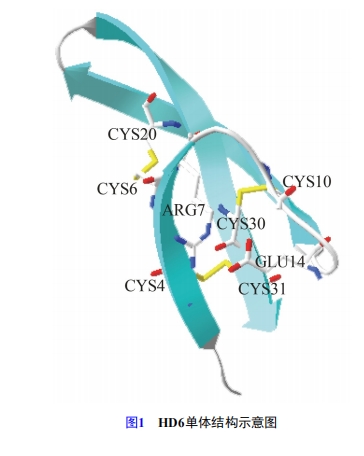
研究发现,某些防御素并没有很强的杀菌抑菌活性,但是它能利用较强的机械防御活性起到防止细菌侵入人体的作用,如小肠隐窝底部潘氏细胞产生的HD6。HD6在随机结合到细菌表面蛋白质(如菌毛、鞭毛)后,经历有序的自组装,形成缠绕细菌的原纤维和纳米网,从而发挥防止肠道病原体入侵的作用,其中,HD6组氨酸-27残基的咪唑环和亮氨酸-32的C端羧基之间的静电相互作用参与介导了这种自组装 [15] 。也有一些实验结果表明,HD6防止细菌入侵的能力是广谱的,对革兰氏阴性或革兰氏阳性细菌没有明显的选择性,这也从另一方面证实了HD6对于细菌的机械防御活性 [16] 。
防御素不仅具有抗菌作用,还有促进共生菌定植的作用。Ou等 [17] 发现,肠道中的α-防御素对共生类杆菌没有任何杀菌活性,反而可通过增强细菌对肠道黏膜的黏附作用,促进共生类杆菌定植,以维持肠道微生物的多样性,从而抵御外来病原体的入侵。
综上所述,防御素不仅有非常广谱的抗菌作用,其抗菌机制也多种多样。如今,由于抗生素的滥用,很多耐药菌株逐渐出现,给临床治疗带来了很大的难题。但防御素独特多样的抗菌机制,能够很好地解决现有的细菌耐药问题,有望替代现有的抗生素成为新一代的抗菌药物。而防御素的模拟物Brilacidin(PMX-30063)、Lytixar(LTX109)等也对多种细菌有抗性,在针对某些感染性疾病的治疗研究中,防御素模拟物甚至已经进入了临床研究阶段,并取得了初步的成功,是非常有前景的抗生素候选药物 [ 18, 19] 。
防御素对包膜病毒和非包膜病毒都有抗病毒活性。其抗病毒机制除了抑制病毒融合,直接针对病毒包膜、糖蛋白和衣壳外,还能结合并调节宿主细胞表面受体、破坏细胞内信号传导,从而抑制病毒复制 [6] 。然而,也有研究表明,防御素在发挥抗病毒作用的同时,也能促进某些病毒对机体的感染。比如,HD1因其抗HIV活性而被广泛研究,但同时HD1也能增加上皮细胞的通透性,促进HIV跨越上皮屏障,从而促进病毒感染和传播 [20] 。
防御素与病毒颗粒等配体结合有多种模式。首先,带正电荷的防御素能与包裹病毒的脂质双分子层直接作用,从而破坏病毒,使其不具传染性。然而防御素对脂质双分子层的破坏取决于包膜脂质成分的差异,负电荷磷脂对防御素敏感,而中性双层脂膜对防御素基本不敏感。并且由于防御素是两性分子,防御素也能通过亲脂性与病毒颗粒相互作用 [6] 。第二,防御素具有与病毒表面糖蛋白结合的活性 [ 21, 22] 。与病毒附着蛋白结合的防御素可破坏病毒与细胞内关键受体的相互作用。HD5可结合与单纯疱疹病毒-2侵入和黏附能力相关的病毒表面糖蛋白D,进而减少病毒对细胞的黏附 [23] 。除此之外,HD1、HD2和HD5可结合HIV-1表面的gp120以及细胞表面受体CD4,从而减少HIV对机体免疫细胞的破坏 [24] 。总之,防御素可直接干扰HIV-1和单纯疱疹病毒-2与细胞的结合和附着。同时,与病毒颗粒结合的防御素分子能够诱导病毒颗粒的聚集,促进抗原呈递细胞对病毒颗粒的摄取、处理,也能通过直接阻碍病毒与细胞结合或使成团的病毒进入较少的细胞从而降低病毒的传染性。除此之外,对新冠病毒的研究发现,HD1和θ-防御素能够诱导新冠病毒棘突蛋白的去折叠和沉淀,并抑制其与血管紧张素转化酶2的相互作用,从而减少新冠病毒对人体的感染 [25] 。
再者,防御素还能通过阻止病毒脱壳从而发挥抗病毒活性。研究发现,人体中α-防御素特别是HD5对抑制人乳头状瘤病毒感染非常有效 [26] 。人乳头状瘤病毒的衣壳蛋白和HD5相互作用,使病毒衣壳更加稳定,直接阻止了病毒的脱壳,并将病毒颗粒转移到溶酶体中,从而中断了病毒的复制。
病毒仅穿透宿主细胞膜还不能完成感染,病毒的转录、蛋白质的产生、病毒的组装和释放都必须发生才能完成一个复制周期。这些步骤为防御素提供了阻断病毒感染的机会。
对于宿主细胞来说,防御素能够与宿主细胞表面的蛋白质结合,从而抑制病毒与宿主细胞的融合。对于HIV-1的入侵,HD1能通过与细胞膜表面受体结合降低细胞膜表面CD4、CCR5和CXCR4受体的流动性,从而抑制病毒与细胞膜的融合 [27] 。对于新型冠状病毒SARS-CoV-2,HD5能够封闭细胞表面的血管紧张素转化酶2受体,从而减少病毒对人体的感染 [28] 。此外,许多病毒(如HIV-1、呼吸道合胞病毒等)在感染宿主细胞的过程中都有蛋白激酶C的参与 [ 29, 30] 。有研究发现,某些防御素能够通过抑制蛋白激酶C的活性参与抑制病毒对人体的感染。这一发现表明,改变或抑制细胞内信号传导通路可能是防御素抗病毒活性的另一种机制 [ 31, 32] 。综上所述,防御素对病毒的抑杀作用涉及多方面机制。防御素发挥抗病毒活性涉及病毒从穿越细胞膜开始至与细胞内的靶标相互作用的全过程。
研究发现,很多病毒感染能够引起机体防御素表达的增加,而提前在小鼠体内注射过量的防御素能够减少病毒感染滴度 [33] 。这些结果提示,在人体内预防性地使用大量防御素是否也能够减少病毒感染滴度,从而起到预防感染的作用? 但是,在人体内预防性地使用大量防御素的利弊还需要更深入的探索和分析。因为研究发现,高浓度的防御素有细胞毒性作用并且能促进某些疾病的发生发展 [ 34, 35] 。因此,在未来使用防御素预防各种病毒感染时,还应综合考虑防御素给机体带来的各种副作用。怎样规避这些副作用,或者怎样找到一个使人类获益最大化的平衡点,还需要进行更加深入的研究。而对于目前严重威胁人类健康的新型冠状病毒来说,已有研究表明,防御素模拟物Brilacidin(PMX-30063)能够同时作用于靶细胞和病毒从而减少病毒进入细胞;另外,Brilacidin(PMX-30063)与瑞德西韦的联合使用也表现出协同的抗病毒活性 [36] 。
起源于上皮组织的癌是目前最常见的恶性肿瘤,特别是由上皮细胞分泌的β-防御素参与了很多上皮源性肿瘤的发生与发展,受到了广泛关注。研究发现, hBD1在前列腺癌等癌症中表达下调,并且可能作为肿瘤抑制因子发挥作用 [37] 。在丙肝病毒感染引起的肝细胞癌中, hBD1的下调能够使E-钙黏蛋白下调、肝细胞生长因子调节的酪氨酸激酶底物上调,抑制癌细胞的生长和迁移 [38] 。而 hBD3却在头颈部肿瘤以及宫颈癌等多种癌症中都有过表达 [39] 。并且,现已发现肿瘤细胞分泌的 hBD3能刺激肿瘤生长和迁移,使肿瘤细胞对凋亡产生抵抗力,并有助于招募与肿瘤进展相关的巨噬细胞、单核细胞、未成熟树突状细胞、记忆T细胞和肥大细胞 [ 39, 40] 。
防御素的表达量在很多类型的肿瘤组织中都有明显的变化,特别是由上皮细胞分泌的β-防御素参与了很多上皮源性肿瘤的发生与发展,一些防御素对肿瘤有抑制作用,另一些防御素则在肿瘤中过表达并促进肿瘤微环境的形成,但这并不妨碍防御素在未来的临床工作中可能作为肿瘤的生物学标志和治疗靶点。目前已有研究表明,HD6的水平与大肠癌患者的总体生存率呈负相关,是大肠癌的独立预后标志物,并且HD6在大肠癌中能促进癌细胞的增殖、迁移和侵袭,是该疾病的良好治疗靶点 [41] 。
不同防御素通过不同的机制作用于特定细胞,既能诱导炎症,又能抑制炎症。防御素的抗炎作用和促炎作用由其表达水平决定,同时也取决于疾病状态和病原体暴露状态。在促炎方面,多项实验表明,β-防御素可通过与多个细胞表面受体结合促进促炎性细胞因子和趋化因子的产生,增强免疫反应。β-防御素不仅能通过CCR2介导单核/巨噬细胞的反应性迁移,也可以通过与CCR6结合,诱导CD4 +记忆T细胞和未成熟树突状细胞的趋化作用 [40] 。人的内源性防御素 hBD2能增强核苷酸寡聚化结构域样受体和维甲酸诱导基因Ⅰ受体的表达并能够诱导其易位,从而直接激活从腹膜分离出的肥大细胞的促炎和迁移反应。hBD2还能增强单核细胞对核苷酸寡聚化结构域样受体和维甲酸诱导基因Ⅰ受体相应配体的敏感性,从而增强单核细胞在炎症中的作用 [42] 。
同时,当病原体被清除后,防御素也能抑制炎症的发展,减少炎症反应对组织造成的损伤。牙周炎的治疗中, hBD3可通过抗炎作用发挥成骨促进剂的作用,从而促进牙周组织的修复再生 [43] 。在急性肺损伤的实验模型中,研究者发现,恒河猴θ-防御素能够通过抑制中性粒细胞趋化和黏附,减弱肺泡巨噬细胞的促炎细胞因子和基因的表达,从而缓解气道炎症 [44] 。
α、β-防御素通常含有6个半胱氨酸残基,它们在分子内形成二硫键,此结构特征类似于作用于钾通道的典型毒素肽 [45] 。近年来研究发现,HD1可以作为一种毒性阻断剂和一种新的修饰剂同时结合到跨膜螺旋S1-S2连接子和Kv1.3通道的孔道区域,而HD5也能作为一种毒性阻断剂结合到Kv1.3通道的孔道区域 [46] 。钾离子通道Kv1.3在T细胞活化中有关键性作用,作为Kv1.3通道的一种新型内源抑制剂,人类防御素与T细胞中的Kv1.3通道结合可能会影响细胞因子分泌,这为防御素在适应性免疫中的作用提供了新的证据 [46] 。
这些研究结果提示,可以利用不同防御素对机体炎症的不同调节作用而获益。目前临床上感染诊断的金标准是细菌培养呈阳性,但细菌培养所需时间长、假阳/阴性率高,并且易受抗生素的影响。而防御素作为机体免疫系统的重要组成成分,在遇到细菌的入侵时可显著升高,可作为细菌感染的早期诊断指标之一。目前,美国食品和药物管理局已经批准了α-防御素的检验可作为骨科假体周围感染临床诊断的辅助手段 [47] 。而在新冠患者中,血清防御素水平也有显著增高 [48] 。在哮喘治疗中,治疗性的鼻内应用防御素也能显著降低哮喘相关细胞因子白细胞介素-9和白细胞介素-13以及其他免疫调节细胞因子的水平,从而有效抑制气道高反应性 [49] 。除此之外,防御素还与克罗恩病等肠道自身免疫性疾病相关 [15] 。
3 展望
防御素是生物体先天免疫系统的重要组成部分,基于自身独特的结构,防御素具有很多生物学活性,其相应分子作用机制也很复杂,尚需进一步的研究探索。
目前,防御素的获取途径主要有三种,分别为从细胞或体液中提取、化学合成以及基因工程制备。但防御素在组织中的表达较少,纯化工艺复杂,成本也较高,产量也较少,因此,基因工程制备无疑成为目前获取防御素的首选方法。并且,防御素的模拟物也具有类防御素的生物学活性,并且在临床研究中已取得进展,也可作为未来药物研发进一步研究的方向。
基于对防御素现有结构的研究,人们可以根据防御素的活性区域与骨架设计新的抗菌药物。如θ-防御素的环形骨架赋予了分子更强的稳定性,可以作为新型药物的结构支架,提高药物的稳定性。β-防御素的γ-核心是其主要的活性区域,可将该活性区域与其他种类防御素或其他药物的活性区域组合形成具有多种活性多种机制的新药物。除此之外,现已有研究表明,抗生素与防御素有协同作用,也可根据这一研究结果,将不同种类的防御素和抗生素配伍,开发联合用药方案,提高疗效 [50] 。
目前,已有研究者发现,防御素可作为生物标志物之一参与预测病人的光敏性,从而辅助系统性红斑狼疮的诊断 [51] 。与此同时,防御素与炎症性肠病的研究也日益增多,那么其他的自身免疫性疾病是否也与防御素相关,防御素对于这些自身免疫性疾病的诊断和治疗是否有帮助,也是一个值得研究的方向。在未来的防御素应用研究中,临床耐药问题也值得关注。而针对目前棘手的新冠病毒疫苗的开发研究,也有研究者将β-防御素佐剂与病毒的多表位肽连接,使该多表位肽表现出了较高的抗原性,可应用于当前新冠肺炎的预防 [52] 。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。