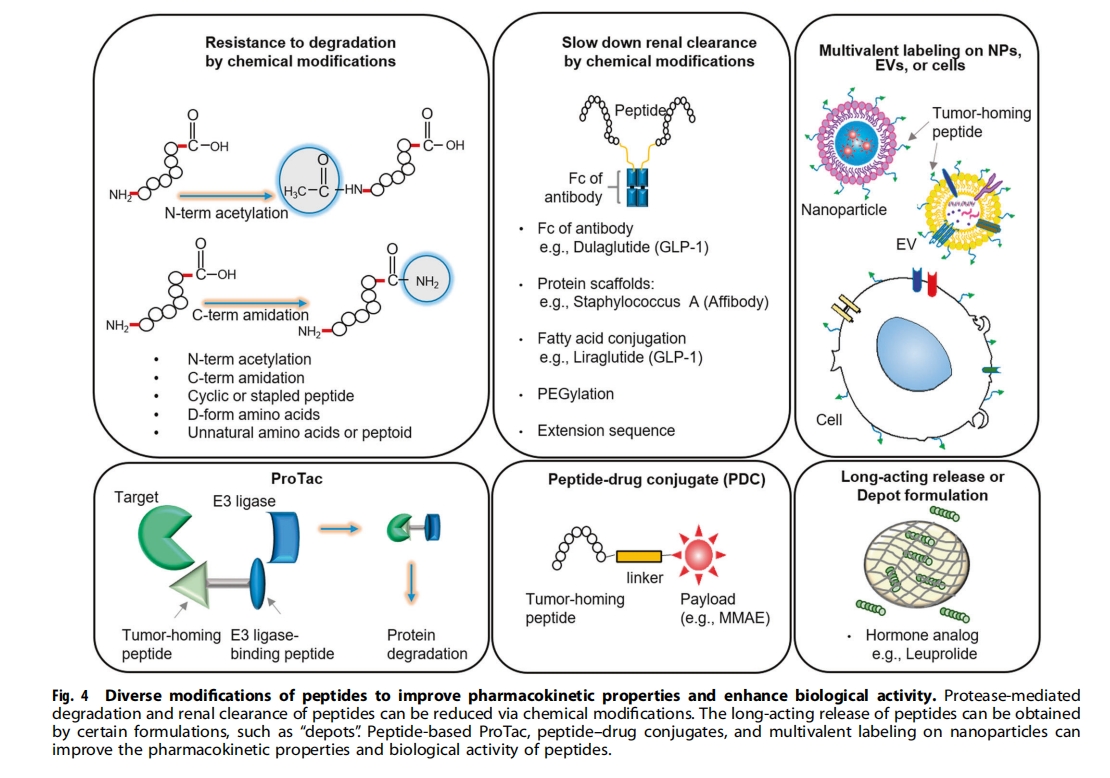
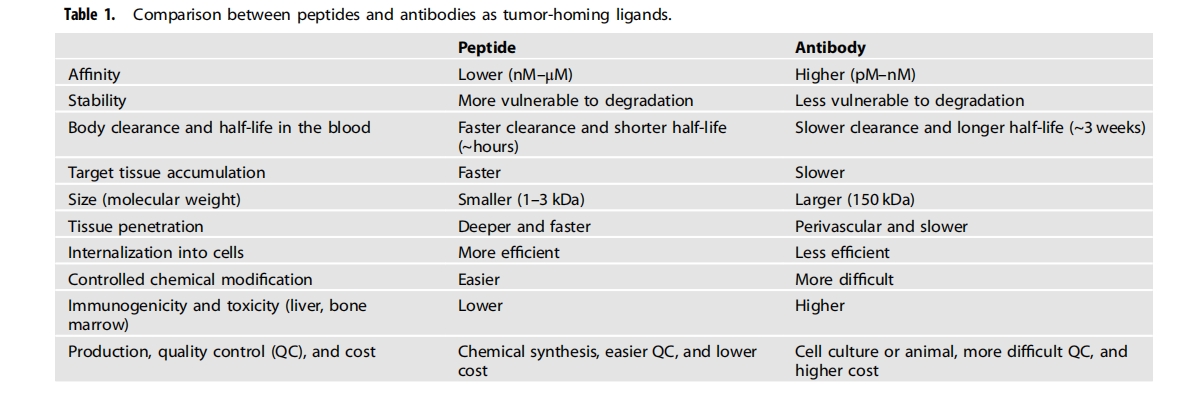
摘要:与抗体相比,肽在体内的亲和力较低,半衰期较短。相反,肽在组织渗透和细胞内化方面比抗体更有效。无论肽的优缺点如何,它们都已被用作肿瘤归巢配体,用于将载体(如纳米颗粒、细胞外囊泡和细胞)和货物(如细胞毒性肽和放射性同位素)输送到肿瘤。此外,肿瘤归巢肽已通过接头与小分子或化疗药物等货物结合,以合成肽-药物偶联物。此外,肽选择性地与细胞表面受体和蛋白质结合,例如免疫检查点、受体激酶和激素受体,随后阻断它们的生物活性或用作激素类似物。此外,进入细胞的肽与细胞内的蛋白质结合并干扰蛋白质-蛋白质相互作用。因此,肽作为癌症治疗中的多功能参与者具有巨大的应用潜力。
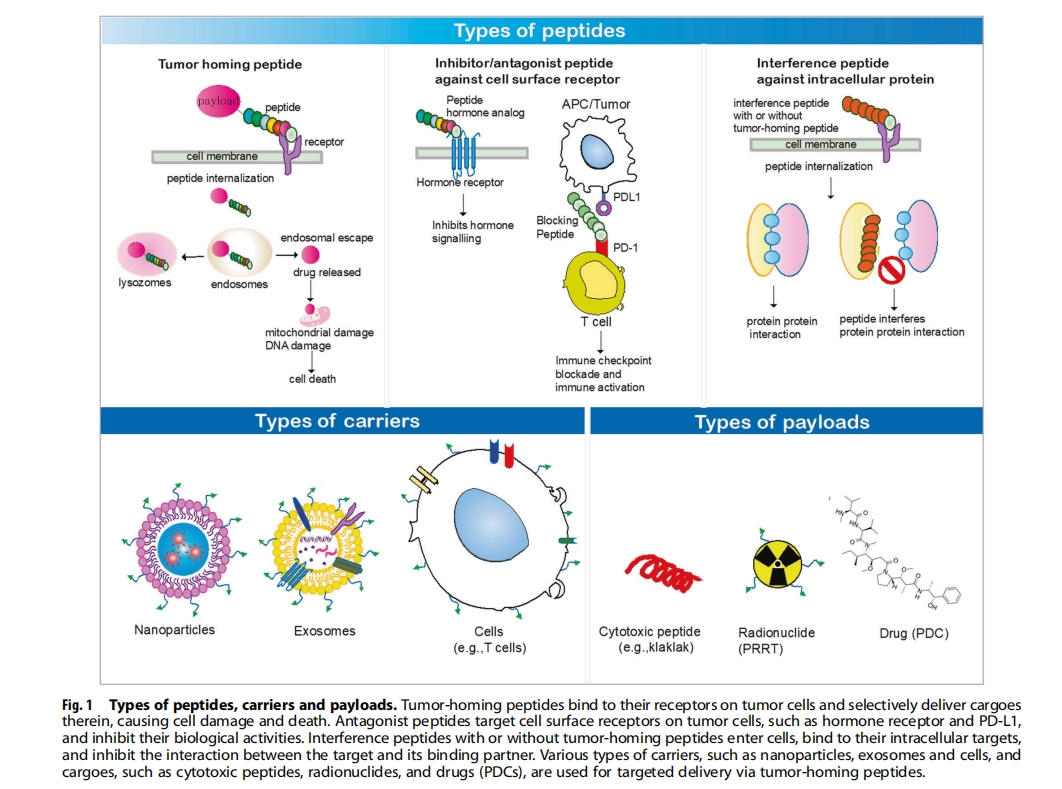
肿瘤归巢肽作为靶向配体
肽靶向纳米粒子递送
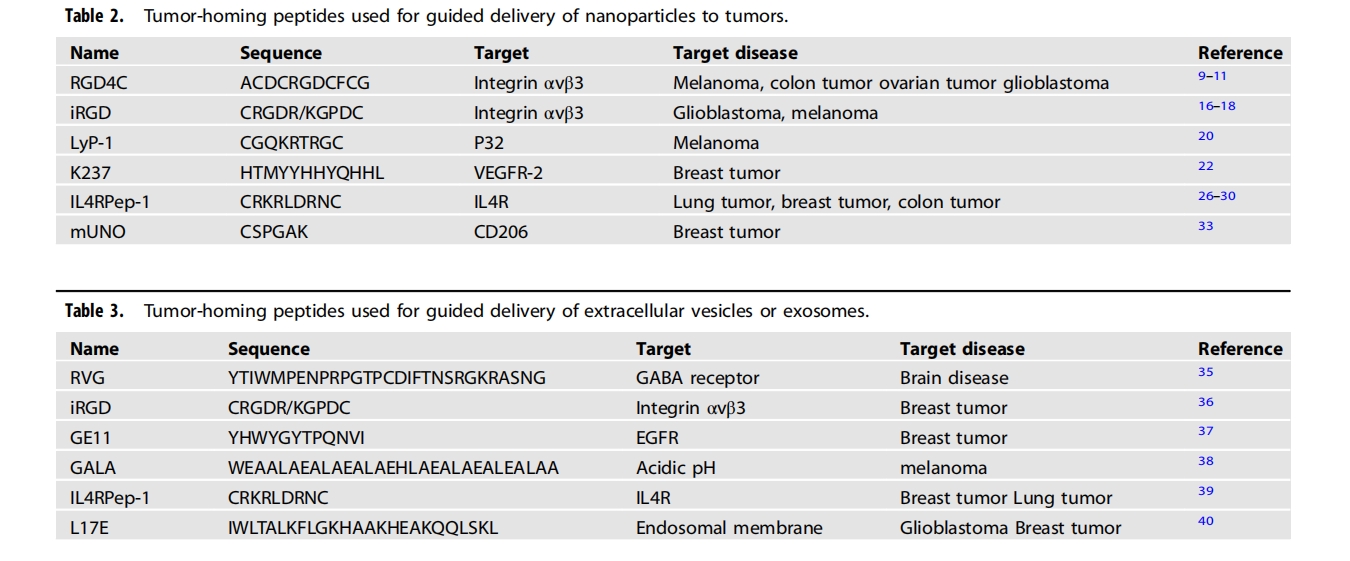
肿瘤归巢肽已用于通过肽与细胞表面受体或结合伙伴之间的直接相互作用将纳米颗粒引导至癌细胞。一般而言,它们被设计为肿瘤细胞特异性的,以增强纳米颗粒进入肿瘤细胞的内化。纳米颗粒上肽的多价标记增加了肽的结合亲和力。此外,肽与纳米颗粒的结合往往可以保护肽免受蛋白酶介导的降解。最著名的肿瘤归巢肽是 RGD 肽,包括 RGD4C (ACDCRGDCFCG) 和 Cilengitide™ (RGDfV),它们与肿瘤血管的血管生成内皮细胞中过表达的 αvβ3 整合素结合,从而抑制血管生成。RGD肽与药物或载药纳米颗粒的结合已在癌症治疗中得到深入研究。内化RGD或iRGD(CRGDR/KGPDC)是RGD肽的改良版本,不仅与αV整合素结合,而且还增加了药物的组织渗透性。RGD基序与肿瘤内皮细胞中表达的αV整合素结合会诱导蛋白酶介导的iRGD肽裂解,产生两种肽,即CRGDR/K和GPDC。随后,含有C末端CendR基序(R/KXXR/K)的CRGDR/K肽与神经纤毛蛋白-1结合,激活内吞途径。因此,iRGD 无论是与药物结合还是共同给药,都能增加药物的组织渗透性。
肽靶向递送EV或外泌体
EV 或外泌体是从细胞分泌到循环中的内源性纳米颗粒。它们可以携带 DNA、RNA、蛋白质和脂质并将它们分布在细胞之间。在装载治疗剂的外泌体表面标记肿瘤归巢肽可以减少癌症治疗中的主要不良副作用。外泌体的表面修饰通过两种方法进行:基因工程和非基因工程。利用基因工程,树突状细胞 (DC) 已被改造为分泌表达 Lamp2 的外泌体,Lamp2 是一种外泌体膜蛋白,与神经元特异性 RVG 肽 (YTIWMPENPRPGTPCDIFTNSRGKRASNG) 融合,随后,RVG 肽引导的外泌体被用于靶向 γ-氨基丁酸 (GABA) 受体,将短干扰 RNA 递送至脑中的神经元、小胶质细胞和少突胶质细胞,诱导靶基因敲除,而其他组织中的非特异性摄取可忽略不计。同样,小鼠未成熟树突状细胞被基因改造以分泌表达与 iRGD 肽 (CRGDR/KGPDC) 融合的 Lamp2 蛋白的外泌体,并显示出对 αv 整合素阳性乳腺癌细胞的高效靶向药物递送,从而抑制肿瘤生长. 经基因工程改造后,表达与 GE11 肽 (YHWYGYTPQNVI)(一种表皮生长因子受体 (EGFR) 结合肽)融合的血小板衍生生长因子受体跨膜结构域的细胞外泌体可选择性地将 let-7a microRNA 递送至乳腺癌组织。此外,经基因工程改造后,表达 pH 敏感的融合 GALA 肽 (WEAALAEALAEALAEHLAEALAEALEALAA) 的肿瘤细胞衍生外泌体可有效地将肿瘤抗原递送至树突状细胞的细胞质中,并通过主要组织相容性复合体 I 类分子促进树突状
细胞的肿瘤抗原呈递
外泌体表面也已使用脂质膜锚、静电相互作用和配体-受体相互作用进行了非遗传修饰。M1巨噬细胞衍生的外泌体用NF-κBp50siRNA和miR-511-3p转染以促进M1极化,并使用磷脂锚用IL4R靶向IL4RPep-1肽(CRKRLDRNC)进行表面修饰;这些构建体通过将IL4R高和M2极化的TAM重新编程为M1样表型来抑制肿瘤进展.通过与转铁蛋白受体相互作用,用转铁蛋白偶联的超顺磁性纳米粒子对血液外泌体进行表面修饰,通过静电相互作用用L17E内体溶解肽(IWLTALKFLGKHAAKHEAKQQLSKL)进行表面修饰,以及通过锚定到脂质膜上用胆固醇偶联的miR-21抑制剂进行表面修饰,可增加肿瘤蓄积和药物输送,并实现有效的内体逃逸.用包含烷基链(C16)、光敏剂(原卟啉IX)和核定位信号肽(PKKKRKV)的嵌合肽(C16K-原卟啉IX-PKKKRKV)进行表面标记的外泌体可以增强光敏剂的核输送,并通过光动力疗法有效抑制肿瘤生长,用于递送EV的肿瘤归巢肽总结于表3中。
肽引导的细胞递送
在过继细胞疗法中,增强细胞毒性T淋巴细胞(CTL)的肿瘤归巢需求很高。因此,嵌合抗原受体(CAR)-T细胞已被用来解决这一限制。CAR-T细胞经过基因改造,可表达由针对肿瘤抗原(如CD19)的抗体、T细胞受体zeta链的细胞质结构域和共刺激结构域组成的嵌合受体。相反,细胞表面的非基因修饰可以降低由细胞基因工程引起的意外风险。使用基于磷脂的膜锚标记有IL4R结合IL4RPep-1肽(CRKRLDRNC)的CTL在携带B16F10黑色素瘤的小鼠中表现出增强的肿瘤归巢和抗肿瘤生长活性.除了CTL之外,在细胞表面与E-选择素靶向肽(CGSDITWDQLWDLMK)结合的间充质干细胞(MSC)通过干细胞上的肽与内皮细胞上的E-选择素之间的相互作用表现出可控的粘附和滚动。此外,使用聚丙烯酰胺接头和生物素/链霉亲和素相互作用对MSC进行非遗传表面修饰,使其与唾液酸LewisX碳水化合物结合,显示出在内皮上强劲滚动,并且在体内更有效地归巢于发炎组织,比未标记的MSC。
肽靶向细胞毒肽
此外,其他细胞毒性或溶解肽,如防御素1(ACYCRIPACIAGERRYGTCIYQGRLWAFCC)、天蚕素B(KWKVFKKIEKMGRNIRNGIVKAGPAIAVLGEAKAL)、爪蟾抗菌肽(GIGKFLHSAKKFGKAFVGEIMSNS)和皮抑菌肽(ALWKEVLKNAGKAALNEINNLVG),可增加膜通透性并促进细胞死亡。乳铁蛋白5衍生物(PAWRKAFRWAWRMLKKAA)也表现出对肿瘤细胞的选择性细胞毒性。eMTD肽(KLNFRQKLLNLISKLFCSGT)由Noxa蛋白的BH3结构域和线粒体靶向结构域组成,通过与电压依赖性阴离子通道2相互作用导致细胞膜损伤和坏死性细胞死亡。此外,由前列腺特异性膜抗原(PSMA)底物与膜破坏性阿米巴变形虫H3肽(GFIATLCTKVLDFGIDKLQLIEDK)连接的肽对表达PSMA的LNCaP前列腺癌细胞具有高度活性,但对PSMA阴性的PC3前列腺癌细胞则无活性。本节中描述的细胞毒性肽总结在表4中。
肽靶向放射性核素:肽受体放射性核素治疗
肽受体放射性核素治疗 (PRRT) 涉及将肿瘤归巢肽与放射性核素或放射性同位素组合作为治疗物质。PRRT 的优点包括其在递送放射性核素方面的选择性,从而减少全身副作用,以及其对晚期、无法手术或转移性肿瘤的有效控制;然而,对健康器官(尤其是骨髓)的放射诱导毒性仍然是一个主要限制。奥曲肽 (Sandostatin®,FCFWKTCT) 是一种生长抑素类似物的 8 聚体肽,在治疗神经内分泌肿瘤患者中起着至关重要的作用. PRRT 与奥曲肽联合治疗旨在选择性照射表达生长抑素受体 2 (SSTR2) 的神经内分泌肿瘤细胞及其周围血管,以抑制治疗期间的血管生成反应。111 In 使用二乙烯三胺五乙酸与奥曲肽连接,而90 Y 和177 Lu (Lutathera®) 则使用四氮杂环十二烷四乙酸作为螯合剂连接。除了 SSTR2,PRRT 还扩展到其他受体,例如胃泌素释放肽 (GRP) 和胆囊收缩素-2 (CCK-2) 受体。99mTc 结合的 RP527 肽( VPLPAGGGTVLTKMYPRGNHWAVGHLM) 是一种 GRP 类似物,已用于治疗人类恶性肿瘤,包括结肠癌和前列腺癌。111 In 标记的微胃泌素 (LEEEEEAYGWMDF) 是一种 CCK-2 受体选择性肽,已用于治疗人类结直肠癌和胰腺肿瘤。
肽靶向小分子药物:肽-药物偶联物
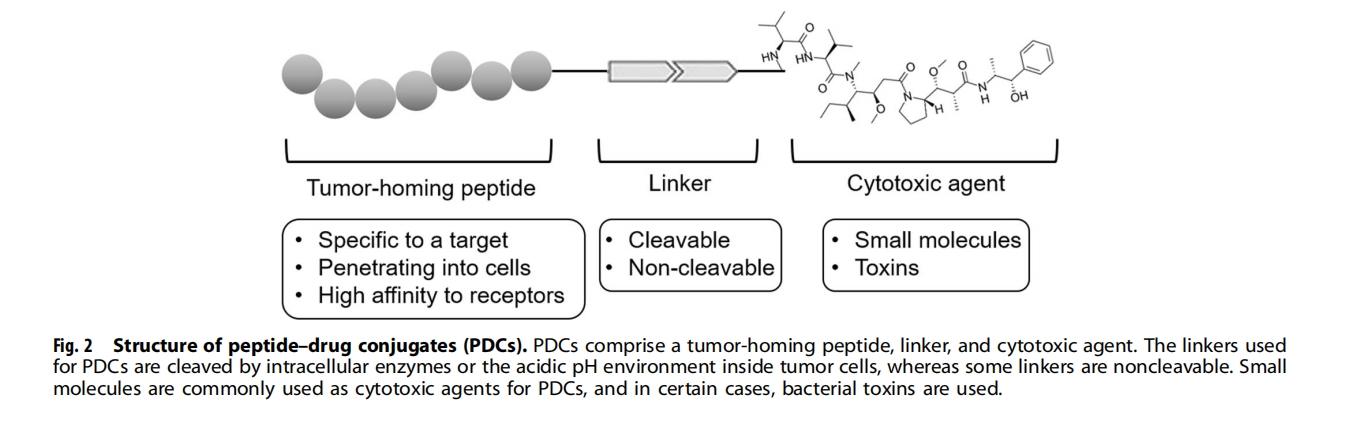
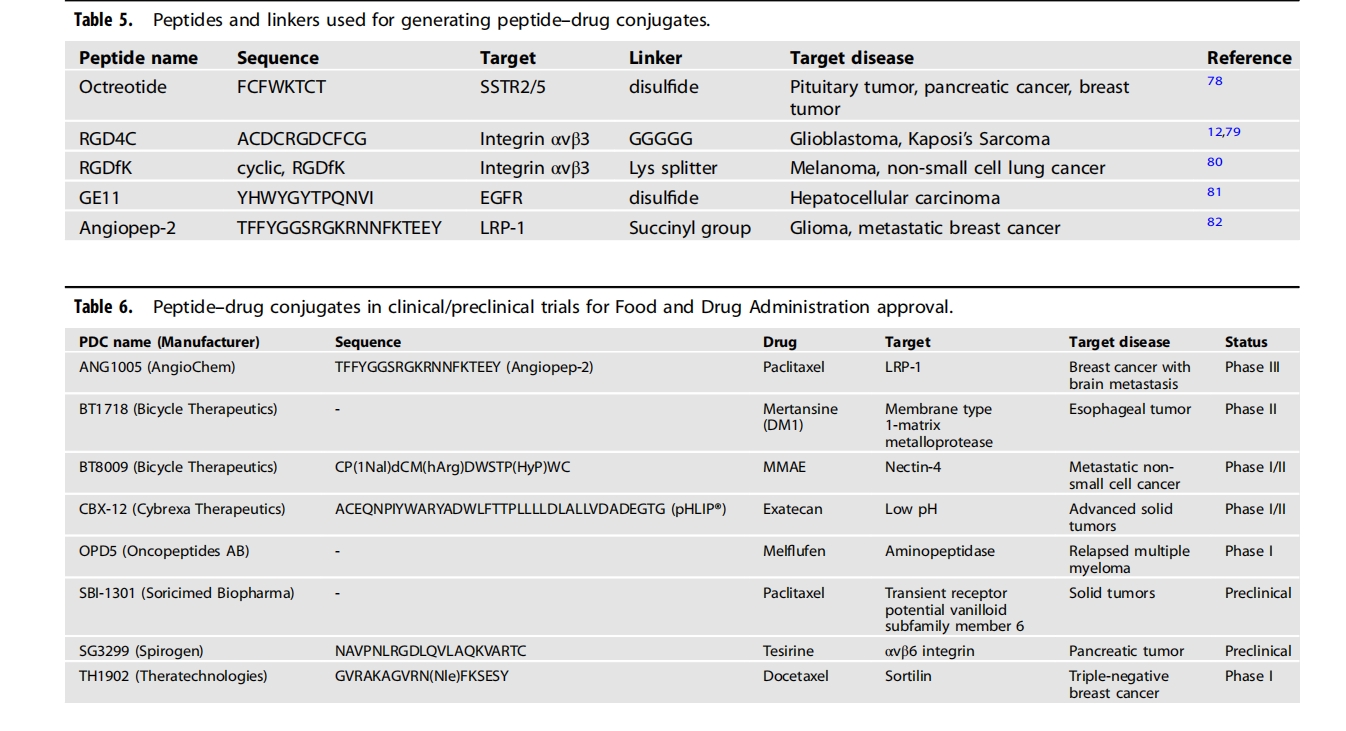
肽抑制剂或细胞表面蛋白拮抗剂
免疫检查点抑制剂
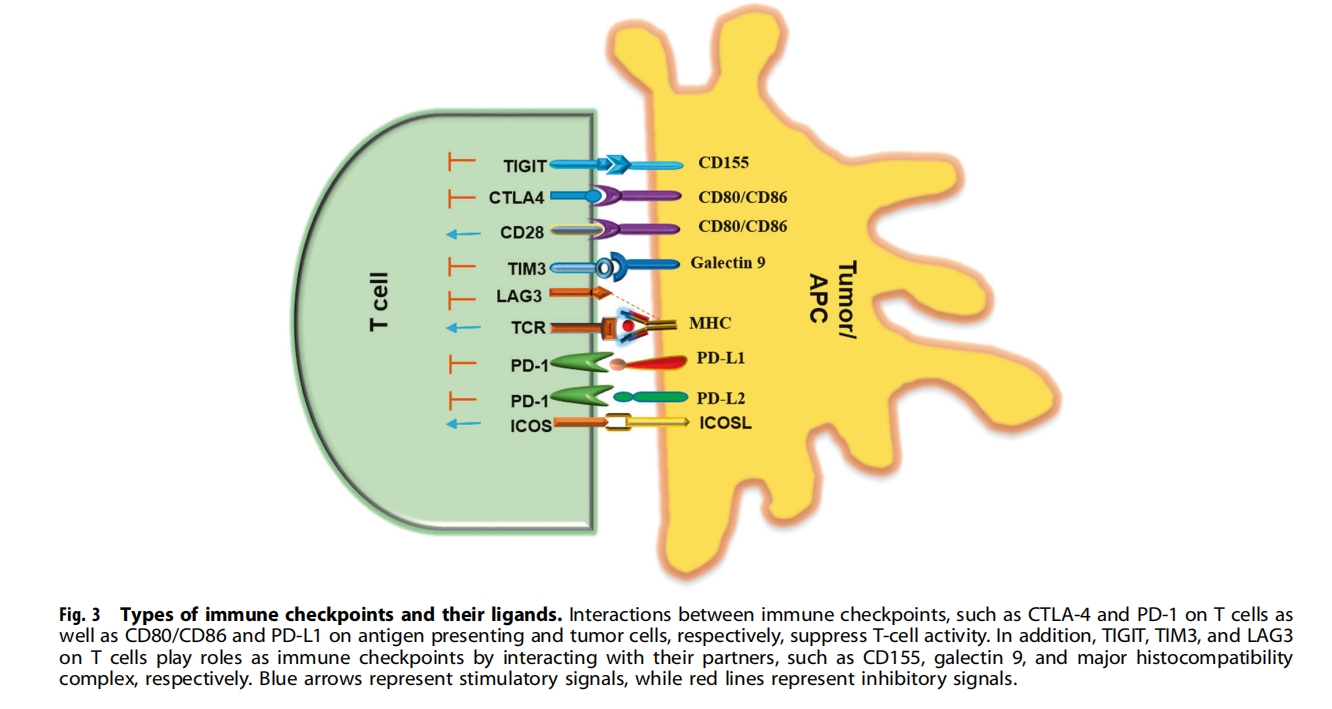
免疫检查点抑制剂 (ICI) 的出现彻底改变了肿瘤治疗领域,并促进了更多免疫检查点阻断剂的开发。ICI 通过阻断 CTL 相关蛋白 4 (CTLA-4)、程序性细胞死亡-1 (PD-1) 和程序性细胞死亡配体-1 (PD-L1) 等免疫检查点与其配体之间的相互作用起作用,从而释放 T 细胞的抑制性制动器并导致免疫反应的强烈激活(图3)。例如,CTLA-4 是一种主要由 T 细胞表达的抑制性受体,可抑制 T 细胞活性并在 T 细胞活化时上调,目前,免疫检查点抑制剂(ICI)被用作各种实体肿瘤的一线治疗手段。在过去的几十年中,抗体药物被广泛应用于免疫检查点抑制剂(ICI)。伊匹单抗是美国FDA批准用于治疗人类癌症的第一个CTLA-4阻断抗体。抗PD-1抗体如派姆单抗和纳武单抗是第二批获批用于治疗人类恶性肿瘤的抗体,随后是抗PD-L1抗体如阿替利珠单抗、度伐单抗和阿维单抗。
受体酪氨酸激酶、激酶相关受体和其他表面蛋白的肽拮抗剂
肿瘤细胞表达丰富的生长因子细胞表面受体。因此,受体阻滞剂或拮抗性抗体和肽可用作抗癌剂。c-Met是一种受体酪氨酸激酶,在许多肿瘤中过表达。它与肝细胞生长因子(HGF)结合,在肿瘤发生和转移中起重要作用。利用计算机模拟,设计了新的肽序列,包括CM7肽(DQIIANN),以高亲和力与c-Met结合。这种新型肽与c-Met表达细胞结合,抑制小鼠中c-Met介导的细胞迁移和侵袭以及肿瘤进展。二硫键约束的HGF结合肽,即HB10(VNWVCFRDVGCDWVL),抑制HGF–c-Met结合,可溶性肝素结合表皮生长因子(sHB-EGF)是抗击癌症肿瘤发生和转移的另一个靶点。利用噬菌体展示技术,已鉴定出两种sHB-EGF结合肽,即DRWVARDPASIF和TVGLPMTYYMHT。它们通过抑制EGFR信号通路来抑制sHB-EGF促进卵巢肿瘤细胞迁移和侵袭的活性。
CD44是一种细胞表面受体,参与细胞粘附到细胞外基质。尽管CD44在正常细胞中表达,但其可变剪接异构体(包括CD44变体6(CD44v6))在肿瘤细胞中上调,通过与c-Met相互作用促进肿瘤细胞迁移和转移。通过结构分析,从人类CD44v6结构域中筛选出v6pep(KEQWFGNRWHEGYR),该结构域与c-Met相互作用并抑制胰腺癌模型中的肿瘤生长和转移。目前v6pep正在进行临床试验,通过筛选噬菌体展示随机肽库,筛选出与CD44v6表达细胞结合的NLN(CNLNTIDTC)和NEW(CNEWQKLSC)肽,这些肽能阻碍HGF介导的c-Met活化,从而抑制CD44v6高的肿瘤细胞迁移和侵袭。
激素受体的肽拮抗剂
有些癌症依赖激素生长,因此,阻断激素的作用可以减缓或控制癌症的生长。这种疗法被称为激素疗法或内分泌疗法。目前,激素疗法适用于某些类型的癌症,例如乳腺癌和前列腺癌。激素疗法在手术或放射疗法之前作为辅助疗法使用,可以缩小肿瘤大小并降低肿瘤复发的风险。
促性腺激素释放激素 (GnRH),也称为促黄体激素释放激素,由下丘脑释放。它与垂体中的 GnRH 受体结合,增加促卵泡激素和促黄体激素的产生,从而刺激卵巢释放雌激素。首次使用 GnRH 类似物时,卵巢激素会激增,这也会引起潮热等多种不良反应。然而,长期使用 GnRH 类似物会减少卵巢激素的产生和分泌,从而下调和降低垂体促性腺细胞中的 GnRH 受体的敏感性,某些癌症中也存在 GnRH 受体,而循环雌激素的减少会减缓激素受体阳性肿瘤(如卵巢癌、前列腺癌和乳腺癌)的生长。由于 GnRH 类似物的半衰期较短,因此在临床环境中使用 GnRH 类似物比较复杂。然而,通过对其氨基酸进行一些修饰,已经成功开发出长效类似物,并用于治疗乳腺癌和前列腺癌。目前在临床上使用的 GnRH 类似物包括戈舍瑞林 (Zoladex®)、(pGlu)HWSY( D -Ser(Bu t )LRP)、亮丙瑞林或亮丙瑞林 (Lupron®、(pGlu)HWSY( D-Leu)LRP) 和曲普瑞林 (Decapeptyl®,(pGlu)HWSY( D -Trp)LRPG)。
生长抑素 (AGCKNFFWKTFTSC) 是一种由遍布胃肠道的旁分泌细胞产生的肽,可与生长抑素受体 (SSTR) 结合。奥曲肽 (FCFWKTCT) 是一种生长抑素类似物,可与 SSTR2 和 SSTR5 结合,并可作为生长激素、胰岛素和胰高血糖素抑制剂。奥曲肽用于治疗由某些肠道肿瘤(如血管活性肠肽分泌肿瘤或转移性类癌)引起的严重腹泻。
细胞内蛋白质-蛋白质相互作用的肽抑制剂
细胞内蛋白质-蛋白质相互作用(PPI)在细胞中发挥着关键作用;例如,它们促进蛋白质复合物的形成以进行信号转导,并促进转录因子与启动子和增强子的结合。因此,人们利用药理学方法来抑制细胞内PPI;相关化合物包括基于分子量<500Da的化学物质的小分子和基于分子量>5000Da的蛋白质的生物制剂。小分子可有效穿过细胞膜,并调节细胞内蛋白质的作用。然而,这些药物无法识别靶位的单个突变,肿瘤细胞容易获得对这些药物的耐药性。此外,由于小分子太小,参与蛋白质相互作用的蛋白质大表面无法被小分子覆盖。相反,生物制剂可以高选择性地结合到更大的蛋白质界面上。然而,它们的细胞渗透性较差。为了解决小分子和生物制剂的局限性,已经开发出分子量在500到5000Da之间的干扰PPI的肽.多肽兼具小分子和生物制剂的优点,包括小分子的细胞通透性和生物制剂的高选择性,可以覆盖大面积的蛋白质。考虑到多肽抑制剂的序列往往来源于参与相互作用的内源性蛋白质,它们中的大多数都充当着天然蛋白质相互作用的竞争对手。
c-Myc是一种参与多种人类恶性肿瘤的转录因子。它通常与其伴侣转录因子形成异二聚体复合物,与DNA结合并调节基因表达。来自Myc螺旋1C末端区域的14个氨基酸肽(RQIKIWFQNRRMKWKK)可阻断c-Myc与其伴侣之间的相互作用。另一个例子是OmoMyc,它包含92个氨基酸,源自Myc的bHLHZip区域,但与Myc有四个氨基酸残基不同。
同源框(HOX)是脊椎动物发育过程中身体分节和模式形成的重要转录因子。HOX基因表达通常在肿瘤中增强,并与肿瘤细胞的血管生成、转移和增殖有关。HOX的常见辅助因子是前B细胞白血病同源框(PBX)。HXR9肽(WYPWMKKHHRRRRRRRRR)干扰几种小鼠肿瘤模型中HOX和PBX之间的相互作用。
KRAS是一种致癌蛋白,通常在多种肿瘤中被激活,包括肺癌和胰腺癌,由于缺乏经典的药物结合位点,因此被认为是一种不可治疗的靶点。KRpep-2d肽(Ac-RRRR-cyclo(CPLYISYDPVC)-NH2)是一种含有>12个氨基酸的环状肽,大环肽及其衍生物可与KRAS结合并抑制KRAS下游信号传导和细胞增殖。
展望:改善肽的药代动力学特性和生物活性