
摘要:利钠肽受体(NPR)家族包括利钠肽受体A(NPRA)、利钠肽受体B(NPRB)及利钠肽受体C(NPRC)。除NPRC、NPRA和NPRB属于鸟苷酸环化酶受体家族的成员。NPR家族广泛分布于人体中,具有多种生理功能。NPR家族在许多恶性肿瘤中表达,在肿瘤的发生发展中起着重要调控作用。NPR家族在恶性肿瘤中的表达和功能已在许多动物模型和研究中得到证实,但NPR家族表达的机制尚不清楚,对其机制的研究尚未应用于肿瘤的临床治疗。该文综述了NPR家族在恶性肿瘤发生、发展中的作用及其潜在的临床价值。
利钠肽受体(natriuretic peptide receptor, NPR)以其广泛的生理功能而闻名,除了稳定心血管系统外,其还与免疫、炎症及癌症有关[1-3]。目前为止,已发现了心房钠尿肽(atrial natriuretic peptide, ANP)、脑利钠肽(brain natriuretic peptide, BNP)、C型利钠肽(C-type natriuretic peptide, CNP)等8种利钠肽激素[4]。ANP主要产生于心房,BNP最初是在猪脑提取物中发现的,存在于人脑,但更多存在于心室。近期研究表明,血清BNP与新生儿持续性肺动脉高压及老年肺部感染的病情程度具有相关性[5-6]。CNP是家族的第3个成员,主要分布于中枢神经系统、垂体前叶、肾脏、血管内皮细胞[7]。这些肽有3个膜受体,即利钠肽受体A(natriuretic peptide receptor A, NPRA)、利钠肽受体B(natriuretic peptide receptor B, NPRB)、利钠肽受体C(natriuretic peptide receptor C, NPRC)。NPR家族主要通过受体结合调控机体各种代谢和生理功能。NPRA和NPRB从其配体激素中获取信息并激活下游信号通路。NPRC主要是一种清除受体,主要参与这些激素的清除或降解。本文就NPR家族及其受体结合在恶性肿瘤发生、发展中的作用及潜在的临床价值进行综述。
1 NPR家族的结构和功能
1.1 NPRA
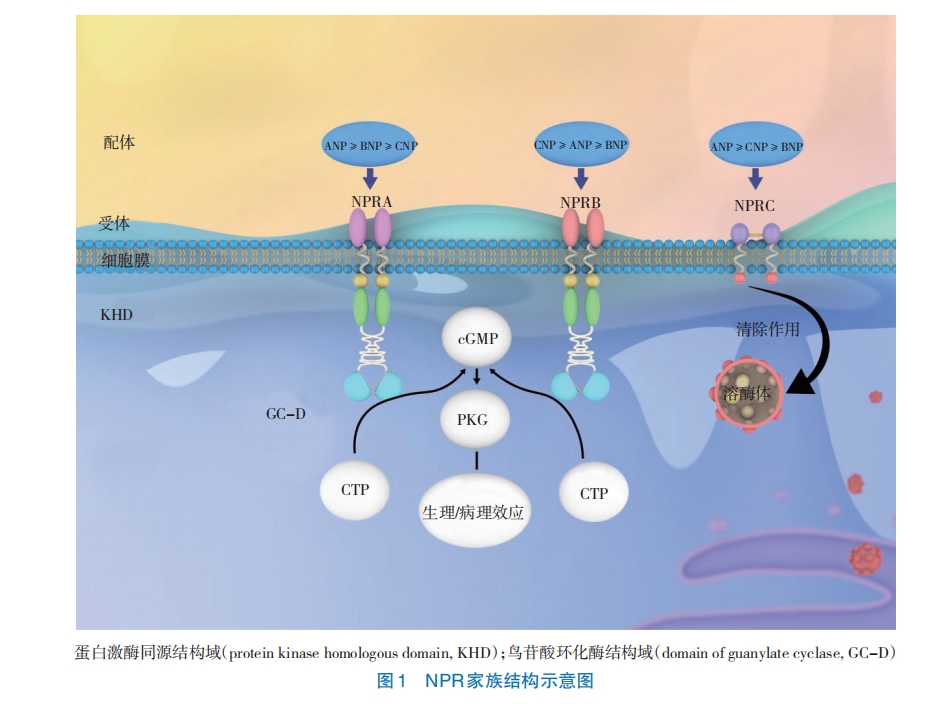
NPRA也被称为NPR1或GC-A。人类NPRA基因长度约16 kb,位于1q21~22上,编码1 061个氨基酸肽,包括21个外显子和21个内含子[8]。该基因首先被3个不同的组在3个不同的模型中克隆出来,如小鼠、大鼠和猪[9]。NPRA基因启动子中含有SP1、SP3、cGMP反应元件结合蛋白(CREBP)和维生素D受体(VDR),这些转录因子调控NPRA的表达。NPRA是一种135 kDa的单跨膜肽同源二聚体,包含至少4个不同的结构域,包括450个氨基酸胞外配体结合结构域、21个残基疏水跨膜结构域和566或568个氨基酸胞内结构域。后者进一步划分为1个250个氨基酸的蛋白激酶同源结构域、1个41个氨基酸的两性螺旋铰链区和1个250个氨基酸的鸟苷酸环化酶c端催化结构域,呈正二聚体结构[10]。NPRA是鸟苷酸环化酶细胞表面受体家族的成员[11],NPRA被生理浓度的ANP和BNP所激活[12]。NPRA的激活顺序为ANP≥BNP>CNP[13]。NPRA在心脏、肾脏、肺、肝脏、脂肪细胞、各种器官及一些癌症中都有表达[1,13],其对心血管稳定、炎症及癌症起关键调节作用[14-15],参与了各种生理和病理反应。
1.2 NPRB
NPRB也被称为NPR2或GC-B。人类NPRB基因长度约为16.5 kb,位于9p21~12上,包含22个外显子[16]。1989年,SCHULZ与他的团队首次克隆了大鼠的NPRB基因[17]。NPRB的拓扑结构与NPRA相似,其属于鸟苷酸环化酶的细胞表面受体家族[13],NPRB被CNP特异性激活[12],NPRB激活的顺序为CNP>ANP≥BNP[13]。NPRB在软骨和骨形态发生中起关键作用,NPRB基因纯合子突变的缺失可导致短肢侏儒症,也称为肢端发育不良[18]。其在维持心率和窦房结功能方面也起到重要作用[19]。NPRB在多种器官中表达,包括心脏、大脑、子宫、卵巢、肾、肺、肝脏及脂肪细胞,且在一些癌症中也有表达[17,20-21]。NPRB的广泛表达表明其在许多生理、病理过程中发挥作用。
1.3 NPRC
NPRC也被称为NPR3。人类NPRC基因长度约为65 kb,位于5p14~p13上,包含8个外显子和7个内含子[22]。小鼠NPRC基因位于15号染色体上,由YANAKA等首次在小鼠中克隆[23]。NPRC的胞外结构域与NPRA和NPRB约30%相同,这与环化酶连接的受体不同,其仅仅含37个胞内氨基酸,没有鸟苷酸环化酶活性[24]。与NPRA和NPRB不同,NPRC是一种由二硫键连接的同型二聚体[25]。NPRC启动子具有SP1、AP-2、YY-1、E2F和CREB转录因子的结合位点[23]。MAACK等[26]提出该受体在生物学上是沉默的,并作为利钠肽的特异性清除结合位点,这种受体被称为清除受体。但近年来研究[27]发现,NPRC对维持心血管系统稳定有着关键作用。BNP和CNP可以与NPRC结合并进行清除和降解。NPRC对利钠肽激素的亲和力顺序为ANP>CNP>BNP[13]。NPRC的表达受多种生理因素的影响。据报道,NPRC在高血压、糖尿病和肥胖患者中的表达非常高,缺乏体力活动会增加NPRC的表达,而定期的体育锻炼或活动会抑制NPRC的表达[28]。NPRC也广泛表达于心脏、肺、肾上腺、大脑皮质、小脑、肝脏、脂肪细胞及一些癌症中[28]。
NPRA和NPRB属于鸟苷酸环化酶受体,而NPRC属于清除受体,利钠肽通过与3种受体NPRA、NPRB及NPRC的胞外结构域结合而起作用,其作用机制也有所不同(见图1)。
2 NPR家族在恶性肿瘤中的作用
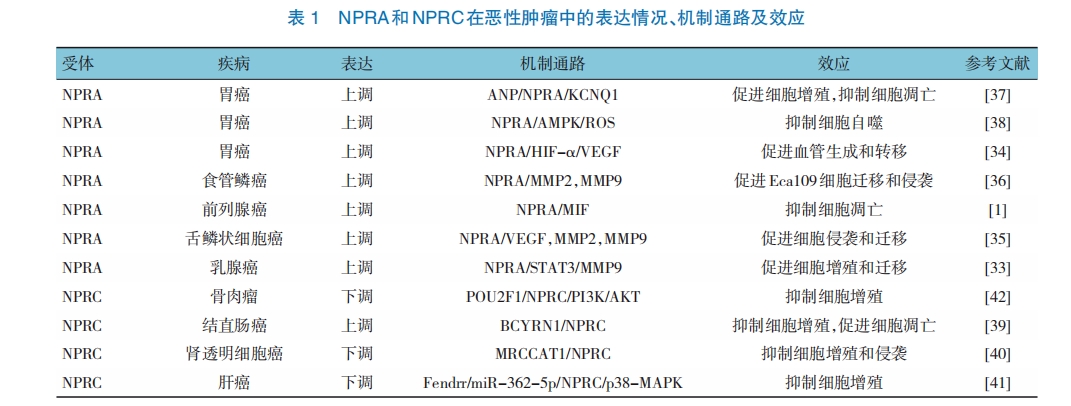
NPRA和NPRC在恶性肿瘤中的作用已经有很多的报道,但关于NPRB的报道较少。本文主要讨论NPRA和NPRC在癌症发生发展中的作用(见表1)。
2.1 NPRA
NPRA在癌症中的研究可以追溯到1993年。OHSAKI等[29]首次在人小细胞肺癌细胞系和HeLa细胞中发现了功能性NPRA。VESELY等[30]进一步研究了利钠肽受体与癌细胞增殖的关系。研究表明,NPRA在多种人类癌细胞中表达,其中包括乳腺癌细胞[30]、前列腺癌细胞等[1]。NPRA由于其广泛的生理功能,在许多肿瘤的发生、发展中起着重要的作用。KONG等[31]首先研究了NPRA在肿瘤发生中的直接作用。动物模型结果显示,缺乏NPRA可以保护C57BL/6小鼠免受肺癌、皮肤癌和卵巢癌的影响。在疾病模型中,下调NPRA可以抑制肿瘤的生长和转移,提示NPRA可能成为一种新的抗癌治疗靶点;其研究还表明,NPRA在肿瘤细胞(A549、B16等)中过表达。NPRA可以通过调节干细胞的募集和血管生成来导致肿瘤的进展[32]。在乳腺癌[33]、胃癌[34]、舌鳞状细胞癌[35]和食管癌[36]中,NPRA可通过不同的途径(MMP2、MMP9、HIF-1α等)来提高VEGF水平,促进血管生成,从而促进肿瘤的侵袭和转移。在前列腺癌[1]和胃癌[37],NPRA可通过抑制肿瘤细胞凋亡来促进肿瘤进展。有研究表明,在胃癌中[38],抑制NPRA的表达可以通过JNK和p38通路,促进胃癌细胞周期阻滞、细胞死亡和凋亡。
2.2 NPRC
NPRC在癌症中的研究近年来才被提及,但NPRC作为一个新兴的靶点,在癌症发生、发展的机制研究中具有巨大的潜力。NPRC作为一种清除受体,一般起着抑癌的作用。在结直肠癌[39],肾透明细胞癌[40]和肝癌[41],NPRC可被上游长链非编码RNA调控。过表达NPRC可抑制细胞增殖,促进细胞凋亡,从而发挥抗癌作用。在骨肉瘤中[42],NPRC可通过阻断PI3K/Akt通路来抑制骨肉瘤细胞的生长。
3 NPR家族在恶性肿瘤诊疗中的临床价值
3.1 NPR家族在恶性肿瘤诊断中的价值
NPR家族在许多恶性肿瘤组织中表达,与肿瘤的诊断、分期及预后密切相关。在食管鳞状细胞癌和胃癌中,NPRA的表达与淋巴结转移和(TNM)分期相关[36,38],对预测肿瘤发展有重要作用;NPRA与舌鳞状细胞癌中VEGF的表达及肿瘤细胞的侵袭和转移有关[35],这可能是一个预后因素;NPRA的表达也与前列腺癌的临床分期呈正相关[1]。NPRB基因在前列腺癌中的表达与肿瘤体积和恶性程度有关,NPRB可成为鉴别良、恶性组织的一种手段[43]。在前列腺癌模型中,NPRC可成为前列腺癌早期诊断的靶点[44]。
3.2 NPRA在恶性肿瘤治疗中的价值
NPRA已被报道为癌症促进靶点。许多实验表明,下调NPRA的表达可以通过不同的途径诱导肿瘤细胞凋亡,抑制细胞增殖和侵袭[33,35-36]。其还可以通过下调VEGF、CXC和CXCR4抑制血管生成,从而抑制肿瘤细胞的迁移[32]。
Isatin是一种天然的杂环苷衍生物,可下调NPRA的表达,抑制气道炎症[45]。Isatin对癌症的治疗很有前景,异构素普遍存在于人体中,其不仅是鸟苷酸环化酶的抑制剂,也是许多其他酶和受体的抑制剂,例如组蛋白去乙酰化酶、碳酸酐酶[46]。异素杂交剂在许多恶性肿瘤中发挥抗癌作用,但其鸟苷酸环化酶抑制剂途径的抗癌机制尚未阐明[47]。此外,Isatin hybrids具有良好的抗癌活性,例如,Semoxind和舒尼替尼可用于治疗许多癌症[47-48]。
分子印迹聚合物纳米颗粒(MIPNPS)对ANP具有亲和力和选择性,可降低癌症中ANP的水平,抑制ANP/NPRA信号通路[49]。编码NP73-102的质粒[前心房利钠肽的NH(2)末端肽]的异位表达下调了NPRA的表达,抑制了A549细胞的肺转移和BALB/c小鼠的肿瘤发生,过表达NP73-102可显著诱导黑色素瘤细胞(B16)的凋亡[31]。血管紧张素Ⅱ可抑制NPR1基因的转录,下调心脏中NPRA的表达[50]。亲环素A是免疫抑制剂环孢素A的受体,可与NPRA结合,催化Pro 822、902或958的顺反异构化,从而使NPRA失活,已成为癌症治疗的靶点[51]。微生物多糖HS-142-1是一种利钠肽拮抗剂,可抑制NPRA和NPRB的激活和结合,但对NPRC无影响[52]。
3.3 NPRC在恶性肿瘤治疗中的价值
在神经母细胞瘤细胞系中,NPRC类似物发挥抗增殖作用,而NPRA和NPRB促进神经母细胞瘤的增殖[53]。一般来说,NPRA和NPRB具有促癌作用,而NPRC具有抑癌作用。NPRC作为一种清除受体,可与ANP、BNP和CNP结合,并进行清除和降解。NPRC是否可以抑制NPRA信号通路还未有研究证明,如果存在大量的NPRC,其是否可以抑制利钠肽激素与NPRA和NPRB的结合,NPRC作为这些信号通路的起点,其作为抑癌靶点的作用机制还需要更多的研究去证明。
4 结论与展望
本文就NPR家族在许多恶性肿瘤的发生、发展中起着重要作用进行综述。许多动物模实验已经证明,NPRA家族在许多恶性肿瘤的发生、发展中起重要作用。然而,由于缺乏合适的NPRA抗体,NPRA在人体组织中表达的研究有限。目前,NPR家族主要有3个应用领域。①NPRA在多种癌症中的促癌作用,可使其抑制作用的研究尤为重要。②NPR家族在肿瘤中的表达与肿瘤的体积、分期、转移和分化密切相关,可作为诊断和预后的参考指标。③NPRC作为一种清除受体,通常发挥抗癌作用,其可以与NPRA竞争配体,抑制其信号通路。NPR家族作为一种抗癌靶点,尚未应用于临床,目前仍处于研究阶段。然而,由于NPR家族在人体中的广泛作用,对其深入研究尤为重要,不仅为癌症的诊断和治疗提供新的思路,而且在利钠肽激素的研究中也是重大突破。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。