
摘要 海洋是地球上资源最为丰富的领域. 海洋生物生存环境复杂, 使它们形成了具有特殊结构的活性物质; 加之科技的进步, 人们也日益关注如何从海洋生物中寻获新的活性物质, 这使得海洋生物活性肽受到广泛关注. 生物活性肽具有多种活性, 经研究表明, 该类物质具有抗氧化、抗高血压、抗病毒、抗肿瘤等活性; 且具有低毒、高度靶向专一性和生物活性强等优点. 目前, 从海兔、芋螺、海鞘、海绵、海洋真菌、软体动物中提取出的生物活性肽或类似物, 部分已上市或已进入临床试验阶段. 针对这些海洋生物活性肽的研究现状, 就其来源、合成方法、化学结构特点、活性、作用机制以及临床有效性及安全性等方面进行综述, 并展望了该领域今后的发展方向.
海洋面积约占全球总面积的 70%, 占据 90%的生物圈, 海洋中生物种类达到全球生物多样性的半数, 因此海洋是一个丰富的天然活性化合物库[1]. 海洋具有特殊的物理和化学条件[2], 如高盐、弱碱, 深海区甚至具有黑暗、寒冷、高压等复杂特点; 加之物种之间强烈的生存竞争, 使得海洋生物常采取化学手段进行自我保护[3]; 逐渐形成了不同于陆地生物的活性物质, 如活性肽、多元不饱和脂肪酸、固醇类、酶、多糖、抗氧化剂和色素等[4]. 随着培养技术、分子生物学技术的发展[5], 从海洋生物中获取新的活性化合物不断取得新进展, 尤其是内源性多肽活性作用的发现以及天然生物活性肽的靶向作用机制的研究, 使得肽类成为海洋活性物质的首要候选资源[6].
生物活性肽由 3~20 个氨基酸残基构成, 具有多种生物活性[7], 如抗氧化性、抗高血压、抗 HIV 病毒、抗增殖、抗凝血、钙离子螯合、抗肥胖、抗糖尿病等活性, 其活性由分子大小、氨基酸种类和次序决定[8]. 因其具有低毒、高效、高选择性等优点而被应用于食品与制药领域[9]. 目前, 国内外对海洋生物活性肽进行了大量研究. 海洋生物活性肽来源主要有海绵、海鞘、海葵、芋螺、海藻、鱼类、软体动物、甲壳类动物, 海洋细菌和真菌等[6,10]. 现在许多研究人员从海洋生物中提取了许多活性较高的天然活性肽, 如 Lee 等[11]从大马哈鱼中通过胰蛋白酶水解分离得到具有抑制血管紧张素 I 转化酶的活性肽 , 其氨基酸序列为 Gly-Leu-Pro-Leu-AsnLeu-Pro, 后又以天然的活性肽为基础合成了活性更高的三肽 Gly-Leu-Pro, IC50值为 9.08 µmol•L-1; Zhan 等[12]从海绵中提取出五种新型环形肽 reniochalistatins A~E, 其中 reniochalistatin E 对 RPMI-8226 细胞和 MGC-803细胞有细胞毒性作用, IC50值分别为 4.9 和 9.7 µmol•L-1. 由此可以看出, 一些海洋生物活性肽有一定的成药潜力. 尤其是近年来, 海洋探测技术的发展, 使得海洋药物的开发得到了巨大进展. 目前, 从海兔、芋螺、海鞘、海绵、海洋真菌、软体动物中提取的具有活性的天然肽, 或以天然肽为母体合成的衍生物已进入全球的药物市场及临床试验阶段[13]. 本文将综述已上市或处于临床试验阶段的海洋生物活性肽, 并按照活性化合物来源分类, 介绍活性化合物化学结构特点、合成、活性、作用机制以及耐受性和毒副作用等, 希望对从事此类研究的科研人员提供一定的参考依据.
1 海兔毒素
Pettit 等[14]于 1972 年开始展开了对印度洋中海兔的提取物所含抗肿瘤活性成分的研究, 他们发现其提取物可以治疗小鼠P388淋巴细胞白血病, 延长小鼠寿命. 随后他们又分离得到一系列具有抑制细胞增殖、抗肿瘤活性的肽类化合物, 命名为 Dolastatin, 其中活性最强的是Dolastatin 10 和 Dolastatin 15. 此后, 许多研究者对Dolastatin 10 和 Dolastatin 15 展开了进一步研究, 并合成了一系列衍生物. 其中, 以 auristatin 系列、Tasidotin和 LU-103793 活性最好, 于 1995 年进入临床试验.
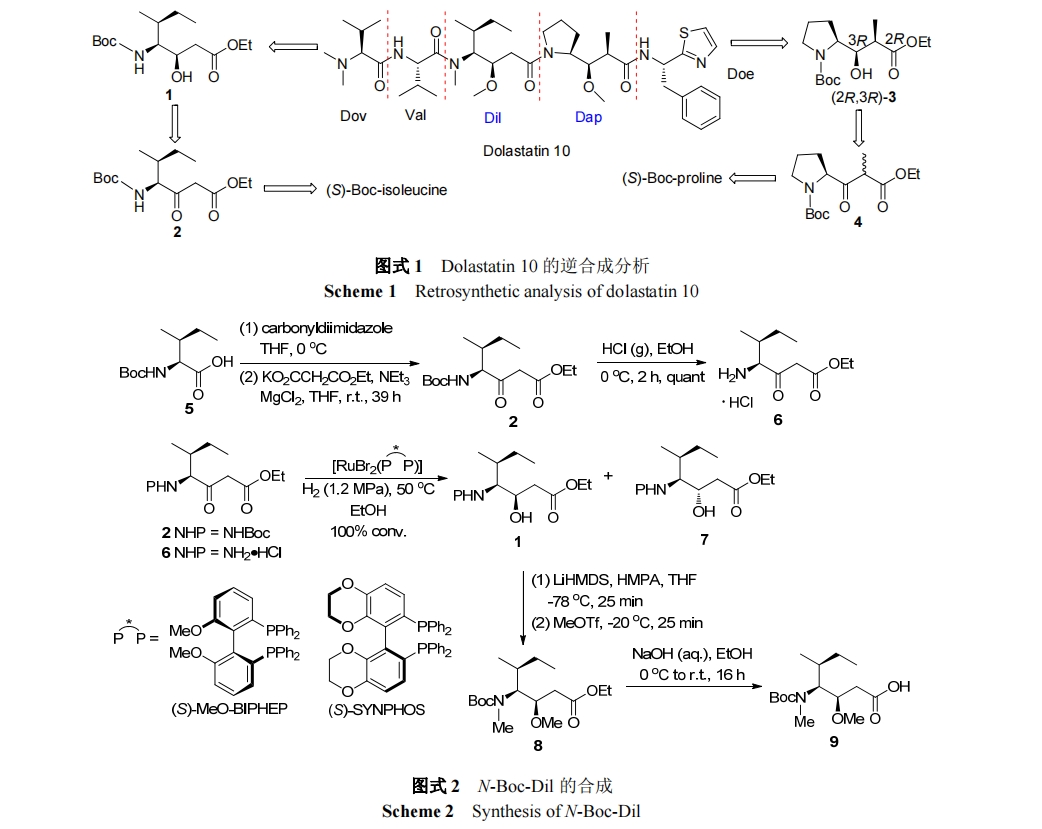
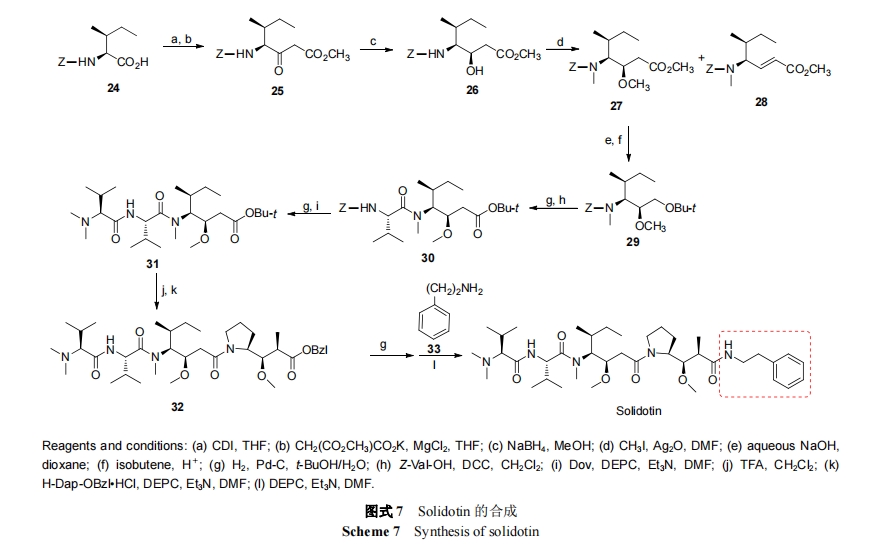
Dolastatin 10 是一种线性五肽, 包含五个子单元, dolavaline (Dov), valine (Val), dolaisoleuine (Dil), dolaproine (Dap)和 dolaphemine (Doe)[15]. Mordant 等[16]通过逆合成分析发现Dap和Dil是合成的两个关键片段(Scheme 1), 因此他们先合成了 N-Boc-Dil (9) (Scheme 2)和N-Boc- (2R,3R)-Dap (11) (Scheme 3). 再以 9 和 11 为原料合成Dolastatin 10 (Scheme 4), 在合成过程中焦炭酸二乙酯(DEPC)和三氟乙酸(TFC)主要用于偶联和脱保护. Dolastatin 10作用机制主要是通过与β微管蛋白结合, 使细胞分裂停滞, 最终导致细胞死亡. 在某些临床前试验中, Dolastatin 10 对一些实体瘤表现出了较好活性, 如对四种非小细胞肺癌 (NCI-H69, NCI-H82, NCI-H446, NCI-H510) IC50值范围为 0.032~0.184 nmol•L-1[17].
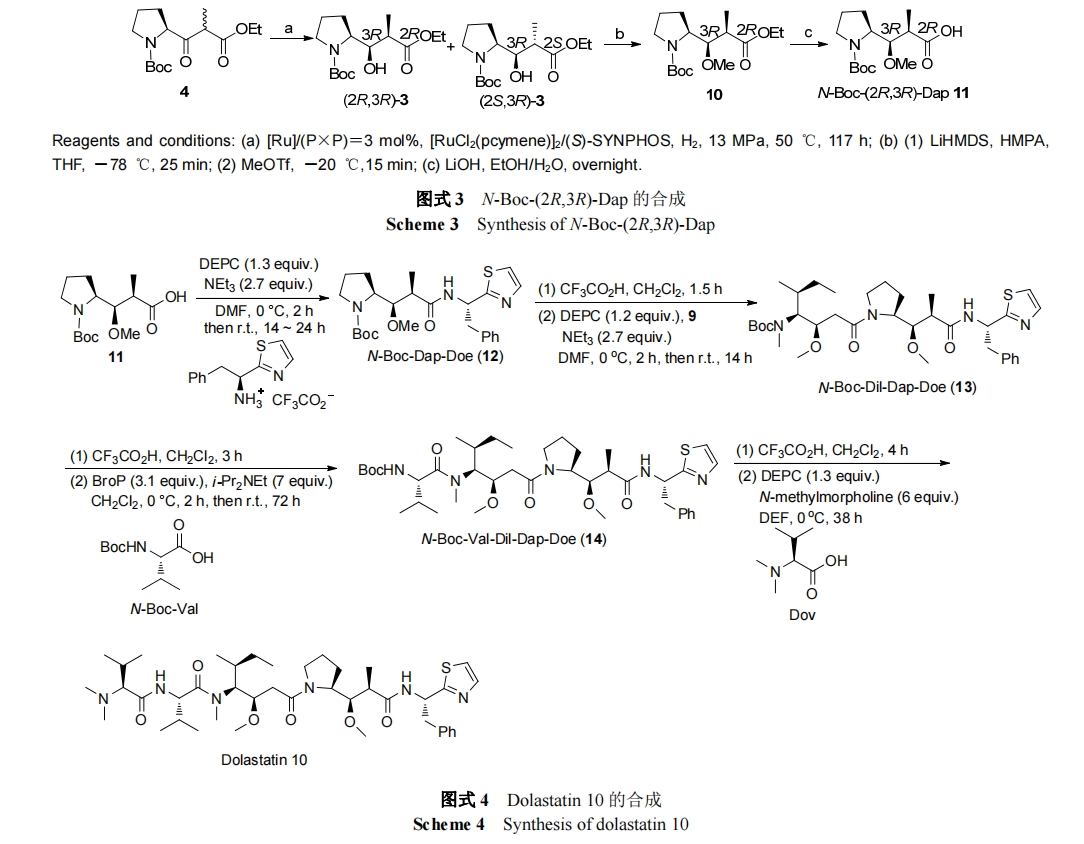
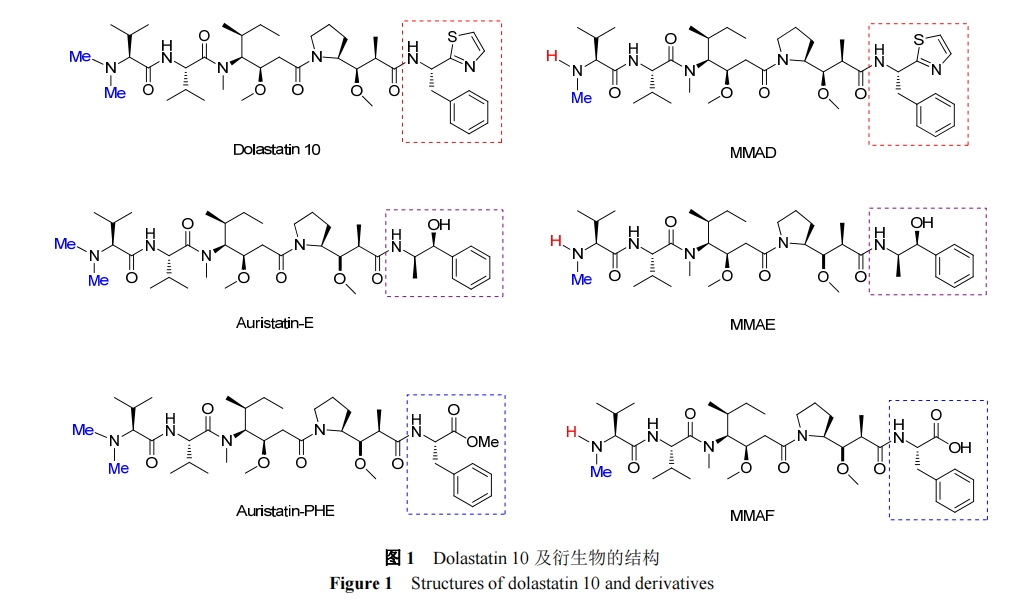
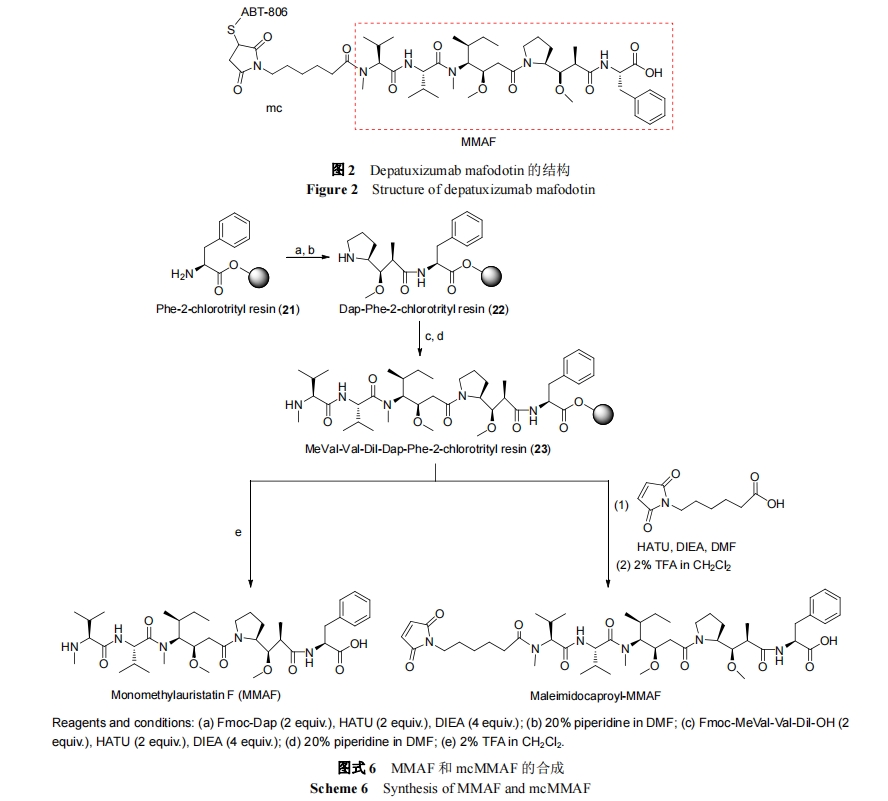
抗体-药物偶合物(ADC)是具有高活性、高靶向性的新兴抗癌治疗试剂. 它由抗体、连接体、细胞毒性试剂三部分构成. 细胞毒性试剂的效力、靶向的选择和连接体的稳定性等是影响新型 ADC 的因素. 目前, 连接体技术的发展和新型高效的细胞毒性试剂的出现都极大地促进了 ADC 的发展[21]. 在海洋生物活性肽中, 以Dolastatin 10 为母体化合物合成的 auristatins 系列被广泛应用于 ADC[22]. 现约有 45 种 Auristatins 类的 ADC 处于临床研究阶段[23]. 下面将以泊仁妥西凡多汀, Depatuxizumab mafodotin, Glembatumumab Vedotin, Polatuzumabvedotin 及 AGS-67E 为例介绍 auristatins 类ADC.
伯仁妥西凡多汀(Brentuximab vedotin, SGN-35)由日本武田(Takeda)制药公司及美国西雅图遗传学公司(Seattle Genetics)联合研发, 于 2011 年由美国食品药品管理局 (FDA) 批准上市 , 用于治疗霍奇金淋巴瘤(Hodgkin’s lymphoma, HL)和系统性间变性大细胞淋巴瘤(Anaplastic large cell lymphoma, ALCL)[24].
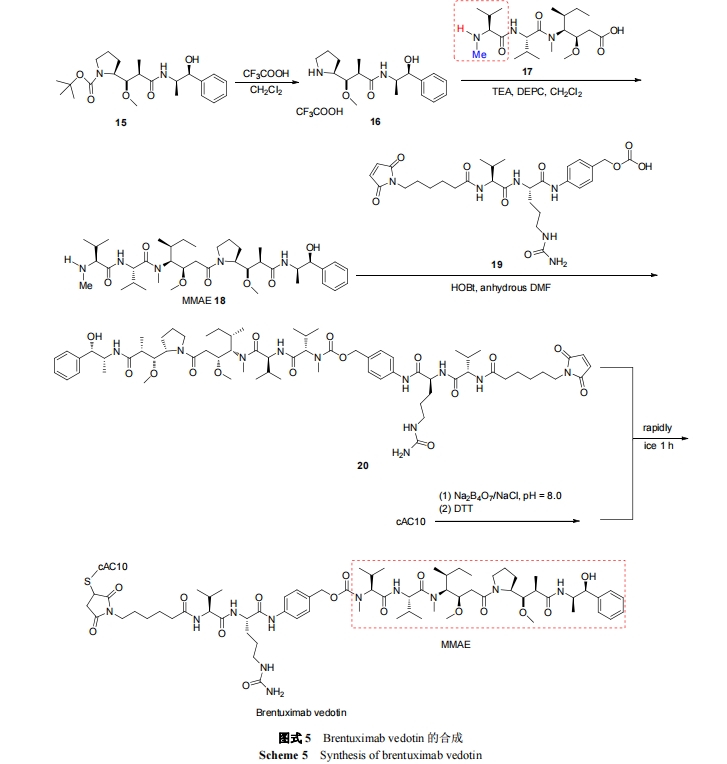
伯仁妥西凡多汀可与表达 CD30 的肿瘤细胞高度特异性结合, 它由 cAC10 (CD30 抗体)、连接体和细胞毒试剂monomethyl auristatin E (MMAE)三部分组成. 伯仁妥西凡多汀所使用的连接体为缬氨酸-瓜氨酸(vc), 为便于连接体(vc)和毒性试剂水解且使水解部位和细胞毒试剂的活性部位远离, 故用对氨基苄氧羰基(PABC)作为间隔体键合于 MMAE 与连接体之间 , 形 成vc-PABC-MMAE 结构, 再将其通过马来酰亚胺己酰基(mc)与单克隆抗体中的半胱氨酸连接[25]. CD30 是膜上的糖蛋白, 属于肿瘤坏死因子(TNF)受体家族成员, 它在 HL, ALCL 等多种淋巴瘤表面高度表达. cAC10 本身具有对抗 CD30 的活性, 但在临床 II 期时活性消失, 为增强其活性, 合成了伯仁妥西凡多汀. 细胞毒试剂MMAE 是从印度洋无壳软体动物截尾海兔 Dolabella auricularia分离得到Dolastatin 10的合成衍生物. 在生理条件下, MMAE 具有高效、溶解度高、稳定性好等优点. MMAE 的药理作用与 Dolastatin 10 相似, 通过抑制微管蛋白的聚合, 使表达 CD30 的淋巴瘤细胞在 G2-M 阶段增长停滞, 从而使细胞凋亡. 泊仁妥西凡多汀作用机制是通过 cAC10 靶向识别肿瘤细胞上的 CD30, 与 CD30结合, 然后经细胞网格蛋白的调节, 泊仁妥西凡多汀被內吞进入细胞, 在溶酶体中被蛋白酶水解释放 MMAE, MMAE 在细胞内发挥作用 , 杀死细胞 [26]. Mc-vc-PBAC-MMAE 的合成是通过用 N-甲基缬氨酸类化合物 15 代替 N,N-二甲基缬氨酸类化合物来保护auristatain E, 从而形成 MMAE (18). 用 mc-vc-PBAC (19)进一步修饰化合物 18 得到 mc-vc-PBAC-MMAE (20), 最后使还原的cAC10与化合物20结合即可得到伯仁妥西凡多汀(Scheme 5)[27].
为评价 Brentuxmab vedotin 对自身干细胞移植后或两次既往化疗后疾病有进展不能接受移植的 HL 患者和1 次既往化疗后疾病进展 ALCL 患者的治疗效果, 在北美和欧洲的 78 个地点进行了 III 期临床试验. 试验选择了 329 例符合要求的患者随机分配至 Brentuxmab vedotin 组(n=165和安慰剂组(n=164). 结果显示, 与安慰剂组相比, Brentuxmab vedotin 组的患者无进展生存期得到显著改善([HR] 0.57, 95% CI 0.40~0.81; p=0.0013), Brentuxmab vedotin 组患者, 中位无进展生存期平均约为 42.9 个月(95% CI 30.4~42.9), 安慰剂组的患者, 中位无进展生存期平均约为 24.1 个月(11.5~not estimabl). III 期临床安全性试验统计 167 名 Brentuximab vedotin 组患者和 160 名安慰剂组患者的不良反应(Adversedrug reaction, ADR)发生情况, 两组 ADR 发生率分别为 98%和 89%, 严重不良反应率(≥Grade 3)分别为 56%和 32%. 在 Brentuximab vedotin 组中, 最常见的不良反应是外周感觉神经病变, 发生率为 30.5%; 因外周神经病变导致 51 人停止使用 Brentuximab vedotin 治疗. 其它常见的 ADR 有中性粒细胞减少、上呼吸道感染、疲劳、外周运动神经病、恶心、咳嗽、腹泻、发热、呕吐等[28].
为评估 ABT-414 与替莫唑胺联合治疗复发性或难以切除恶性胶质瘤的安全性和有效性, 对 12 位受试者开展了 I 期临床试验. 9 位患者治疗效果较好, 其中 1 位完全缓解, 2 位部分缓解. 发现一般 ADR (≥3 名患者)包括视力模糊(n=5), 角膜沉积(n=4)、眼部异物感、恶心、发热和头痛(每项 n=3). 严重 ADR 包括淋巴球减少症、角膜沉积、皮肤感染和血液胆固醇升高(每项 n=1). 在一定剂量范围内(0.5~1.0 mg/kg)药代动力学(PK)参数与剂量成比例, 半衰期为 7~8 d. 其结果表明ABT-414 对于治疗复发性或难以切除恶性胶质瘤值得进一步的研究[33].
Glembatumumab Vedotin 是由 CuraGen 公司研发的ADC, 目前处于治疗转移性乳腺癌、黑色素瘤、骨肉瘤的临床 II 期试验以及治疗鳞状细胞癌的临床 I/II 期试验阶段. 2010 年 FDA 将 Glembatumumab Vedotin 加入快速审批名单, 以治疗晚期、顽固性、高表达非转移性黑色素瘤糖蛋白 B (GPNMB)乳腺癌.
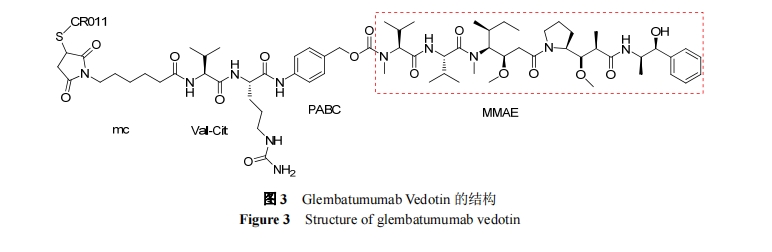
为评估 Glembatumumab Vedotin 治疗晚期、顽固性、高表达 GPNMB 乳腺癌的安全性和有效性, 对 124 名患者进行了 II 期临床试验. 将所有受试者以 2∶1 的比例随机分成两组, 一组为 Glembatumumab Vedotin 组(n=83), 另一组由研究者选择(IC)药物(艾日布林、卡培他滨、长春瑞滨、吉西他滨、紫杉醇、紫衫特尔、盐酸多柔比星、多柔比星脂质体、紫杉醇与白蛋白结合型混悬液), 单药化疗(n=41). 其结果表明, 与 IC 药物相比, Glembatumumab Vedotin 表现出较好的耐受性, 较低的血液毒性; 出现的一般 ADR 有皮疹、瘙痒、神经病和脱发. 在初级终点, Glembatumumab Vedotin 组与 IC 化疗组相比, 客观缓解率没有显著性差异. 但在次级终点, Glembatumumab Vedotin 组中高表达 GPNMB (≥25%的肿瘤细胞)患者的客观缓解率(ORR)为 30%, 明显高于IC 化疗组的 9%. 在此次试验中, 还测得了患有三阴性乳腺癌患者的 ORR, Glembatumumab Vedotin 组为 18%, IC 化疗组为 0%. 对于过度表达 GPNMB 的三阴性乳腺癌患者, Glembatumumab Vedotin 组 ORR 为 40%, IC 化疗组为 0%. 此结果表明, Glembatumumab Vedotin 对于治疗过度表达GPNMB的乳腺癌患者, 具有较好的疗效, 尤其对于三阴性乳腺癌展现出较高的活性[35].
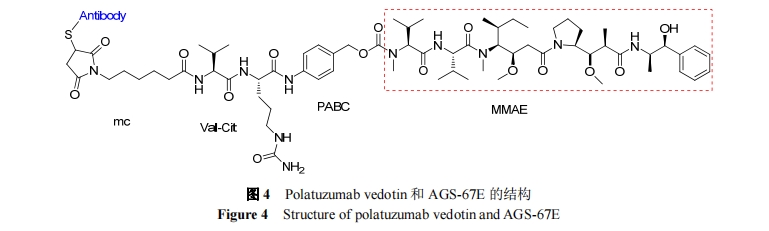
为进一步评估 Polatuzumab vedotin 治疗 NHL 和CLL 的安全性及有效性, Palanca-Wessels 及其同事[37]纳入 95 例患者进行 II 期临床试验, 这些患者经过 I 期、多中心、非盲研究, 表达 CD79B, 难以治疗且治疗意义不大. 试验组别设置为: NHL 剂量递增组 34 名, CLL 剂量递增组18名, 以确定Polatuzumab vedotin的最大耐受剂量; II期推荐剂量 NHL扩展组 34 名, NHL 利妥昔单抗联合组9名(由于剂量递增组缺乏疗效未设置CLL扩展组)NHL 患者最常见的 ADR 为中性粒细胞减少症, 贫血和周围神经病变. 在 42 名可评估的 NHL 患者中, 23 名客观缓解, 其中 7 名完全缓解、16 名部分缓解. Polatuzumab vedotin 和利妥昔单抗联合治疗的 9 名患者中7 名患者客观缓解, 包括 2 名完全缓解和 5 名部分缓解. 临床试验结果表明, Polatuzumab vedotin 治疗 NHL 患者安全性和耐受性良好, 但对 CLL 患者则无效, 因此这一疗效应在 NHL 方面进行进一步评估.
AGS-67E 是由 Agensys 公司(安斯泰来的子公司)研发用于治疗急性髓性白血病(AML)、淋巴细胞白血病等血液恶性肿瘤的 ADC. 现处于临床 I 期的研究阶段.
AGS-67E 靶向于 CD37, 由完全人源化 IgG2型单克隆抗体、连接体和MMAE构成(图4, 抗体为人源化IgG2抗体). CD37 是四跨膜蛋白超家族(TM4SF)的成员, 具有四个潜在的跨膜区. CD37 通过 C 和 N 末端结构域可以直接介导双信号转导. CD37 在由原始 B 细胞到外周成熟 B 细胞的发育过程中表达量逐渐增加, 但在浆细胞、T 细胞及单核细胞中不表达, 在自然杀伤(NK)细胞中表达水平非常低, 在血小板和红细胞上不存在. 鉴于CD37 选择性表达于 B 细胞, CD37 成为治疗 B 细胞恶性肿瘤(CLL)的良好靶标. 后来有人发现, CD37 也可在 T细胞淋巴瘤、AML 和表达 CD34+CD38-的 AML 干细胞中表达, 但在正常的表达的 CD34+CD38-干细胞很少或没有表达. AGS-67E 的作用机制与 Brentuxmab Vedotin相似, 首先通过抗体识别靶点, 形成复合物进入细胞内, 再在溶酶体中被蛋白酶水解, 释放 MMAE, 使 MMAE在细胞内发挥毒性作用. 体内外试验表明, AGS-67E 可以抑制 AML 细胞系. 以上结果均表明 AGS-67E 以CD37 为靶标治疗 AML、淋巴细胞白血病等血液恶性肿瘤前景光明[38].
为评价在有/无生长因子(GF)预防情况下, AGS-67E治疗复发性/难治性非霍奇金淋巴瘤患者的安全性、有效性及药代动力学(PK), 进行了剂量递增、多中心、Ⅰ期临床试验[39]. 13名患者分为7个剂量组(无GF: 0.05~1.2 mg/kg, 有 GF: 1.2 mg/kg)进行单药治疗, 3 周/次. 没有GF 预防患者的最大耐受剂量(MTD)超过 1.2 mg/kg, 在第一次给药后的 8~15 d 观察到 3 名患者出现严重中性粒细胞减少. 在给予 1.2 mg/kg 剂量组中一名患有弥漫性大 B 细胞淋巴瘤的患者完全缓解. 在 1.2 mg/kg 时, S-67E 和游离 MMAE 的半衰期分别为 1.44~3.08 和2.34~3.64 d. 其结果表明 3 周/给药 AGS-67E 具有治疗淋巴瘤的活性且安全性良好.
为评价 Solidotin 治疗晚期或转移软组织肉瘤的安全性及有效性, Patel 等[43]纳入 28 名符合患者进行 II 期临床试验. Solidotin 组, 肿瘤进展的中值时间为 44 d (95%置信区间[95% CI], 43.0~54.0), 中位生存期为 178 d (95% CI, 134.0~317.0). 常见的不良反应是中性粒细胞减少、疲劳和便秘. 本试验结果表明, Solidotin 安全性及耐受性良好, 但并不能有效缓解肿瘤进展. 另一项由Riely 等[44]组织的 II 期临床试验选择了 32 名符合条件的患者. 以 28 d 为一给药周期, 在第 1 d 和第 8 d 给予患者2.4 mg/m2 Solidotin. 在试验中, 最常见的严重不良反应是白细胞减少和中性粒细胞减少. 4 名患者在接受Solidotin 的 30 d 内死亡, 3 名患者病情进行, 1 名患者出现肺炎和中性粒细胞减少. 试验结果表明, 以 28 d 为一周期, 在第1 d和第8 d给予患者2.4 mg/m2 Solidotin, 患者病情未出现客观缓解, 未达到预期治疗效果.
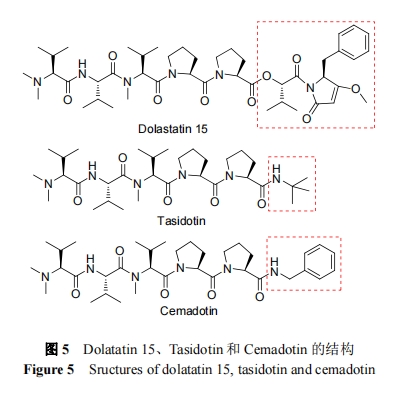
Tasidotin 是 Dolastatin 15 的第三代合成衍生物. 在结构上, Tasidotin 在羧基末端用叔丁基胺取代 Dolastatin 15的酯基团(图5). Tasidotin的主要作用机制是抑制纺锤体的形成. Tasidotin 在体内的主要代谢产物是 N,N- 二甲基缬氨酸-缬氨酸-N-甲基缬氨酸-脯氨酰基-脯氨酸(P5), P5 抑制微管蛋白聚合的活性要比 Tasidotin 高, 但作为细胞毒性剂的活性要比 Tasidotin 低[46].
为评价 Tasidotin 的安全性、耐受性和药代动力学, Mita 等[47]纳入 30 名受试者进行 I 期临床试验. 在 7.8 至62.2 mg/m2的剂量范围设置 6个剂量组, 1次/周给药, 持续 82 个疗程. 在所有剂量水平上, 发生一般 ADR 有腹泻和呕吐, 非血液学毒性通常为轻至中度且易于控制. Tasidotin 药代动力学是轻度非线性的, 而代谢动力学是线性的. 非小细胞肺癌患者服药后病情轻微缓解, 肝细胞癌患者在 11 个月内病情稳定.
Cemadotin 是 Dolastatin 15 的水溶性合成衍生物. 由 Abbott 公司研发, 用于治疗癌症, 曾处于临床 II 期, 现已被终止. 在结构上, Cemadotin在 C端用苯甲胺取代了 Dolastatin 15 的酯基团(图 5)[45]. Cemadotin 的结合位点区别于长春碱, 其进入细胞后, 抑制微管蛋白的聚合,使细胞周期停滞在 G2-M 阶段[48].
一项 II 期临床试验评估了 Cemadotin 在转移性乳腺癌患者中的安全性和有效性. 在可评价的 23 名患者中, 11 位患者发生了严重中性粒细胞减少症, 其它一般ADR 有乏力、口腔炎、肌痛及血清胆红素升高, 主要ADR 为高血压. 在试验期间, 患者病情无客观缓解, 故终止试验[49].
2 芋螺毒素
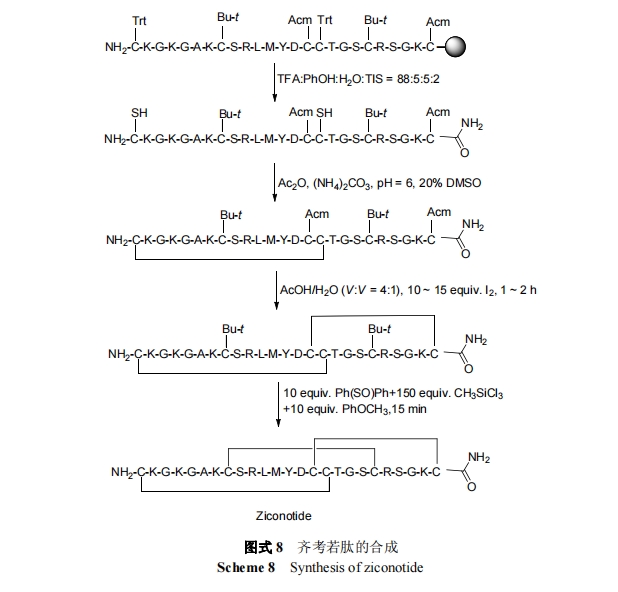
齐考诺肽(以前称 SNX-111)是来源于太平洋的幻芋螺毒液中具有亲水性 ω-MVIIA 芋螺毒素的合成形式. 它于 2004 年 12 月经 FDA 批准上市, 用于常规治疗不耐受或难于治疗的慢性严重性连续鞘内病变患者的疼 痛[52]. 一项专利[53]报道了其合成路线(Scheme 8), 以Fmoc-氨基树脂为固相载体, 从 C 端到 N 端依次用缩合反应连接 25 个侧链保护的氨基酸, 形成二硫键的三组Cys 分别连接 Trt, Acm 和 t-Bu 保护基, 将树脂进行线性切割, 同时脱去除 Cys (Acm)和 Cys (t-Bu)外的所有氨基酸的侧链保护基, 氧化线性肽形成第一对二硫键, 得到单二硫环肽, 然后依次脱除 Cys (Acm)和 Cys (t-Bu)中的Acm 和 t-Bu, 在脱除时同时环化, 得到三二硫环肽, 最后经 HPLC 纯化, 冻干得到齐考诺肽.
齐考诺肽包含25个氨基酸, 富含有三个二硫键, 其药理活性依赖于这些完整的二硫键, 这些二硫键也是分子三维结构的决定因素. 3 股 β 折叠可进一步稳定空间结构, 增强肽对酶的抗性, 也可能增强结合力和效力. 蛋白表面与带电和极性氨基酸侧链连接, 使得齐考诺肽高度亲水. 齐考诺肽的结构暗示其可以用于成药[54].齐考诺肽是一种效果非常好的非阿片类镇痛药, 它对 N型电压敏感钙通道具有较高的亲和力, 可以有效地阻断钙离子的流通. 因此, 它可以通过有效和选择性阻断 N性钙离子通道, 从而控制多种突触释放的神经递质. 它可能在脊髓水平上中断了疼痛信号的传递[55].
为评估鞘内齐考诺肽对常规治疗难治的疼痛患者的安全性和有效性进行了双盲、安慰剂随机对照试 验[56], 试验选择 111 例癌症或 AIDS 患者, 以 2∶1 的比例随机分配至齐考诺肽组和安慰剂组. 在可评价的患者中, 齐考诺肽组中 52.9%的患者疼痛缓解, 在安慰剂组中, 只有 17.5% (P<0.001), 并且在接受齐考诺肽的患者中, 有 5 位患者达到了完全缓解. 结果表明齐考若肽对于缓解难治型疼痛具有很好的疗效.
3 海鞘素
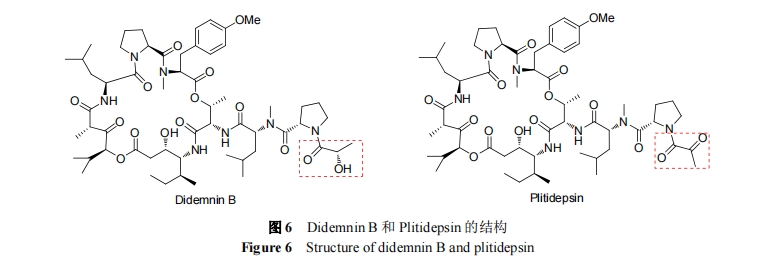
为评价 Didemnin B 治疗复发或发展的 NHL 患者的功效和毒性, 进行了临床II期试验. 试验选择了51名患者. 在试验中, 患者都产生了 3~4 级的不良反应, 毒性较大, 因此停止了实验[61].
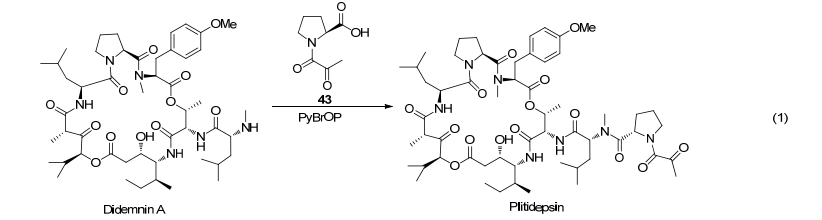
Plitidepsin 亦称 Aplidin, 由 PharmaMar 研发. 它是从地中海海鞘 Aplidium albicans 中分离得到的抗肿瘤活性天然产物的合成形式. 它经 FDA 和欧洲委员会批准为治疗多发性骨髓瘤的孤儿药. 在活性浓度时, Plitidepsin 显示比 Didemnin B 更低的毒性[62]. Plitidepsin 具有更高的治疗价值, 现处于治疗多发性骨髓瘤的临床Ⅲ期阶段.
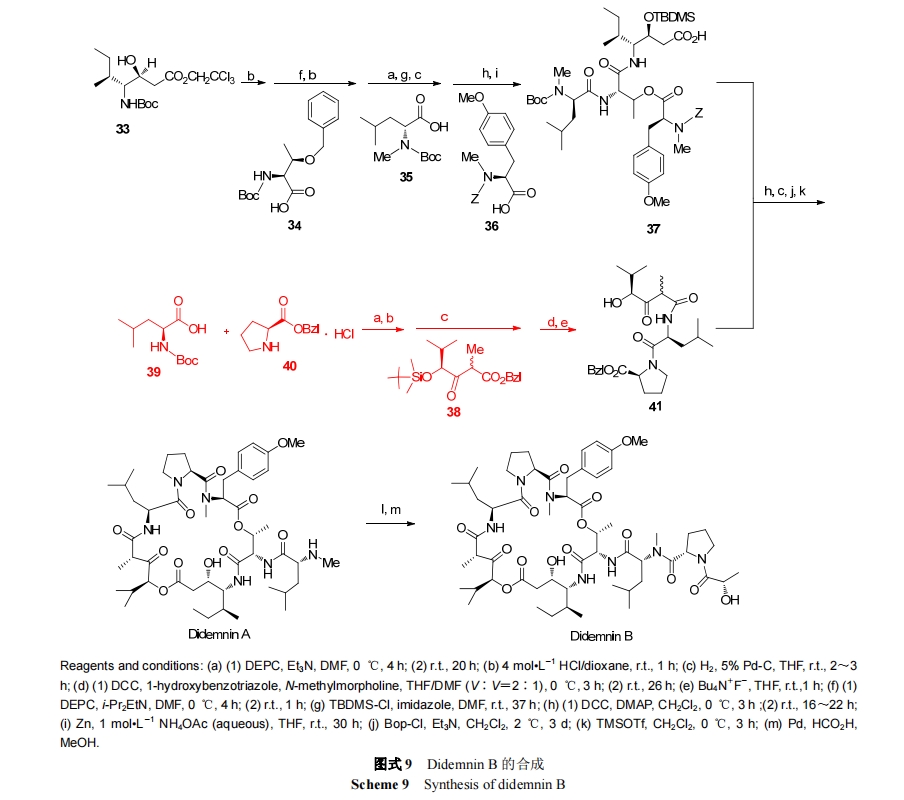
Plitidepsin 作用机制是通过与细胞膜表面高亲和力的位点结合后, 激活 Rac1, P38/MAPK 和 JNK 信号传导, Fas/CD95 转移至脂筏处, 最终引起半胱氨酸蛋白酶的激活, 使细胞凋亡[63]. Plitidepsin 通过(S)-Pro-Pyr (43)与Didemnin A 中的(R)-N-甲基-Leu 侧链中的氨基结合形成(Eq. 1)[64].
一项多中心、单组、开放且具有前瞻性的 II 期临床试验[65]评估了 plitidepsin 治疗复发/难治性多发性骨髓瘤(MM)患者的安全性和有效性. 在可评价的 47 名患者中, 单独使用 plitidepsin 时的总缓解率(OR)为 13%, 与地塞米松联合使用时为 22%. 一般 ADR 有贫血(29%)、血小板减少症(18%)、疲劳(16%)、肌肉毒性(6%)和瞬时丙氨酸氨基转移酶/天冬氨酸氨基转移酶(27%)和肌酸磷酸激酶(23%)增加. 这表明单用或与地塞米松联用plitidepsin 治疗复发/难治性多发性骨髓瘤患者是安全、有效的.
4 海绵活性肽
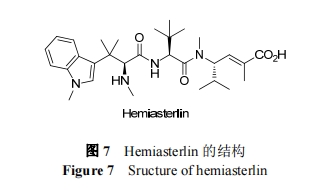
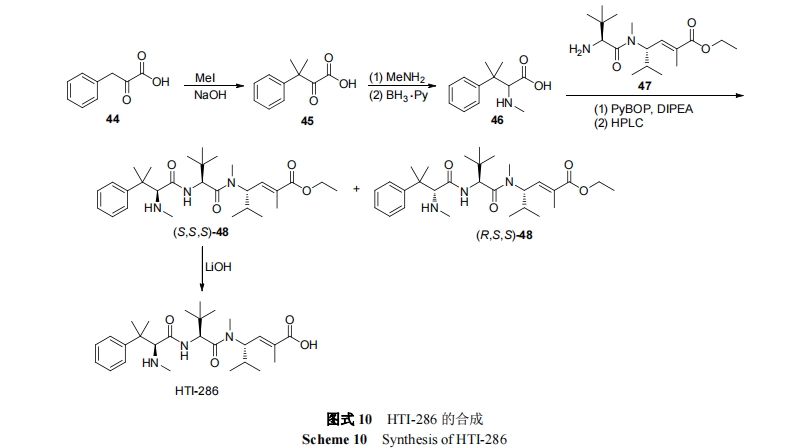
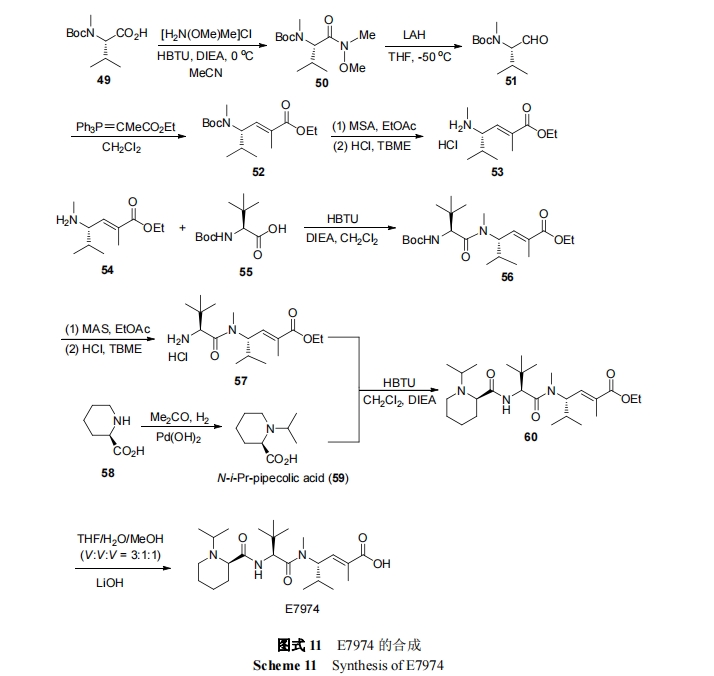
为评价了 E7974 治疗晚期实体瘤的安全性和有效性, 进行了 I 期临床试验. 试验选择了 28 名患者, 分为5 个剂量组(0.18, 0.27, 0.36, 0.45 和 0.56 mg/m2; MTD 为0.45 mg/m2), 28 天/次, 静脉注射给药(2 至 5 min). 在 17名患有难治性结肠癌患者中, 7 名(41%)患者病情得以稳定. 中位无进展生存期为 1.2 个月, 中位总生存期为 6.7个月. 出现血液 ADR 有嗜中性白血球减少症、贫血、白血球减少症; 一般 ADR 有疲劳、秃头症、恶心、呕吐、便秘[75].
5 海洋真菌活性肽
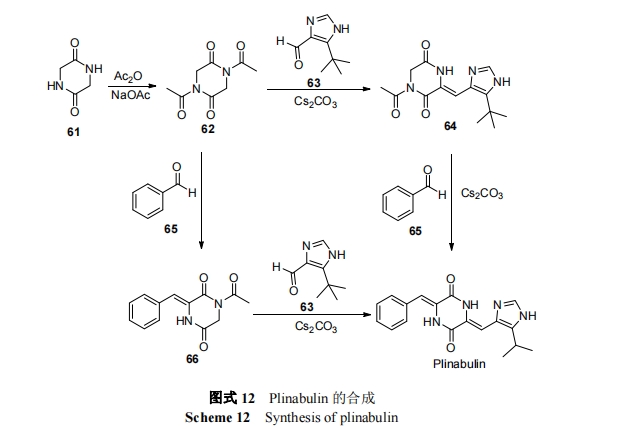
一项 II 期临床试验, 对比了 Plinabulin (N)联合多烯紫杉醇(D)治疗和单用多烯紫杉醇(D)治疗非小细胞肺癌NSCLC 患者的效果. 将 172 名患者随机分成两个不同剂量水平的大组, 163 个治疗组, 第一大剂量组由 30 个小组构成, 给药剂量为 50DN, 55D; 第二大剂量组由 20个小组构成, 给药剂量为 40DN, 18D. 在第一大组中, 使用 DN 联合治疗的总生存期为 8.7 个月, 单独使用 D治疗是 7.5 个月; DN 组的缓解率为 14%, D 组为 14.5%; DN 组的药效持续时间为 12.7 个月, D 组为 1.5 个月; 第一大组治疗效果优于第二大组. 此次试验中出现最常见的 ADR 为恶心、疲劳、腹泻、便秘和厌食. 在两个给药大组中, DN 组中性粒细胞减少发生率较低, 严重ADR 发生率较低. 此试验表明具有大的肺肿瘤(>3 cm)和之前经过标准化疗(ChRx)的患者在 DN 组存活几率比D 组高[81].
6 软体动物活性肽
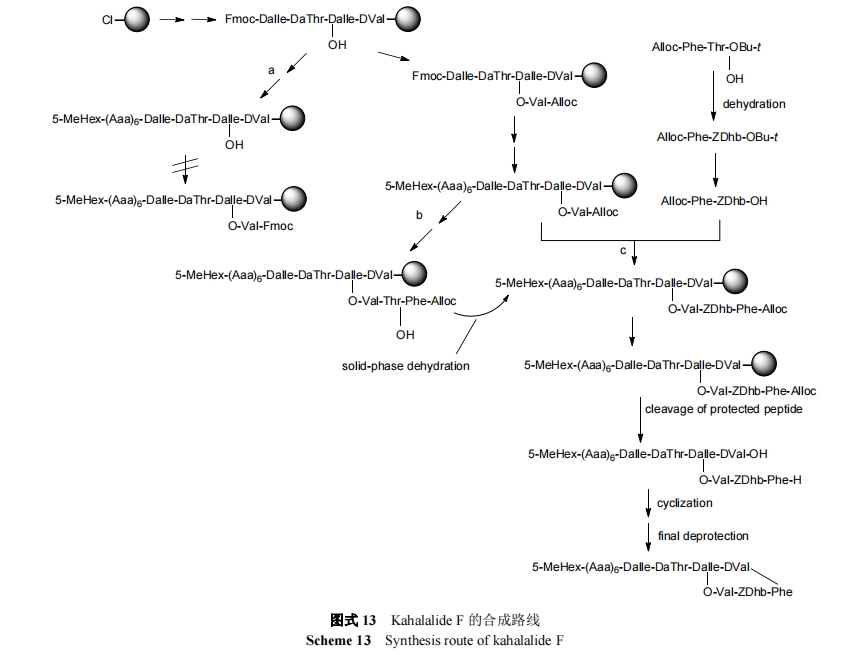
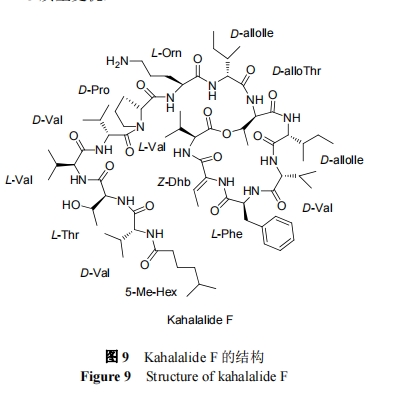
在体外, Kahalalide F 作用的发挥与 ErbB3 和 Akt 信号有关[83]. 体外实验表明, Kahalalide F 对前列腺癌和乳腺癌细胞显示出较强的细胞毒活性, IC50 范围为 0.07 µmol•L-1 (PC3)~0.28 µmol•L-1 (DU145, LNCaP, SKBR-3, BT474, MCF7). 重要的是, 人类正常细胞(MCF10A, HUVEC, HMEC-1, IMR90)对药物的敏感性低 5~40 倍(IC50=1.6~3.1 µmol•L-1). Kahalalide F 在细胞内发挥作用时, 会发生一系列的变化: 细胞质肿胀和空泡化, 内质网的扩张和囊泡形成, 线粒体损伤和质膜破裂. 细胞核内不规则染色质聚集成小的块状, 而染色质从其他核域消失, 但核包膜被保留, 没有检测到DNA降解[84].
为评价 Kahalalide F 治疗晚期恶性黑素瘤患者的效果. 试验选择了 24 例符合条件的患者, 1 次/周注射给药. 14 例患者有化疗或生物治疗史, 但实体瘤的疗效评价标准(RECIST)评价较差. 在 5 名患有皮肤黑色素瘤化疗患者中, 疾病稳定为 3 个月, 中位无进展生存期为 1.7个月(95% CI, 1.2~1.9 个月), 中位总生存期为 10.8 个月(95% CI, 5.0-上限未达到). 患者服药期间最常见的生化指标变化是转氨酶(ALT/AST)和 γ-谷氨酰转移酶(GGT)的非累积增加. 在研究期间患者未出现白细胞减少和血小板减少. Kahalalide F 是一种安全性良好的化疗物质, 但由于恶性黑素瘤患者缺乏客观缓解, 该试验在第一阶段后停止[85].
为评价 Elisidepsin 治疗晚期胃食管癌的有效性, 进行了 Ib/II 期临床试验. 将 44 名患者随机分配至两个剂量组. 其中 12 名患者处于 Ib 期临床试验, 32 名患者处于 II 期临床试验. 在试验期间, 较少发生 ADR, 但是由于疗效不佳没有进行下一步试验[88].
7 展望
随着海洋开发的步伐加快及对生物活性肽认识的不断深入, 海洋生物活性肽是目前药物研发的一个重要方向. 虽然对于来自于海洋生物的活性肽研究历程较短, 但由于其结构的特殊性吸引了众多的科研工作者, 开展了化学合成、构效关系、药理毒理、临床及相关的不良反应等方面的研究. 但由于海洋生物活性肽结构复杂、活性成分含量低及封闭的 N 末端等特殊结构, 使得给开发研制增添了诸多困难. 从目前上市药物和处于临床试验阶段的活性化合物来看, 对于海洋生物活性肽的开发, 主要在抗肿瘤药物研发领域, 化物来源局限于海兔、芋螺、海绵、海鞘、软体动物等少数几种生物体中, 绝大多数海洋生物尚未得到开发.
为将更多的海洋生物活性肽类化合物开发为药物, 我们应从三个方向进行: (1)以天然肽为先导化合物, 对其进行功能化修饰, 研究其构效关系, 以筛选有更好药效的活性肽类似物; (2)海洋药物的研究需要探测、现代生物、分离纯化和产品制备等相关技术, 故需加大力度建设活性肽的分离鉴定需要的高效灵敏的技术平台. (3)海洋是一个巨大的宝库, 还存在着许多未开发利用的生物活性肽类化合物, 应进行更多的广泛深入研究, 以寻找更多和更有价值的新型海洋药物.
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。