
摘要:该文总结了二次离子质谱、基质辅助激光解吸电离质谱和常压敞开式离子化质谱三大类型质谱分子成像(MSI)技术的概况、技术与方法及其应用新进展。MSI技术作为免标记、高覆盖、高灵敏、检测范围广的可视化分析手段,不局限于生物组织或细胞中某种特定分子的检测,可对已知和未知多种分子进行同时成像分析,获得不同分子的空间分布、相对含量及结构信息,实现其分子的定性、定量与定位分析;还可提供不同生理及病理过程中功能分子的动态时空变化信息等。因此,MSI技术成为质谱领域以及分析化学等领域的研究前沿与热点方向之一,并在化学、医学、生命科学、药学和环境科学等领域显示出重大应用前景。此外,MSI技术是单细胞可视化分析和空间分辨代谢组学的强有力分析手段,可从动物或器官组织的整体、微区、单细胞等不同空间尺度,获取具有空间分布特征、时空动态变化的功能分子全景轮廓信息等而备受关注。
当今质谱技术的发展非常迅猛,新技术或新型质谱仪的研发“日新月异”,极大地拓展了质谱技术的应用领域。其中,随着1997年Caprioli等人首次将基质辅助激光解吸电离质谱(MALDI-MS)技术用于生物组织中多肽和蛋白质成像分析后,极大地推动了质谱成像(MSI)技术的发展[1]。20多年来,因不同原理及多种类型MSI技术的发展及应用拓展,使MSI成为质谱领域乃至分析化学、分子影像技术以及生物医药等领域的研究前沿与热点方向之一。MSI技术是一种免标记,不局限于某种特定分子的新型分子成像技术,不仅可同时获得生物组织或细胞中多种分子的空间分布、相对含量及结构信息,还能够提供不同生理及病理过程中功能分子的动态变化与功能关联的信息[1-2]。目前,根据不同的离子化方法及工作原理,MSI技术主要分为三大类型:二次离子质谱(SIMS)、MALDI-MSI以及近年来发展迅速的常压敞开式离子化质谱成像(Ambient MSI)技术。因MSI技术具有灵敏度高、专属性好、无需特异性标记、检测对象广以及样品处理简单等优势,已在化学、医学、生命科学、药学和环境科学等领域显示出重大应用前景[2-8]。此外,近年来基于MSI技术驱动发展的空间分辨代谢组学备受关注,它可实现原位可视化分析与代谢组整体分析的优势互补,获取具有空间分布特征、时空动态变化的功能分子全景轮廓信息[9]。
1 质谱分子成像技术与应用
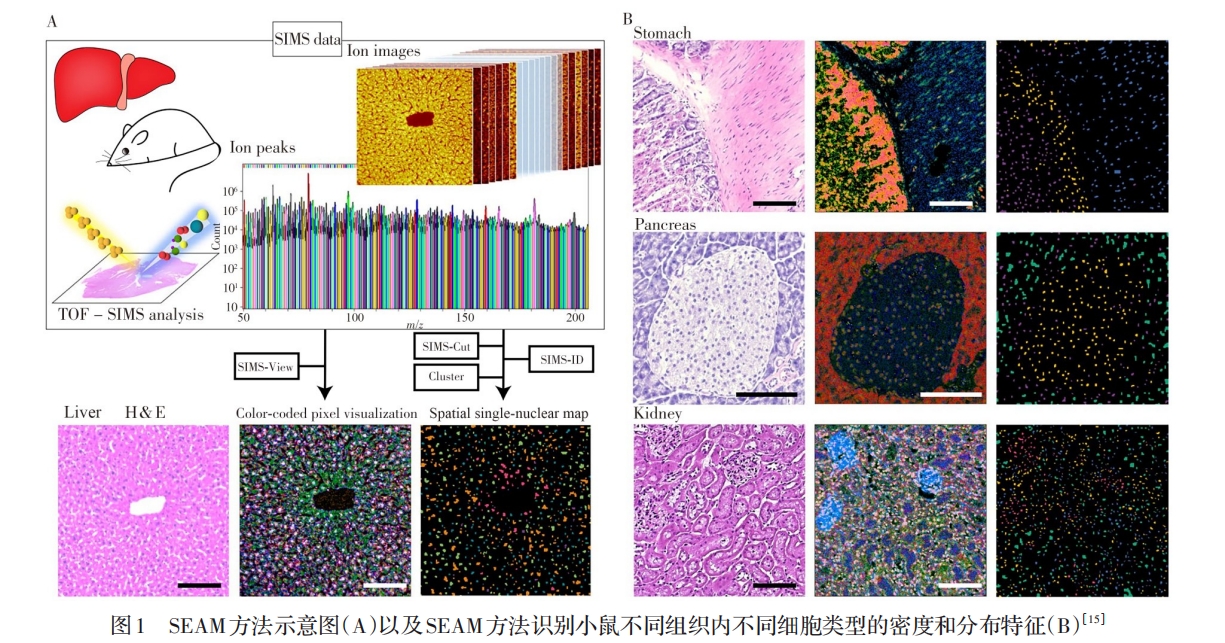
SIMS技术是一种基于离子束轰击被测样品且需在真空下操作的MSI技术,具有很高的空间分辨率(达nm级水平),因此常被用于单细胞乃至亚细胞水平的MSI分析[2]。SIMS仪分为动态和静态两种分析模式,二者的区别主要根据一次离子在样品内的注入量为标准,通常一次离子束流低于1012个离子/cm2为静态SIMS模式,高于该值为动态SIMS模式;二者常用的离子束种类和质量分析器不同,对样品表面及其被测物质的破坏程度也不同。其中,以Nano SIMS为代表的动态SIMS是破坏性更强的一种,通常采用高能量的一次离子束轰击样品表面(正离子模式常用O+2离子源,负离子模式为Cs+离子源),主要用于金属等元素的成像分析。
静态SIMS的典型代表是飞行时间二次离子质谱(TOF-SIMS)[2,10]。该技术一般采用双束离子源,即一个离子源(如Ar+n氩团簇离子)负责对样品表面进行溅射剥离,另一个离子源常用Ni+3液态金属离子枪(团簇离子)等负责被测物的离子化,获得离子在纵向的分布信息。静态SIMS分析要求一次离子束流应低于1012/cm2,以降低一次离子对样品表面的破坏,使一次离子只与样品表面的原子层作用,而且团簇离子对于样品表面及其有机分子的破坏性会变弱,因此TOF-SIMS技术不仅用于生物组织或细胞中的元素分析,还可用于药物和脂类代谢物等生物及有机分子的成像分析。然而,TOF-SIMS技术需在真空下操作,尤其是对于生物及有机分子的检测,因其离子化过程主要产生的是碎片离子,难以获得被测化合物的分子离子等完整结构信息;或者因碎片离子多、其信号强度很高,则会掩盖分子离子的信号。

另外,值得指出的是德国吉森大学Spengler团队致力于高空间分辨的大气压MALDI离子源及其MSI技术的研究。他们采用独特的激光束与离子流同轴设计,实现大气压条件下的激光解吸离子化,研发出TransMIT AP-SMALDI 5 AF高分辨与自动聚焦3D快速MSI系统[29],其空间分辨率可达3 μm;自动聚焦MALDI-MSI技术能够提升检测效率与分析通量,可实现组织切片和非平坦表面的三维化学形貌以及生物样品的高分辨、高速扫描及成像分析。从目前的结果来看,该系统主要针对脂质类代谢物的检测,且灵敏度有待提高。此外,近期Capolupo等[30]采用高分辨AP-SMALDI 10和AP-SMALDI 5 AF MSI技术,结合单细胞mRNA测序,解析真皮成纤维细胞的脂质组学和转录组学信息,发现真皮成纤维细胞存在多种脂质组成状态,且脂质在决定细胞状态中起着驱动作用。该研究表明单细胞脂质组与转录组之间存在紧密联系,细胞特定脂型影响信号受体的活性,促进细胞不同的转录状态。
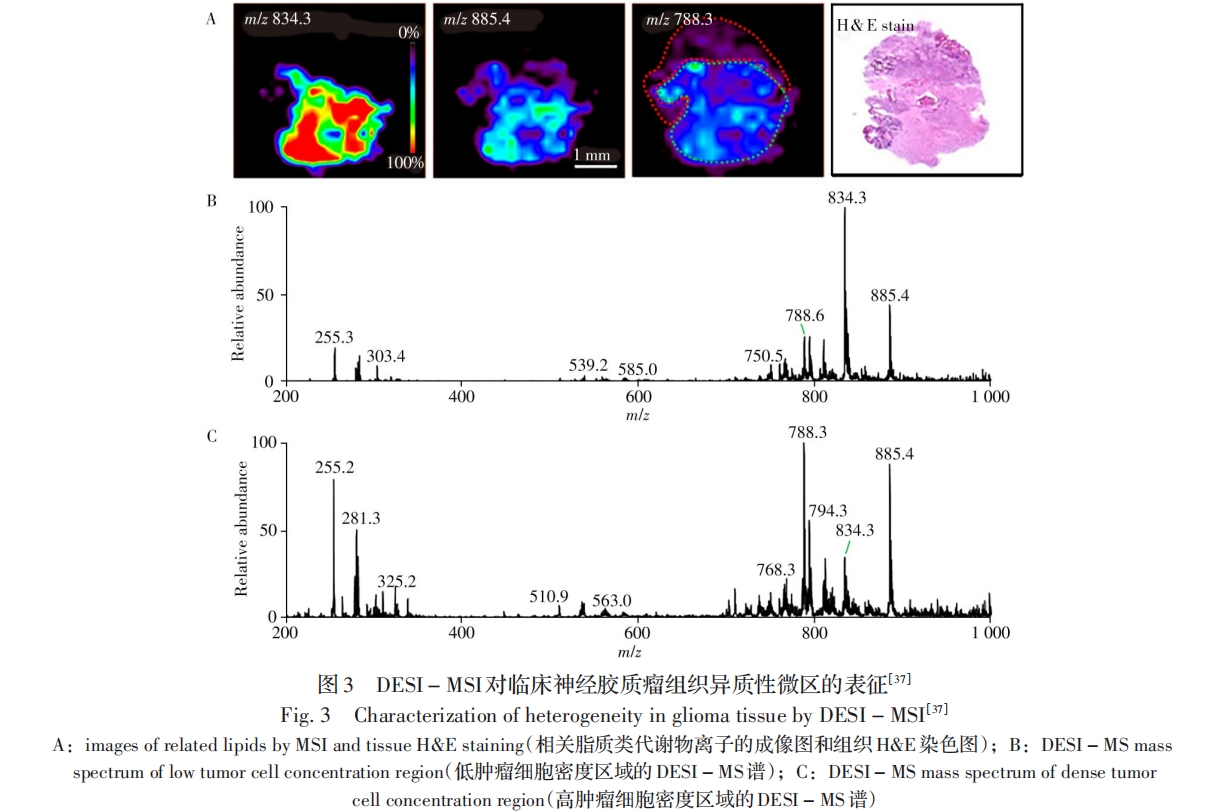
此外,Eberlin等开发了简易敞开式声波喷雾离子化技术(EASI)[41],并采用EASI-MSI技术实现了细菌琼脂培养物的成像分析[42]。Vertes等研发出一种LAESI技术[43],利用LAESI-MSI实现了富含水分的小鼠脑组织中小分子及脂质类代谢物的成像分析[44],并通过将不同深度的独立二维成像相叠加获得三维组织成像结果[45]。Fernández等[46]开发了一种红外激光消融亚稳诱导化学电离(IR-LAMICI)技术,通过将样品表面的分子消融并解吸,使被分析物与处于激发态的亚稳态气体分子相互作用而实现离子化,并对小分子进行成像分析。Feider等[47]研发出基于液相微连接表面采样探针(LMJ-SSP)的敞开式MSI方法,实现了大鼠脑组织、人卵巢癌组织和正常组织切片中磷脂酰胆碱和多种蛋白质的成像分析。
近年来,我国科技人员亦开发出一系列新型敞开式离子化技术,其中一些技术作为MSI方法应用于分子可视化分析。例如,张新荣等利用低温等离子体(LTP)低温无损等特点,研发出一种新型结构的LTP探针离子化技术[48],建立了样品表面原位无损分析的MSI方法[49],并基于印章油墨成分的MSI分析,实现了艺术品真品与赝品的鉴别。刘虎威等通过整合三波长激光解吸附,利用等离子体对解吸的样品进行离子化,并与薄层色谱技术联用,开发了PAMLDI技术[50]及其敞开式MSI方法[51],实现了印章、打印字以及中药黄芩中有效成分分布的成像分析。
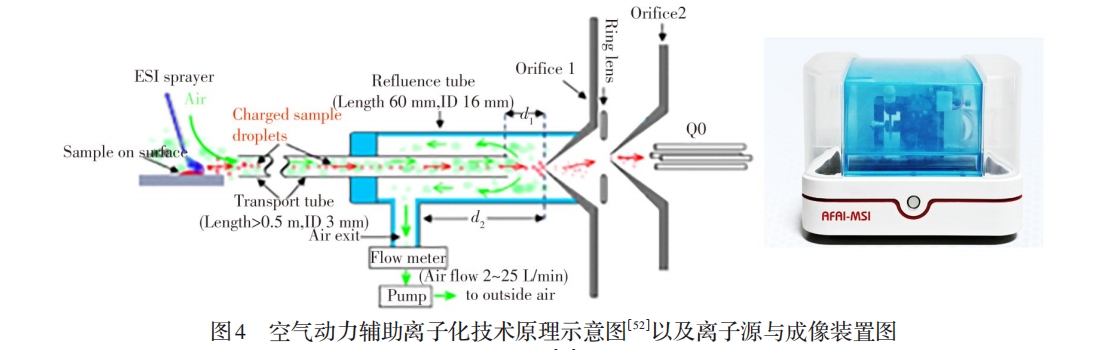
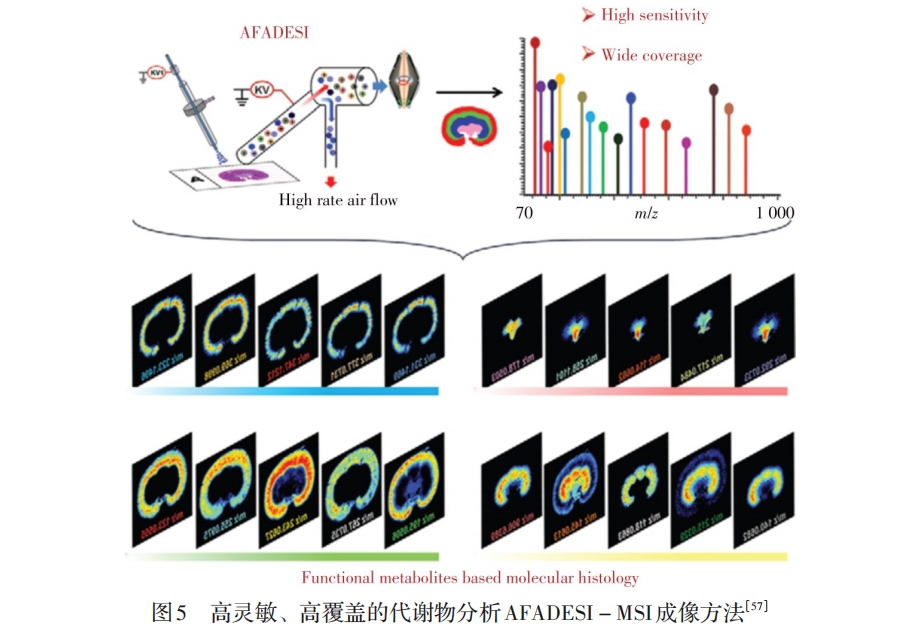
本课题组与清华大学王晓浩课题组合作,2005年以来致力于常压敞开式离子化及其MSI技术的研究,研发出新型的空气动力辅助离子化技术(AFADESI)[52](见图4)。该技术扩展了待测样品空间和操作灵活性,提高了敞开式离子化质谱技术的离子化效率及检测灵敏度。基于AFADESI技术的特点,进一步研制出便捷、高灵敏的质谱分子成像技术与装置(AFADESI-MSI)[53-58]和辨识度强的MSI软件MassImager[59]。近年来,先后建立了无需切割的整体动物体内药物分析MSI方法[53],无需添加内标的虚拟校正定量MSI分析方法[55],高灵敏、高覆盖的代谢物MSI分析新方法[57](见图5)和水凝胶辅助组织原位衍生化的MSI分析方法[58]等一系列成像分析新方法。采用建立的方法实现了药物靶向分布表征、肿瘤原位标志物筛查、组织微区中功能代谢物的精准表征;同时解决了低丰度或难电离分子的MSI检测技术难题,实现了高覆盖、宽动态范围的十余种1 500个代谢物的成像分析等。
可见,敞开式离子化质谱及其Ambient MSI技术推动了MSI技术的新发展,并拓展了MSI技术在生命科学、医学和药学等领域的应用途径。然而,Ambient MSI技术的空间分辨率低(一般为50~100 µm),限制了单细胞水平的成像分析;同时针对生物组织中不同类型分子,尤其是低含量或难电离的化合物,还需要发展基于化学选择性的手段来提高全面的离子化效果,解决原位信号放大及检测灵敏度等难题。
2 空间分辨代谢组学方法与应用
近20年来,代谢组学及其应用取得迅速发展,成为生命组学的重要组成部分,已在化学、生物学、生命科学、医学及药学等领域显示出巨大发展前景。其中,单细胞代谢组学入选IUPAC“2021年度化学领域十大新兴技术之一”,更加备受关注。此外,空间分辨多组学入选Nature杂志“2022年度七大榜单技术”,其中空间分辨代谢组学是很重要的发展方向,因此将MSI技术与代谢组学整合,发展空间分辨代谢组学方法,可实现代谢组整体分析与原位可视化分析的优势互补,更有利于获取具有空间分布特征、时空动态变化的综合分子轮廓信息[9,60]。深入开展生物组织中代谢物的成像与原位分析,能够深层次地理解其在生命活动及病变过程中的作用和机制[61],尤其是发展单细胞空间分辨代谢组学方法,可发掘代谢组在组织微区和细胞间的差异分布,实现微环境中不同代谢特征细胞的分子识别与分型精准表征[62-64]。
需要指出的是,发展空间分辨代谢组学可为组织代谢异质性及细胞微环境的分子可视化研究提供新的创新手段。其中,恶性肿瘤在演进过程中,肿瘤细胞及其微环境表现出高度的空间与时间异质性[65];肿瘤异质性及其微环境是癌症治疗失败和产生耐药性的关键因素,较低的肿瘤内异质性与患者预后良好之间存在高度相关性[66-67],也有可能是免疫治疗成败的决定性因素[68];而肿瘤间异质性是肿瘤分子分型、分级和分期的生物学基础[69]。此外,肿瘤代谢异质性是肿瘤异质性的重要表现形式[70];而肿瘤细胞的代谢表型不仅与基因型相关,也与肿瘤微环境密切相关,可直接反映基因与环境的共同作用,这为研究肿瘤异质性提供了新的思路[71]。因此,发展空间分辨代谢组学或单细胞空间分辨代谢组学新方法,对全面了解生物组织或细胞微环境的功能分子构成及其动态变化具有重要意义,尤其为疾病发病机制与诊疗新技术研究、药物耐药性、药物靶向精细化分布表征及药效作用与毒性机制研究甚至新作用靶点的发现等诸多研究领域提供新的视角和创新手段。
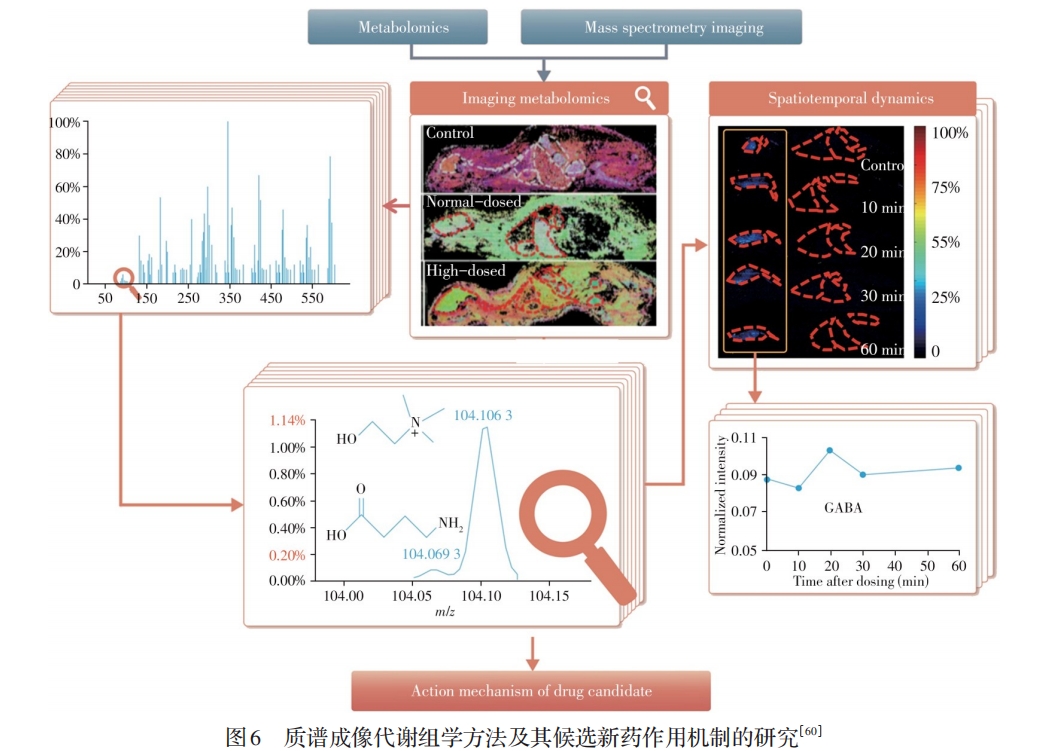
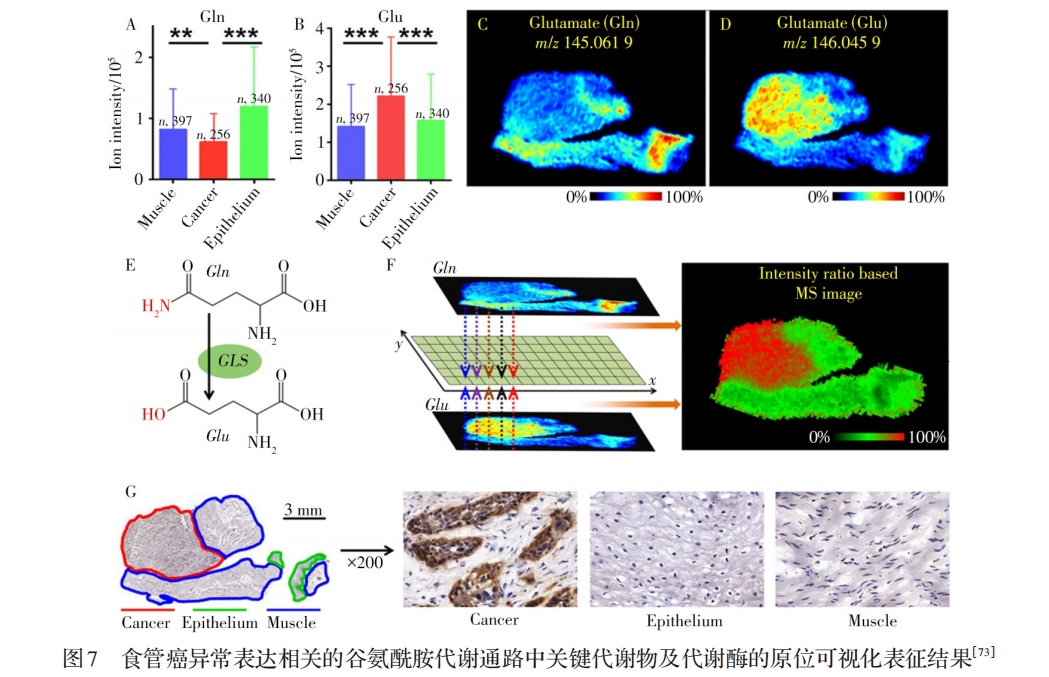
本课题组将AFADESI-MSI技术与代谢组学相结合,2015年在国际上首次提出了质谱成像代谢组学新方法(Ambient mass spectrometry imaging metabolomics method)[60](见图6);研究表明,MSI这一可视化分析技术与液相色谱-质谱(LC-MS)、气相色谱-质谱(GC-MS)等手段相比,在代谢组原位表征方面显示出独特优势。几乎同时Takats等[72]基于DESI-MSI技术提出空间分辨代谢表型(Spatially resolved metabolic phenotyping)分析方法,并应用于乳腺癌的研究。之后上述提法演变为“空间分辨代谢组学”,并与空间分辨转录组学等其它组学构成空间分辨多组学技术而被高度关注。这些年,本课题组系统开展了基于AFADESI-MSI技术的空间分辨代谢组学分析方法及其应用研究[60,73-80],将建立的方法用于候选新药的药效机制及中药活性成分的毒性机制研究[60,74],提出“下游代谢物与上游代谢酶关联”表征肿瘤代谢改变的研究策略,发现食管癌代谢特征与异常表达的6个关键代谢酶[73](见图7),并在肿瘤小分子标志物的原位筛查与癌症的分子分型[75-76],肿瘤异质性研究[77],糖尿病肾病/脑病发病机制以及药物干预作用[78-79]和大鼠脑代谢网络表征新方法[80]等方面取得重要进展。
3 结论与展望
质谱技术以其广谱性、灵敏度高、特异性好和检测动态范围宽等特点成为目前最主要的分析手段之一,并显示出很强的生命力和发展空间。而将质谱分析与影像技术相结合的质谱分子成像技术,作为免标记、高覆盖、高灵敏、检测范围广的原位可视化分析手段,不局限于生物组织或细胞中某种特定分子,可对已知和未知(目标/非目标)的多种类分子进行成像分析,同时获得不同分子的空间分布、相对含量及结构信息,实现其分子的定性、定量与定位分析,还可提供不同生理及病理过程中功能分子的动态时空变化信息等,而备受关注。因此,目前MSI技术成为质谱领域乃至分析化学领域的研究前沿和热点方向之一,并在化学、医学、生命科学、药学和环境科学等领域显示出重大应用前景。此外,MSI技术是单细胞可视化分析和空间分辨代谢组学的强有力分析手段,并可发挥不同MSI技术的优势与功能特点,从动物或器官组织的整体、微区、单细胞等不同空间尺度,获取具有空间分布特征、时空动态变化的功能分子全景轮廓信息,有利于发展多层次的空间分辨代谢组学方法。更高的空间分辨率和更高的灵敏度仍是今后MSI技术的重点发展目标,而单细胞、3D和定量MSI方法的研究是需要关注的重要发展方向。此外,先进的质谱成像软件和海量数据挖掘系统的开发将促进MSI技术的快速发展。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。