
摘要:基于通过激活宿主天然免疫应答杀死癌症细胞的优势, 免疫治疗有望成为癌症治疗的新方法. 与传统治疗方法相比, 免疫治疗能够诱导长期的免疫记忆以预防癌症复发和转移, 具有更广谱的抗癌效果以及较小的副作用. 然而建立具有高生物安全性和免疫应答能力的策略仍然具有挑战性. 由于其与天然蛋白质类似的结构特征, 多肽分子有望通过直接引发免疫应答或改善药物递送效果来解决这些挑战. 本文总结了过去十年内发现的利用短肽分子作为免疫治疗药物或递送平台的癌症免疫疗法. 从简要介绍癌症免疫治疗开始, 我们概述了多肽分子的特定药物功能, 包括免疫检查点抑制剂、疫苗抗原和佐剂. 随后着重介绍了基于多肽纳米结构作为递送平台, 用于药物靶向递送或多种药物共同递送以增强免疫原性的进展. 最后对基于多肽的癌症免疫治疗面临的挑战以及未来的发展趋势进行了展望.
癌症是威胁生命的主要疾病之一,尽管手术切除、化疗和放射治疗等传统治疗策略取得了进展,但其治疗仍面临着充分治疗的挑战[1,2]免疫治疗作为替代疗法,由于其疗效显著、药物脱靶副作用小等优势,在过去几十年受到广泛关注。[3,4]。与直接攻击癌细胞不同,免疫疗法引发宿主的自然免疫反应,从而杀死癌细胞。自第一个针对毛细胞白血病的免疫疗法上市以来,各种癌症疫苗已被开发并应用于癌症免疫治疗[5]近年来,基于激发免疫反应的新策略,癌症免疫治疗取得了突破性进展通过针对不同的免疫细胞[6]原则上,免疫系统由先天免疫系统和适应性免疫系统组成,前者依赖于参与的免疫细胞,包括先天免疫系统中的微噬细胞、单核细胞、中性粒细胞和树突状细胞,后者依赖于适应性免疫系统中的T或B淋巴细胞。根据免疫激活机制,针对不同免疫反应的治疗药物可分为癌症疫苗、免疫佐剂、细胞因子、检查点阻断剂和工程化T细胞以及其他新兴类别。目前,检查点阻断免疫治疗[7,8]以及利用工程 T 细胞进行过继免疫治疗[9]是临床试验中使用的两种有希望的策略。程序性细胞死亡 1 (PD-1) 及其配体 PD-L1 或细胞毒性 T 淋巴细胞抗原 4 (CTLA-4) 的检查点是包括抗体或小分子药物在内的阻断剂的两个常规靶点。过继转移工程化 T 细胞(如嵌合抗原受体 T (CAR-T) 细胞)以取代天然 T 细胞受体也允许直接引发免疫反应[10–13]。尽管具有巨大的治疗潜力,但由于免疫原性低和严重的不良副作用(如细胞因子释放综合征)而导致许多临床试验失败,这严重阻碍了其进一步发展。因此,需要有效调节免疫反应的新治疗剂和减少不良反应(如自身免疫副作用)的新型递送支架。
肽是由与天然蛋白质类似的氨基酸组成的,已广泛应用于组织再生和药物输送的药物和生物材料的开发[14–16]. 由于肽序列具有源自天然蛋白质或模仿蛋白质底物结构特征的潜在能力,因此可能表现出与外来病原体或癌细胞结合的倾向,并可用作肽疗法。例如,受抗菌肽引起的先天免疫反应的启发,人们通过合理设计肽序列与广谱抗生素来开发抗菌剂,以防御细菌和真菌[17,18]。与大分子蛋白抗体相比,短肽疗法在给药和肿瘤蓄积方面表现出几个显著的优势。缩短的肽序列易于合成,也潜在地有利于渗透到实体肿瘤组织中。短肽的结构也可以进行精确调整,以防止由药物污染物引起的任何过敏或自身免疫反应。短肽的治疗效果不需要稳定的整体构象类似物的蛋白质抗体,这对于抗体的疗效至关重要,并导致蛋白质抗体给药的挑战。此外,调节肽疗法的非共价相互作用可以促进肽自组装成纳米药物,而纳米药物通常表现出可控的药代动力学。另一方面,与聚合物系统相比,肽形成的纳米结构在作为递送平台时具有特定特征。虽然肽的天然成分使其具有出色的细胞相容性,但肽的合理设计可以精确调整它们的结合,从而创建具有可控形态的纳米结构,随后开发用于疾病诊断和治疗的功能性生物材料从而创建具有可控形貌的纳米结构,并随后开发用于疾病诊断和治疗的功能性生物材料从而创建具有可控形貌的纳米结构,并随后开发用于疾病诊断和治疗的功能性生物材料[19,20]. 对肿瘤微环境有反应的肽组装体,特别是对生物标志物有反应的肽组装体,是高效肿瘤成像的理想支架[21–23]并针对性地交付[24,25]并被广泛应用于传统癌症治疗[26–28]. 结合这些优势和潜在的跨膜能力,肽在癌症免疫治疗中具有巨大潜力,可作为治疗剂或递送支架[29–31]。
迄今为止,合成短肽及其组装体已用于不同类型的癌症免疫治疗(图 1)[32,33]. 来自天然蛋白质内结构域的肽表位可能能够与先天或适应性免疫细胞或癌细胞中存在的受体相互作用,从而赋予其调节宿主免疫系统的治疗功能[34,35]。此外,分子进化技术可以再次设计针对参与抑制或激活免疫系统的受体的肽,从而为发现肽免疫疗法提供了另一种方法。迄今为止,已有相当数量的短肽作为检查点阻断剂[36,37]、癌症疫苗[38,39]和佐剂[40]已经开发出来。另一方面,肽组装体已被广泛用作纳米载体,用于将免疫治疗剂(从细胞和抗体等大物体到小药物)靶向递送到肿瘤部位[41,42]基于肽组装体的形态转变,肽纳米载体还可以增加治疗药物的循环时间[43–45]. 最近,肽组装体在传统治疗和免疫治疗方法的结合中引起了特别的关注[46–50],因为它们具有共同装载多种货物的多功能性。尽管肽在癌症免疫治疗中具有巨大潜力,但基于肽的策略的进展尚未总结。
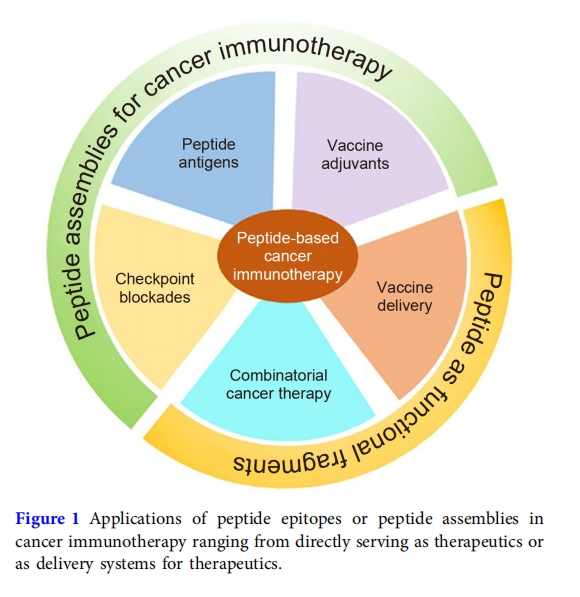
本综述从肽在治疗过程中的作用方面总结了基于肽的癌症免疫治疗策略。我们首先概述了利用肽作为免疫疗法的基于肽的免疫疗法。随后,将介绍肽纳米结构作为治疗剂递送支架的应用。我们特别强调了协同免疫疗法或涉及常规化疗和光动力疗法的组合免疫疗法。值得注意的是,本综述仅涵盖利用短肽作为治疗剂或递送支架的癌症免疫疗法,而不涉及涉及蛋白质和多肽等长序列的策略。此外,免疫治疗肽出现已有几十年,迄今为止已开发出大量用于不同治疗方式和癌症的治疗肽。为了准确说明所涵盖的参考文献,本文总结的免疫治疗肽大多是过去十年内发现的,并且肽递送平台是最近为新兴的免疫治疗方式(如检查点阻断和组合免疫疗法)创建的。基于肽的复杂特性,总结基于肽的癌症免疫治疗策略可以概述肽在免疫治疗中的应用现状,并可能刺激开发新策略以提高疗效,从而可能促进未来癌症免疫治疗的临床转化。
肽检查点阻断剂
免疫检查点是指免疫系统中存在的负调节剂,用于维持体内平衡并防止自身免疫不加区别地攻击细胞[51]然而,免疫检查点机制也可以在癌细胞中被激活,以抑制新生的抗肿瘤免疫反应,从而导致癌细胞逃逸和生长[52,53]抑制免疫检查点可以阻止癌细胞的免疫逃避,并刺激细胞毒性T细胞等免疫细胞的活性来防御癌细胞,这被认为是一种有前途且有效的癌症免疫治疗策略[54]原则上,活化T细胞表达的主要抑制性受体包括PD-1[55], 免疫细胞化学抗原-4[56], 淋巴细胞活化基因 3滞后-3 [57–59]、T细胞免疫球蛋白3(TIM-3)[60–62]以及 T 细胞免疫球蛋白和 ITIM 结构域 (TIGIT)[63–65]因此,这些受体作为靶向免疫检查点,可以开发出激活免疫反应的抑制剂,如当前临床前研究和临床试验中广泛使用的 PD-1 和 CTLA-4(图 2)[63]。
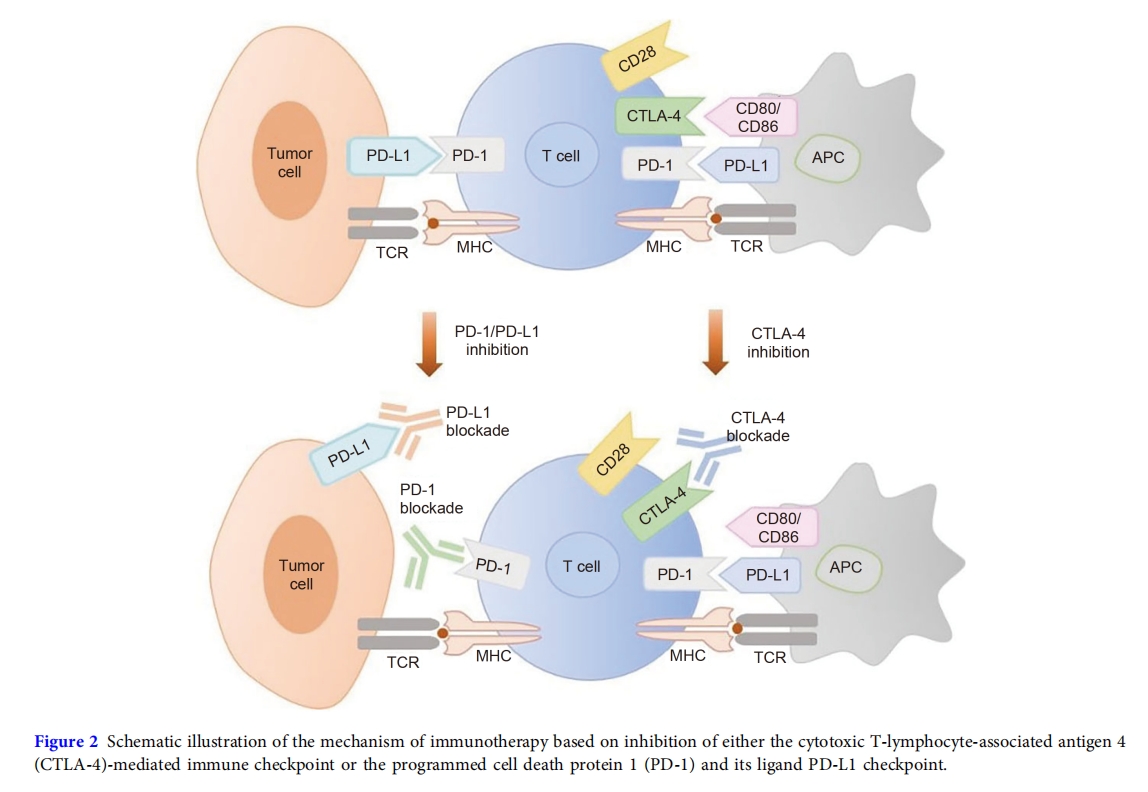
CTLA-4 是一种跨膜糖蛋白,在调节性或活化性T细胞上高度表达[66]CTLA-4与T细胞表面的共刺激分子受体(CD28)具有高度同源性,能够与B7蛋白结合,即CD80(B7-1)和CD86(B7-2),其结合亲和力比CD28高出约20倍(图 2这使得 CTLA-4 能够与 CD28 竞争 B7 结合,从而阻止 CD28-B7 共刺激信号的释放并抑制 T 细胞活化[67–69]。目前的研究表明,CTLA-4 可能通过信号或非信号通路抑制 T 细胞免疫反应。信号通路表明 CTLA-4 激活磷酸酶,使 T 细胞受体 (TCR) 的信号去磷酸化。非信号通路表明 CTLA-4 可能通过转胞吞过程从抗原呈递细胞 (APC) 的膜上捕获并去除 CD80 和 CD86 蛋白,从而减弱 CD28 激活[70,71]PD-1 是另一个属于扩展 B7/CD28 家族的免疫检查点,在活化的 T 细胞、B 细胞、自然杀伤细胞、树突状细胞和肿瘤相关巨噬细胞中高度表达[72]PD-1 蛋白由胞外结构域、跨膜结构域和胞内结构域组成。与影响幼稚 T 细胞的 CTLA-4 不同,PD-1 通常表达于成熟 T 细胞上,并调节肿瘤微环境内的效应 T 细胞活性(图 2)[73]. PD-1 的配体包括 PD-L1(B7-H1 或 CD 274)和 PD-L2(B7-DC 或 CD 273),由 APC 和肿瘤细胞表达[74,75]PD-1与其配体结合导致T细胞激酶失活和TCR信号去磷酸化,从而最终减少炎性细胞因子的产生并调节T细胞活性[76,77]因此,阻断PD-1/PD-L1通路可以维持肿瘤特异性T细胞的活性,使免疫系统重新识别和攻击肿瘤细胞,从而阻止肿瘤细胞的免疫逃避。
到目前为止,虽然常见的CTLA-4检查点抑制剂是抗体,但 PD-1 和 PD-L1 的明确序列及其复杂结构启发人们合理设计能够超越 PD-1 和 PD-L1 关联的短仿生肽(表1)尽管单克隆抗体作为PD-1/PD-L1检查点抑制剂在临床试验中取得了一定进展,但抗体的实体瘤组织穿透性差、稳定性差、生产成本高、给药途径有限、药代动力学可控性较差等问题严重阻碍了其临床转化[78,79]。此外,抗体抑制剂通过自然杀伤细胞和巨噬细胞激活细胞毒性免疫反应的能力有限。作为 PD-1/PD-L1 检查点阻断剂的肽或其他小有机分子是解决单克隆抗体这些问题的替代药物。考虑到短肽的非凡生物相容性和易于合成,基于肽的 PD-1/PD-L1 抑制剂在癌症免疫治疗中引起了广泛关注。本节主要介绍肽 PD-1/PD-L1 抑制剂的开发,并总结了临床试验和临床前试验中的可用序列。
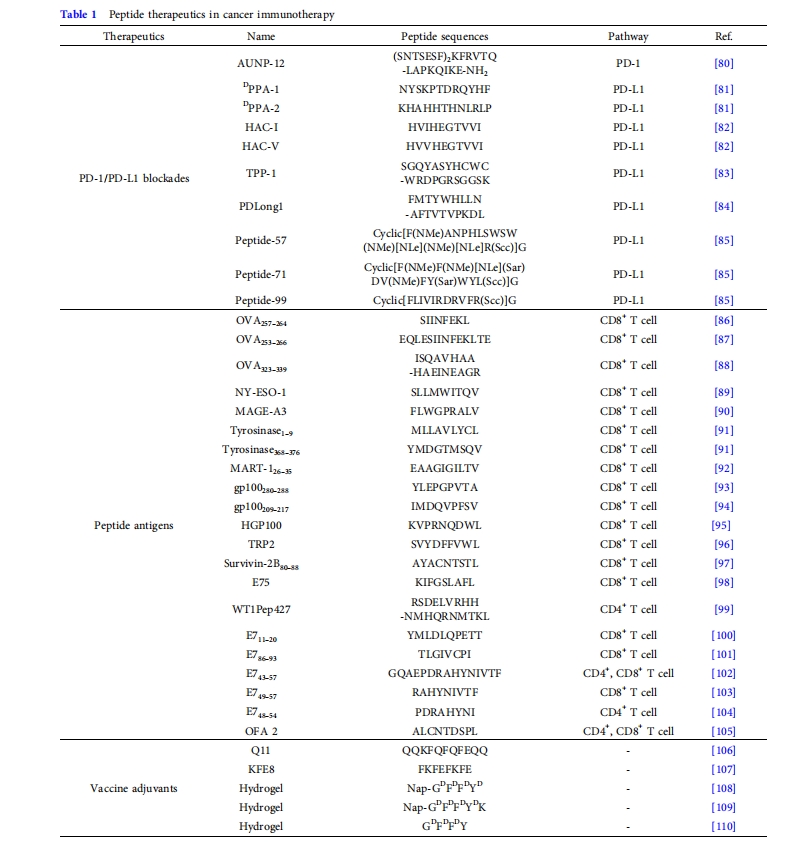
AUNP-12是先驱肽PD-1/PD-L1抑制剂之一,由 Aurigene Discovery Technologies 和 Pierre Fabre 实验室发现,与抗体抑制剂相比具有药代动力学优势,其基于人类和鼠 PD-1 胞外域内 7 至 30 聚体域的非线性组合[80]在临床前研究中,AUNP-12表现出显著的抑制多种肿瘤生长的能力,包括B16F10小鼠黑色素瘤细胞和小鼠乳腺癌4T1细胞。体内研究表明,介导干扰素γ(IFN-γ)的产生是AUNP-12抑制活性的潜在信号通路。对AUNP-12构效关系的研究表明,删除C末端8个残基或酰化N末端丝氨酸残基都会导致抑制活性的丧失,而去除分支结构域或酰化C末端赖氨酸残基则保留了活性。还发现了AUNP-12肽的短肽模拟物,与AUNP-12相比,其在癌症免疫治疗中表现出更好的活性。在此研究之后,Aurigene基于此概念开发了一系列肽模拟物PD-1/PD-L1抑制剂。
此外,Chang等人。[81]基于镜像噬菌体展示技术,开发出首个抗蛋白水解的D肽PD-1/PD-L1 相互作用拮抗剂 ( DPPA-1,NYSKPTDRQYHF)。镜像噬菌体展示技术允许使用化学合成的 D 肽诱饵筛选与L靶标结合的D 克隆。从免疫球蛋白样可变 (Ig-V) 结构域开始,作者设计了折叠IgV结构域的 D版本 ( D IgV PD-L1 9),用作镜像噬菌体展示中的诱饵肽。通过筛选 M13 噬菌体上展示的十二进制肽库,作者选择了两个D序列 ( DPPA 1: NYSKPTDRQYHF,DPPA 2: KHAHHTHNLRLP) 的频率最高。表面等离子体共振光谱估计了结合常数 (钾D PPA 1 和D PPA 2 与人 PD-1的比率为 0.51,并且1.13μmol·L −1,流式细胞术实验表明,与D PPA 2相比, D PPA 1 表现出更优异的抑制 PD-1/PD-L1 相互作用的能力。体内实验表明, D PPA 1给药抑制了36只Balb/c小鼠体内植入的CT26细胞的生长,这可能是由于激活了抗肿瘤免疫系统所致。因此,抗水解D肽具有作为癌症免疫治疗小分子药物的潜力,目前已在多项临床前研究中得到应用。
在酵母表面展示技术的基础上,Maute等人。[82]采用双文库策略,开发了与 PD-L1 具有高亲和力的竞争性肽拮抗剂,即 HAC-I (HVIHEGTVVI) 和 HAC-V (HVVHEGTVVI)。在这种方法中,源自与 PD-L1 相互作用界面的人类 PD-1 结构域的第一代文库允许识别控制高亲和力的突变残基,而第二代文库确定残基的最佳组合。结果,产生了两个仅在位置 41 处异亮氨酸或缬氨酸残基不同的 HAC 肽序列,并且所得的 HAC 序列能够与 PD-L1 结合钾D值约为100 pmol L −1。治疗研究表明,HAC 肽具有治疗小型和大型肿瘤的能力。特别是,对 HAC 肽进行放射性标记后,可通过正电子发射断层扫描成像显示肿瘤中是否存在 PD-L1,从而实现直接免疫诊断。
基于交替随机和聚焦文库筛选策略的细菌表面展示技术,Zhu 等人[83]发现了一种靶向PD-L1肽 (TPP-1, SGQYASYHCWCWRDPGRSGGSK),它与 PD-L1 具有高结合亲和力,并能抑制PD-1/PD-L1相互作用。体外和活检测显示,用 TPP-1 治疗肿瘤可激活 T 细胞并引发免疫反应,从而证明其在癌症免疫疗法中的抑制效力。Andersen 及其同事[84]设计并合成了一个源自PD-L1的T细胞表位,称为PDLong-1(FMTYWHLLNAFTVTVPKDL),其中包含一个PD-L1衍生的CD8 + T细胞表位(PDL1 15–23,LLNAFTVTV)。作者发现,用PDLong-1共刺激基于树突状细胞(DC)的疫苗接种可显著增加T细胞数量。这一发现表明,PD-L1相关T细胞的重新激活可能允许直接调节DC疫苗接种的免疫原性。此外,从百时美施贵宝开发的大环肽PD-L1抑制剂出发,Magiera-Mularz等人。[85]研究了肽-57、肽-71、肽-99这三条大环肽与PD-L1的结合亲和力。作者发现这三条大环肽均能抑制PD-1/PD-L1相互作用,并且它们与PD-L1的亲和力按肽-71的顺序进行评估>肽-57>肽-99。这些有限的例子表明,肽是新兴的检查点阻断剂,在调节免疫系统方面具有很强的效力。将肽抑制剂与肽纳米载体相结合,可以实现一种有希望的低副作用癌症免疫治疗策略。
基于肽的癌症疫苗
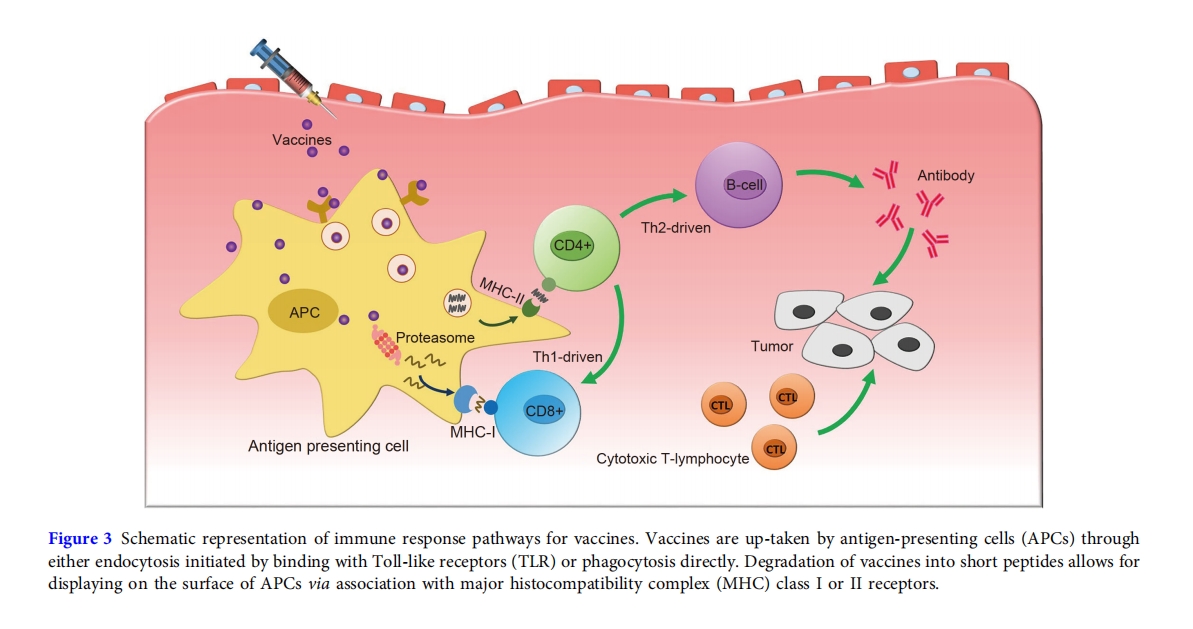
作为免疫治疗的另一种代表性方法,癌症疫苗旨在激活宿主免疫系统,利用肿瘤细胞相关抗原来抵抗癌细胞。由于抗原特异性免疫反应和长期免疫记忆,癌症疫苗在癌症免疫治疗中表现出巨大的潜力。疫苗接种可能是最经典的免疫治疗方法,从古代到现代医学都得到了广泛的应用[111]。在传统的癌症疫苗中,从不同类型的癌细胞中收集的肿瘤细胞相关抗原用于刺激 B 细胞和 T 细胞等免疫细胞。在接种疫苗期间,注射的疫苗可以通过与 Toll 样受体 (TLR) 结合引发的内吞作用或直接吞噬作用被抗原呈递细胞吸收(图 3)[112]在APC细胞中,吸收的抗原在蛋白酶体介导的过程中降解为短肽。将产生的肽展示在APC细胞表面通过与主要组织相容性复合体 (MHC) I 类或 II 类受体结合可激活免疫反应。在 MHC I 类通路中,抗原与 MHC 和 T 细胞受体 (TCR) 结合可产生 CD8 +细胞,引发细胞毒性 T 淋巴细胞 (CTL) 细胞的细胞免疫反应[113]. 然而,抗原与 MHC II 类受体结合会激活 T 辅助细胞,进而产生 B 细胞以进行体液免疫,或产生 CTL 细胞以进行细胞免疫[114,115]传统的癌症疫苗是减毒生物或病毒以及从病毒中分离出的活性蛋白亚基。尽管在某些癌症治疗中取得了成功,但传统的疫苗疗法仍然具有挑战性,主要原因是与污染物相关的免疫风险、抗原稳定性差、生产和运输到淋巴结困难以及脱靶引起的不良自身免疫等[116]。
肽抗原
最近,具有最小抗原表位与靶向受体结合的短肽由于其精确的结构和易于生产而被开发为替代疫苗[117,118]抗原对TLR或MHC受体具有足够的亲和力对于促进CD4 +或CD8 + T细胞的产生以进行免疫反应至关重要。由于短肽抗原的免疫原性有限,利用肽佐剂来协助激活肽抗原的免疫反应是一种典型的策略,事实上,迄今为止已经开发了许多肽佐剂。本节简要总结了肽疫苗,包括涉及少于20个氨基酸序列的肽抗原的设计。由于肽疫苗研究时间较长,有关肽疫苗的更详细评论已参考其他地方[111,112]。
根据生物体或病毒疫苗中天然蛋白质的序列,这些蛋白质的亚基启发设计短肽作为潜在抗原,以诱导对病毒的显着和长期免疫力(表 1根据刺激途径,设计的与MHC I类受体相关的、用于激活CD8 + T细胞的肽抗原通常由8–10个氨基酸组成,而由MHC II类受体和CD4 + T细胞加载的抗原通常具有13–18个氨基酸,尽管对肽长度没有严格的限制[117]由于个体患者的MHC受体存在异质性,临床试验中观察到对肽抗原的免疫耐受性。将靶向递送与免疫反应中的肽佐剂辅助相结合,使得肽抗原在癌症免疫治疗中仍然很有前景[119]这里我们总结了过去十年内开发的肽抗原,重点关注肽的原创性和潜在的免疫原性机制。
肽疫苗已广泛应用于黑色素瘤免疫治疗[120]. 大多数黑色素瘤肽抗原来自黑色素细胞分化蛋白,例如酪氨酸酶、MART-1(Melan-A)和糖蛋白 100(gp100)[121]并主要促进 CTL 的产生以产生免疫力。例如,酪氨酸酶是黑色素合成中的限速酶,它含有两种免疫原性肽,IE,酪氨酸酶1–9和酪氨酸酶368–376 [91]. 酪氨酸酶368–376结构域第 3 位天冬酰胺残基被天冬氨酸取代,被证实具有非凡的免疫原性。原始 MART-1 26–35结构域[92,122]在临床试验中也被用作抗原来治疗黑色素瘤患者。此外,蛋白质 gp100 中的gp100 280–288结构域[93]黑色素瘤和健康黑色素细胞均表达的 CTL 导致大部分患者产生免疫原性,尽管 CTL 产生量较低。将疫苗限制域 gp100 209–217与免疫激活剂白细胞介素 2 (IL-2) 结合可改善对癌细胞的免疫反应。亲水性表位 HGP100 25–33和酪氨酸相关蛋白 2 (TRP2 180–188 ) 内的疏水性表位是两种替代的黑色素瘤衍生抗原。Guo等人。[95]通过整合由聚(D,L-丙交酯-合作-乙醇酸酯)与抗原 HGP100 功能化,佐剂单磷酰脂质与甘露糖包被的脂质体。Mirkin 及其同事[123]将抗原 HGP100 肽附着到免疫刺激球形核酸上以开发疫苗。Wakabayashi等人。[96]利用油包固纳米分散体作为纳米载体,共递送抗原TRP-2肽,该肽经三个赖氨酸残基修饰(KKKGSVYDFFVWL)和佐剂雷西莫德(R-848)。该系统在抑制黑素瘤生长和抑制荷瘤小鼠肺转移方面表现出了强大的能力。抗原HGP100和TRP2也同时共封装到中空介孔二氧化硅纳米粒子中,可有效刺激树突状细胞(DC)及其成熟,并进一步分泌肿瘤坏死因子-α(TNF-α)、IFN-γ、IL-12和IL-4,以促进免疫[124]。
源自卵清蛋白的表位被广泛用作肽抗原,包括 OVA 257–264,OVA 253–266 ,OVA 250–264和 OVA 323–339,并通常激活 CD8 +细胞毒性 T 细胞免疫反应。利用由 60 个非病毒丙酮酸脱氢酶 E2 亚基组成的纳米胶囊,Wang 等人[86]开发了一种病毒模拟疫苗支架,该支架包裹抗原 OVA 257–264和寡核苷酸佐剂胞嘧啶-鸟嘌呤基序 (CpG)。这种多功能疫苗平台表现出协同时空递送治疗剂到树突状细胞,从而增强 CD8 + T 细胞的产生和免疫激活。此外,将 OVA 257–264表位延长至具有两个硫醇基团的 CCYSIINFEKL 允许现场制备荧光抗原-金纳米簇(肽-AuNC),其表现出增强的免疫刺激能力[125]通过在 AUNC 表面同时加载 CpG 佐剂,免疫力得到进一步提高。此外,Zhang 等人[88]创建了以成熟树突状细胞为靶点的清道夫受体B1类功能化的超小型生物相容性纳米疫苗,可有效地将包括OVA 257–264、OVA 323–339和HGP100 25–33在内的肽抗原递送至淋巴结。
膜结合糖蛋白粘蛋白 1 (MUC1) 在保护上皮表面和信号转导中起关键作用,在许多癌症(如乳腺癌和胰腺癌或骨髓瘤和淋巴瘤)中通常因糖基化突变而过度表达,从而使 MUC1 具有免疫原性[126]。这一现象启发了能够诱导 MUC1 相关细胞毒性 T 淋巴细胞反应的肽抗原的设计。MUC1 是一种 I 型跨膜糖蛋白,其特征是胞外结构域由可变数量的 20 个氨基酸重复序列 (PDTRPAPGSTAPPAHGVTSA) 组成,并且每个串联重复序列中的丝氨酸和苏氨酸残基具有高糖基化水平。因此,可以根据 MUC1 表位的糖基化来设计 MUC1 相关肽抗原。例如,Huang等人。[127]设计并合成了几种候选疫苗通过将 HGVTSAPDTRPAPGSTAPPA 序列与位置 9 或 16 的糖基化苏氨酸残基结合到组装域 Q11。这些含有 B 细胞表位的疫苗引发了显著的细胞毒性 T 细胞免疫反应,该反应由 I 型 T 辅助细胞激活。此外,Zhao 及其同事[128]还设计了基于抗原候选糖肽串联重复TSAPDTRPAP与组装序列Nap-G D F D F D Y D K共价连接的MUC1相关抗肿瘤疫苗。
除了广泛使用的黑素细胞突变蛋白、卵清蛋白和 MUC1 外,一些其他免疫原性蛋白也被用于设计肽疫苗。例如,HER2/neu 衍生的表位 E75 被设计并用于乳腺癌治疗,HER2/neu 是一种在许多上皮癌中表达的原癌基因[98]. 源自 Wilm 肿瘤蛋白 (WT1) 的 WT1 Pep427 也被发现是免疫原性抗原,并与单壁碳纳米管共价结合,以诱导快速特异性 IgG 反应[99]. 纽约食管鳞状细胞癌-1(NY-ESO-1)[89]是一种免疫原性癌症睾丸抗原,在许多人类癌症(黑色素瘤、乳腺癌)中高度表达,并能够诱导 T 细胞相关免疫。Gazzinelli 和同事[129]将抗原 NY-ESO-1 和佐剂 CpG DNA 连接到碳纳米管 (CNT) 上,开发出一种新的抗癌疫苗平台。Wang 和同事[90]采用E2病毒样胶囊同时包裹抗原NY-ESO-1和HLA-A2,以克服单个抗原免疫原性低的问题。此外,来自人乳头瘤病毒(HPV)的表位包括HPV16 E7 11–20 [100,101],E7 86–93 [101],E7 43–57 [102,103,130],E7 49–57 [101,103,131]以及 E7 48–54 [103,104]或来自癌胚抗原,包括 OFA 1、OFA 2 和 OFA 3[105]等多肽已被用作癌症免疫治疗的抗原,由此延伸而来的是新一代的多肽抗原,如多价或多功能多肽抗原、多肽鸡尾酒抗原、混合多肽抗原以及个性化多肽抗原(新抗原)等,在临床试验中引起了广泛关注,并显示出对癌症治疗的巨大潜力。
肽疫苗佐剂
用短肽设计疫苗抗原得益于其明确的结构和免疫系统内的选择性靶标。然而,肽抗原引起的免疫原性仍然不足,需要疫苗佐剂的存在。基于对抗肿瘤免疫反应的深入了解,疫苗佐剂已被广泛用于增强疫苗接种期间的免疫反应。尽管迄今为止已使用铝盐等多种佐剂进行肽免疫治疗,但目前可用的佐剂包括油乳剂、病毒体和 TLR 配体,仍然存在结构异质性问题,导致机制理解和给药困难[132,133]最近,肽组装体已被开发为均质肽抗原,主要是因为其具有在肽组装体表面展示多价抗原的能力。
Collier 团队报告了肽疫苗佐剂的开创性工作[106]其中作者将抗原 OVA 323–339附着到能够自组装成明确纳米纤维的结构域 Q11 (QQKFQFQFEQQ) 上,从而导致肽 OVA-Q11 在温和条件下组装成明确纳米纤维(图 4)。用肽 OVA-Q11 治疗 C57BL/6 小鼠导致血清中 IgG 滴度群体显著增加,从而增强了免疫原性。OVA-Q11 的这种增强的免疫原性可能归因于原纤维上表位的多价表面展示。更详细的研究表明,OVA-Q11 诱导的细胞因子反应缺乏和 IgM 反应升高,表明存在独立于 T 细胞反应的免疫原性机制。Q11 结构域还用于连接具有各种糖基化苏氨酸残基的 MUC1 衍生表位,以从表面展示 B 细胞表位的纳米原纤维中开发自佐剂抗原。Q11 结构域的替代品,Collier 及其同事[107]还将抗原 OVA 323–339连接到组装序列 KFE8 (FKFEFKFE),导致 OVA-KFE8 形成纳米纤维并激活类似于 OVA-Q11 的强抗体反应。此外,Rudra 及其同事[134]将 Q11 结构域中的天然 D-氨基酸改为 L-氨基酸,并研究了纳米纤维对 OVA 表位免疫反应的对映体效应。在对映体纳米纤维的表征基础上,作者发现与 L-对应物相比,由 D-氨基酸序列组成的纳米纤维增强了小鼠的抗体反应并延长了抗原呈递时间,这表明 D-肽在疫苗接种中具有高级性能,并且立体化学相关生物材料在调节免疫系统方面也具有高级性能。这些结果表明,利用肽组装体作为均质肽疫苗佐剂可以促进疫苗接种。
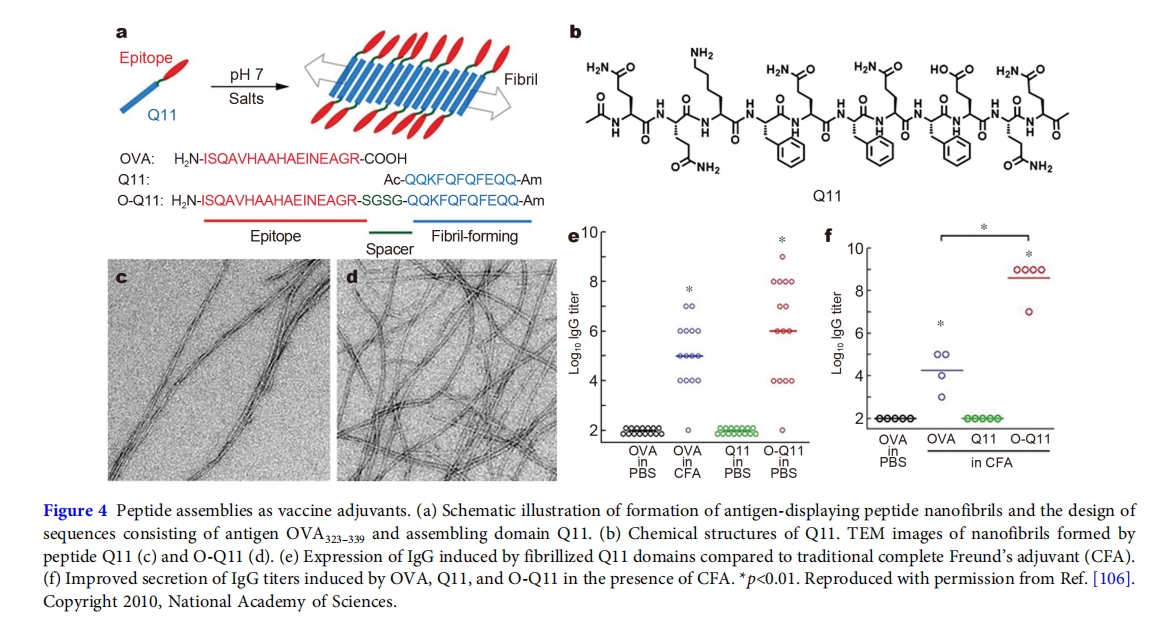
除了肽组装之外,Yang 及其同事[135]创建由肽组装体组成的水凝胶来开发疫苗佐剂,这可能会简化疫苗管理并提高佐剂的生物安全性(图 5)。作者通过合成由 D 型或 L 型氨基酸组成的肽凝胶剂,即 Nap-GFFpY-OMe 和 Nap-G D F D F D pY-OMe,研究了所得水凝胶对疫苗接种的对映体效应,这些凝胶剂在碱性磷酸酶 (ALP) 诱导的去磷酸化作用下发生水凝胶化。凝胶剂与 OVA 蛋白的共组装保持了水凝胶化行为,这意味着水凝胶中 OVA 的有效吸收。体内研究表明,两种对映体水凝胶佐剂均能有效诱导免疫抗体的产生和细胞因子的分泌,这是由于细胞对抗原的摄取增强、抗原在淋巴结的积累、树突状细胞的成熟和生发中心的形成。特别是,作者发现与 L 型水凝胶相比,D 型肽水凝胶在积累 OVA 和预防肿瘤生长方面具有更好的性能。
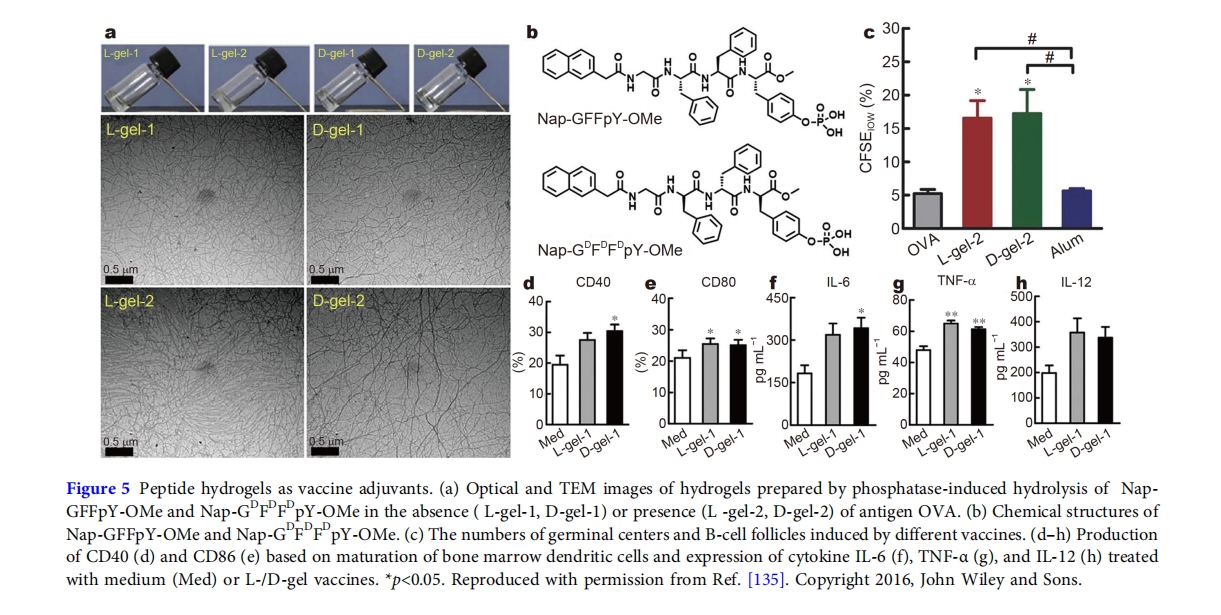
为了进一步避免酶水解引起的疫苗佐剂制备困难,作者直接从对映体肽凝胶剂Nap-GFFY和Nap-G D F D F D Y开发了水凝胶佐剂[108]。所得水凝胶的触变特性使其能够有效封装抗原OVA。此外,水凝胶还封装了X射线减毒肿瘤细胞,作为抗原治疗剂,通过CD8 + T细胞活化途径抑制肿瘤生长并延长肿瘤小鼠的生存期。与酶指导的水凝胶化类似,Nap-G D F D F D Y水凝胶在激活免疫反应方面比L肽水凝胶表现出更强大的能力。基于水凝胶佐剂的概念,一系列源自Nap-GFFY或Nap-国航序列已被开发用于疫苗佐剂。例如,在 Nap-G D F D F D Y D 的C 端添加带正电荷或负电荷的残基,可生成 Nap-G D F D F D Y D K 和 Nap-G D F D F D Y D E[109]。在包覆OVA蛋白时,带正电的多肽组成的水凝胶比带负电的多肽水凝胶表现出更好的诱导免疫反应能力,这可能归因于OVA的有效包覆。在另一个例子中,作者用非甾体抗炎药取代G D F D F D Y N末端的萘单元,从而得到几种药物修饰的疫苗佐剂[110]。结合药物的抗炎特性,吸收OVA的水凝胶在小鼠中表现出非凡的肿瘤消除能力。除了OVA蛋白外,将MUC1表位整合到Nap-G D F D F D Y D K序列中可以增强抗原MUC1的免疫原性[128]。
癌症免疫治疗中的肽组装体
尽管在一些临床前研究和临床试验中肽免疫疗法在免疫激活方面取得了成功,但在临床试验中仍然存在免疫原性较低的问题。原则上,将天然蛋白质的序列缩短至部分表位会显著削弱肽对相应靶向受体的亲和力,也增加了短肽被酶促降解的可能性,这进一步降低了肽的循环寿命和在淋巴结周围的积累。除了这些缺点之外,患者的APC细胞的异质性进一步导致肽疗法在有效免疫原性方面的挑战。基于这些考虑,探索肽在癌症免疫治疗中的其他功能变得至关重要。
肽自组装成明确的纳米结构,其形态从纳米颗粒[136]、纳米纤维[137], nanoribbons [138]、纳米管[139],到由非共价相互作用(包括疏水相互作用、氢键相互作用和 π-π 堆积相互作用)驱动的分层网络,具有解决这些问题的强大潜力。基本上,所得纳米结构是递送和展示肽疗法的理想平台,因为它们具有独特的结构特性,例如生物相容性和生物降解性[132,140]。将肽治疗剂整合到肽纳米结构中可以延长治疗剂的循环,并增加与靶向受体的亲和力,这是由多价效应引起的。此外,肽纳米结构的被动或主动靶向能力有助于治疗剂在肿瘤部位的积累。肽组装体的这些优势使肽基生物材料具有作为疫苗佐剂增强抗原免疫反应或作为免疫治疗剂递送平台的巨大潜力。本节介绍在癌症疫苗接种中使用肽组装体的癌症免疫疗法,包括疫苗佐剂或免疫治疗剂递送系统,包括基因、疫苗、抗原、检查点阻断剂、或将其与传统癌症治疗方法相结合。
疫苗递送中的肽组装体
尽管癌症疫苗在体液和细胞免疫反应中具有巨大潜力,但许多疫苗临床试验仍然受到免疫原性低的困扰。这可能是由于多种原因造成的,例如免疫抑制、T 细胞浸润不良和 T 细胞产量低。开发能够靶向抗原呈递细胞并促进抗原产生的新型递送支架可以改善免疫原性,从而可能带来积极的临床表现。与传统生物材料相比,肽组装体的精确可定制特性使其在作为癌症疫苗递送系统方面具有巨大潜力。肽组装体从作为递送平台的传统功能扩展而来,调节肽治疗剂的聚集特性还可以建立自我递送系统,称为药物两亲物[141]. 药物两亲分子的组装除了具有肽传递系统的优点外,还可增加平台表面抗原的密度,并消除药物制剂中无用成分的含量,从而降低生物安全性、降低生产成本并简化给药。将传统策略与新兴方法相结合,开发肽传递系统用于癌症疫苗以提高其免疫原性是有希望的。
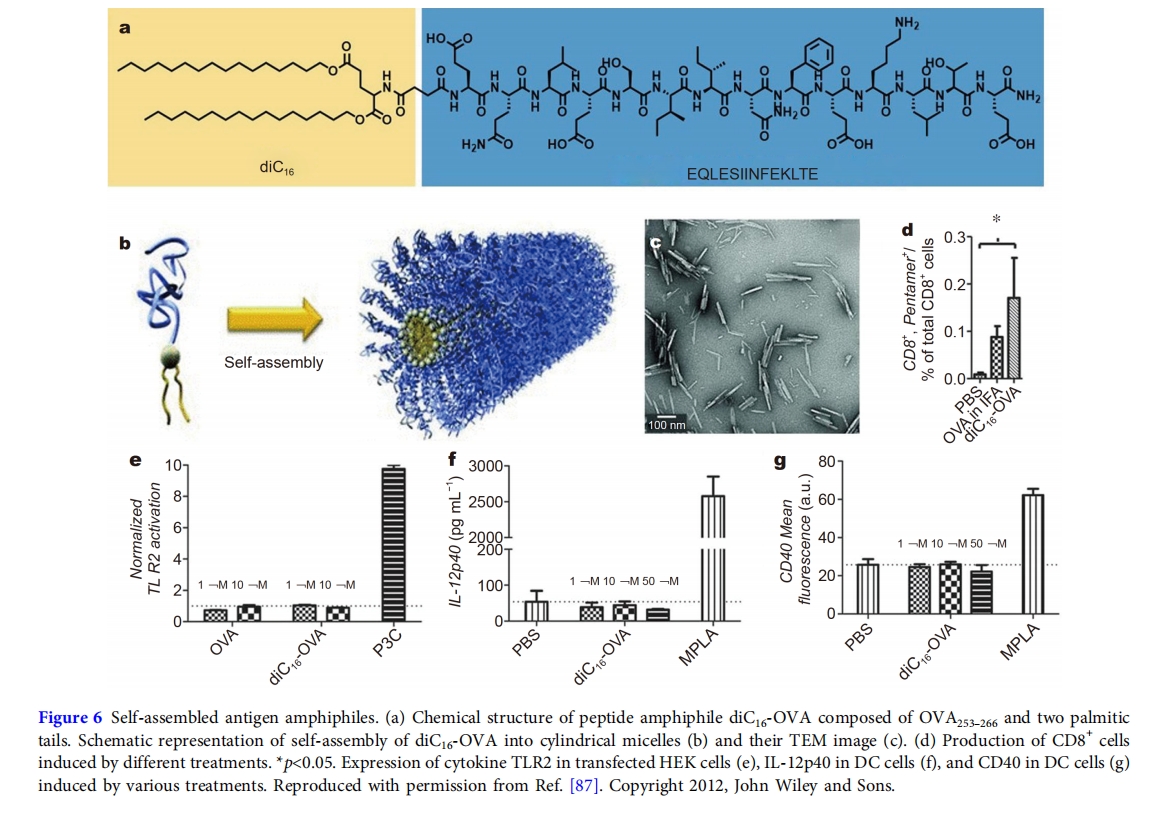
对于药物两亲物,Tirrell 和同事们[87]通过将两个棕榈酸链连接到来自卵清蛋白的细胞毒性T细胞表位,即OVA 253–266(SIINFEKL),开发了抗原两亲物的开创性工作,从而形成了抗原两亲物DiC16-OVA(图 6). DiC16-OVA 两亲分子自组装形成圆柱形胶束,直径约为8 纳米长度分布主要在200至500纳米。所得圆柱形胶束由烷基尾组成的疏水核心和展示抗原表位的亲水表面组成。在生理条件下,抗原胶束稳定,寿命超过数小时,有利于抗原运输和积累到淋巴结。细胞测定表明,在 DiC16-OVA 组装体存在下孵育细胞不会导致 DC 细胞刺激产生免疫反应。体内研究表明,对患有肿瘤的小鼠进行治疗,可通过激活细胞毒性 T 细胞免疫反应来抑制肿瘤生长并延长小鼠的存活时间。这一概念表明,抗原两亲物自组装成纳米结构是一种有效的抗原递送策略,也是开发自辅助抗原系统的有效策略。
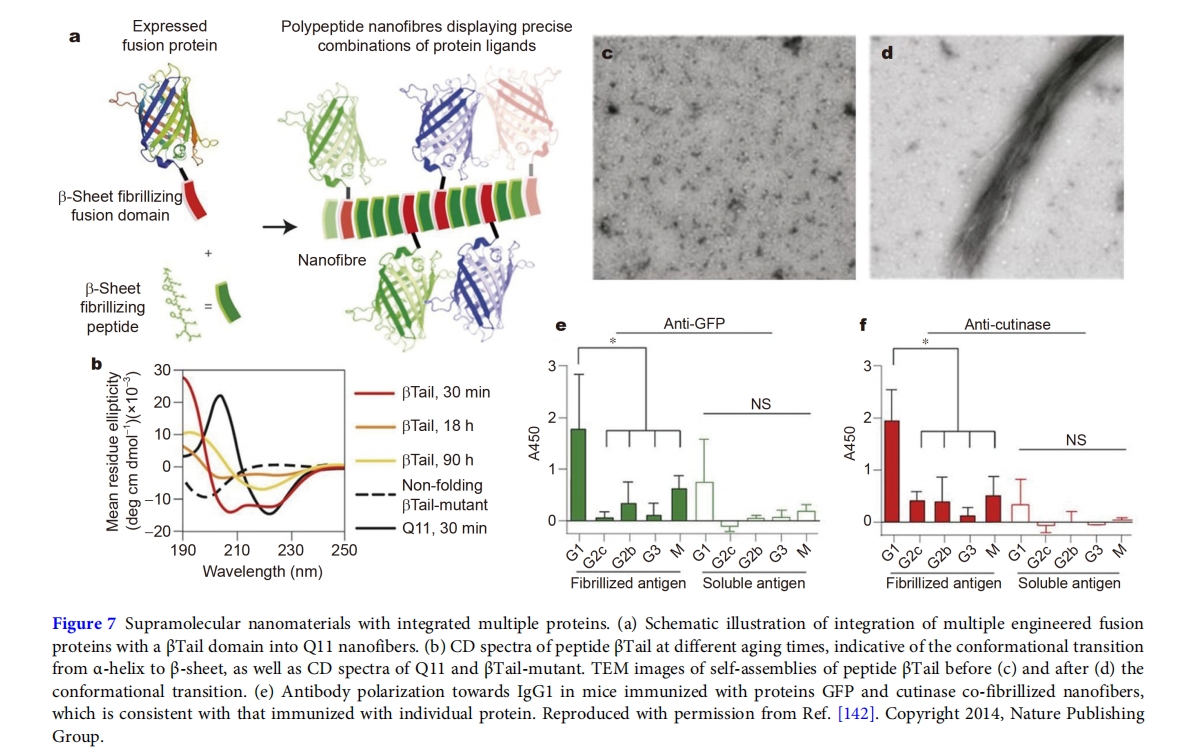
除了运送单一癌症疫苗外,肽组装体还用于以可调剂量比运送多种抗原。为此,Collier 及其同事[142]开发了一种创建肽纳米纤维的策略,该策略能够整合多种蛋白质,同时保持其独立的构象和生物活性(图7)蛋白与标签序列 MALKVELEKLKSELVVLHSELHKLKSEL 融合,称为 βTail,在溶液中会经历从 α 螺旋到 β 折叠的缓慢构象转变。将 βTail 融合蛋白 βTail-GFP 与快速组装成纳米纤维的肽 Q11 同时溶解,可使融合蛋白高效整合到纳米纤维中。纳米纤维中整合蛋白质的剂量可根据溶液中的蛋白质浓度精确调整。该方法用于将不同的蛋白质,即 βTail-GFP 和 βTail-cutinase,以可控的摩尔比整合到纳米纤维中,从而诱导单个蛋白质相关的抗体滴度。结合单个融合蛋白的佐剂性和精确整合多个蛋白质的能力,建立了一种可定制的多抗原疫苗支架,该支架的抗原优势可根据各抗原的剂量和加强剂配方进行控制。多抗原疫苗平台具有同时对不同病原体产生免疫力和对单一病原体具有高亲和力的优势,在癌症疫苗接种方面具有巨大的潜力。
组合免疫疗法中的肽组装
由于宿主免疫运作机制复杂,且个体表型异质性大,单一免疫治疗方法在大多数情况下不足以调节免疫反应,导致免疫原性较低,限制了癌症免疫治疗在临床试验中的应用。同时整合不同疗法的免疫治疗被认为是通过各种途径增强免疫反应的有效方法[143–145]此外,与化疗、光疗等传统疗法的即时治疗效果相比,免疫反应的持续时间相对较长,且免疫反应通常需要反复给药,这进一步限制了癌症免疫治疗在晚期癌症患者中的临床应用。将肿瘤的常规治疗与免疫治疗相结合可增强免疫反应,对转移性癌症的治愈性治疗具有协同作用[146,147]因此,为了有效延长患者的生存期,人们也开发了涉及传统疗法和免疫疗法的组合疗法。由于肽组装体具有共价和非共价吸收货物的固有能力,因此已广泛应用于组合免疫疗法。本节介绍了最近在利用肽组装体作为多种疗法共同递送平台进行组合免疫疗法方面取得的进展。值得注意的是,联合给药免疫疗法或使用给药增强剂的方法[38],而不是共同递送策略,本文将不予讨论。此外,使用多肽作为递送载体的策略[50]由于重点关注肽的自组装,因此也不会被覆盖。
组合免疫疗法
由肽组装体组成的肽纳米结构或水凝胶能够封装多种免疫治疗剂,从免疫原性细胞和抗体等大型物质到肽和小分子合成药物等小型物质。特别是,肽组装体的水凝胶化行为简化了注射剂的制备,并增加了给药期间肿瘤部位治疗剂的维持。此外,肽组装体可以在与癌症生物标志物或肿瘤微环境相关的刺激下进行操纵,从而有可能实现治疗剂的空间和时间按需释放。因此,利用肽组装体共同递送多种免疫治疗剂具有增强癌症免疫治疗中免疫反应的巨大潜力。这里我们总结了最近几个使用肽组件共同传递多种免疫疗法治疗剂的例子。
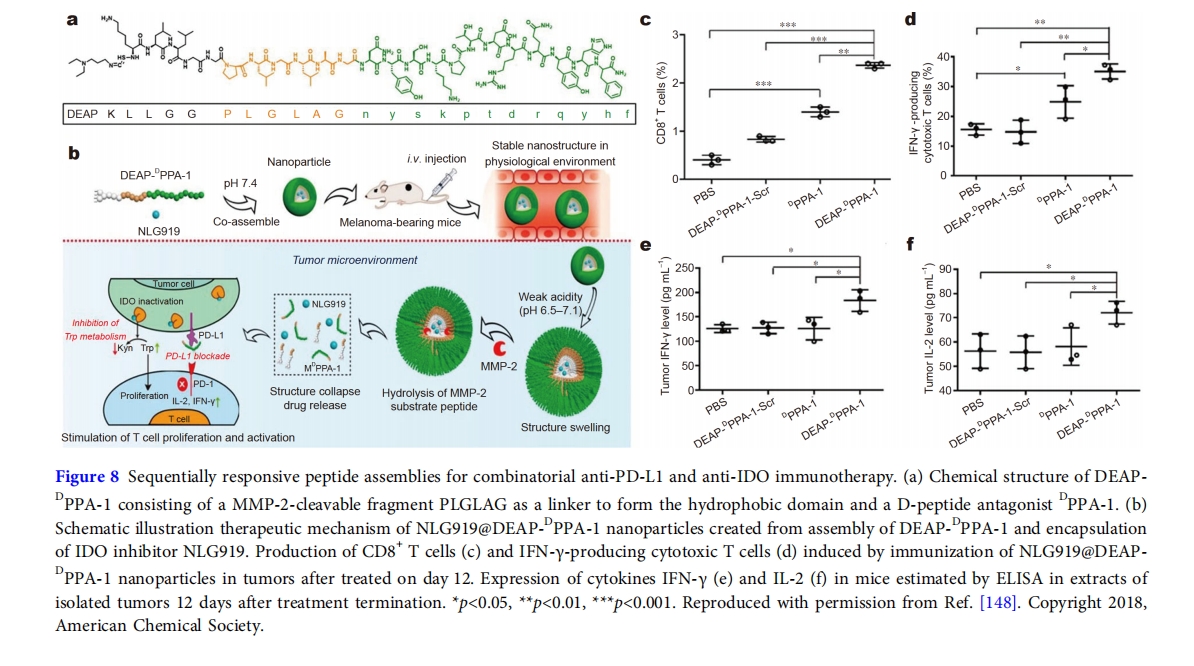
基于共递送策略,肽组装体用于共递送短肽抗原和小分子药物抑制剂。Nie 等人[148]创建了一种肽组装纳米粒子,该纳米粒子基于含有 3-二乙基氨基丙基异硫氰酸酯 (DEAP) 片段、可被基质金属蛋白酶-2 (MMP-2) 裂解的结构域 PLGLAG 和短 D 肽拮抗剂 ( D PPA-1) 的两亲性肽的共组装,其中药物 NLG919 是碘油胺 2,3-双加氧酶 (IDO) 的抑制剂,该酶是一种免疫抑制酶,因为它能够将 L-色氨酸水解为 L-犬尿氨酸 (图 8)。由于DEAP部分质子化导致疏水性降低,弱酸性微环境诱导所得纳米粒子(称为NLG919@DEAP- D PPA-1)的结构肿胀,从而促进MMP-2裂解PLGLAG结构域并使纳米粒子崩塌,从而释放上载的货物。肿瘤细胞过表达MMP-2可使拮抗剂D PPA-1和药物NLG919在肿瘤部位周围空间释放,它们分别靶向PD-L1和IDO。流式细胞分析显示,裂解的LAG DPPA-1结构域尽管增加了三个N末端残基,但仍表现出与PD-L1的强结合亲和力。在弱酸性条件下,在MMP-2存在下,NLG919@DEAP- D PPA-1处理诱导的IDO表达抑制与游离NLG919相当。用NLG919@DEAP- D PPA-1治疗患有黑色素瘤的小鼠可增加肿瘤浸润CTL的水平,从而有效抑制肿瘤的生长。
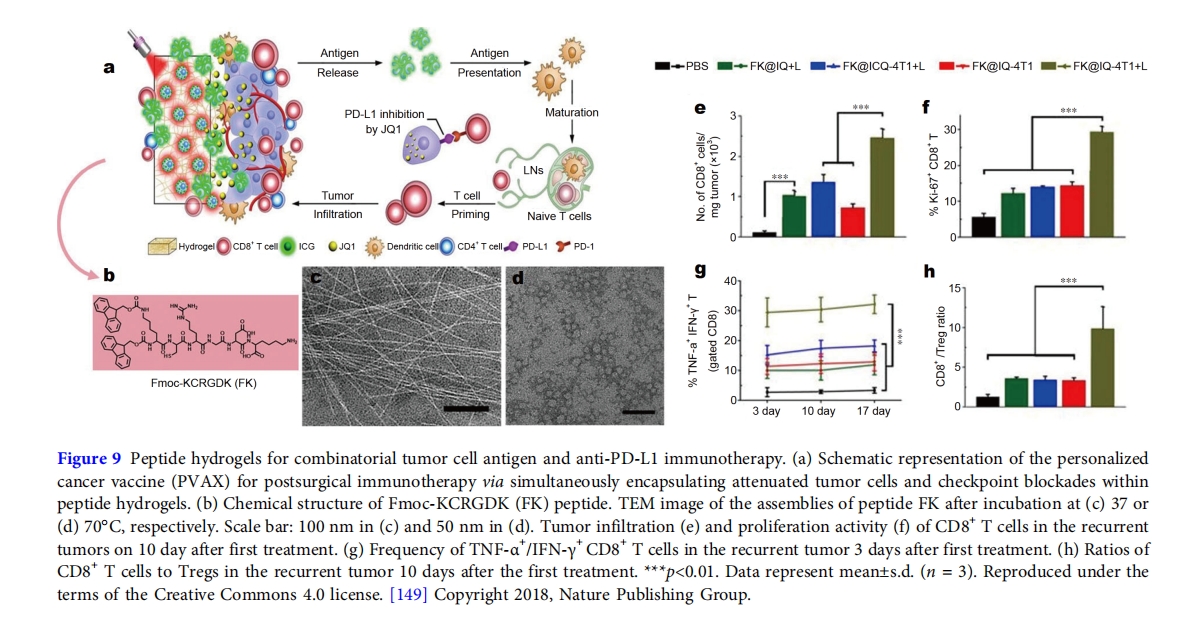
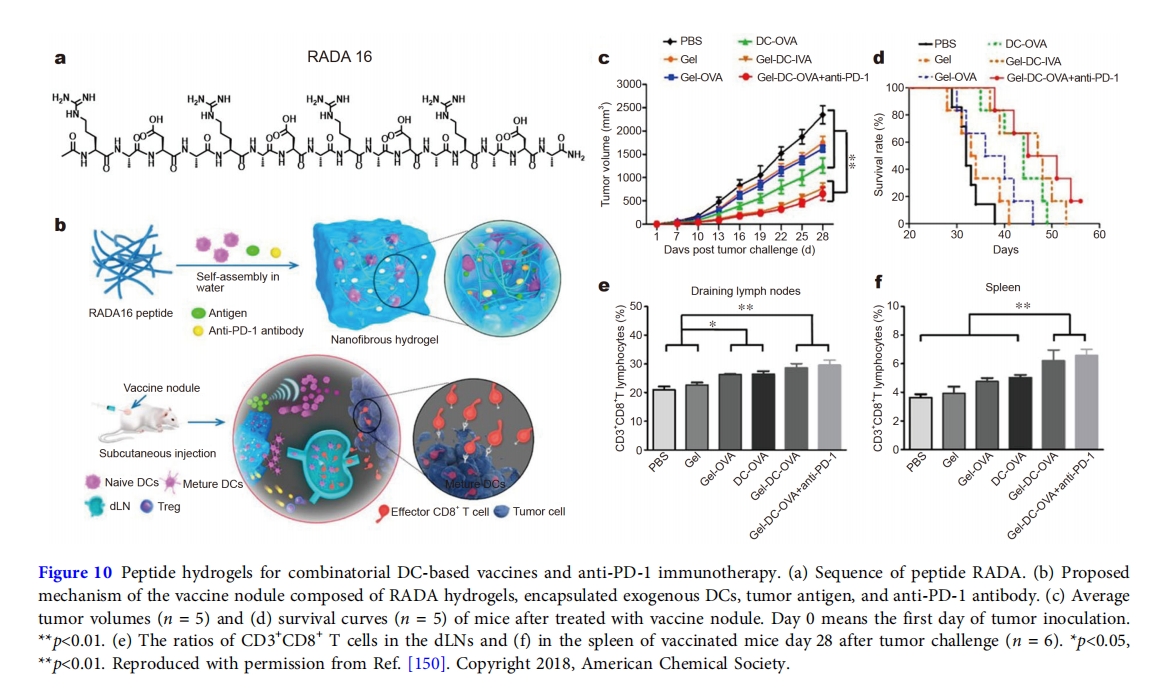
此外,杨教授利用肽水凝胶作为载体,等人 [150]形成疫苗结节通过同时将外源性DC细胞、OVA抗原、抗PD-1抗体封装于RADA16肽水凝胶中(图 10)。肽 RADA16 是一种交替的疏水和亲水序列,已被证明是一种有效的水凝胶剂,可以形成坚固的肽水凝胶[14]。将 DC 细胞封装在水凝胶中可以保持 DC 细胞的细胞活力,延长其在注射部位的持续时间,并促进其运输到淋巴结。DC 细胞和抗原的组合引发外源性和先天性 DC 相关免疫反应,从而增强抗原特异性 T 细胞免疫。将抗 PD-1 抗体额外封装到水凝胶中,通过阻止由 PD-1/PD-L1 关联引起的 MHC I 下调,促进肿瘤内 CD8 + T 细胞的增殖或浸润。虽然两者活和体外实验证实了Gel-DC-OVA疫苗能够诱导DC细胞成熟和刺激抗原特异性效应T细胞;用Gel-DC-OVA+anti-PD-1治疗小鼠可以延长荷瘤动物的生存期并明显抑制肿瘤的生长。Gel-DC-OVA+anti-PD-1诱导的超强免疫原性归因于CD8 + T细胞向淋巴结的浸润和对肿瘤内Treg细胞的抑制。
联合常规治疗和免疫治疗
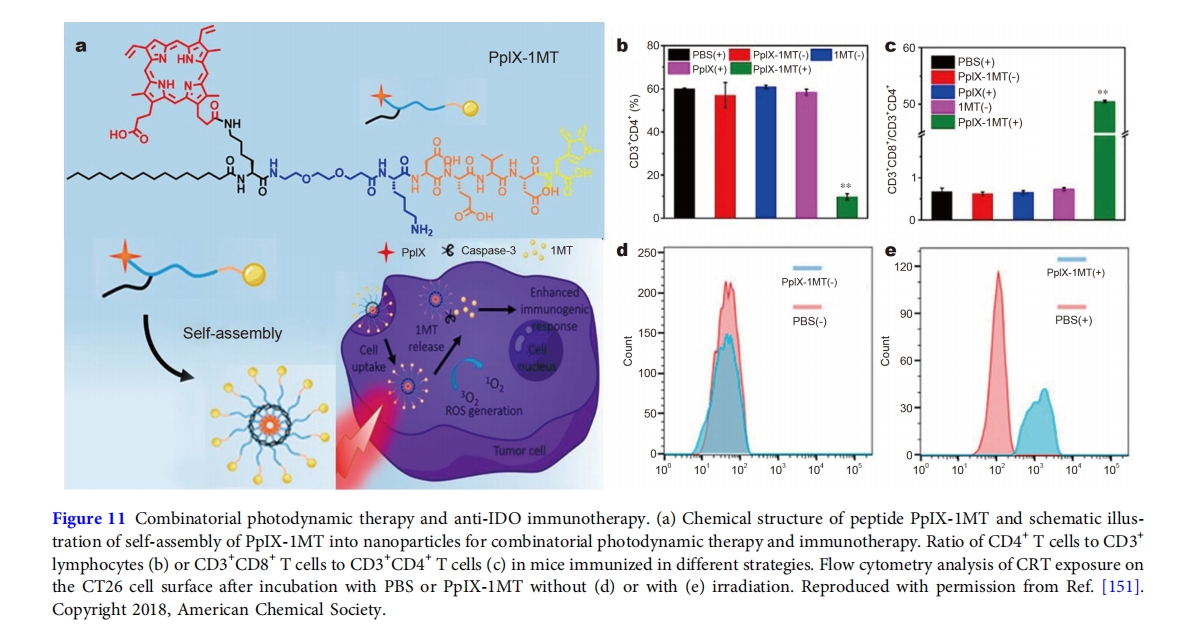
除了联合不同的免疫疗法,肽组装体还显示出在常规治疗和免疫治疗中联合给药的巨大潜力。例如,光动力疗法和化疗都能有效抑制原发性肿瘤的生长,同时也可能引起免疫原性细胞死亡,有利于免疫反应,增强抗肿瘤免疫力。因此,常规治疗与免疫治疗的联合应用表现出协同治疗作用,因此在临床前研究中引起了广泛关注。在此背景下,宋等人 [151]报道了一种由嵌合肽组成的纳米粒子,称为PpIX-1MT,用于组合光动力疗法和免疫疗法(图 11). 肽PpIX-1MT由疏水段组成,包括棕榈酸尾和光敏剂PpIX,亲水段包括短PEG链,通过caspase-3可裂解的DEVD连接子与免疫检查点抑制剂1-甲基色氨酸(1MT)连接。在生理条件下,肽PpIX-1MT聚集成纳米颗粒,平均直径约为128.5 纳米主要由疏水相互作用驱动,通过增强渗透性和滞留作用靶向肿瘤细胞。光敏剂PpIX产生的活性氧(ROS)诱导癌细胞凋亡后,caspase-3的诱导表达切割DEVD序列,从而释放1MT分子(IDO抑制剂),以防止CTL细胞的下调和Treg细胞引起的免疫抑制。流式细胞术证实了光动力疗法基于钙网蛋白在细胞表面的暴露引起的免疫原性细胞死亡,以及CD8 + T细胞免疫反应的激活。体内研究发现,将光动力疗法促进的癌细胞凋亡和免疫激活与IDO抑制引起的免疫反应增强相结合,可以达到清除原发性肿瘤和清除肺转移瘤的目的。深入研究其机制发现,光动力疗法抑制了原发性肿瘤生长,而激活CD8 + T细胞免疫反应则清除了肺转移瘤,从而建立了一种级联协同治疗策略。
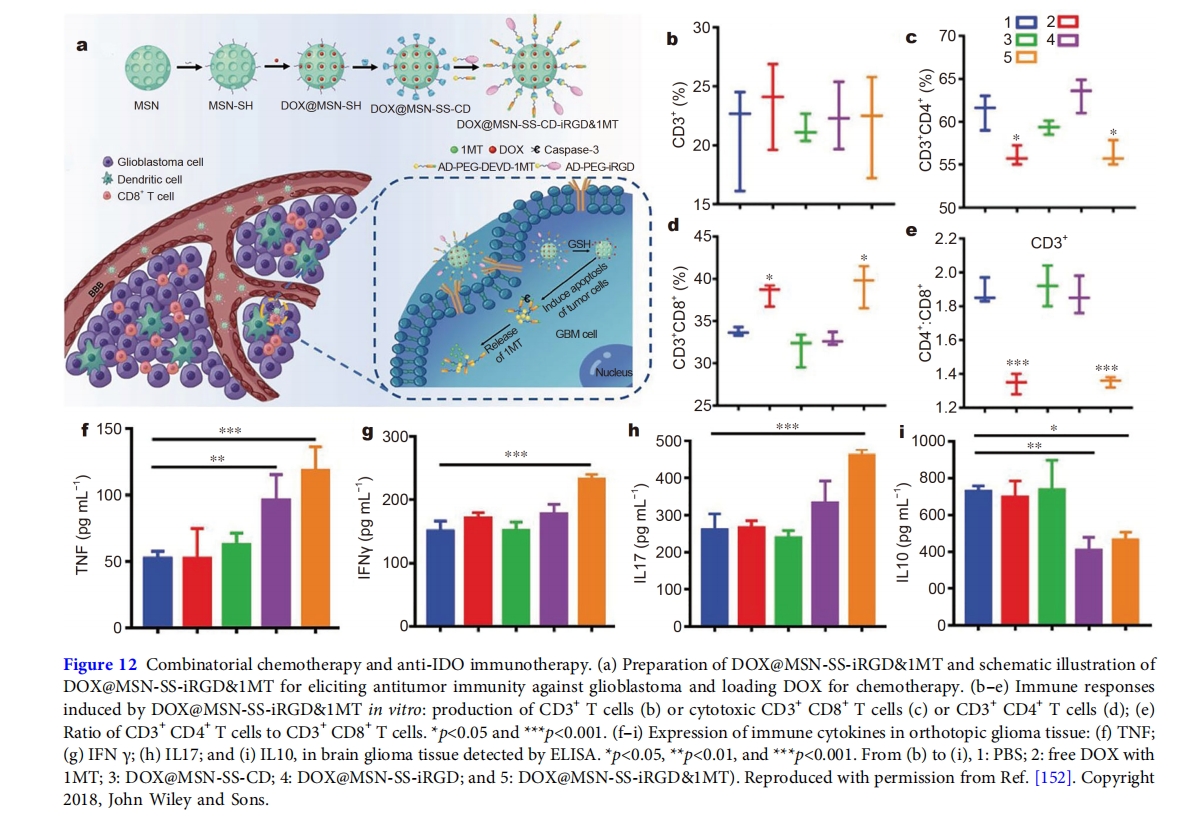
此外,张教授实验室还开发了基于同时向原位胶质瘤注入化疗药物阿霉素(DOX)和免疫检查点抑制剂1MT的联合化疗和免疫疗法治疗胶质母细胞瘤(图 12) [152]。共递送系统称为 DOX@MSN-SS-iRGD&1MT,由载有药物 DOX 的介孔二氧化硅纳米粒子 (MSN) 组成,并在表面显示免疫检查点阻断剂 1MT 和肿瘤细胞靶向表位 iRGD。而载有 DOX 的 MSN 被 β-CD 覆盖通过二硫键,表面展示部分通过 β-CD-金刚烷结合非共价连接。连接抑制剂 1MT 和金刚烷通过DEVD 结构域允许在暴露于 caspase-3 时释放抑制剂,而 GSH 还原二硫键导致 β-CD 的去除促进了 DOX 从 MSN 中的释放。体外实验表明,用DOX@MSN-SS-iRGD&1MT治疗神经胶质瘤可诱导神经胶质瘤细胞凋亡并引发抗肿瘤免疫反应。体内研究证明DOX@MSN-SS-iRGD&1MT能够穿透血脑屏障,在肿瘤部位进行空间递送和释放DOX和1MT,通过化疗和免疫治疗的协同作用,诱发CTL免疫反应,抑制Treg细胞的活化,从而延长胶质瘤荷瘤小鼠的生存期,抑制肿瘤的生长。
癌症免疫疗法因其在引发宿主免疫反应以保护局部癌细胞和潜在地诱导长期免疫记忆以防止癌症复发和转移方面的优势,在肿瘤治疗中具有广阔的应用前景。本综述从肽或肽组装体的治疗功能及其调节免疫反应的机制方面总结了基于肽的癌症免疫治疗策略。由于肽的非凡生物相容性和其蛋白质衍生的结构特征,虽然短肽已被用作检查点阻断剂、抗原和疫苗佐剂等治疗剂,但肽组装体在以可控方式靶向递送或共同递送治疗剂方面表现出了先进的能力。迄今为止,许多临床前研究发现肽类疗法具有调节免疫反应和抑制肿瘤生长的显著能力,证明了肽类免疫疗法在临床试验中的巨大潜力。
尽管在过去十年中取得了进展,但基于肽的癌症免疫疗法的临床应用仍然具有挑战性,并且只有有限的实例获得批准。主要的挑战是在大多数情况下免疫原性相对较低,这归因于许多方面[153]与抗体或疫苗等大分子蛋白相比,源自蛋白质的表位通常对特定靶标表现出较低的选择性亲和力。此外,个体中靶标或受体的表型异质性可能会进一步降低这种关联。基于临床前试验中观察到的显著副作用和综合征,肽基免疫疗法的另一个重大挑战在于给药安全性。这些副作用和综合征可能源于治疗或递送系统的生物相容性差、治疗的脱靶递送以及由此产生的自身免疫等。尽管利用肽递送系统已经提高了治疗的靶向释放效果,但在肿瘤部位定量释放货物仍然具有挑战性[154]。
考虑到上述挑战,开发具有高免疫原性和可接受的给药安全性的制剂将成为肽类免疫疗法的未来发展方向。关于新疗法的开发,多价肽检查点阻断剂、抗原和新抗原的设计[155]是一种多功能策略,可提高治疗剂与靶标底物的亲和力,从而可能引发高免疫反应[156]。通过创建新的递送系统,可以增加淋巴结中活化 T 细胞的浸润和积累,或整合具有协同作用的多种免疫疗法,可以潜在地改善免疫原性。特别是,建立多生物标志物控制的药物释放和将多个靶向引导表位纳入递送系统可能会防止治疗剂的脱靶释放。此外,基于相塌陷的药物两亲分子自组装也已被开发为一种新的药物递送策略,其中配方中几乎不存在无用物质,因此可能提高载体安全性。结合这些想法,基于肽的癌症免疫疗法是未来癌症治疗的一种有前途的策略。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。