
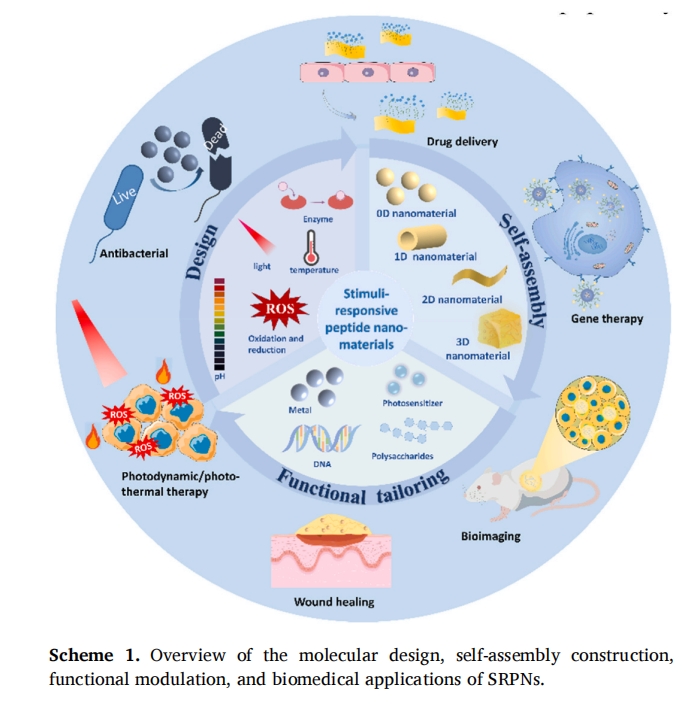
摘要:肽分子具有设计灵活性、自组装能力、高生物相容性、良好的生物降解性和易于功能化等特点,使其作为多功能生物材料在组织工程和生物医学中得到广泛应用。此外,用其他添加剂组分对自组装肽纳米材料进行功能化可增强其刺激响应功能,促进由内部和外部刺激引起的功能特异性应用。在本文中,我们展示了肽基纳米材料在肽分子设计、自组装、功能定制和生物医学应用方面的最新进展。分析了设计和合成具有不同维度的单、双和多刺激响应肽基纳米材料的策略,并讨论了肽纳米材料与金属/金属氧化物、DNA/RNA、多糖、光敏剂、二维材料等活性成分的功能调控。此外,还介绍和讨论了具有温度、pH、离子、光、酶和 ROS 响应能力的基于肽的纳米材料的设计,用于药物输送、生物成像、癌症治疗、基因治疗、抗菌以及伤口愈合和敷料应用。这篇全面的综述从分子生物学、材料科学和纳米技术的角度提供了关于肽纳米材料合成的详细方法和先进技术,这将指导和启发具有特定和多功能肽的分子水平设计,用于功能特异性应用。
1 介绍
肽作为生命活动的基本物质之一,主要直接或间接地参与许多生理过程。肽由不同排列方式的氨基酸之间通过酰胺键连接,具有丰富的可设计性和多样的结构。基于肽的自组装特性,可以设计和组装不同形貌的肽纳米材料,而氨基酸侧链的可修饰性也为自组装肽(SAP)纳米材料提供了广阔的应用前景[1–3],通常情况下,肽的自组装行为可以由内部或外部环境刺激触发,因此刺激响应肽纳米材料(SRPN)的设计和开发是推进肽纳米材料在生物医学和组织工程应用的重要组成部分。[4,5]。
SRPNs的自组装往往需要外界刺激肽链上的特定位点作为驱动力,温度、pH、金属离子、溶液类型等均可引发肽链的自组装行为。此外,对肽链进行修饰也可实现对特定物质的响应[6–9],基于多肽的可设计性、可修饰性以及环境友好的合成方法,设计出可用于不同环境的SRPN为生物医药的发展提供了更多的选择。然而多肽分子的固定性在一定程度上限制了其功能多样性的发挥,因此充分利用氨基酸侧链基团的丰富性和多肽的可修饰性对多肽进行功能化尤为重要。[10–12]。可以寻找合适的材料进行肽功能化,以合成SRPN,其可以在pH、温度、酶、活性氧(ROS)和光等条件下发生行为变化[13–16].刺激响应特性对于药物输送、肿瘤诊断、生物成像和生物传感器等生物医学应用非常重要。[17–19]。
根据不同的生物医学需求设计不同的SRPN具有很强的针对性,能够在刺激下快速精准定位并产生特定的行为变化。例如,恶性肿瘤周围的微环境往往呈酸性,特定蛋白质、酶等物质增多。首先,基于肿瘤微环境(TME)的这一特性,设计SRPN在TME的刺激下实现药物释放、光热治疗(PTT)或成像引导具有广阔的应用前景[13,20,21],其次,炎症微环境中ROS的产生为以ROS为基础的SRPNs提供了明确的靶点。此外,利用DNA或RNA对SRPNs进行修饰,可以实现基因传递体内并从内部诱导病变细胞的程序性凋亡[22]。更重要的是,SRPN能够在目标刺激的影响下实现不同尺寸的肽纳米材料。尺寸较大的SRPN往往具有更高的比表面积,并且更难进入细胞或组织。先前的研究表明,温度或pH刺激使肽纳米纤维(PNF)和肽纳米颗粒(PNP)之间的转变更适应生理环境[23肽纳米材料在刺激下发生的形态变化有利于促进SRPN进入靶位并聚集,从而发挥更好的功能和治疗效果。
2 刺激响应肽(SRP)的设计
通过添加特定的功能化成分,可以很容易地对肽进行化学修饰,形成对外部和内部刺激有反应的SRP。24SRP在受到单一或多重刺激时可以组装成不同尺寸和形状的纳米结构。当受到单一或多重刺激时,SRP可以自组装、拆卸或基于化学键合改变尺寸和形状。从制备角度来看,SSRPN的特点是制备简单,纳米材料可以很容易地设计为对单一环境作出反应。但人体环境的复杂性通常需要SRPN对多种触发因素作出反应。双重或多刺激反应可以结合内源性和外源性刺激,在靶向递送方面表现出更高的精准度和可控性。此外,双重或多刺激反应不仅对药物针对的单一刺激作出反应,当多种刺激同时触发时也会表现出增强的效果。因此,本节讨论了单一刺激响应以及双重和多重刺激响应对肽纳米组分的影响。
SSRPN 可以通过将肽与功能性连接体交联或通过简单的偶联反应或开环聚合 (ROP) 反应来制备。当受到 pH、GSH 和 ROS 的影响时,设计的 SRPN 会随之发生变化。在本节中,我们展示了不同类型的 SSRPN 的分子设计和合成。
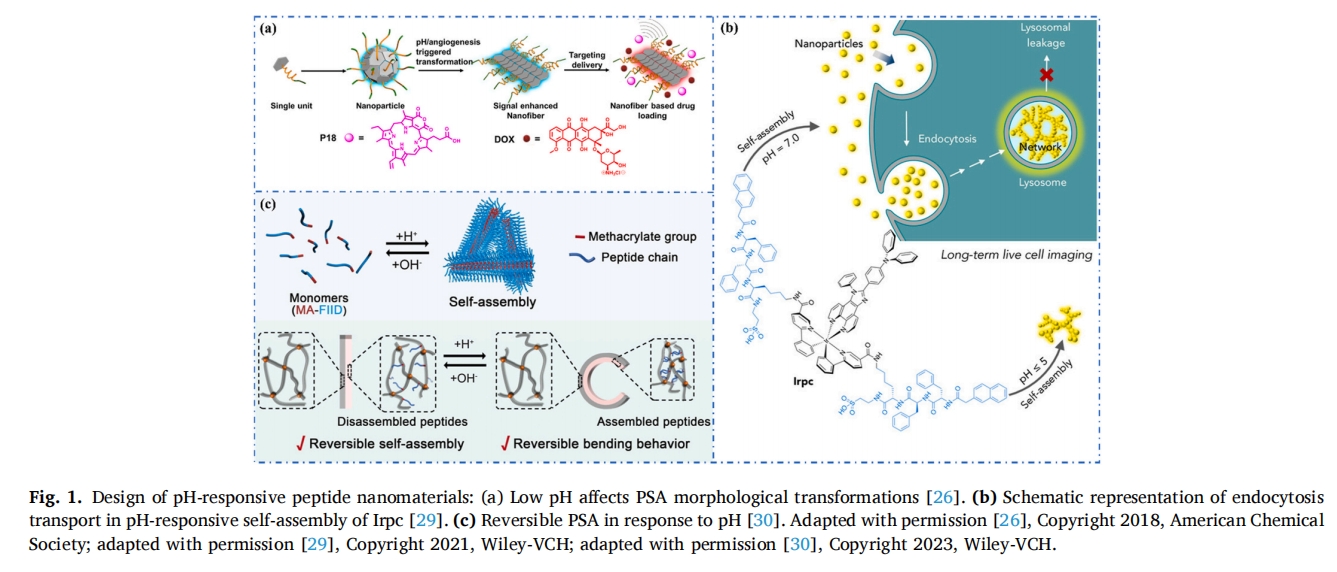
此外,L-Phe-L-Phe(FF)及其衍生物在不同条件下可以自组装成不同的纳米结构[28].考虑到溶酶体的酸性环境,金等人选择了具有聚集诱导发光(AIE)特性的双环金属铱(III)(Ir)作为核心,连接两个羧基,形成Irc复合物[29],萘-苯丙氨酸-苯丙氨酸-赖氨酸(Nap-FFK)与核心Ir(Ⅲ)连接,实现π-π相互作用,促使PSA形成复合物Irpc,实现在溶酶体中的长期荧光成像。图 1b) Irpc在pH 7.0~8.0时以大分子纳米颗粒形式分散,在pH 6.0时转变为小分子颗粒,在溶酶体微环境(pH 4.0~5.0)中,小分子颗粒连接成纳米颗粒网络,利于溶酶体内吞,因此,这种具有良好生物相容性的肽基纳米探针可实现长期溶酶体成像。
pH 依赖性 PSA 的形成和解离表现出极好的可逆性,这为肽基水凝胶的体积收缩和膨胀提供了驱动力。例如,Bao 等人报道了一种 pH 敏感肽 (MA-FIID) 的设计,它既有疏水端,又有 pH 敏感的天冬氨酸 [三十将MA-FIID肽负载到聚N异丙基丙烯酰胺(PNIPAM)骨架上,利用不同条件下肽的解离和重新组装,构建双层和非均质水凝胶(图 1c).MA-FIID肽在pH刺激下的自组装和解组装为这些含肽水凝胶的可逆弯曲和拉伸提供了动力,为智能水凝胶材料的生产提供了一种新方法。
在另一个案例中,Pahovnik 等人开发了一种可生物降解的 pH 响应肽水凝胶[31].该水凝胶以I-谷氨酸(Glu)为主要成分,通过等摩尔比原理将Glu与I-胱氨酸交联或与I-赖氨酸或I-苯丙氨酸共聚,形成3种类型的SAP水凝胶(P(Glu)、P(Glu-co-Phe)、 P(Glu-co-Lys))。研究发现,pH值的变化影响水凝胶对缓冲液的吸收,与P(Glu-co-Lys)水凝胶在pH值小于4或大于9时表现出较高的缓冲液吸收率不同,含有P(Glu)和P(Glu-co-Phe)的水凝胶随着pH值的升高吸收性更强。
酶是维持生物体正常生命活动不可缺少的基本物质,其催化反应具有高效、温和、特异、灵敏等特点。多种疾病的病理组织微环境中都存在酶的异常过表达,包括基质金属蛋白酶(MMP)、透明质酸酶(HAase)等。酶响应系统因反应条件温和、副作用小而受到越来越多的关注[32],将其掺入聚合物、蛋白质或药物中,实现药物靶向输送、疾病诊断、控制释放、增强细胞渗透等领域的应用[33,34]。
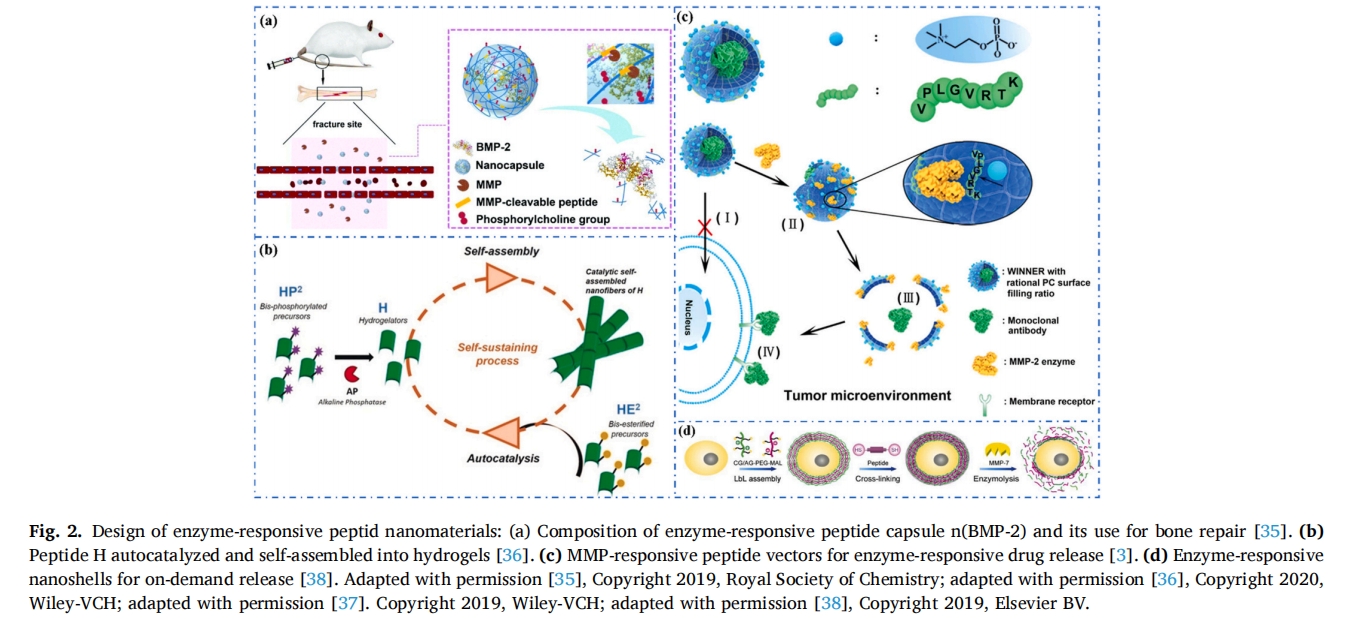
在另一项研究中,Fores 等人展示了一种催化生长的超分子水凝胶 (CASH) [36],设计了一种两亲性二酯基七肽HE2,两个酯基水解后剩下一个七肽H(Fmoc-GFFYGHY),再利用磷酸基修饰七肽H的酪氨酸得到HP2 ( Fmoc-GFFpYGHpY),在碱性磷酸酶(AP)催化作用下释放出七肽H,同时七肽H可以自组装成纳米纤维,随着时间推移纳米纤维不断生长并自组装成水凝胶(图 2b).通过酶的生物催化引发和定位来合成水凝胶是一种新技术,这是朝着模拟细胞生长和繁殖行为的局部自组装策略的发展迈出的重要一步。
将药物与MMP反应肽整合,实现酶反应性药物释放,也是治疗疾病的一种潜在方式。Li等人设计了一种简单灵活的策略来制备酶反应载体(称为WINNER),用于精确递送细胞外功能性蛋白质药物(图 2c)[37],WINNER的外壳由磷脂酰胆碱(PC)(填充比例50.5%~58.3%)和MMP-2酶反应肽(VPLGVRTK)组成,起到保护内部蛋白药物的作用,WINNER的外壳可以保护其不被正常细胞摄取,当其在肿瘤部位富集时,过表达的MMP-2被外壳酶位点特异性识别,帮助载体将内部功能性蛋白药物释放到细胞外,与肿瘤细胞表面受体结合,达到有效抑制肿瘤生长的目的。
此外,用薄而稳定的膜或半透性水凝胶包裹细胞可以降低免疫力并增加细胞活性。与其他方法相比,纳米壳封装效率更高。例如,已经合成了酶反应肽纳米壳来封装 HeLa 细胞和人骨髓间充质干细胞 (hMSC),从而提高了癌症治疗的效率 [38]。高度稳定的酶响应纳米壳是由带相反电荷的聚乙二醇(PEG)-明胶逐层(LBL)和半胱氨酸封端的肽接头(序列CGGPLGLAGGC)自组装而成的(图 2d).当酶反应纳米壳被运送到肿瘤部位时,高浓度的MMP-7诱导酶反应肽的裂解,随后PEG-明胶壳解离,并促进HeLa细胞和hMSC的释放。
ROS是一类由氧衍生的化学物质(例如羟基自由基、过氧化氢、超氧化物、ETC。活性氧(ROS)是体内产生的一种重要物质,在病理过程和生理代谢中起着不可替代的作用。当细胞或组织中ROS过量产生时,通常会导致氧化应激效应,破坏细胞稳态,从而影响一系列病理状况[39,40]。
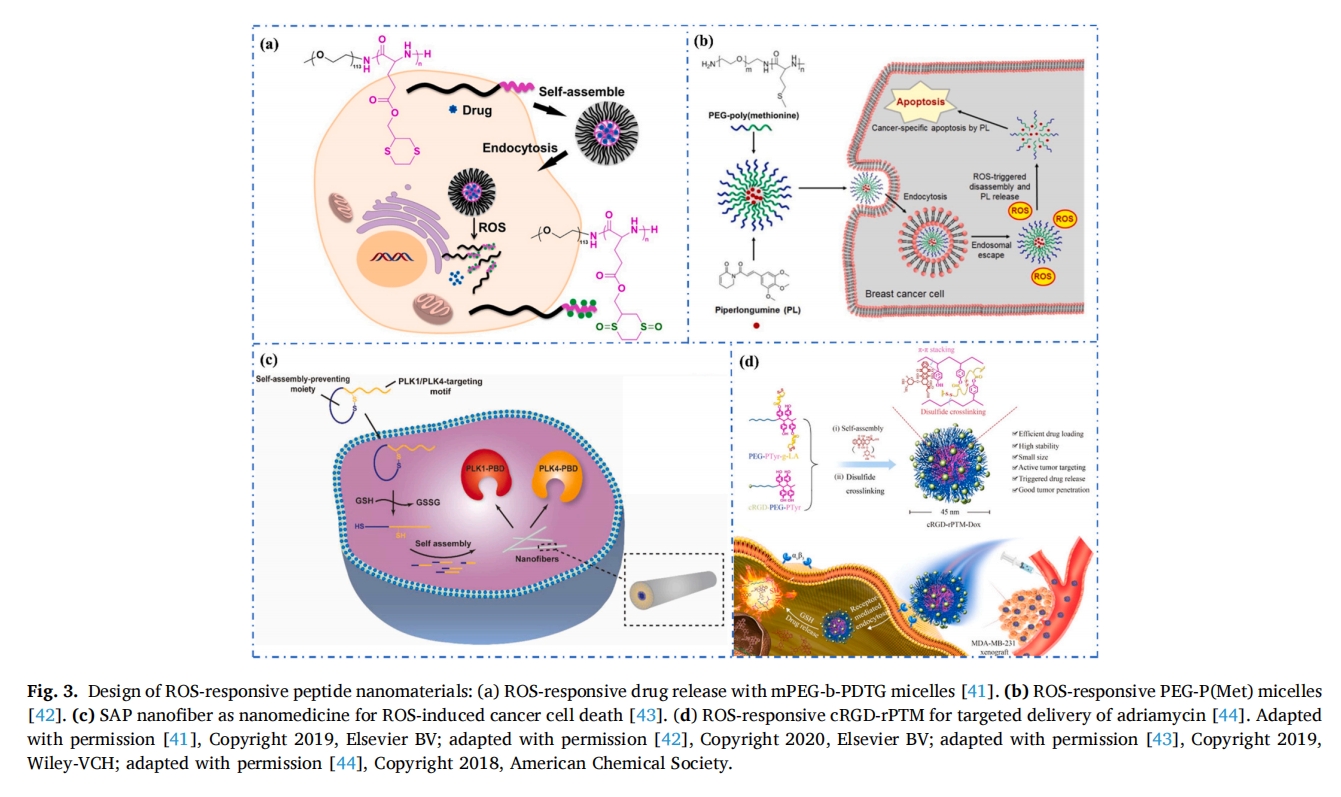
相比之下,还原性分泌物(如 GSH)为检测和杀死细菌提供了另一种可能的方法。在 TME 中,GSH 至少比健康组织中高十倍。值得注意的是,Yang 等人合成了一种能够响应还原性 GSH 的环肽前体,用于合成 ROS 响应性超分子纳米药物 [43],环肽前体进入癌细胞后,由于胞内GSH浓度较高,导致PSA中二硫键减少,形成纳米纤维(图 3c).该生物活性纳米纤维能特异性结合Polo样激酶(PLK1和PLK4),导致人类宫颈癌细胞凋亡,是一种有效的治疗宫颈癌的抗癌纳米药物。
此外,Song 等人设计了一种基于 PEG-b-聚(I-酪氨酸)硫辛酸(PEG-b-PTyr-LA) 偶联物,其表现出小尺寸和稳健性,可负载阿霉素并具有高效的靶向递送特性(图 3d)[44],当肽胶束到达肿瘤微环境后,cRGD可以选择性地与整合素αvβ3和αvβ5特异性结合,实现靶向递送,进入肿瘤细胞后,在高浓度GSH的作用下,纳米胶束中二硫键还原,释放药物,对乳腺癌的治疗效果更为显著。
除了许多内源性刺激外,外源性刺激也会对 PSA 产生不同的影响。温度作为影响肽发生结构变化和自组装的因素已被广泛研究[45],例如,Barker 团队设计了两种弹性蛋白样肽(ELP)(序列(VPGXG)n,其中X是除脯氨酸以外的任何氨基酸)二嵌段(A80-I60,P40–I60)[46]。当温度依次升高至I60、A80和P40的转变温度时,I60首先发生坍缩,形成胶束壳。然后A80肽从纤维蛋白原上脱离,最后P40收缩形成微尺度簇。该PSA系统可以触发原位响应温度刺激的释放行为。
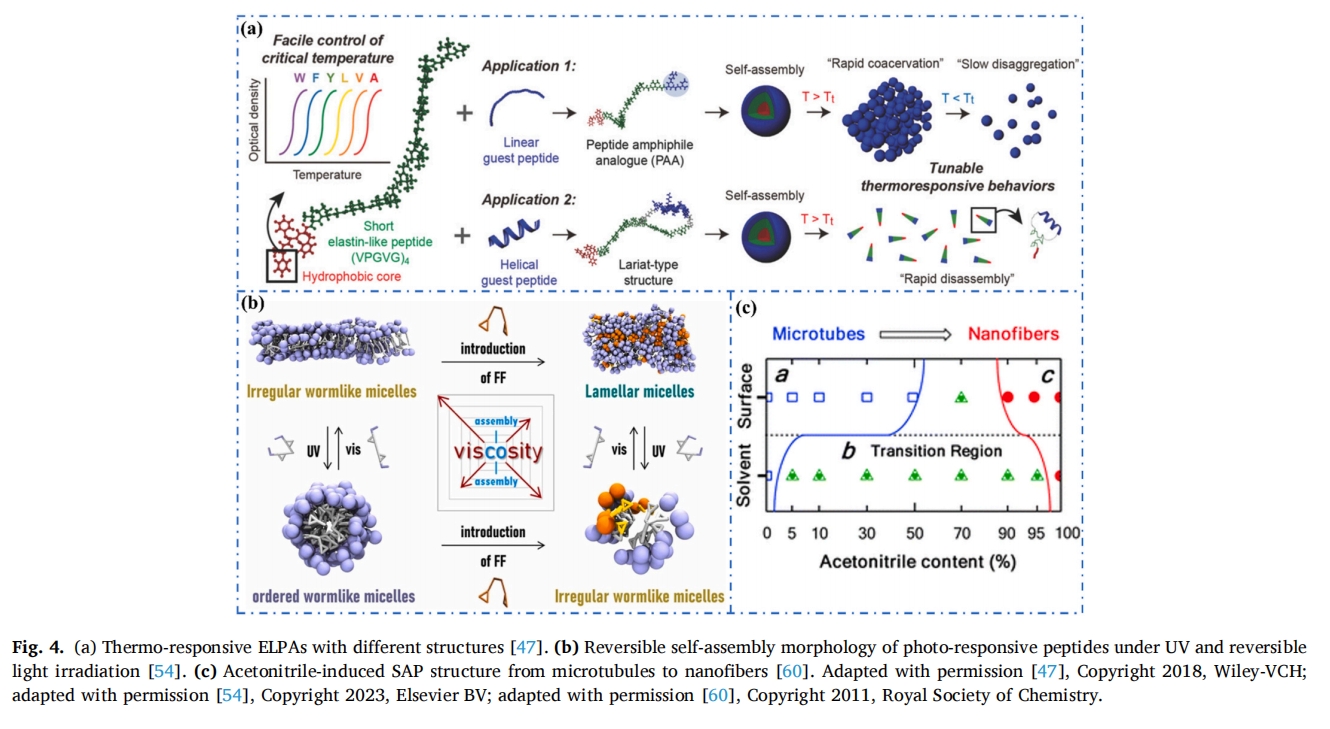
在另一个案例中,Basheer 等人设计了基于低临界温度(LCST)的弹性蛋白肽(EBP)和基于高临界温度(UCST)(LCST < UCST)的弹性蛋白肽(RBP)的二嵌段共聚物肽[四十八]。通过调节温度研究了EBP-RBP二嵌段共聚物的PSA行为的变化,发现当温度低于LCST和UCST时,EBP保持水合状态,RBP发生聚集,导致二嵌段共聚物肽自组装成胶束或囊泡。当温度高于LCST和UCST时,EBP和RBP表现出相反的行为,纳米结构发生逆转。这种温度响应性共聚物肽在温度的刺激下可以自组装成不同的纳米结构。
在众多外源刺激中,光刺激具有非侵入性、时空选择性强等特点,成为近年来研究的热点之一。49,50许多光响应分子通过形成或断裂键来对光做出反应,从而引发几何形状的变化。51例如,Pal 等人利用紫外线照射实现了肽(NVFFAC)从一维纳米纤维到二维纳米片的自组装[52]谢等人利用三叉神经创建了一种抗菌系统β-环糊精(三β-CD) 和含有偶氮苯侧链的带正电肽。它们都经历了动态自组装,形成了具有高表面电位的微尺度层状结构[53在紫外光照射下,偶氮苯与三β-CD被弱化形成小而稳定的纳米球,该体系与可控光响应PSA相结合,为抗菌材料的制备提供了新思路。
在 Wang 等人的工作中,双偶氮苯丙氨酰丙氨酸 (FA) 实现了不规则纳米网络的自组装[54]如图所示图 4b,紫外光照射使胶束形貌由网状变为规则的蠕虫状胶束,可见光照射后形貌发生逆转,在FA中加入二苯丙氨酸(FF)后,胶束形貌由不规则的网状变为层状,紫外光和可见光照射也实现了胶束形貌的可逆转变。
Xiang 等人设计了一种具有高聚集倾向的光响应肽 (DDFFFKK)[55]。二肽(KK)的存在导致PSA无法与水反应,而光照可以去除KK,进而引发PSA进一步形成SAP水凝胶。同时,他们设计了光响应肽Fmoc-KDFFFNBKK,实现了时空精准可控的光响应水凝胶。此外,控制光照时间可以调控形成的水凝胶的机械强度,拓展其在生物医学领域的应用。
显然,前面提到的pH、酶、ROX、温度和光刺激都会对PSA产生影响。除了这些可以调节肽行为的因素外,还有其他因素可以引发PSA行为的变化,例如离子反应、溶剂反应等。
许多多肽可以通过配体结合作用与金属离子自组装成不同形貌的纳米结构,在多肽体系中引入金属离子可以激发多肽构象发生改变,从而导致多肽纳米材料的性质和性能发生显著变化。56,57Ulijn课题组设计了三肽FFD和GHK的共组装纳米结构,并证明了PSA行为可受到金属离子的影响[58]。由于静电相互作用,共组装的FFD-GHK缀合物在水中形成纳米带结构。加入Cu 2+后,刺激肽与Cu 2+络合,SAP结构从纳米带变为纳米纤维,纳米纤维缠绕形成水凝胶。此外,为了研究不同金属离子对PSA的影响,Cienfuegos等人分别将Cs +和Ca 2+添加到Fmoc-FF肽溶液中[59]。在加入Cs +的溶液中,肽自组装成尺寸均匀的纳米棒,然后纳米棒聚集成纤维。在这两种情况下,最终都可以得到肽水凝胶。然而,加入Cs +形成的水凝胶的机械强度比在Ca2+存在下形成的水凝胶要弱得多。这是因为Cs +倾向于稳定水-溶液界面,从而减弱疏水相互作用并促进亚稳态中间体的形成。相反,Ca2 +破坏水溶液界面的稳定性并增加疏水相互作用,导致 PSA 变成更大的纤维聚集体并形成具有更高机械强度的水凝胶。
二肽FF可以自组装成纳米管或纳米纤维。Huang等探究了FF在不同溶剂中的自组装行为[60他们发现PSA从微管到纳米纤维的结构转变更有可能发生在以乙腈为共溶剂的水相中(图 4c).当增加乙腈比例,直至溶剂为纯乙腈时,微管含量逐渐减少直至消失,得到尺寸均匀的纳米纤维。
显然,SSRPN 在受控和特定应用方面具有显著优势。然而,由于目标位点微环境的复杂性,单一的刺激-反应可能无法准确实现预期结果。[61]因此,许多研究人员一直致力于开发双重或多重刺激响应肽纳米材料(DSRPN或MSRPN),以实现更精准的治疗。
在所有的DSRPN和MSRPN中,pH/ROS响应系统是研究者们热衷的研究对象之一。例如,Yue等人设计了基于亲水性PEG和含有硫醇侧链的l-半胱氨酸肽共聚物(PEG-D-PC)的混合NPs[62]。混合纳米颗粒具有可脱落的PEG冠和动态二硫键交联核心。它可以装载抗癌药物喜树碱(CPT)用于癌症治疗,如图所示图 5a. 在TME的影响下,形成的纳米颗粒尺寸急剧减小,电位升高。高浓度的GSH破坏二硫键可以精准有效地释放和积累CPT,从而提高抗癌效率。在另一个案例中,赵等人设计了一种pH/ROS双响应的载DOX羧甲基壳聚糖纳米凝胶(CMCSN),该凝胶被血管肽-2(ANG)修饰,用于靶向治疗胶质母细胞瘤(GBM)(图 5b)[63]。ANG 是一种双功能肽,可特异性识别低密度脂蛋白受体相关蛋白 1 (LRP-1),该蛋白在 BBB 和 GBM 上高度表达。DOX-ANG-CMCSN 被肿瘤细胞摄取后,纳米凝胶被裂解,由于其对 pH 和 GSH 的敏感反应,DOX 被释放用于抗癌治疗。
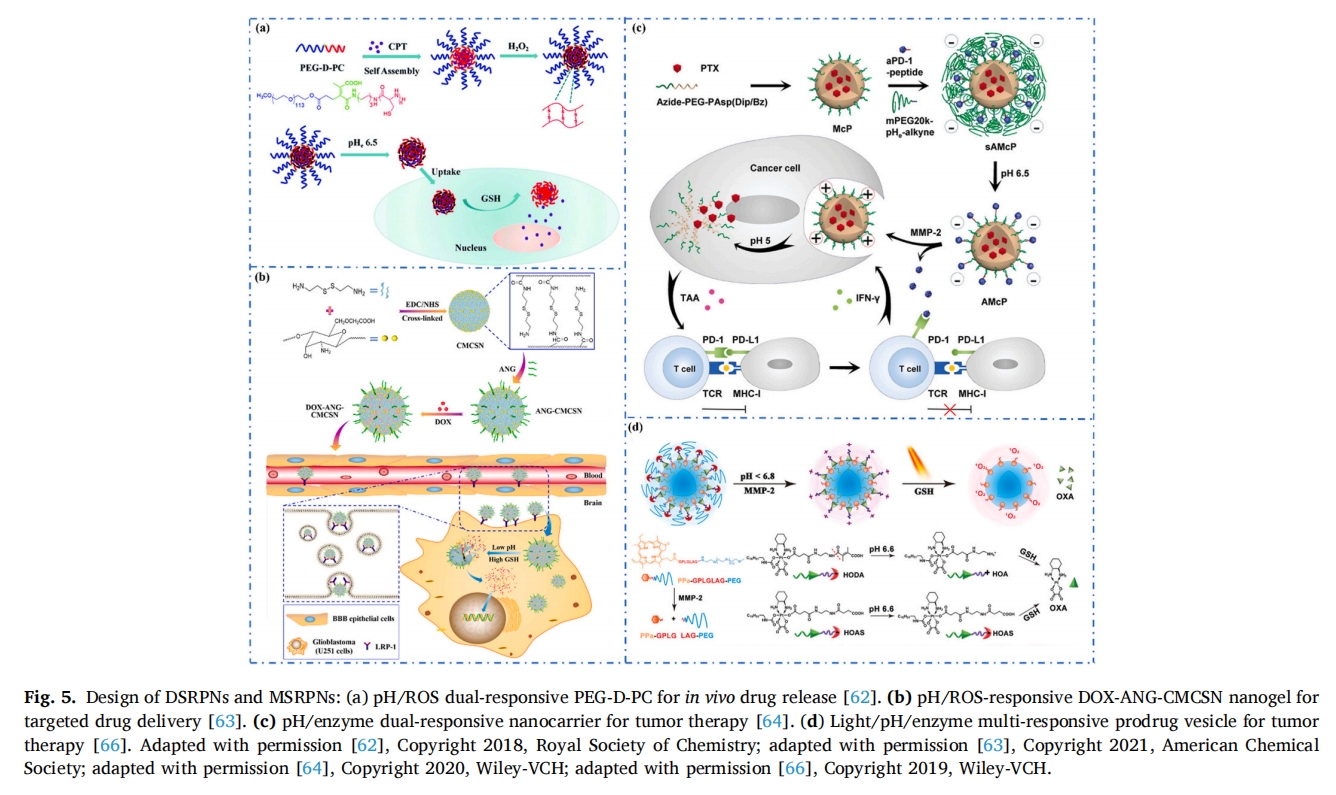
除了基于 pH/ROS 的 DSRPN,基于 pH/酶的 DSRPN 在生物医学应用方面也发挥着重要作用。例如,Shuai 等人制备了一种双响应纳米载体,其中负载有抗 PD-1 抗体 (aPD-1) 和化疗药物紫杉醇 (PTX)。64这种以叠氮化物-PEGPAsp为外壳的双响应纳米载体将PTX包裹在胶束的中心。如图所示图 5c,肿瘤组织中过表达的MMP-2识别并裂解MMP-2敏感肽(Mal-GGPLGVRG-Pra-NH2),释放aPD-1进入肿瘤细胞。此外,低pH刺激NPs释放PTX。因此,基于pH/酶的DSRPN实现了两种药物的按需顺序释放,充分发挥两种药物的协同抗癌作用。
除了上述内源刺激的组合外,内外刺激的组合也得到了广泛的研究,其中对pH/温度双刺激具有响应性的多肽纳米材料受到了更多的关注。Shi等以PEG和聚(l-谷氨酸)衍生物分别作为温度和pH敏感级分,制备了一系列具有良好胶凝能力的含多肽两亲物(PPCAs)[65]结果表明,当pH为单一变量时,PPCAs表现出可逆的溶胶-凝胶转变温度,当pH为7.4时,水凝胶的溶胶-凝胶转变温度为10~70℃,当pH为6.5~7.4时,对PPCAs的凝胶温度有显著影响,PPCAs在37℃下凝胶。本研究为实现生理相关的双pH/温度响应肽水凝胶提供了有益的思路。
受双重刺激-反应优势的启发,研究人员进一步开发了MSRPN。目前,化学免疫治疗只能用于一小部分患者。为了突破这一限制,周等人通过整合奥沙利铂(OXA)和PEG修饰的光敏剂(PS)开发了一种可在TME中刺激的前药囊泡[66如图所示图 5d、前药囊泡随血液循环至肿瘤部位,MMP-2靶向识别肽,剥离前药囊泡的PEG冠层,在肿瘤酸性微环境的影响下,其表面电荷由负电荷转变为正电荷,实现在肿瘤细胞内的聚集,在激光照射和大量GSH存在下,实现OXA的精准释放。这些结果表明MSRPNs是一类更精准、更有前景的材料。
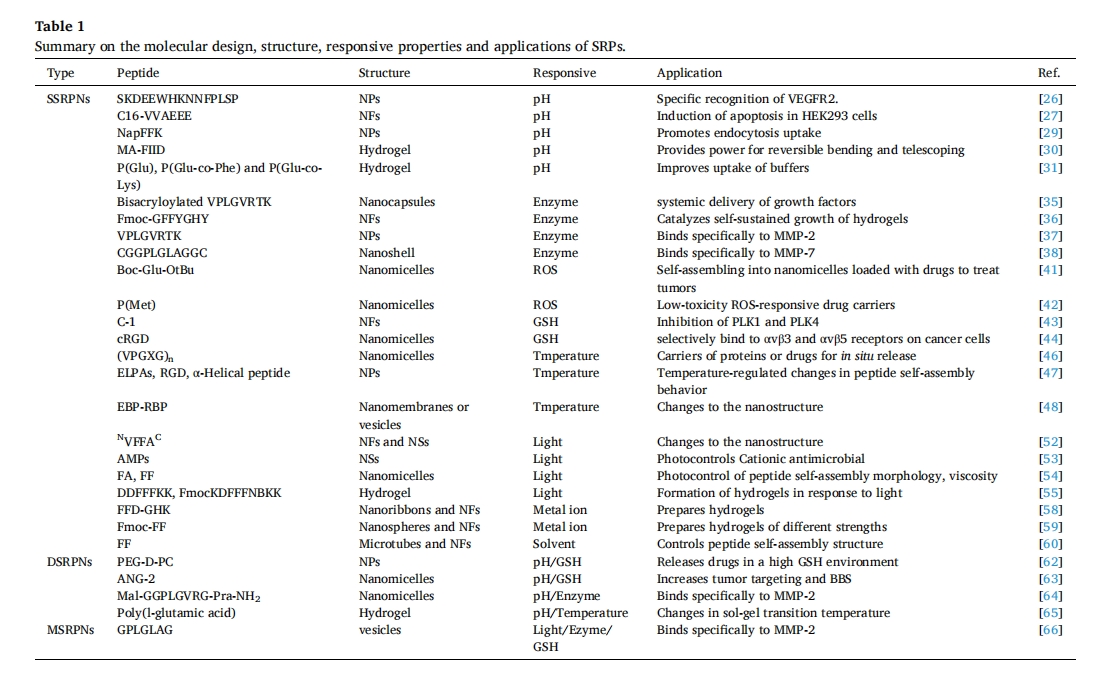
以上各节介绍了各种肽的分子设计、自组装、纳米结构和刺激响应特性。为了更清楚起见,这里有一个表格(表 1) 来概括这些重要案例所揭示的关键信息。
多肽是由若干个氨基酸通过酰胺键连接而成的,通过氨基酸的排列组合,可以得到不同长度和种类的多肽。SAP结构通常是通过非共价相互作用形成的,包括静电作用、疏水作用、范德华力,以及芳香族氨基酸残基所形成的氢键和π-π相互作用[67–69]。
肽具有多种序列和结构,可通过调节分子间或分子内相互作用自组装成不同形态的纳米结构,如零维PNP、肽纳米球和肽量子点(PQD),一维PNF、肽纳米线(PNW)、肽纳米管(PNT)和肽纳米棒(PNR),二维肽纳米片(PNS)和肽纳米带,以及三维水凝胶等结构。不同形貌的肽纳米结构在肽基杂化纳米材料中发挥着不同的作用,零维纳米材料PNP、纳米球和PQD尺寸小、比表面积小,更容易被细胞摄取,在信息传递和作为药物载体进入细胞和组织方面具有更大优势[70]。相比于0D纳米材料,PNFs、PNWs、PNTs、PNRs等1D纳米材料拥有更长的结构,为其他材料的附着提供了丰富的活性位点。此外,1D纳米材料可以将两种原本没有结合力的材料连接起来,制备出杂化纳米材料。2D纳米材料巨大的表面积为其他材料的附着提供了更丰富的活性位点,优异的功能化能力使其在生物和材料科学的各个领域,如生物传感器、光热诊断与治疗、ETC。[71,72]3D水凝胶可以提供宏观的视觉观察。此外,丰富的孔隙结构使其更容易装载药物或生物分子以输送到体内[73]不同维度的纳米结构也有其相应的缺陷。0D纳米材料尺寸较小,不易与其他材料复合;1D纳米材料延展性和变形性较差;2D纳米材料与0D相比,边缘活性位点较差[74]3D水凝胶和支架体积较大,不易获取,制备难度较大,因此选择合适尺寸的纳米结构至关重要。
SRPN 通过改变肽性质(例如改变肽表面电荷)或切割不稳定或响应性键来调节自组装行为,进一步实现满足特定需求的生物医学应用。大量可切换的肽是由微环境 pH 触发的,这通常是氨基酸质子化和去质子化的结果 [75]通过加工pH响应性肽,可以实现α-螺旋向β-折叠或β-折叠向α-螺旋的可逆转变。同时,温度对肽自组装的影响也不容小觑,温度升高会削弱氢键作用,增强疏水作用,导致肽自组装从一种特定形貌转变为其他形貌。高温通常会破坏肽的二级结构,从而使其失去功能[76]金属离子与不同氨基酸侧链相互作用可诱导肽构象由未折叠状态转变为折叠状态。[77]。酶可以作为肽改变的触发因素之一。肽在微环境中被酶切割或降解,从而促进肽纳米材料的功能。此外,利用发光部分在战略位置对肽进行修饰,形成光响应肽。在光照射下,肽的结构或功能发生改变。
肽及多肽具有较强的自组装能力,可控制自组装成不同尺寸的纳米材料。基于肽及肽缀合物的自组装纳米结构具有稳定性好、选择性精确、生物相容性优良、细胞毒性低等优点,在药物递送、生物成像、临床疾病治疗、抗菌材料、组织工程等领域展现出广阔的应用前景。[78,79]。
3.1 0D肽纳米材料
肽具有良好的自组装能力,很容易形成PNP、PNS和PQD,被广泛用作药物输送和癌症治疗的纳米载体。[3,80,81[,肽纳米材料的优异性能在胶原蛋白模拟纳米材料中引起了越来越多的关注。Xiao等证明,当三螺旋肽G(PRGPOG)5将N端带有芳香族基团的多肽与单链肽EOG-10在室温下混合[82].由于π-π堆积和静电相互作用,肽自组装成大小均匀的PNS。这种由肽引发的具有良好生物相容性的胶原蛋白模拟肽的自组装在生物领域显示出潜在的应用。
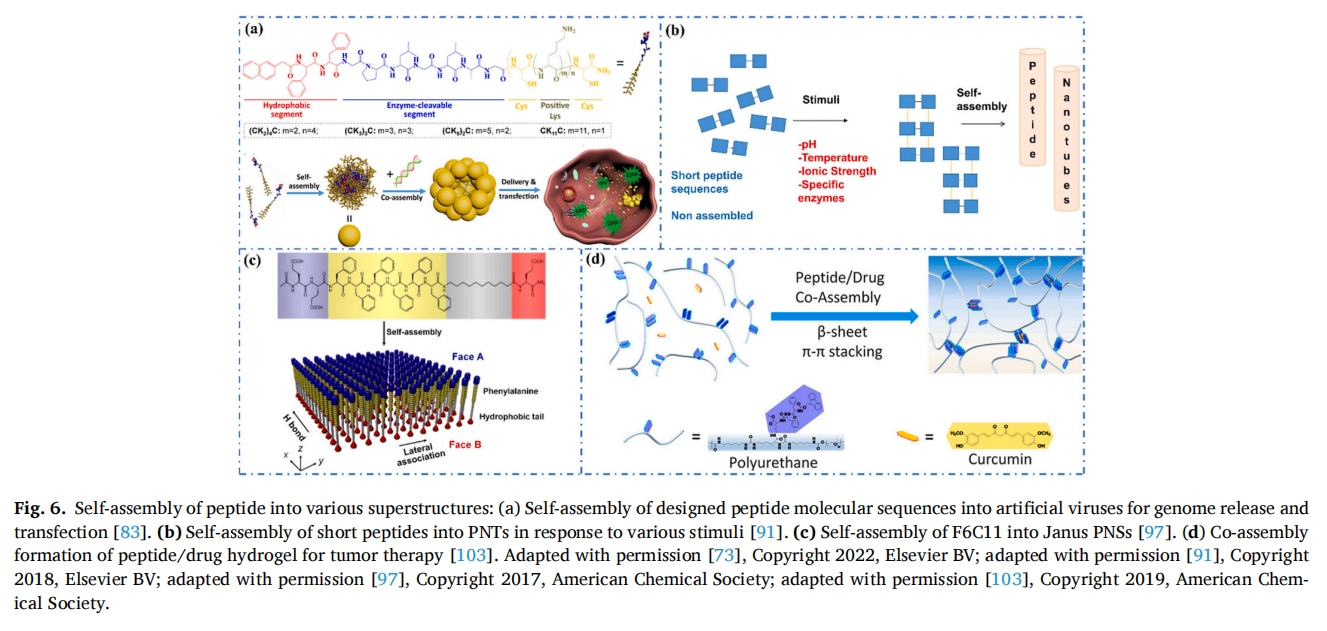
人工病毒能够在癌细胞中产生高水平的基因转录。曹等人基于Nap-FFGPLGLAG(CK)设计了几种肽来模拟人工病毒的外壳米)nC(Nap = 萘)肽序列,通过改变 m 和 n 的值(图 6a)[83]有趣的是,设计的(CK5)2C 或 (CK3)3C肽在疏水作用和π-π堆积作用下自组装成小于10纳米的稳定PNP结构,进一步与遗传元件共组装形成人工病毒用于基因递送和转录,已用于选择性递送治疗性核酸至癌细胞,实现高效的基因治疗。
通过光激发,可以制备具有特定功能的0D肽纳米材料。例如,Sun等人设计了一种具有KLAKLAKKLAKLAK肽序列的丙烯酰胺单体(KLA肽丙烯酰胺)。由促凋亡肽-聚合物两亲分子组成的球形胶束在光引发聚合的诱导下自组装成NPs[84]。通过改变亲水性和疏水性结构单元的长度,可以调整以这种方式形成的NPs的尺寸。在另一个例子中,Li等人通过将含有组氨酸的短肽、金属离子和PS组合在一起,制备了一种用于抗肿瘤治疗的金属纳米药物[85].在Zn 2+存在下,短肽与PS通过多种非共价相互作用共组装成金属纳米药物,实现药物在TME中的快速释放。
3.2 一维肽纳米材料
一维肽纳米材料具有稳定性高、形貌细长、生物相容性好、化学物理性质及功能可调等独特优势,有利于改善组织黏附、延长血液循环,是制备生物成像、肿瘤治疗、基因传递、可穿戴生物传感器等功能复合材料的理想构建材料[86,87]。一维肽超结构主要包括PNF、PNW、PNT和PNR。
在 Wei 及其同事的研究中,半序列离子互补肽 RATEA16 (CH 3CO-RATARAEARATARAEA-CONH 2) 是为 PSA 开发的 [88]肽RATEA16具有稳定的β片层二级结构,自组装成直径70.3nm、长度273nm的PNF,遇到血液后迅速形成三维网络凝胶结构,达到止血效果。具有良好生物相容性的多肽RATEA16可开发为手术过程中理想的止血剂。
最近,Raganato等人首次报道了L,D-八肽-葡聚糖共轭化合物DEX29-(L VD V)4嵌段共轭[89]。(L VD V)4线性肽促进共轭化合物自组装生长为0.10–1 μm的PNW,以此方式组装的具有葡聚糖性质的PNW具有良好的亲水性、生物相容性且无毒性,在生物医学应用方面具有很高的潜力。
PNT 具有优异的高纵横比和表面积,在介导药物输送和细胞相互作用中起着重要作用。同时,管状 NPs 与靶细胞的接触面积更大,可以更好地粘附在细胞上[90],Laverty 等人研究了 FF 基序的自组装行为,其中羧基末端 FF 基序 (NH2-FF-COOH) 能够在溶液中自组装成 PNT,这归因于分子中相邻苯基之间的疏水、π-π 堆积和氢键相互作用[91] 响应 pH、温度、离子强度和酶等刺激,β-片层二级结构形成并自组装成PNT(图 6b). FF自组装形成的PNT表现出足够的抗菌能力,可以消灭感染各种患者的生物膜形式的细菌。
此外,Zhang等人利用淀粉样蛋白的同源序列KLVFFAβ(一个β) 肽和载脂蛋白 E 受体结合域的模拟肽 COG1410 构建独特的载脂蛋白 E 模拟肽 (MOP) 来合成 PNR[92]。MOP具有固有的自组装能力,其自组装行为受溶液pH值和离子强度的影响。在酸性和中性环境中,MOP被诱导自组装成球形。当pH调节为9时,观察到尺寸为50×100nm的NR结构。在Na2所以4不同浓度的溶液中,生成的纳米棒的长宽比不同。与球形纳米结构相比,这种棒状纳米结构能够更好地穿透血脑屏障,设计的PNR提高了MOP向脑部的输送效率,改善了Aβ,有效解决了阿尔茨海默病(AD)治疗的关键问题。
3.3 二维肽纳米材料
二维肽纳米材料具有较大的比表面积和丰富的表面功能基团,更容易与其他纳米材料结合进行功能调控[93,94],此外,二维肽纳米材料具有灵活可控的表面功能以及优异的生物降解性和生物相容性,在生物医药、环境科学等领域得到了广泛的应用[95]。
PNS 和肽纳米带是典型的二维肽超结构,弥补了低维和三维材料之间的差距。富含酪氨酸和苯丙氨酸的肽倾向于形成二维 PNS 和肽纳米带 [96]例如,Stevens 等人通过二维操控含有六苯丙氨酸、疏水尾和谷氨酸的 PA (F6C11) 展示了厚度约为 5 nm 的单层 Janus PNS 的合成(图 6c)[97],F6C11 中的六苯丙氨酸片段提供的氢键诱导肽形成β-片层在 x 轴方向上,而芳香相互作用导致β-sheets 在 y 轴方向堆叠。此外,烷基尾部增强了 x 轴和 y 轴的疏水作用,最终组装出具有高度有序结构的 PNS。在另一项研究中,Albert 等人设计了一种富含苯丙氨酸的肽 (EEFFFFFFFFFF) 与 DNA 结合形成二嵌段共轭物 (DP) [98].将DP加入1,1,1,3,3,3-六氟异丙醇(HFIP)中,再将溶液注入磷酸盐缓冲溶液(PBS)中,制备PSA。实验结果表明,DP自组装产生了平均厚度为5.1±1nm的PNS。DP中的谷氨酸残基降低了疏水相互作用,大量苯丙氨酸提供的丰富氢键和π-π堆积形成了二维纳米片。该方法进一步被应用于设计DNA1-肽-DNA2三嵌段共轭物,通过在相反表面呈现两种不同的DNA序列,成功地自组装成Janus混合纳米片。
此外,Castelletto 等人通过乙酸酐反应将 N 端封端到 FF 二肽上,制备了芳香肽 CapNFF[99].PSA在水和乙腈混合溶液中进行,观察到自由漂浮的纳米片层状结构,这是π-π堆积驱动的分子间相互作用力的结果。
3.4 3D肽纳米材料
自组装肽三维纳米材料主要有水凝胶和气凝胶。在一定条件下,肽自组装形成超长纳米纤维,纳米纤维再进行包裹,形成三维水凝胶。水凝胶作为独特的载体,能有效提高生物制剂的释放并提供机械支撑,在促进组织再生、药物输送、伤口愈合等方面具有巨大优势。[100,101]。
Sun 等制备了一类以二苯丙氨酸为基础、C 端氨基酸不同的联苯三肽化合物[102].所设计的多肽如BPAA-FFG、BPAA-FFA、BPAA-GFF、BPAA-AFF等在一定条件下均可形成不同长度的纳米纤维或纳米带,进行高密度缠绕重叠形成水凝胶,这是受氢键、π-π堆积、空间位点电阻等影响的结果。
载药水凝胶具有广阔的生物医学应用前景。Zhang 等人将 PEG 修饰的 Fmoc-FF 肽与聚氨酯杂交,其中 Fmoc-FF 肽自组装形成β片状纳米结构[103添加的姜黄素通过π-π堆积与Fmoc-FF肽组装形成混合水凝胶(图 6d).由该肽-聚合物制备的水凝胶表现出强的自修复性能,在组织工程和生物医学领域有良好的应用前景。
Han 等开发了一种功能性肽水凝胶,用于包封外泌体并确保外泌体的稳定和持续释放[104].自组装PA GTAGLIGQ通过GG肽与心脏保护肽(GHRPS)连接,生成PA-GHRPS。同时使用Nap-FF修饰PA-GHRPS可提高PA-GHRPS在水中的溶解度,并使其自组装形成水凝胶。与单独使用外泌体治疗相比,水凝胶载体可通过减少炎症、避免心肌纤维化和延长外泌体在体内的滞留时间来改善心肌梗死后的心脏功能。
4 SRPN 的功能定制
肽可以通过共价和非共价相互作用与其他材料结合,实现纳米材料的靶向功能化,从而改善纳米材料的生物相容性并降低其细胞毒性。[105].本部分介绍了肽与金属及金属氧化物/硫化物、DNA/RNA/PNA、多糖、PS等材料杂化对SAP材料进行功能调控。
4.1 利用金属和金属氧化物/硫化物进行功能调节
金属纳米粒子可用于对各种生物分子进行表面改性,以实现特定的功能定制[106],金属与肽结合形成的金属/肽杂化纳米材料具有广泛的应用,如细胞成像、组织工程、光疗和药物输送[107,108]。
金纳米粒子(AuNPs)具有惰性、无毒的特性,相对于其他金属纳米粒子来说更安全,因此受到科研人员的广泛研究[109],例如,Borglin 等人利用对 Zn2+ 和 MMP-7 具有双重刺激响应的肽 (JR2EC)制备了一种用于多光诱导发光 (MIL) 的高信噪比生化造影剂 [110].螯合剂刺激多肽自组装成四螺旋束后去除Zn 2+ ,AuNPs达到悬浮状态;MMP-7的释放导致JR2EC的消除和AuNPs的聚集,显著增强了MIL信号。
AuNPs被认为是一种很有前途的癌症治疗光动力治疗剂。Yang等通过涂层法合成了AuNPs@PNPs用于前列腺癌的靶向治疗[111],该肽(序列:CREKA-YPFFK(Nph))在血清碱性磷酸酶(ALP)刺激后自组装(图 7a). 与未组装组相比,AuNPs@PNPs在肿瘤部位的滞留时间增加了约3倍。此外,作为PTT剂,设计的AuNPs@PNPs可以有效提高肿瘤的温度体内在近红外 (NIR) 照射下。在另一项研究中,Chen 等人使用肽 (CALNNKKKK 和 CALNNKKKKGRGD) 功能化的 AuNPs (GNPs@peptide) 和二氧化硅纳米粒子 (MSN) 的混合物构建了刺激响应性药物输送系统 (图 7b)[112]。带负电荷的羧基化MSN通过静电相互作用与带正电荷的GNPs@peptide结合,防止药物过早泄漏。在溶酶体的微酸性环境中,MSN表面电荷发生逆转,导致GNPs@peptide被去除,药物被靶向释放。
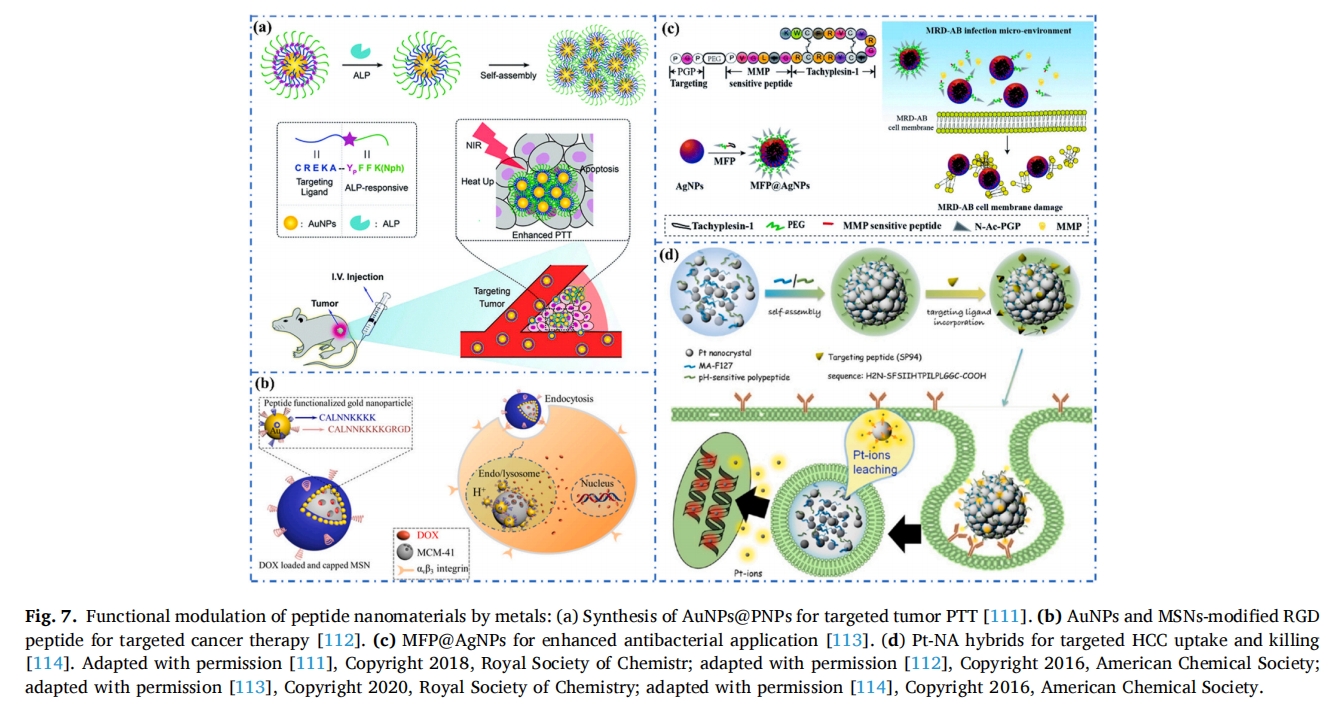
除了单质金属,金属氧化物/硫化物也可以被功能化来修饰肽基纳米材料。例如,Yang 等人设计了一种 pH/温度双响应纳米凝胶 (NG),用于药物 (雷帕霉素、RAPA) 输送和磁共振成像 (MRI) 荧光成像 [115该系统与抗IV型胶原蛋白肽(KLWVLPK)表面偶联,形成纳米凝胶(RAPA/Fe3哦4@NGS-Col IV) 用于靶向药物输送。磁性 Fe3哦4核心赋予纳米凝胶成像能力,进一步提高了 MRI 分辨率。此外,磁性 NPs 的表面疏水性增加了疏水性药物的负载。因此,双响应多功能 NG 实现了 RAPA 靶向释放,并且比非靶向 NG 更有效地抑制了肿瘤内皮肿瘤形成。
在之前的报告中,Zhao 等人构建了一种多 pH/酶/氧化还原刺激响应的荧光多孔 pSiO2纳米载体(pSiO2-GSSG NS)具有较高的药物储存能力[116载体由氨基官能化的二氧化硅(pSiO2)、氧化谷胱甘肽 (GSSG) 和荧光 ZnO QDs。GSSG 附着在 pSiO2通过酰胺键连接纳米球,将氨基化的ZnO QDs共价偶联到GSSG侧链的羧基上。通过在酸性环境中分解ZnO QDs,酰胺键和二硫键分别被蛋白酶K和GSH切断,导致ZnO QDs脱落并控制药物的释放。此外,氨基化的ZnO QDs在紫外光照射下发出黄色荧光,可作为潜在的荧光探针用于原位监测药物从孔道中的释放。
此外,陈等人设计了一种基于CuS的热敏诊断胶束来封装氨基黄酮类化合物(AF),用于三阴性乳腺癌(TNBC)的靶向治疗[117]。通过热敏两亲性嵌段共聚物聚(丙烯酰胺-丙烯腈)-聚乙二醇(PAAmAN-PEG)对CuS NPs进行功能化,形成胶束,然后将其与肿瘤靶向配体GE11肽(YHWYGYTPQNVIGGGGC)偶联。在近红外光照射下,CuS NPs的温度升高不仅引发了PTT,而且还诱导了亲水性PAAmAN片段向具有高临界温度(约38°C)的疏水性PAAmAN片段的转变,从而加速药物释放。此外,CuS NPs具有光声成像特性,可以实时监测肽纳米材料的抗肿瘤作用。
4.2 利用 DNA/RNA/PNA 进行功能定制
DNA和RNA是维持机体正常免疫反应的生物分子,在细胞增殖、分化以及通过复制、转录和翻译过程传递信息中发挥着不可替代的作用。118此前,它们已广泛应用于纳米技术、临床诊断和治疗领域[119]。
基于 DNA 的肽纳米杂化物具有尺寸和结构可控性以及优异的生物相容性,是一种很有前途的运载载体。120]。肽核酸(PNA)是一类DNA类似物,其中糖磷酸骨架被肽骨架取代。PNA对DNA和RNA不具有静电排斥性,因此具有高稳定性和出色的特异性识别。特别是,PNA具有稳定有效的RNA靶标识别。靶向肿瘤相关microRNA(miR)的PNA已被证明具有强大的抗肿瘤作用体内和体外Gupta 及其同事通过修饰反义 γPNA 开发了一种 miR-210 抑制策略,用于具有极高 DNA/RNA 亲和力的 MGγPNA [121].将MGγPNAs与低pH插入肽偶联,封装于聚(丙二醇-乙醇酸-共-乙醇酸)(PLGA)NPs中进行细胞递送。实验结果表明,MGγPNA可以通过PLGA NPs递送有效释放。在正常pH值下,pHLIP与细胞膜的相互作用较弱,而在低pH环境下,pHLIP会折叠并插入细胞膜,促进细胞对NPs的摄取。实验结果表明,MGγPNA可以通过PLGA NPs递送有效释放,并对肿瘤生长表现出明显的抑制效果,为通过靶向miRs治疗癌症提供了有力的手段。
核酸适体是一类寡核苷酸序列,具有易于合成和修饰、毒性低、特异性强等优点,可与多肽、药物偶联,增强细胞穿透能力,进行靶向治疗[122,123例如,Tan等人构建了一种含有DOX的适体-肽复合物(APPC-DOX)[124].抗热休克蛋白70(HSP70)肽(P8:SPWPRPTY或P17:YCAYYSPRHKTTF)与具有识别跨膜糖蛋白粘蛋白(MUC-1)能力的MUC-1适体组成的结合物(图 8a).所得结果表明,设计的APPC-DOX不仅对过表达MUC-1的耐药乳腺癌细胞具有良好的靶向能力,而且可以增强DOX对癌细胞的敏感性,并显著降低DOX的毒性。
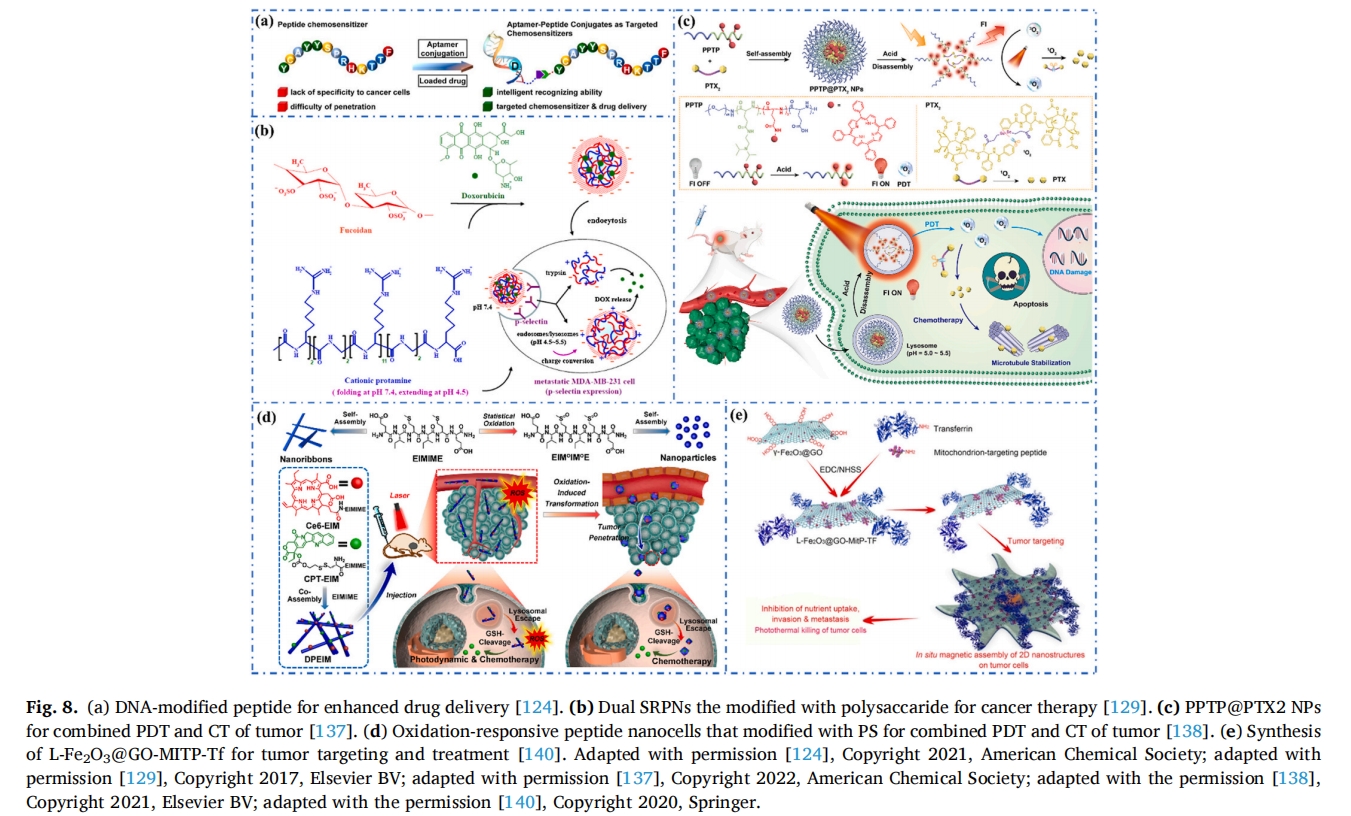
岩藻糖基纳米材料常用于开发治疗癌症和心血管疾病的药物纳米载体。陆教授等通过静电相互作用将岩藻多糖与阳离子肽(鱼精蛋白)结合,负载DOX后自组装成双刺激响应的PNP,用于抑制转移性乳腺癌细胞(MDA-MB-231)(图 8b)[129].褐藻糖胶靶向作用于MDA-MB-231细胞的P-选择素,在胰蛋白酶和酸性环境下发生电荷转换和体积膨胀,释放出DOX,有效抑制MDA-MB-231细胞的生长。
基于纤维素和抗菌肽 (AMP) 的纳米材料具有良好的溶解性和生物降解敏感性。在 Weishaupt 及其同事的一项研究中,将 2,2,6,6-四甲基-1-哌啶氧基 (TEMPO) 氧化纳米纤维纤维素 (TONFC) 和 AMP 结合在一起,通过自组装形成具有抗菌性能的 pH 响应性纳米复合材料 [130],当溶液pH值高于羧基的pKa值,且离子强度较低时,表面正电荷乳球菌细菌与TONFC提供的大量负电荷结合,导致原纤维半径增大,纤维柔韧性降低。与金黄色乳球菌, TONFC-金黄色乳球菌生物复合材料表现出更强的抗菌活性枯草芽孢杆菌和金黄色葡萄球菌.α-乳糖特异性识别肝癌细胞并在介导内吞作用中发挥关键作用。
最近,孟等利用酪蛋白疏水肽(CHP)修饰CS,合成了一套具有较宽HLB值范围的Pickering乳化剂CS-CHP NPs(NPs3-1、NPs1-1、NPs1-3)[131CS-CHP NPs 表现出更好的乳化能力、抗氧化性能和高稳定性。同时,乳液类型可以从 O/W 转化为 W/O,表现出 pH- 和 CO2/N2响应性,并在不同pH下有效处理姜黄素。封装和智能释放为改善药物输送提供了一种新方法。
4.4 利用光敏剂(PS)进行功能调整
近年来,集多功能于一体的光热纳米材料为医学的靶向诊断和治疗提供了优良条件。[132]结合光敏剂和肽的光热纳米药物被认为是癌症光疗的有前途的治疗剂。[133]光化学稳定性和安全性是作为光敏剂使用的先决条件[134].光敏剂与多肽相结合的刺激响应性纳米材料能够对微环境做出精确响应并发生相应变化,在药物的靶向递送和积累以及多功能成像方面具有良好的功效[135]。
肽纳米材料与 PS 的功能化可以实现药物的精确释放,提高光疗的治疗效果。例如,在 Le 等人的一项研究中 [136],将单体 ELP 与 PS (TT1) 结合,并与二嵌段 ELP (dbELP) 共组装以生成靶向 NPs。TT1 生成1 O2在光照下,TT1 氧化了单块 ELP 中的 Met 残基,使 ELP 具有亲水性,从而引发 NPs 的解离。此外,TT1 通过 π-π 相互作用与 dbELP 中的苯丙氨酸相互作用,诱导生成尺寸更小的 NPs,实现更深的穿透,获得有效的抗癌治疗。在另一篇报道中,Zhang 等人设计了基于聚谷氨酸的双响应 PNPs,用于 PDT 和 CT 联合治疗 TNBC 聚谷氨酸 [137].以四苯基卟啉(TPP)为PS,与N,N-二异丙基乙二胺(DPA)共同连接到多肽骨架上,形成胞内pH响应肽(PPTP),PPTP与紫杉醇二聚体药物(PTX2)自组装形成可生物降解的PNPs(PPTP@PTX2NPs)(图 8c). 静脉注射后,PPTP@PTX2 NPs被动聚集于肿瘤部位并被肿瘤细胞摄取,在酸性环境下被激活,释放并恢复TPP荧光信号,生成单线态氧( 1 O2)在660 nm激光照射下,刺激PTX2返回为PTX,因此PDT与CT的协同作用明显抑制了4T1 TNBC肿瘤的生长。
有趣的是,Yu 等人设计并合成了一种氧化响应肽纳米细胞 (DPEIM),其中包含两个带有蛋氨酸残基的六肽 (EIMIIE、EIIIIME 和 EIMIME) [138],它是通过与PS Ce6共组装得到的,命名为CPT(图 8d). Ce6 掺入多肽产生 ROS原位在激光照射下,实现PDT和Met的氧化,进一步导致支架形貌的转变,提高肿瘤穿透率。肿瘤细胞中大量的GSH使CPT与多肽相互作用,两者之间的二硫键断裂,释放出CPT,实现PDT和CT的协同治疗。在类似的研究中,Hu等人用聚(2-甲基丙烯酰氧乙基磷酸胆碱)(PMPC)、酶反应肽GFLG和聚-l-赖氨酸与Ce6[139].负载吉西他滨的肽束(GEM)实现了癌症的光动力治疗(PDT)和化学治疗(CT)的联合治疗。
4.5 与其他活性材料进行功能调整
除了上述可与多肽结合丰富功能的材料外,还有一些其他材料也与多肽具有良好的结合能力,如石墨烯及其衍生物[氧化石墨烯(GO)、还原氧化石墨烯(rGO)]具有较大的比表面积和丰富的表面功能基团,多肽可很容易地通过非共价相互作用与其结合,在生物医药领域具有巨大的应用潜力。
刘等人合成了大尺寸磁性纳米片(L-Fe2哦3使用含有γ-氧化铁(γ-Fe2哦3@GO)、肿瘤靶向蛋白转铁蛋白 (TF) 和线粒体靶向肽 (MITP) (图 8e)[140],纳米片靶向肿瘤细胞并自组装原位在肿瘤细胞表面形成二维结构,大尺寸二维磁性组装体抑制肿瘤细胞对营养物质的吸收,降低肿瘤细胞转移的可能性。此外,在近红外光的刺激下,二维PSA能有效响应近红外辐射,产生光热效应,显著损伤线粒体,诱导癌细胞死亡。在另一篇报道中,Zhang等人将凋亡肽(KLAKLAK)连接到2(KLA) 通过形成二硫键负载到GO表面,再通过π-π相互作用和氢键相互作用负载DOX,最后包覆牛血清白蛋白 (BSA),形成具有双pH/GSH响应的抗癌纳米系统 (DOX@GO-SS-KLA/BSA) [141DOX@GO–SS–KLA/BSA进入癌细胞后,多肽与GO之间的二硫键断裂,释放出KLA,在大量GSH存在下,基于GO的药物载体在弱酸环境下容易快速释放DOX,实现协同抗癌治疗。
在以上章节中,我们介绍并讨论了肽基纳米材料与各种成分的功能定制,以增强 SRPN 的刺激响应能力。为了更清楚起见,我们总结了有助于读者理解案例的重要细节,如下所示表 2.

与非肽纳米材料相比,肽基材料具有优异的生物相容性、生物活性和生物降解性,且排斥性降低。氨基酸之间的特定相互作用导致高度有序和稳定的组装体。肽可以自组装成不同的纳米结构。合理设计的氨基酸序列允许单个分子内组合不同的功能,例如刺激响应性,从而使肽可以自组装或与其他材料组装成多功能纳米材料,这对纳米材料来说是一大优势[142]。SAPN 能够响应刺激而发生构象和化学变化,并已广泛应用于生物医学,作为药物载体、成像剂、抗肿瘤、抗菌和组织修复等用途。在本节中,我们重点介绍 SRPN 在药物输送、生物成像、基因治疗、PTT/PDT、抗菌生物材料、伤口愈合和伤口敷料中的生物医学应用。
5.1 药物输送
近年来,药物输送技术取得了长足的进步,但传统的药物输送仍然存在诸多问题,如药物过早泄漏、无法识别靶病灶、药物释放缓慢等。[143,144]肽类药物已被批准用于治疗癌症肿瘤和胃肠道疾病等疾病。利用新兴纳米材料递送小分子药物是一种有效的方法。通常,纳米载体可以通过靶向部分进行功能化,以特异性识别特定器官或患病细胞[145]。
SRPN作为药物递送载体,将药物递送至病变细胞附近,并受病变细胞微环境影响按需释放药物,提高药物递送的特异性和有效性。与无机纳米材料相比,肽纳米载体具有良好的稳定性、膜穿透性、生物相容性,以及较低的细胞毒性。
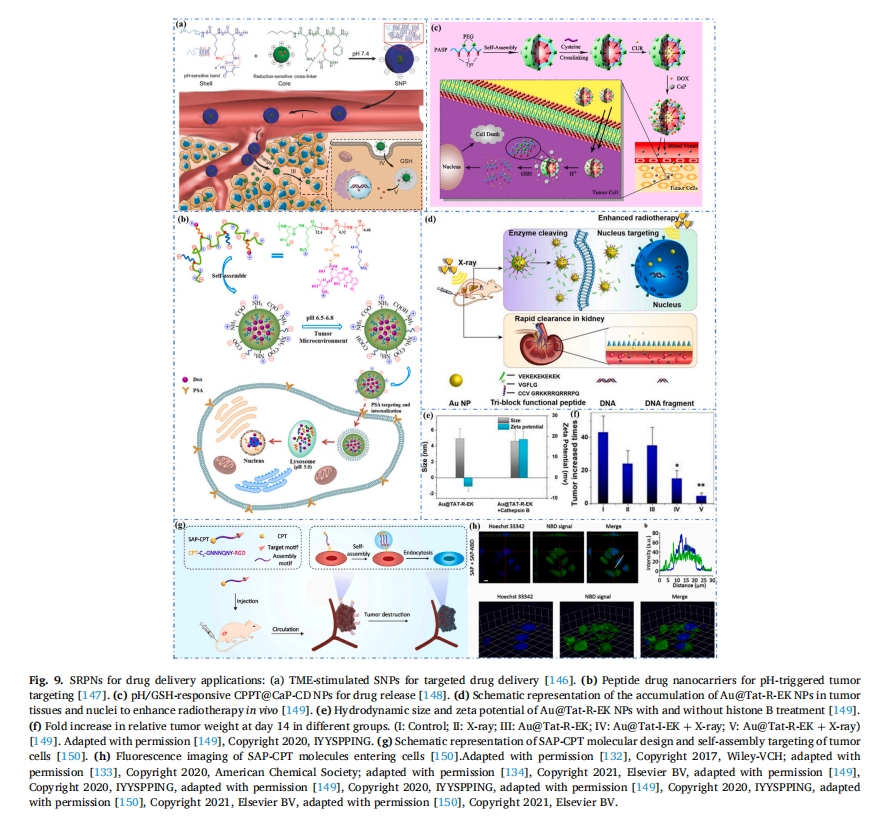
尺寸可变形的药物纳米载体可根据肿瘤组织的空间尺寸进行灵活调控,实现有效穿越屏障,保留组织间质空间。陈等人利用刺激响应壳分离技术设计了壳堆叠纳米颗粒(SNPs)[146].甲氧基PEG封闭的聚-l-赖氨酸(mPEG113-b将具有电荷反转性质的SNP纳米粒子(SNP-PLL25/DMMA)通过静电相互作用堆叠形成壳层(Shell-DMMA),内壳通过二硫键交联,在肿瘤组织酸性环境中富集后,SNP有效地在肿瘤部位实现了显著的尺寸减小和有效的电荷反转(尺寸从约145nm减小到40nm,表面电荷从-7.4mV反转到8.2mV)(图 9a).在细胞内,二硫键的解离加速了药物的释放,提高了抗肿瘤活性。具有可变形尺寸和电荷反转的SNPs可以将药物递送到更深的肿瘤部位,显著提高抗肿瘤效果。是肽纳米药物深度递送的可靠载体。
与传统增敏剂相比,SRPN 具有更强的穿透性和高度内化靶组织的能力。在 Ding 等人的研究中,制备了三嵌段功能肽修饰的超小金纳米粒子 (Au@Tat-R-EK NPs),用于癌症放射治疗 (图 9d)[149].Tat肽(GRKKKRRQRRRPQ)是一种强大的细胞穿透和核靶向肽,它与金纳米粒子连接。GFLG肽可以被组蛋白B切割,从而连接Tat和两性离子防污肽(EKEKEKEKEK)。制备的金纳米粒子表现出极好的稳定性、组蛋白响应性和核靶向性。当遇到组蛋白B时,GFLG被选择性地切割,暴露出Tat肽,Au@Tat-R-EK的zata电位从负移变为正。这种变化增强了肿瘤细胞对其的选择性摄取(图 9e) 随后,Au@Tat-R-EK进入肿瘤细胞,精准靶向细胞核进行聚集,与X射线联合使用,表现出良好的放射治疗增敏作用。体内放射治疗实验显示,Au@Tat-R-EK NPs+X射线组肿瘤生长速度最慢,第14天肿瘤体积仅扩大了4.5倍。Au@Tat-R-EK NPs介导了高达90%的放射治疗,显著延长了小鼠的生存时间(图 9f).
体内肽基纳米材料的自组装是一种很有前途的诊断策略。与传统 CT 相比,肽药物偶联 (PDC) 药物具有改善药物靶向性和减少不良反应等优势。王等人制备了一种 PDC 药物 (SAP-CPT) 用于体内原位自组装策略提高药物向肿瘤细胞的渗透性[150SAP-CPT由靶向RGD肽、GNNNQNY肽和药物分子喜树碱(CPT)组成(图 9g). SAP-CPT 药物靶向癌细胞受体 αVβ3,然后形成纳米簇就地并通过内吞作用进入细胞。在细胞质和细胞核中观察到强烈的荧光信号(图 9h)与单体SAP-CPT药物相比,组装后的SAP-CPT药物进入肿瘤细胞的能力增强。此外,与常规PDC药物相比,SAP-CPT药物通过自组装成功聚集,提高了细胞穿透率,从而取得了相应的优异治疗效果。
5.2 生物成像
生物成像是一种非侵入性成像技术,可在一段时间内观察生物体的行为,为深入了解生物过程和药物作用提供直观证据,在临床诊断和治疗中发挥着不可替代的作用。151].SRPN能够靶向结合病变部位,提高成像的稳定性和准确性。
荧光成像对复杂生物系统的探索做出了巨大贡献。有机荧光团和绿色荧光蛋白 (GFP) 在生物医学应用中得到了更广泛的应用。双光子吸收 (TPA) 荧光成像由于其出色的时空分辨率,在诊断和生物医学领域也前景广阔。152]。但对于GFP来说,进入细胞并稳定其作用则更为复杂。为此,Kong等人设计了一种具有Fc-YYGCGPGRC序列的环肽,通过将细胞穿透肽(CPP)与二酪氨酸结合[153该肽可以自组装成具有生物活性的pH响应性纳米颗粒,当Tyr的酚基去质子化后,纳米颗粒发出明亮的绿色荧光,可以有效穿透细胞膜进入细胞发挥功能(图 10a).此外,酪氨酸肽具有良好的生物相容性、胞内逃逸能力、较低的细胞毒性,在监测、追踪生物过程等生物医学应用方面具有巨大的潜力。
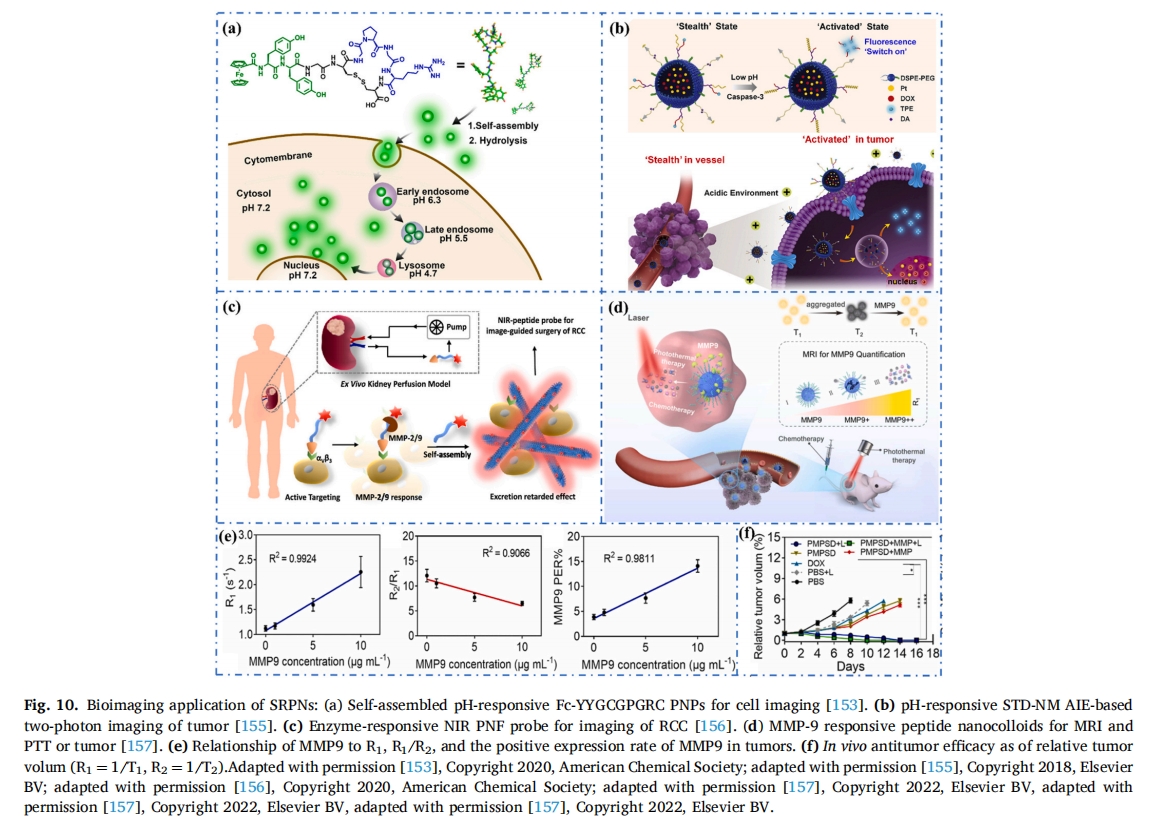
由于成像探针在某些特定代谢器官(如肾脏和肝脏)中会非特异性聚集,因此癌细胞的成像仍存在很大困难。此前,An 等人设计了一种具有肿瘤特异性外排抑制 (TER) 效应的近红外肽探针 TER-SA (RGDRDDRDDPLGYLGFFC(Cy))[156]。它特异性识别肾癌细胞中过表达的αvβ3整合素,该整合素在TME中被MMP2/9特异性切割。残基自组装成PNF原位在病变部位。提高人类肾细胞癌 (RCC) 高性能成像的信噪比 (S/N) (图 10c).肿瘤被完整切除,降低了术后复发率,提高了患者生存率。基于TER策略的NIR肽探针可以准确识别RCC和肿瘤边界。这是一种很有前途的实现代谢器官肿瘤成像的方法。
对TME有反应的造影剂在肿瘤治疗监测中具有重要意义。其中,T1&T2双模MRI具有较高的灵敏度和准确性。陈等人设计了一种对MMP-9有反应性的纳米纤维素(PMPSD),可用于定量肿瘤成像[157如图所示图 10d,超顺磁性氧化铁 (USPIO) 聚集,纳米胶体作为 T1 造影剂。在 MMP-9 存在下,MMP-9 敏感肽 (Fmoc-GPLGL) 被裂解,使纳米胶体解离并将其转化为 T2 造影剂。T1/T2 转换使 MMP-9 浓度可视化(图 10e)。此外,PMPSD 表现出优异的光热性能。如图所示图 10f、PMPSD加MMP9联合放射治疗的抗肿瘤效果最好,肿瘤内MMP9浓度越高,抗肿瘤效果越好。因此设计的PMPSD具有T1-T2双模显像监测药物释放的能力,可实现PTT/CT联合治疗。
5.3 基因治疗
基因治疗是通过基因转移技术将外源正常基因导入靶细胞,在基因水平上进行治疗,具有高效性、高选择性等特点,为癌症治疗提供了有效的途径。传统的基因递送载体存在制备困难、药物靶向性差、生物安全性较低等缺点[158近年来刺激响应型纳米载体得到快速发展,可以实现高选择性、特异性的靶向递送和可控的基因释放行为,提高基因治疗的整体效率[159]。
胶质母细胞瘤 (GBM) 的传统治疗方法,例如 CT 和放射疗法,存在药物输送不足和脱靶药物输送等缺点。[160]基于纳米技术的小干扰RNA(siRNA)是治疗GBM的一种有前途的治疗方式。然而,由于脑结构的复杂性,单纯的靶向策略仍然无法满足GBM的治疗需求。刘等人设计了一种新型电荷转换仿生siRNA递送纳米平台,该平台具有三层核壳结构[161]。这是一种由血管肽-2修饰的红细胞膜(Ang-RBCm)包裹的纳米复合材料(Ang-RBCm-CA / siRNA),可避免siRNA受到免疫攻击并促进其穿透BBB。当它到达肿瘤细胞附近时,微环境中的弱酸性会引发负电荷向正电荷的转移,从而诱导红细胞膜裂解并加速肿瘤细胞中siRNA的释放(图 11a). 纳米复合物在携带人类GMB的小鼠的治疗实验中产生了优异的抗癌治疗效果原位且未产生其他副作用。总体而言,这种新型多功能仿生纳米复合物具有良好的生物相容性、优异的血脑屏障通透性以及靶向递送能力。本研究为GBM靶向基因治疗提供了有力的途径。
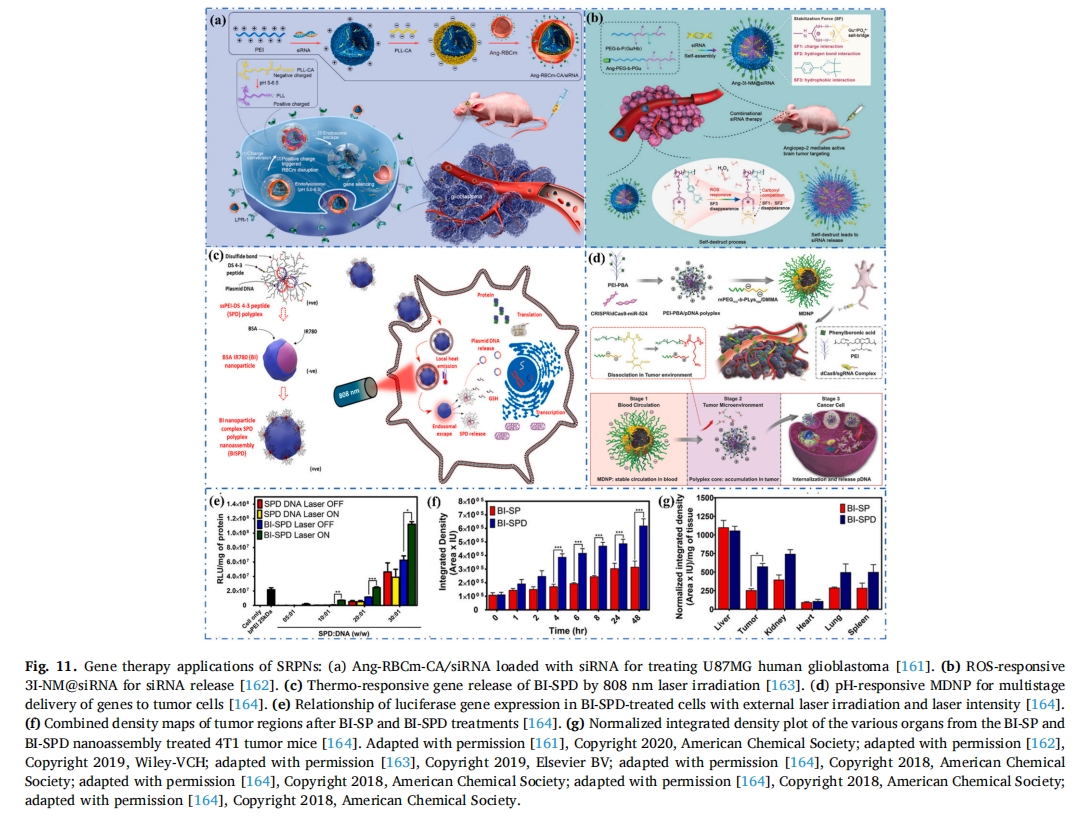
值得注意的是,Shi 等人设计了一种高度稳定的 ROS 响应 siRNA 纳米药物 (3I-NM@siRNA) [162].利用功能化的Angiopep-2肽(Ang-3I-NM@siRNA)靶向GBM,当Ang-3I-NM@siRNA到达TME后,能够主动穿透BBB靶向进入脑肿瘤细胞,在大量ROS存在下,苯基硼酸酯变为亲水性化合物,从而实现siRNA的有效释放,实现靶向治疗(图 11b). 经核实体内小鼠实验表明,以Angiopep-2肽功能化的纳米药物具有良好的血脑屏障穿透能力、脑肿瘤靶向能力和良好的siRNA释放能力。本研究为脑肿瘤基因治疗提供了一种安全有效的策略,也具有治疗其他肿瘤和脑部疾病的潜力。
基因释放可以通过空间或时间来控制,以提高转染效率。Park 等人利用 CPP (DS4-3) 与二硫键交联的 PEI (ssPEI) 偶联形成多聚体 (SPD) [163].SPD与负载IR780的牛血清白蛋白(BI)NPs复合,形成双刺激响应纳米复合物(BI-SPD)。进入乳腺癌细胞后,该纳米组装体受到808nm激光照射,局部热触发SPD多聚体内体的逃逸。二硫键在含有大量GSH的细胞质中断裂,释放出DNA质粒进行基因表达(图 11c). 4T1细胞系实验表明,BI-SPD的转染效率比单独使用SPD多接头的转染效率高出2倍(图 11e) 与 BI-SP 相比,接受 BI-SPD 治疗的 4T1 肿瘤小鼠的荧光强度增加,纳米组装体的积累明显增加(图 11f和g)。该纳米复合材料对周围健康组织无明显毒性,稳定性高,具有细胞穿透性。在激光照射下,多聚体的内体逃逸加速,转染率提高了4倍。
核酸酶失活的成簇规律间隔短回文重复序列 (CRISPR) 相关蛋白 9 (dCas9) 可以在短向导 RNA 的帮助下靶向基因组中的几乎任何位置,从而实现精准、高效的基因表达,而不会干扰宿主基因组。CRISPR/dCas9 的抗癌方法在有效靶向递送方面仍面临巨大挑战。为了解决这一问题,刘等人构建了一种具有核壳结构的多级递送 NP (MDNP),以增强 CRISPR/dCas9 系统的肿瘤靶向性 (图 11d)[164当MDNP在血流中运输并到达肿瘤组织酸性微环境时,壳层中的DMMA基团发生分解,壳层结构被破坏,核心阳离子聚合物暴露出来,增强复合物在肿瘤组织中的蓄积。癌细胞中唾液酸的过表达与聚合物中的PBA结合,增强了阳离子聚合物的胞内化。因此,MDNP实现了高效的多级递送,有效抑制了肿瘤生长,为基于CRISPR/dCas9系统的基因治疗提供了有效的策略。
5.4 光动力治疗/光热治疗
传统的癌症治疗手段对人体的损伤不可避免,且副作用较大,甚至容易导致疾病复发。光疗是一种较新的微创癌症治疗方法,对健康组织毒性低,对人体损伤小,分为PDT和PTT。
PDT依靠特定波长激活PS,产生ROS,氧化靶细胞,引起细胞凋亡或坏死,从而导致肿瘤细胞死亡。165传统临床应用的PS存在水溶性差、生物相容性差、生物利用度低等缺点,限制了PDT在临床医学中的应用[166相比之下,肽基纳米材料由于其良好的生物相容性和可降解性、低细胞毒性以及结构和功能的多样性,被广泛用作PDT药剂。[167].SRPN的使用增加了PDT的选择性和效率,同时消除了副作用。
针对PS聚集性差、保留时间短的问题,Sun等设计了一种新型高灵敏度的PEG化PS-PNF(称为PHHPEG6NF),它表现出快速、高效的肿瘤聚集性,可用于PDT肿瘤成像[168],如图所示图 12a、纳米纤维可以在组织的TME中快速有效地聚集,诱导单线态氧(1O2), 提高了 PDT 效率。此外, 由于 PHHPEG6PNF在PDT前后呈现不同的荧光信号,可全程监测PDT治疗过程,在PDF肿瘤治疗中优势明显;在PDT临床试验中,利用荧光成像引导PDT治疗,开发出具有AIE特性的PS,提高了治疗效率。
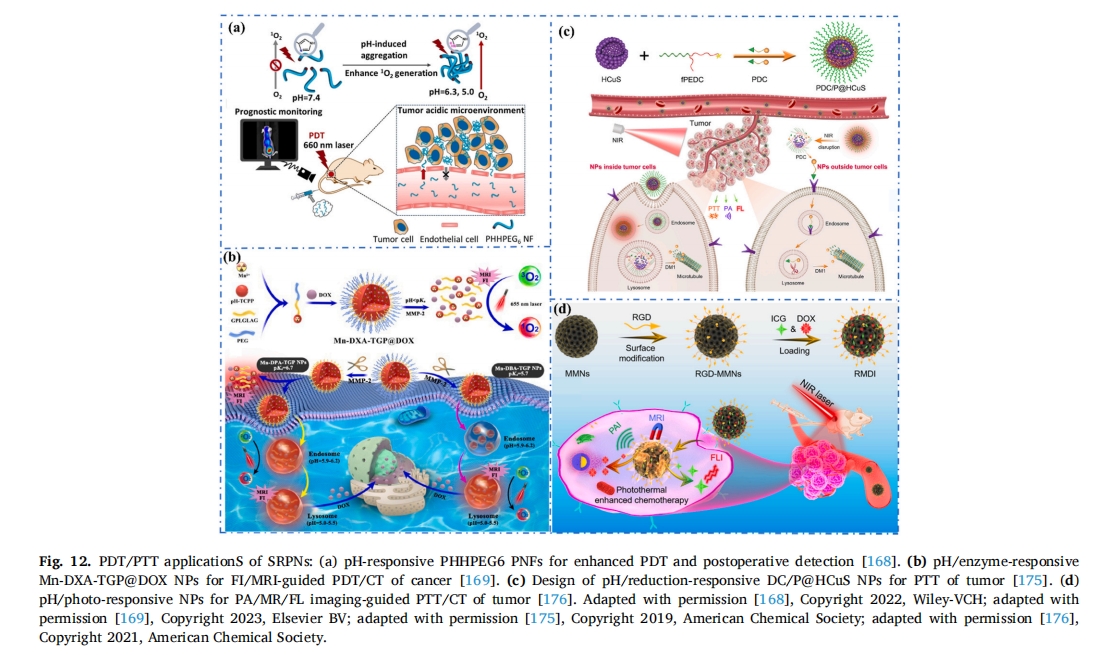
细菌性角膜是导致角膜失明的主要原因之一。光动力治疗通过氧化应激杀死细菌来治疗细菌。然而,越来越多的细菌对传统的光动力治疗产生了耐药性。为此,Yao 等人设计了一种 MMP 响应性超分子纳米颗粒 (MMP-S NPs) [170]。它们由金刚烷(Ad)封端的MMP敏感肽(YGRKKKRRQRRR-GPLGVRG-EEEEEEE)和β-CD 前体药物(β-CD-CE6)。带负电荷的EEEEEE肽壳阻止NPs粘附在健康的角膜细胞上。到达角膜炎微环境后,MMP-9蛋白酶切断肽链,EEEEEE肽壳被去除。暴露的阳离子肽有效地促进了MMP-S NPs的渗透和积累,后者与铜绿假单胞菌假单胞菌细胞并在很大程度上消除了角膜炎症。此外,使用小鼠验证了 MMP-S NPs 对角膜炎的治疗效果。通过使用 660 nm 光原位活化产生 ROS,细胞膜被破坏,角膜结构基本正常化。因此,设计的 MMP-S NPs 可以作为靶向炎症细胞并提高 PDT 抗菌性能的可行抗菌替代品。
PTT 是一种癌症治疗方法,利用激光照射光热剂 (PTA),将光转化为热能,利用高温杀死癌细胞[171],PTT疗法可以破坏病理组织而不损伤正常组织,具有选择性强、耐药性低、副作用小等优点,使实体肿瘤的局部非侵入性治疗成为可能[172,173]。
P-糖蛋白(P-gp)的过度表达是癌细胞产生多药耐药性(MDR)的主要原因之一,刺激响应性纳米药物可以绕过P-gp并在一定程度上克服MDR。Ding等人利用聚(I-半胱氨酸)偶联得到的PNOC制备了一种NIR响应性NO释放肽纳米复合材料PNOC - PDA20-聚(乙氧基亚甲基)[45](PC) 包裹在热敏 NO 供体 SnO 上,然后将仿生聚多巴胺 (PDA) 包裹在肽胶束周围[174]。它能够将吸收的近红外光转化为热量并释放NO来优化CT。细胞内高浓度的NO气体可以促进PTT消灭癌细胞,实现温和PTT、NO气体疗法和CT的协同作用,提高治疗效果。此外,通过蛋白印迹法测定不同条件下MCF-30 / ADR细胞中P-gp的表达水平,与对照组相比,经PNOC处理的细胞中P-gp的表达水平显着降低,表明释放的NO气体可以有效抑制MCF-30 / ADR细胞中P-gp的表达并降低MDR。
此外,Sun 等人构建了用于 pH/还原响应双峰成像的混合 NPs[175]如图所示图 12c、中空介孔硫化铜纳米粒子(HCuS)与载有靶向分子肽-药物偶联剂(cRGD-SMCC-DM1,PDC)的荧光标记两亲共聚物(fPEDC)偶联,形成具有靶向治疗作用的纳米复合物(PDC/P@HCuS)。在近红外光照射下,PDC/P@HCuS表现出优异的荧光和光声成像性能。在pH和氧化还原刺激下,PDC/P@HCuS成功诱导肿瘤部位药物释放,实现肿瘤双模态成像和联合PTT/CT,在影像辅助癌症治疗中具有广阔的应用前景。
最近,Lin 等设计了一种基于黑色素包裹磁性纳米颗粒(MMN)的双pH/光响应纳米诊断剂,并引入RGD肽、DOX和吲哚菁绿(ICG),用于生物/物理双靶向治疗U87 MG肿瘤(图 12d)[176]。在外部磁场和RGD的影响下,纳米诊断剂在肿瘤部位聚集,增强光声成像/MRI以及PTT。此外,在NIR光照射以及肿瘤酸性微环境的影响下,实现了DOX和ICG的靶向释放。两者体内和体外实验证明这种双重刺激响应的纳米诊断剂可以完全消融U87 MG肿瘤细胞,并且复发率低、生物毒性小,达到PTT和CT的协同作用。
5.5 抗菌/抗菌生物材料
随着纳米技术的快速发展,纳米药物在抗菌应用方面表现出巨大优势,如提高药物的生物利用度,降低副作用,以及抑制生物膜的形成,降低细菌耐药性,ETC。[177],而刺激响应性纳米材料则大大提高了杀菌剂的有效性[178]。
细菌生物膜引起的慢性肺部感染是囊性纤维化 (CF) 患者死亡的主要原因,铜绿假单胞菌是主要的细菌来源[179],为了降低细菌生物膜的耐药性和更好的药物渗透性,Gao等设计了一种通过静电相互作用包覆阿奇霉素(AZM)的簇状纳米粒子(AZM-DA NP)[180]。当纳米粒子到达受感染的肺组织时,它们被酸性微环境分解,带正电荷的PAMAM-NPs被释放,这可以有效改善细菌生物膜的通透性并增强AZM的内化。因此,AZM-DA NPs是一种很有前途的抗生物膜纳米平台,其抗菌活性优于游离AZM,并且能够减缓细菌耐药性的产生。
为了更好地去除生物膜并加速慢性伤口的愈合,Wang 等人设计了一种基于八肽的 pH 响应型抗菌水凝胶 (IKFQFHFD) [181此外,在水凝胶中添加光热剂cypate和前胶原成分脯氨酸,形成纳米纤维网络,到达感染组织附近后,水凝胶在酸性环境下解离出具有抗菌肽(ABP)分子结构的IKFQFHFD,在慢性创面病理环境下按需释放负载的cypate,破坏细胞外聚合物(EPS),在近红外(808nm)照射下产生PTT,达到更好的生物膜去除效果;脯氨酸可促进胶原和ECM的形成,促进细胞增殖和血管生成,实现慢性创面的快速愈合(图 13a).该方法实现了抗菌水凝胶、PTT和脯氨酸的协同作用,在抗菌和加速慢性伤口愈合方面具有巨大的潜力。
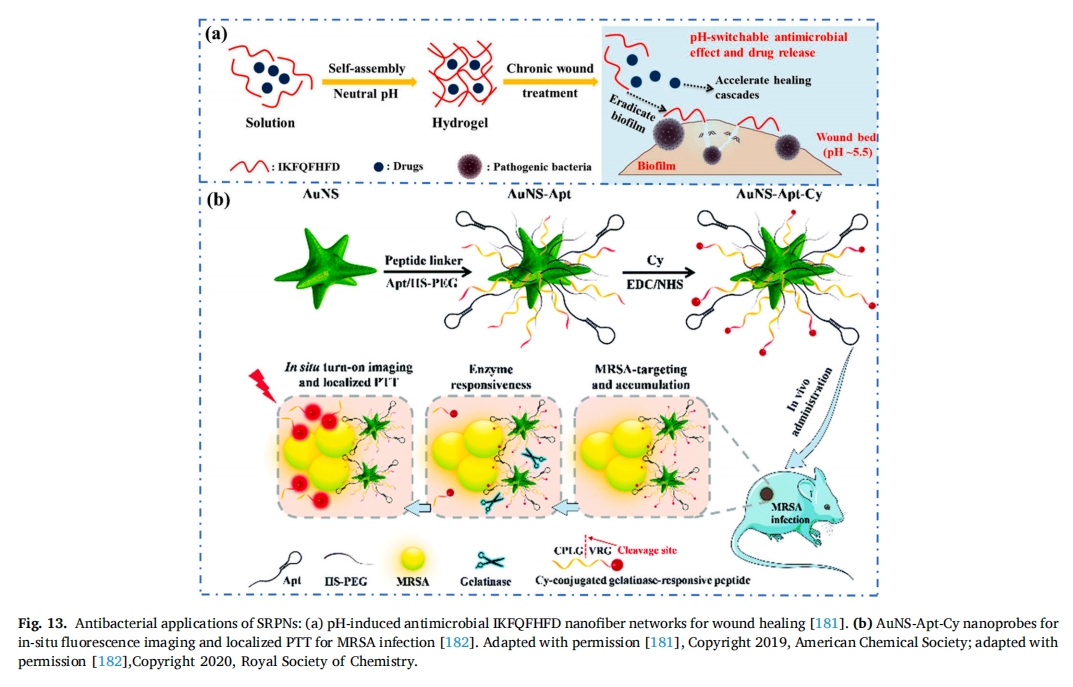
PTT 的短抗菌周期可表现出优异的广谱抗菌能力,可有效治疗耐多药 (MDR) 细菌感染。Du 等人将光热剂 (cypate) 引入具有明胶酶响应的功能化探针中,用于近红外荧光成像和耐甲氧西林细菌的局部 PTT金黄色葡萄球菌(耐甲氧西林金黄色葡萄球菌)感染(图 13b)[182]。纳米探针(命名为AUNS-APT-Cy)以七肽CPLGVRG-Cy复合物的光热金纳米星(AuNS)为中心,耐甲氧西林金黄色葡萄球菌可识别的适体(APT)。ATP 使纳米探针能够靶向到达耐甲氧西林金黄色葡萄球菌感染的微环境,在明胶酶存在下,Cy 凭借其光热效应和近红外特性会裂解肽 CPLGVRG 并开启近红外荧光成像原位因此,设计的纳米探针可以靶向聚集在耐甲氧西林金黄色葡萄球菌感染部位,从而减少了对健康组织的热损伤,并实现了耐甲氧西林金黄色葡萄球菌- 特定治疗和局部 PTT。
基于ABPs良好的生物相容性和光谱抗菌性能,以及PDA的光热活性,Andoy等人设计了一种基于PDANPs和ABP(CWR11)的抗菌剂,通过多种协调机制靶向杀死细菌[183]。当NIR激光刺激到达细菌位置时,PDANP-CWR11纳米系统局部加热杀死细菌,并通过降低细菌失活的临界温度来减少对周围健康组织细胞的不利影响。此外,形态学结果表明PDANP-CWR11纳米系统表现出特异性靶向破坏细菌外膜机械完整性的优异特性大肠杆菌。
5.6 伤口愈合
总体而言,伤口愈合是一个复杂的长期生物过程,其特征包括止血、炎症、增殖和组织重塑等多个阶段。[67]慢性伤口若得不到及时治疗,致残率较高,严重者甚至会导致患者死亡[184]具有高生物相容性的SRPN具有自组装能力,可根据生理环境改变结构,实现对伤口愈合不同阶段的功能化控制,有利于伤口治疗。
糖尿病伤口由于过度的氧化应激和持续的炎症而难以愈合。为了促进糖尿病伤口愈合和皮肤再生,Shi等制备了一种能够将氧化伤口微环境转化为再生微环境的胶束(P311@PEPS)[185].P311@PEPS 是基于 P311 肽和 PEG-block-聚(丙烯硫化物)(PEPS)的自组装而合成的,它对 ROS 具有响应性。过量的细胞内 ROS 刺激 P311 肽从该胶束中持续释放,从而减弱炎症反应并加速表皮细胞迁移。本研究为伤口愈合提供了一种简单有效的 ROS 响应 SRPN 系统。
在另一项工作中,Wang 等人开发了一种可注射的 ABP 水凝胶(称为 FHE),它具有自修复和热敏性(图 14a)[186]。FHE由肽(ε-聚-l-赖氨酸,EPL)、氧化透明质酸钠(OHA)和Pluronic F127(F127)反应而成,在37°C下凝胶形成,可用于递送生物活性外泌体。脂肪间充质干细胞外泌体(AMSCs-exo)通过与EPL的静电相互作用被装载到水凝胶中。在弱酸性环境下,席夫碱键断裂,外泌体被释放。体内和体外实验表明,与单独使用FHE或外泌体相比,FHE@exo水凝胶加速了细胞增殖和迁移,促进了血管生成,并表现出强大的皮肤再生能力。本研究为控释外泌体和响应性水凝胶在慢性伤口协同修复中的应用提供了新思路。
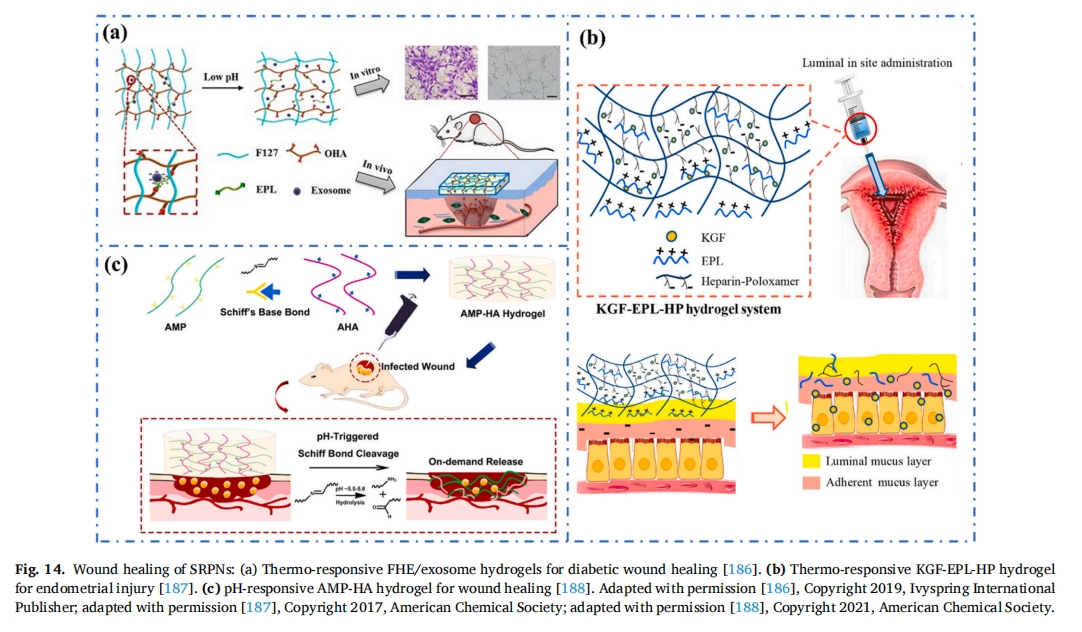
在另一篇报道中,Suo 等人设计了一种基于 HA 的 AMP 水凝胶[188该水凝胶通过AMP交联(序列:KK(SLKL)3KK),它在酸性刺激下触发 AMP 的释放,用于治疗慢性伤口感染(图 14c). 所制备的 AMP-HA 混合水凝胶具有较高的机械强度,并且在体内和体外.这项研究为功能性伤口敷料的开发开辟了选择。
合适的免疫调节生物材料在组织修复中起着至关重要的作用。为了动态调节巨噬细胞的免疫功能,Wang 等人设计了一种基于 HA 的光响应性水凝胶纳米复合材料,其中丙烯酸酯化的 HA (HA-AC) 大分子链用于通过与 MMP 交联肽 (GCRDVPMSMRGGDRCG) 交联将巨噬细胞封装在基于 HA 的 ECM 中[189]。在紫外光照射下,实现了RGD肽与HA-AC的偶联。光控RGD偶联激活巨噬细胞αvβ3整合素,进一步增强抗炎巨噬细胞的极化。本研究提出了一种通过调节免疫细胞来促进组织修复的可控途径。
5.7 伤口敷料
伤口敷料用于覆盖伤口,作为防止外部感染的物理屏障[190,191]传统的伤口敷料如棉纱布、绷带等具有经济、易操作的优点,但肿瘤细胞和组织容易粘附于其上,频繁更换容易给患者造成继发性创伤和疼痛[192,193]新型SRPN能够对不同刺激作出反应并发生改变,作为伤口敷料表现出良好的生物相容性和可降解性,与某些功能化试剂结合可适用于不同伤口敷料,加速伤口愈合。
理想的伤口敷料应具有良好的细胞相容性和抗菌性能。Rezaei 等人通过加载不同浓度的 AMP(称为 AMP-TCTS)合成了热敏、抗菌的 CS 水凝胶[194]。所形成的水凝胶在37℃下凝胶时间为15分钟,可作为人体抗菌伤口敷料使用。实验结果表明,含有16μg/mL AMP的AMP-TCTS水凝胶对标准菌株和耐药菌株均表现出较强的抗菌活性鲍曼不动杆菌.这种水凝胶具有作为抗耐药细菌伤口敷料的巨大潜力。
近年来,具有 pH 依赖性膨胀行为的 2-丙烯酰胺-2-甲基丙磺酸 (AMPSA) 已用于伤口敷料。Malik 及其同事设计了一种基于聚天冬氨酸和 AMPSA 的高吸水性水凝胶,具有葡萄糖和 pH 敏感特性 [195]。聚天冬氨酸和AMPSA赋予水凝胶较高的吸水性能,在酸性和碱性环境中均能迅速吸收和膨胀。因此,在伤口感染的环境下,水凝胶作为伤口敷料吸收更多的细菌渗出物。此外,在皮肤愈合治疗中,水凝胶对GHK-Cu肽的包封率高达72.8%,24小时释放率为88.46%。这是一种治疗皮肤伤口和糖尿病的有效伤口敷料。
此外,吴等人制备了一种可生物降解、pH 敏感的肽基水凝胶,其中负载了三氯生,用于抗菌伤口敷料[196]。与传统的可生物降解水凝胶相比,这种pH依赖性膨胀肽基水凝胶在药物释放和伤口敷料应用方面表现出巨大的潜力。
在另一份报告中,Wang 等人开发了一种具有抗菌和过量 ROS 清除能力的水凝胶[197]水凝胶由深度学习-二硫苏糖醇、聚乙二醇二丙烯酸酯 (PEGDA) 和苯基硼酸修饰的 ε-聚赖氨酸 (EPL-PBA),逐一混合,然后用蓝光照射,生成水凝胶原位。EPL-PBA的加入使水凝胶具有更好的吸水性和抗菌性能。此外,水凝胶可以对过量的ROS作出反应。作为糖尿病慢性伤口敷料,该水凝胶不仅表现出良好的生物相容性和优异的抗菌性能,而且还通过调节炎症和胶原蛋白沉积来促进伤口愈合。
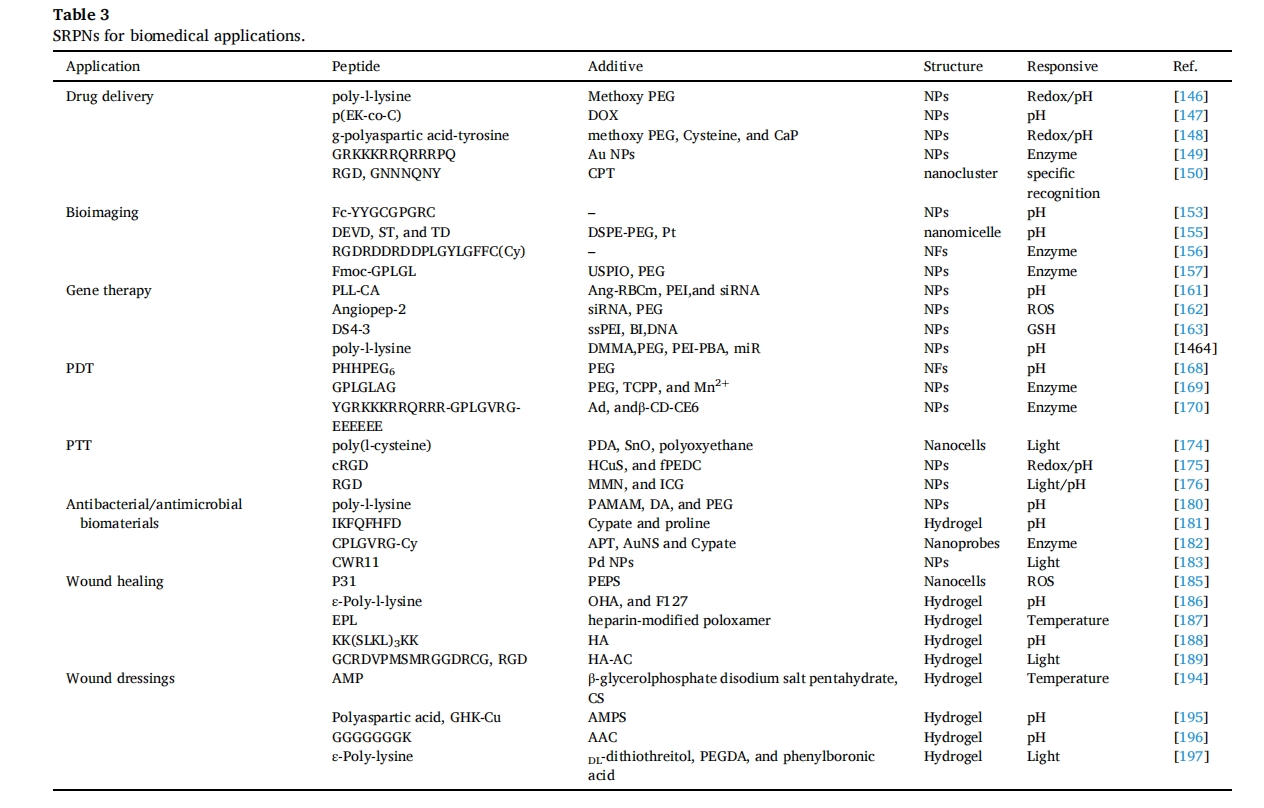
在以上章节中,我们介绍了一些将 SRPN 用于各种生物医学应用的案例。很明显,用不同的功能成分对肽纳米材料进行功能化增强了材料的刺激响应特性,并促进了它们与刺激响应相关的广泛应用。为了更清楚起见,我们提供了一个表格(表 3) 来总结 SRPN 在生物医学应用中的这些细节。
目前,全球已有 80 多种多肽药物上市,约 150 种多肽药物处于临床开发阶段,数百种多肽药物处于临床前研究阶段。值得注意的是,第一个获批用于临床基因治疗的是基于 p53 的 [198报道称,超过一半的癌症患者都是由于p53致癌基因突变或功能障碍引起的,因此调控和替换异常的p53基因是治疗癌细胞的有效方法[199陈等人利用二硫键交联 CPP (CR8C) 和 C-KLA (TPP) 合成双功能肽 (xPolyR8-KLA(TPP)) 可有效浓缩 p53 基因,以便装载和递送[200]. xPolyR8-KLA(TPP)/p53复合物内化,二硫键断裂,释放出C-KLA(TPP)和p53基因,通过C-KLA(TPP)和p53基因通路诱导癌细胞凋亡,xPolyR培养细胞凋亡和坏死率8与用其他载体培养的细胞相比,-KLA(TPP)/p53 约为 45.5%。
然而,在肽纳米药物用于人体之前,需要进行大量的临床试验,以测试人体对药物的耐受性以及药物的实际效果。目前已有超过 2000 项基于治疗性肽的临床试验。例如,BLP25 脂肽(STAPPAHGVTSAPDTRPAPGSTAPP)疫苗是 MUC1 特异性的,L-BLP25 癌症疫苗已在 III 期试验中评估用于治疗不可切除的 III 期非小细胞肺癌[76. 细胞穿透肽 (CPP, D-JNKI-1) 用于阻断 jun-N 末端蛋白激酶 (JNK) 通路已被证明是一种有效的预防和治疗急性耳蜗损伤的方法。在 Meyer 等人的报告中提到的临床试验中,用 D-JNKI-1 治疗的严重急性听力损失患者具有显著的治疗效果。[201]在临床实践中,靶向肽与化疗药物和特异性蛋白质的偶联得到了迅速发展。Mahalingam 等人开发了一种靶向前药 (Mipsagargin),由前列腺特异性膜抗原特异的肽底物和 12ADT 与 TG 组成[202]对米沙金进行了安全性评价,并探索了以甘油三酸酯为靶点的治疗晚期实体瘤的临床试验,结果显示米沙金具有良好的耐受性和优异的抗肿瘤活性,在肝细胞癌的治疗中显示出显著的疗效。
综上所述,目前已开发出多种基于肽的纳米药物,并在体内和体外实验中取得了优异的实验结果。体外目前,多肽药物的研究还在进行中,部分多肽药物已获得美国食品药品监督管理局(FDA)的批准,多肽作为治疗药物受到广泛关注。为了更好地将多肽药物应用于实践,还需要深入探究临床使用过程中可能遇到的诸多问题,因此,开发具有高效临床疗效的多肽纳米药物还有很长的路要走。
7 结论和观点
综上所述,本文综述了近年来刺激响应肽在分子水平设计和控制合成方面的研究进展,并对SRPN的功能调控进行了详细讨论。氨基酸的不同排列方式为多肽设计提供了多样性,同时,丰富的氨基酸侧链为多肽与其他材料的结合提供了基础。内外环境的刺激可以引发多肽不同的结构和行为,使得合成不同尺寸、具有特定刺激响应的SSRPN、DSRPN和MSRPN成为可能。此外,为了拓宽SRPN的生物医学应用,可以利用金属、核酸、多糖、PS等物质对SAP纳米材料进行特殊的功能剪裁,以及其他物质与肽的偶联。鉴于SAP纳米材料的功能可调性,它们在药物输送、生物成像、基因治疗、光疗、抗菌药物以及伤口愈合和敷料等领域显示出良好的应用前景。
虽然近年来 SRPN 的设计制备及其功能调控得到了广泛的讨论和发展,但它们在生物医学领域的应用仍面临一些挑战。这里我们想给出一些建议。首先,从合成方法学的角度来看,开发简单、绿色、可控的 PSA 平台对于功能化 SRPN 的制备尤为重要。其次,虽然多肽具有良好的生物相容性,但对于体内在实际应用中,由于生理环境复杂,多肽需要其他化学物质进行修饰,因此,SRPN 的生物相容性和稳定性至关重要。体内需要进行长期评估和测试。第三,尽管肽的细胞毒性较低,但与肽偶联的化学物质可能会对正常组织和细胞的存活产生影响。因此,设计SRPN仍需要进一步研究其生物降解和降解产物的毒性,以确保其在人体内具有稳定的安全性。第四,需要加强对癌细胞中PSA行为的探索,这将有利于深入了解SRPN在特定环境中的智能转化体内第五,现阶段PSA过程实时反馈的方法和技术已经成熟体内并实时监测癌症治疗仍缺乏。SRPNs通过共价和非共价方式载药。为了促进细胞内化和肿瘤部位积累,需要创造更多的活性位点并增强SRPNs的靶向能力。最后,由于TME的复杂性,必须开发更具体的刺激响应机制来提高SRPNs的安全性和治疗效率,以实现有效的临床癌症治疗。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。