
摘要:癌症进展的标志是免疫抑制细胞的浸润,如肿瘤相关巨噬细胞(tam)、调节性T淋巴细胞(Tregs)和髓源性抑制细胞(MDSCs)。这些细胞在消除细胞毒性T淋巴细胞介导的(CTL)免疫反应中发挥关键作用,使肿瘤生长继续不减弱。此外,通过使用肽和基于肽的纳米药物靶向这些免疫抑制细胞已显示出有希望的结果。在这里,我们回顾了免疫抑制细胞在癌症进展中的起源和功能,用于其靶向的基于肽的系统,并探讨了癌症免疫治疗的未来研究途径。这些研究的成功证明了肿瘤免疫微环境在癌症传播中的重要性,以及肽基纳米材料作为免疫调节剂的潜力。
1 介绍
癌症是全球主要死亡原因,2018 年估计有 960 万人死亡[1]。该疾病的致死率部分归因于免疫来源的免疫抑制细胞(如肿瘤相关巨噬细胞 (TAM)、调节性 T 淋巴细胞 (Treg) 和髓源性抑制细胞 (MDSC))进入肿瘤微环境 (TME)。这些细胞进入 TME 与多种癌症(如皮肤癌、前列腺癌、肺癌和卵巢癌)患者的不良预后有关 [2–10]这些细胞通过抑制人体的肿瘤杀伤免疫反应,即 CD8 +细胞毒性 T 淋巴细胞 (CTL),来支持癌症进展,这种免疫抑制主要通过免疫检查点分子的表达以及抗炎细胞因子的分泌来介导。11例如,程序性死亡配体 1 (PD-L1) 和 CD80/CD86 在 TAM 表面表达,并分别与免疫检查点程序性死亡蛋白 1 (PD-1) 和细胞毒性 T 淋巴细胞相关蛋白 4 (CTLA-4) 相互作用,后者存在于活化的 CTL 表面,并削弱其效力和增殖[12]。
1.1 CTL 简介
CTL 是适应性免疫系统的主要组成部分,与 B 淋巴细胞一起。与构成先天免疫系统的自然杀伤 (NK) 细胞、巨噬细胞和树突状细胞 (DC) 不同,CTL 必须先针对特定抗原进行启动和扩增,然后才能表现出细胞毒性。肿瘤相关抗原 (TAA) 是短肽序列(约 8-11 个氨基酸),由抗原呈递细胞 (APC) 从癌细胞中清除,然后抗原呈递细胞将这些肽呈递到称为主要组织相容性复合体 (MHC) 的表面蛋白复合物上 [13]。载有抗原的 MHC 用于通过 T 细胞受体 (TCR) 激活幼稚 CTL,使其对所呈递的抗原产生特异性反应。CTL 的激活以共刺激方式发生,取决于 MHC 同时激活 TCR,以及 APC 表达的 CD80/CD86 激活另一种表面蛋白 CD28。激活后,CTL 在 IL-2 存在下进行克隆扩增,并对表达抗原的细胞表现出细胞毒性。CTL 的细胞毒性效应功能由细胞毒素(如颗粒酶、穿孔素和颗粒溶素)的释放介导,这些毒素会诱导靶细胞中的孔形成和膜溶解[14]。此外,CTL 可通过表达 FAS(FS-7 相关表面抗原)死亡配体,通过细胞间接触直接诱导细胞凋亡。激活后,CTL 表现出 CD28 表达下调和 PD-1 和 CTLA-4 等免疫检查点表达上调。这些检查点与巨噬细胞、DC、Treg 和癌细胞上表达的相关配体(分别为 PD-L1 和 CD80/CD86)相互作用,可通过削弱 CTL 的效应功能和增殖来阻止免疫反应。由于 CTL 构成了适应性免疫反应的大部分,因此重新刺激 CTL 介导的肿瘤免疫一直是癌症免疫治疗领域的主要关注点。
1.2 当前的免疫治疗策略
免疫疗法的发展是为了刺激癌症中被抑制的 CTL。尽管癌症驱动的免疫抑制背后的机制最近才被发现,但早在 19 世纪,免疫刺激和治疗之间的联系就已被经验性地观察到。第一项记录这一概念的研究发生在 1868 年,由 Wilhelm Busch 进行,他在研究中观察到,在细菌感染介导的肿瘤消退后,化脓性链球菌[15],25年后,威廉·科利发表了一份报告,证实了细菌感染在10例不同患者身上治疗癌症的疗效。[16]。一种含有该菌株的细菌疫苗被命名为“科利毒素”,以纪念他的工作,并被用作抗癌药物数十年[17],直到 20 世纪 90 年代,免疫学的进步确定了免疫细胞在控制癌症生长中的关键作用,免疫疗法的概念才被搁置,取而代之的是小分子细胞周期抑制剂和放射疗法。[18–20]。
单克隆抗体作为免疫检查点抑制剂的应用涵盖了大多数免疫疗法,首次成功的临床前应用是在 1996 年由 Allison 等人报道的。[21],2010 年发表了一项利用 CTLA-4 靶向单克隆抗体(伊匹单抗)的临床试验结果,结果显示,与标准治疗 gp100 肽疫苗相比,转移性黑色素瘤患者的生存期有所改善(10.1 个月 vs. 6.4 个月)[22],这些结果促使伊匹单抗于次年获得 FDA 批准,商品名为 Yervoy,用于治疗转移性黑色素瘤。[23]。不久之后,FDA 还批准了两种 PD-1 免疫检查点抑制剂,派姆单抗/兰布罗利珠单抗(Keytruda)和纳武单抗(Opdivo),用于治疗黑色素瘤、非小细胞肺癌和肾细胞癌[24,25],此外,抗 PD-L1 单克隆抗体阿特珠单抗 (Tecentriq) 于 2016 年获批用于治疗膀胱癌,并于 2019 年再次获批用于治疗小细胞肺癌和三阴性乳腺癌[26] 值得注意的是,2018 年诺贝尔生理学或医学奖被授予 Allison 和 Honjo,他们首次证明了 CTLA-4 和 PD-1 免疫疗法的有效性[27,28]。
免疫检查点抑制剂通过防止免疫反应过早关闭而发挥作用,而其他免疫疗法则侧重于协助启动 CTL 以产生更大的免疫反应。肽疫苗已在临床前模型和临床试验中得到探索 [29–31],肽疫苗的目的是合成与癌细胞上呈现的TAA相同的肽序列,并将其递送至CTL,以增加其对表达这些抗原的癌细胞的激活和启动。这一概念可以推广到体外设计表达具有抗原结合和T细胞活化部分的嵌合抗原受体(CAR)的CTL(CAR-T细胞)[32],CAR-T 细胞是通过过继细胞转移产生的,即从患者体内提取自体的 T 淋巴细胞,对其进行改造以表达 CAR,针对患者特异性抗原进行引发,在体外扩增,然后重新引入患者体内。[33,34]。
另一种有前景的免疫治疗方法是将肽、单克隆抗体和核酸适体等治疗剂靶向并递送至免疫抑制的 TAM、Treg 和 MDSC。[38–41],尤其是肽类药物,它是免疫疗法的有力候选药物,已用于针对免疫抑制细胞的各种研究,因为它们具有许多有吸引力的特性,如生物相容性、成本效益和多功能性,既可作为靶向部分,又可作为治疗剂。然而,肽在体内稳定性较差,因为它们容易被血清和组织中的蛋白酶降解,因此其应用受到限制。纳米颗粒系统通常用于规避这个问题,从而可以安全地将肽递送到靶细胞。此外,即使这些小细胞群处于高度异质的微环境中,也已使用对免疫抑制细胞具有特异性的肽功能化的纳米颗粒来操纵它们。
这篇小型评论详细介绍了与癌症传播有关的免疫抑制细胞的起源、生物标志物和功能,然后强调了肽和肽功能化纳米颗粒在靶向这些细胞以进行免疫治疗反应中的应用。我们引导读者阅读其他评论,这些评论广泛描述了免疫治疗的一般免疫疗法和纳米医学策略.
2 癌症中的免疫抑制细胞
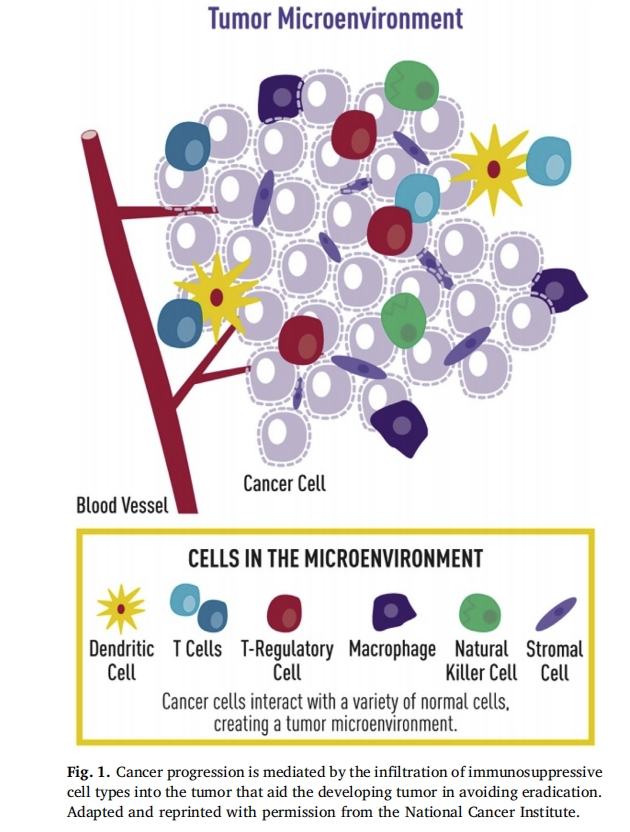
浸润性免疫细胞(如 M2 样 TAM、Treg 和 MDSC)在癌症中发挥抑制作用,抑制 CTL 介导的肿瘤免疫。(图 1)。M2 巨噬细胞和 Treg 的内源性功能是在感染得到处理后停止免疫反应,以及预防自身免疫。然而,在癌症的背景下,这些细胞通过抑制 CTL 介导的对疾病的免疫反应与疾病进展有关。MDSC 是一种独特的细胞亚群,仅在病理情况下观察到,包括癌症。TAM、Treg 和 MDSC 在癌症进展中的起源、标记和作用将在下文进一步讨论。
2.1 肿瘤相关巨噬细胞 (TAM)
巨噬细胞是一种免疫细胞,能够吞噬异常细胞和外来入侵者,并呈递抗原和分泌免疫调节细胞因子。49单核细胞衍生的巨噬细胞根据炎症线索从血流中招募为未分化的单核细胞,例如 CCL2(或单核细胞趋化蛋白-1,MCP-1)、CCL3(或巨噬细胞炎症蛋白-1a,MIP-1a)、CXCL12(或基质衍生因子-1,SDF-1)和 CX3CL1(或分形因子)[50–55]。根据这些单核细胞渗出到的免疫学环境,它们可能分化为促炎性 M1 表型或抗炎性 M2 表型巨噬细胞。M1 巨噬细胞受脂多糖和 Th1 细胞因子(如干扰素γ (IFN-y) 和粒细胞-巨噬细胞集落刺激因子 (GM-CSF))极化 [56它们与杀死病原体和释放促炎细胞因子(TNF-α、CCL3、IL-6、IL-12)有关,从而使其具有杀肿瘤作用[57–59而 M2 巨噬细胞则由 Th2 细胞因子(如 IL-4 和 IL-13)激活。与细胞外基质重塑以及抗炎和免疫抑制细胞因子分泌(IL-10、TGF-β)有关,有助于支持肿瘤的生长[62]。由于 M1 和 M2 巨噬细胞在免疫系统中发挥不同的功能,因此可以通过评估代谢输出来区分两者。例如,巨噬细胞功能的差异在氨基酸精氨酸的代谢中得到了很好的体现。M1 巨噬细胞通过一氧化氮合酶代谢精氨酸产生一氧化氮,一氧化氮通过靶细胞膜扩散并介导细胞毒性,另一方面,M2 巨噬细胞被观察到利用精氨酸酶将精氨酸转化为鸟氨酸,鸟氨酸是一种参与尿素循环的氨基酸,通过刺激基质蛋白(如胶原蛋白)的生成来促进细胞增殖和组织修复。TAM 通常属于 M2 分类,在癌症进展中发挥重要作用,因为它们与不良的患者预后有关,研究表明,TAM 向肿瘤和周围微环境的浸润是由癌细胞的化学信号介导的,癌细胞主要通过 MCP-1 信号轴从外周血中募集未分化的单核细胞[68]。癌症分泌的 IL-4 和 IL-13 随后促进这些浸润性单核细胞向 M2 表型极化[69]。
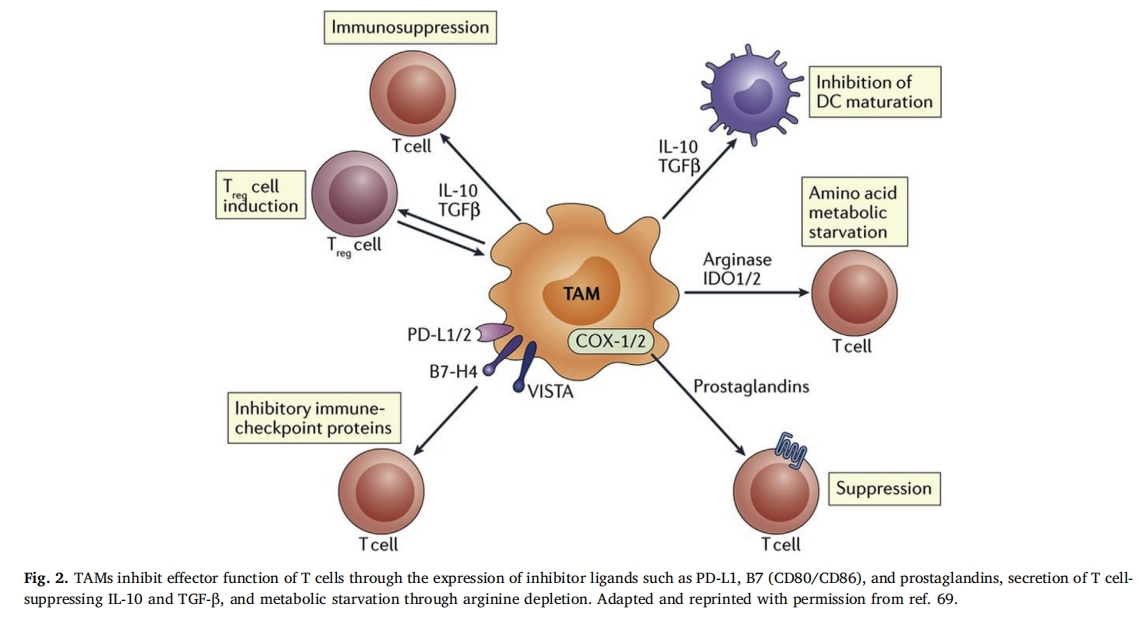
据观察,TAM 通过主动抑制 CTL 反应来调节 TME(图 2)。这主要通过在细胞表面表达抑制性配体以及释放损害 CTL 扩增和功能的免疫抑制细胞因子来实现。TAM 还在募集免疫抑制性 Treg 方面发挥作用,其功能和在免疫抑制微环境中的作用将在后面的部分进一步讨论。TAM 表达许多与 CTL 表面显示的免疫检查点相互作用的配体,从而导致 CTL 抑制。例如,TAM 表达 PD-L1,它与激活的 CTL 表面的 PD-1 受体结合,下调其功能和增殖 [70,71]。TAM 还表达 CD80 和 CD86 配体,它们可以起到免疫刺激或免疫抑制作用,具体取决于它们与哪种受体相互作用[72CD80/CD86 可与 CD28 相互作用,共同刺激幼稚 CTL,然而,这些配体对活化 CTL 上的 CTLA-4 具有更强的亲和力,CTLA-4 在幼稚 CTL 中的表达水平非常低,但当这些细胞被激活/启动时,其表达就会上调。因此,CTLA-4 可以充当制动机制,使被 CTL 效应活性吸引到该位点的表达 CD80 和 CD86 的 TAM 在免疫反应消除癌症之前将其关闭。[78]这种动态通常被用来在疾病清除之前过早抑制 CTL 功能,例如在 CD80 + /CD86 + TAM大量浸润的癌症情况下。
TAM 促进免疫抑制微环境,这是其与患者预后和结果不佳相关的主要原因之一。这些巨噬细胞还发挥许多其他促进肿瘤的功能,例如诱导血管生成和细胞外基质重塑,但这些不在本文的讨论范围内,其他研究已详细介绍 [79–82]。
2.2 调节性T细胞 (Treg)
Treg 是 CD4 + T 细胞的一个重要亚型,其作用是在异物清除后维持免疫原性自我耐受并抑制适应性免疫反应。CTL 和 Treg 之间的平衡被破坏已在多种病症中观察到,包括癌症。在 I 型糖尿病、多发性硬化症和类风湿性关节炎等自身免疫性疾病中,Treg 无法抑制 CTL,导致自身免疫 [84]。另一方面,Treg 的过度活跃使得 CTL 群体无法中和病原体或肿瘤。正是 Treg 活性的上调使得癌症能够避免被 CTL 反应消灭。
Treg 起源于幼稚 CD4 + T 细胞,其在胸腺中不断成熟,直到 TCR 激活和叉头框 P3 (FoxP3) 表达促进抑制表型 [85可以通过 CD4、CD25、CTLA-4、淋巴细胞活化基因 3 (LAG-3)、神经纤毛蛋白-1 (Nrp1) 和 FoxP3 的表达来识别 Tregs。[86–88],Treg 能够通过接触依赖性抑制以及通过释放调节性细胞因子来直接抑制活化的 CTL 功能。Treg 被吸引到炎症部位并通过 IL-2(一种由活性 CTL 分泌的炎症细胞因子)激活 [89]。由于 IL-2 也是 CTL 激活和扩增所必需的,因此 Treg 上 IL-2 受体 IL-2R 的高表达使它们能够迅速消耗周围微环境中的 IL-2,从而抑制 CTL 激活。Treg 还可以通过接触依赖性机制更直接地抑制效应功能。Nakamura 等人已经证明,转化生长因子 β-1 (TGF-β1) 在 Treg 表面的表达以接触依赖性方式促进免疫抑制,尽管控制这一过程的生物分子机制尚不清楚[90]。Treg 还表达 LAG3,这是另一种对 MHC II 类和 CD4 具有亲和力的免疫抑制细胞表面配体。尽管 LAG3 是一种主要与 CTL 相关的抑制性受体,但最近的研究表明,它对 Treg 的免疫抑制功能至关重要,尽管其原因仍有待阐明[91]。LAG3 与一种 T 淋巴细胞亚群 (CTL) 中的抑制有关,但与另一种 T 淋巴细胞 (Treg) 的激活有关,这种现象已在其他细胞表面标志物(如 PD-1 和 CTLA-4)中观察到。Treg 分泌的免疫抑制细胞因子也在下调免疫反应中发挥作用。据观察,这些调节细胞会释放高水平的可溶性 TGF-β1 和 IL-10,这两者都对 CTL 活性和增殖有负面影响。TGF-β1 通过抑制 CTL 扩增所必需的 TCR 复合物的活化而起作用 [92IL-10 通过抑制 CD28 的磷酸化发挥作用,CD28 是 CTL 激活共刺激途径中与 TCR 互补的表面蛋白 [93]。
癌症的诱发往往伴随着免疫抑制环境的建立,而免疫抑制环境的建立则以幼稚 T 淋巴细胞的募集和激活为先导,形成 Treg。与 TAM 募集类似,Treg 遵循癌细胞建立的趋化梯度,主要基于 CCL22 趋化因子 [94],TGF-β 和 IL-10 等生长因子刺激 TME 中 Treg 的快速增殖 [95]。TGF-β 还通过促进非抑制性 CD25 − T 淋巴细胞转化为抑制性 CD4 +、 CD25 +、 FoxP3 + Treg 表型而发挥额外作用。Treg 转运到刺激其扩增的 TME 中,形成协同循环,其中癌细胞和 Treg 促进对方的生长和增殖,从而建立高度免疫抑制的环境。
2.3 髓系抑制细胞 (MDSC)
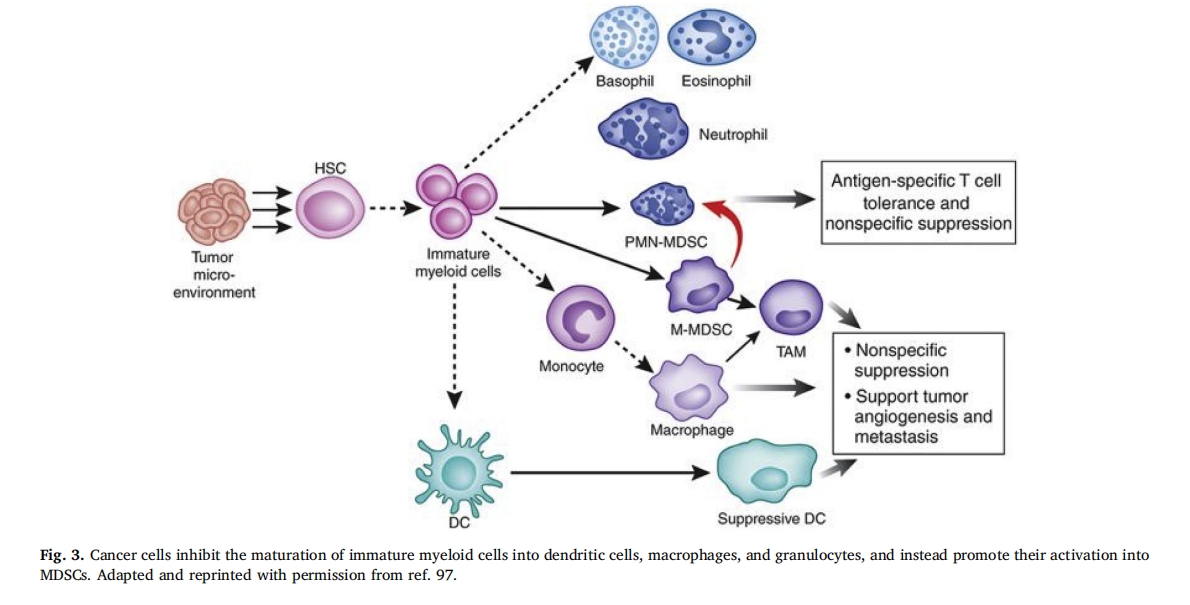
MDSC 是存在于 TME 中的免疫抑制性髓系细胞,与患者预后不良有关 [96健康个体中不存在 MDSC。这些细胞是癌症等病理条件下特有的,它们来源于髓系祖细胞,这些细胞向成熟髓系的分化受到抑制(图 3)[97]。正常情况下,未成熟的髓系细胞从骨髓转移到外周器官,在那里它们迅速成熟为巨噬细胞、树突状细胞或粒细胞。然而,在癌症中,这些未成熟细胞的分化受到肿瘤中存在的各种信号因子的抑制,例如 GM-CSF、巨噬细胞集落刺激因子 (M-CSF)、IL-6、IL-10 和 TNF-α[98,99]。此外,这些因素还会诱导未成熟的髓系细胞活化为免疫抑制表型。这些未成熟的免疫抑制髓系细胞被称为MDSC。
MDSC 没有 MDSC 特异性生物标志物。相反,它们表达指示髓系谱系的生物标志物,例如 CD11b 和 CD33,但缺乏完全分化细胞的标志物 [100]。利用这些标准,MDSC 通常以人类的 CD11b + CD14 − CD33 +生物标志物谱和小鼠的 CD11b + Gr1 +谱为特征 [100]。MDSC 通过趋化因子分泌被募集到 TME。特别是,癌细胞产生的 CCL2、CXCL8 和 CXCL12 与大多数 MDSC 运输有关 [101]。
MDSC 的免疫抑制是由活性氧 (ROS) 和细胞因子产生以及精氨酸耗竭介导的。在 Corzo 等人的一项研究中,MDSC 中 ROS 的产生增加导致 CTL 中的 DNA 损伤和细胞凋亡 [102]。ROS 还会干扰 CTL 通过 TCR 识别抗原的能力,从而下调 CTL 活性。例如,超氧化物 (O2− ) 可与一氧化氮 (NO) 反应形成过氧亚硝酸盐 (ONOO − ),这种物质通过诱导细胞凋亡和抑制控制 TCR 正确形成的磷酸化途径来抑制 CTL 活性 [103]。CTL 的代谢饥饿是 MDSC 抑制免疫反应的另一种方式。精氨酸是 CTL 中蛋白质合成和扩增所必需的氨基酸 [104MDSC 大量表达一氧化氮合酶 (NOS) 和精氨酸酶(两种主要的精氨酸代谢物),严重降低 CTL 可利用的精氨酸量,削弱其增殖和控制癌症生长的能力。[105]。
此外,MDSC 还能招募其他免疫抑制细胞。Huang 等人的过继细胞转移研究表明,MDSC 产生的 IL-10 和 TGF-β 是诱导 Treg 及其相关免疫抑制所必需的 [106此外,Sinha 等人将 MDSC 与 M1 巨噬细胞共培养,并表现出以接触依赖的方式向促进肿瘤的 M2 表型极化 [107]。这一观察结果显示巨噬细胞释放的T细胞刺激性IL-12减少。此外,他们的研究表明,通过使用化疗药物吉西他滨消除MDSC可恢复IL-12的产生和肿瘤免疫力。
如上所述,免疫抑制细胞并不是单独导致癌症进展的孤立细胞群。相反,它们以协同和相互依赖的方式相互作用并与周围环境相互作用。它们所依赖的生化信号(尤其是趋化因子)有很多重叠,这使得这些信号分子成为免疫疗法的潜在靶点。
3 针对免疫抑制细胞的肽
肽是免疫疗法的有力候选者,因为它们能够以高度特异性的水平结合并诱导靶细胞/受体的反应。此外,肽化学领域的最新进展使其合成速度更快、更具成本效益且更方便[108此外,肽可以整合到纳米颗粒系统中,增强其体内稳定性,并允许将其纳入多模式疗法中[53–55,109–113],例如,纳米粒子可以用肽进行功能化,以促进与细胞膜的相互作用并介导内吞作用。[114]。纳米颗粒还可以通过将肽浓缩成致密的纳米颗粒来增强肽的治疗效果。[115]。这通常是通过化学结合将肽部分植入纳米材料基底上来实现的。例如,一种常用的结合策略是使用 1-乙基-3-(3-二甲氨基丙基)碳二酰亚胺 (EDC) 将肽 N 端的游离胺与用羧酸基团功能化的纳米颗粒基底反应,在肽和纳米颗粒基底之间形成酰胺接头[116–119],由于肽的 C 端也有游离羧酸,因此可以利用同样的策略将肽与胺基封端的纳米粒子结合。将肽直接结合到纳米颗粒基质上的另一种方法是用富含硫的半胱氨酸基团终止肽序列,并与马来酰亚胺功能化的纳米颗粒反应。高亲和力、非共价相互作用也可用于将肽与纳米颗粒底物连接。例如,生物素化的肽可用于与展示链霉亲和素部分的纳米颗粒紧密结合,此外,可以调节静电相互作用以实现肽和纳米颗粒之间所需的相互作用,据Blank-Shim等人报道,他们使用强正电荷的精氨酸同肽(等电点为11.15)与带负电荷的磁性纳米粒子结合。
可以通过动态光散射 (DLS) 和透射电子显微镜 (TEM) 表征纳米粒子特性来确认纳米粒子的功能化,以检查肽结合之前和之后的纳米粒子大小、形态和多分散性。此外,纳米颗粒的zeta电位通常用于检测肽官能化赋予的表面电荷差异,核磁共振(NMR)和圆二色性(CD)光谱的变化也用于确认肽结合,以及检查肽二级结构.
本篇小型评论的其余部分将重点介绍以肽为重点的研究,这些研究已用于癌症免疫治疗策略,重点是解决免疫抑制 TAM、Treg 和 MDSC,并评估免疫治疗肽和肽纳米颗粒的前景。
3.1 瞄准目标客户
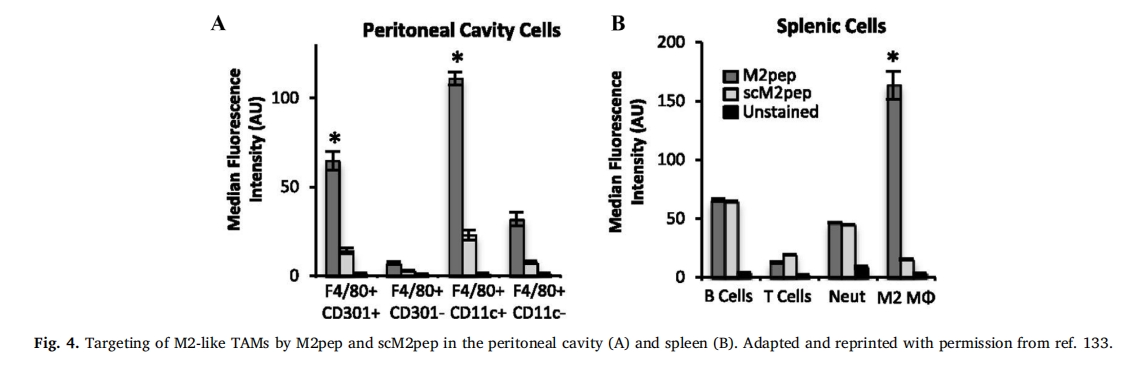
鉴于 TAM 的免疫抑制作用及其与癌症预后的负相关性,已开发出多种新型肽,不仅靶向巨噬细胞本身,还靶向其单核细胞前体,以及促进其诱导和病理行为的生化途径。Pun 等人通过噬菌体展示开发并验证了一种新型 M2 巨噬细胞靶向肽 M2pep (YEQDPWGVKWWY) [133]。通过将 Alexa Fluor 660 标记的 M2pep 注射到小鼠腹腔内来确定 M2pep 的靶向能力。从腹腔内细胞以及脾脏中采集的细胞表明,M2pep 能够靶向 B 细胞、T 细胞和中性粒细胞等混合细胞群中的 F4/80 +、CD301 +、CD11c + M2 巨噬细胞(图 4a 和 b)。此外,与非靶向 (乱序肽) 对照相比,M2pep 表现出更高的结合力。
Scodeller 等人进行的噬菌体展示实验确定了一个短肽序列 CSPGAKVRC(称为“UNO”),能够靶向 M2 巨噬细胞特异性 CD206 表面标志物 [136]。通过将荧光标记的 UNO 注射到 4T1 肿瘤小鼠体内,验证了 UNO 的靶向能力。小鼠被处死,注射后 2 小时收获其器官。收获组织的共聚焦显微镜检查显示 UNO 和 CD206 高度共定位,96% 的 UNO 阳性细胞也对 CD206 染色呈阳性。此外,Lee 等人将蜜蜂毒液中发现的 26 个氨基酸肽蜂毒素 (MEL) 确定为 CD206 靶向序列 [137,138MEL 是一种两亲性肽,已被研究作为一种抗癌药物,因为它能够通过线粒体孔隙形成诱导癌细胞凋亡,以及通过下调 VEGF 表达抑制血管生成。[139,140]。作者研究了MEL单独作用以及MEL与细胞毒性T细胞因子(KLAKLAK)融合的抗肿瘤作用。2通过将 MEL 或 MEL-KLA 施用于 Lewis 肺癌 (LLC) 小鼠模型,可以产生肽 (KLA) (MEL-KLA) [138]。治疗在肿瘤接种后 5 天开始,每 3 天注射一次,直到接种后 12 天处死小鼠。结果显示,与 PBS 治疗的对照组以及 KLA 和 MEL 单一疗法相比,MEL-KLA 治疗后肿瘤重量显着下降。为了进一步研究 MEL 的 M2 靶向能力,该组的另一项研究表明,在 LLC 模型中,MEL 治疗后 M1/M2 巨噬细胞比率从 0.65 增加到 1.55 [137M1/M2 比率是一种越来越常用的指标,据报道,该比率与人类癌症的预后呈正相关。141]。M1/M2比率的变化归因于MEL对M2巨噬细胞的细胞毒性,通过流式细胞术和qPCR中M2巨噬细胞标志物CD206的减少得到验证。
3.2 针对 Tregs
2004 年,神经纤毛蛋白-1 (Nrp1) 受体首次被 Bruder 等人发现为潜在的 Treg 标记物。[88]。Nrp1 最初被确定为 VEGF 的辅助受体,现在已被确定为 Treg 功能所必需的。其在这些 T 细胞上的表达与 FoxP3 表达相关,暗示其作为免疫抑制表型的介质的作用 [142此外,Delgoffe 等人最近的一项研究还发现了其在维持 Treg 稳定性中的作用,因为通过 Nrp1 的上调导致该群体不稳定是癌症的常见特征。143毫不奇怪,涉及基因敲除模型和抗体阻断的 Nrp1 临床前研究已导致皮肤癌、肺癌和前列腺癌的肿瘤生长减少。144Nrp1 肽 LyP-1 (CGNKRTRGC) 的发现导致了通过 Nrp1 专门针对 Tregs 的 NP 系统的开发[145,146]。LyP-1 属于肽家族的一部分,称为 C 端 C 端规则 (CendR) 基序肽,它们具有肿瘤穿透能力。在一项研究中欧等人开发了一种纳米粒子,该粒子包含一个 PLGA 核心,其中负载有抗 CTLA-4、酪氨酸激酶抑制剂伊马替尼 (IMT) 和 LyP-1 作为靶向配体,与传统的抗 CTLA-4 免疫疗法相比,该纳米粒子显著降低了 B16 小鼠黑色素瘤模型中的肿瘤生长。在肿瘤接种后 10 天开始,每 2 天对小鼠进行一次治疗,共 15 天,治疗药物包括 PBS、游离 IMT、游离抗 CTLA-4、非靶向 IMT 负载纳米粒子、靶向 IMT 负载纳米粒子以及靶向抗 CTLA-4 和 IMT 负载纳米粒子。结果表明,包含 LyP-1、IMT 和抗 CTLA-4 的完整纳米粒子最为有效,与游离抗 CTLA-4 相比,肿瘤体积减少了 50% 以上,证明了基于肽的纳米粒子在增强临床标准方面具有潜力 [144]。
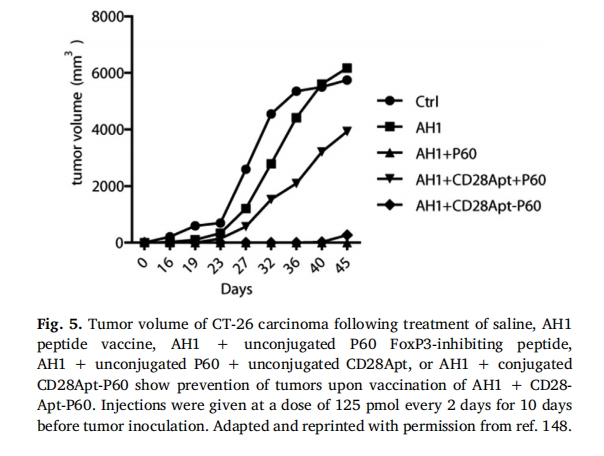
Pastor 等人通过将 FoxP3 抑制肽 (P60) 与 CD28 靶向适体 (AptCD28-P60) 结合,创建了另一种靶向 Treg 的纳米颗粒 [147,148]。结果表明,与未结合的 P60 相比,结合分子能够以低 200 倍的浓度(100 μM vs. 0.5 μM)对抗 Treg 介导的 CTL 免疫抑制。此外,与盐水对照、单独肽疫苗、肽疫苗和未结合的 P60 以及肽疫苗和未结合的 P60 与未结合的 AptCD28 相比,用 AptCD28-P60 联合肿瘤抗原肽疫苗 (AH1) 治疗 CT-26 癌模型可消除肿瘤,表明将 P60 与 AptCD28 结合以实现协同治疗的必要性(图 5)。
鉴于 MDSC 属于未成熟细胞群,尚未发现它们表达可用于肽结合的 MDSC 特异性生物标志物。不过,Qin 等人已利用噬菌体展示筛选 MDSC 结合肽 [149]。所选肽(MEWSLEKGYTIK)与鼠 IgG2b 的 Fc 区融合,形成肽抗体结合物(H6 肽体)。用 H6 肽体治疗导致多种鼠淋巴瘤模型(EL4、EG.7、A20)中脾脏和循环中的 MDSC 耗竭,并在 EL4 模型中表现出抗肿瘤功效。此外,Wang 等人研究了趋化因子阻断作为间接影响 MDSC 群体的手段的有效性 [150他们使用 CCL2 激动剂来抑制 CCL2 信号传导,CCL2 信号传导是与 MDSC 迁移有关的主要趋化剂[151,152]。这导致肺癌模型中 MDSC 向 TME 的浸润显著减少。值得注意的是,观察到 CCL2 阻断也提高了抗 PDL1 治疗的疗效,可能是通过 MDSC 耗竭实现的。
4 当前展望和结论
近年来,在建立和维持免疫抑制微环境方面,人们对免疫抑制细胞和癌细胞之间的相互作用的理解取得了进展。此外,在将这些知识应用于本文所述的肽基疗法方面也取得了长足进步。然而,针对免疫抑制细胞的肽和纳米药物在癌症免疫疗法中的应用还处于早期阶段。因此,这些技术在人类身上的临床应用受到限制。这可能是由于缺乏对肽纳米颗粒与生物环境相互作用以及改变纳米颗粒命运、功效和毒性的蛋白质外壳形成的理解[153,154]。另一个挑战包括扩大肽功能化纳米颗粒的规模,以及批次间差异,从而限制了商业化潜力。此外,在将免疫抑制细胞的免疫治疗靶向转化为临床之前,需要对人体的免疫网络有更深入的了解。例如,尽管TAM、Tregs和MDSC与经典CTL的相互作用已经得到充分研究,但其他免疫细胞,如自然杀伤(NK)细胞、B淋巴细胞和树突状细胞,都具有独特而复杂的功能和相互作用,值得进一步研究。基于肽的纳米颗粒是一种工具,可为研究人员和临床医生提供一种靶向特定分子途径和细胞间相互作用的方法,这些途径和相互作用有助于癌症进展,但为了有效利用这些工具,扩展我们对免疫学的理解至关重要。进一步了解免疫网络将使研究人员不仅能够更好地开发新型纳米颗粒系统,还能更好地预测其体内功效。
我们对癌症免疫疗法的认识的一个主要缺陷在于,无法确定临床治疗反应的预测性生物标志物。尽管有些病例表明免疫疗法可以根除化疗耐药性肿瘤,但现实情况是,只有少数患者对治疗有反应。患者反应不一致可归因于癌症的异质性,也可归因于缺乏预测性生物标志物,尽管已经鉴定出一些标志物,如免疫检查点和免疫调节细胞因子,但其他预后标志物的发现可以用于优化患者选择,并进一步了解免疫治疗背后的机制。此外,这些生物标志物的组合使用能够具有更准确的预测能力。
纳米医学使组合疗法的使用更加可行,因为纳米颗粒可以设计成包含多个生物活性部分。此外,将生物活性材料包装到纳米颗粒中可确保它们被递送到所需的目标,从而减少脱靶递送和毒性。这里重点介绍的许多研究表明,组合疗法可以提高单一治疗临床标准的有效性和安全性[137,148]。随着科学研究不断填补上述知识空白,基于肽的纳米粒子将继续发展,并构成一类能够靶向免疫抑制细胞群的纳米材料。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。