
摘要:得益于新的生产、修饰和分析技术,肽类药物的开发在过去十年中取得了巨大进展。肽类药物的生产和修饰采用了化学和生物方法,并采用了新颖的设计和递送策略,这有助于克服肽类药物的固有缺陷,并推动该领域的持续发展。人们已经获得并研究了多种天然和修饰肽类药物,涵盖了多个治疗领域。本综述总结了肽类药物发现、生产和修饰方面的努力和成就,以及它们目前的应用。我们还讨论了治疗性肽类药物未来发展的价值和挑战。
治疗性肽是由一系列有序氨基酸组成的一类独特药物,分子量通常为500-5000Da。治疗性肽的研究始于对胰岛素、催产素、加压素和促性腺激素释放激素(GnRH)等天然人体激素及其在人体中特定生理活性的基础研究[2]。自1921年合成第一个治疗性肽胰岛素以来,已经取得了令人瞩目的成就,全球已有80多种肽类药物获批。因此,肽类药物的开发已成为药物研究的最热门话题之一。
20世纪上半叶,人们发现了几种可以拯救生命的生物活性肽,例如胰岛素和促肾上腺皮质激素,这些肽最初都是从天然来源中研究和分离出来的。胰岛素是一种含有51个氨基酸的肽,它的发现和开发被认为是药物发现领域的重大科学成就之一。它于1921年由FrederickBanting首次分离出来,并由Frederick和CharlesBest进一步开发[3,4],在首次分离后仅一年便可用于治疗糖尿病患者。1923年,胰岛素成为第一种商业化肽类药物,迄今已造福数千名糖尿病患者。然而,20世纪人类胰岛素的产量无法满足市场需求,牛胰岛素和猪胰岛素等动物源性胰岛素在胰岛素市场上占据主导地位近90年,直到被重组胰岛素取代。
20世纪50年代至90年代,更多具有治疗潜力的肽激素及其受体相继被鉴定和表征7。同时,蛋白质纯化合成、结构解析和测序技术取得实质性进展,加速了肽类药物的研发,全球已有近40种肽类药物获批。值得注意的是,除了天然肽外,合成催产素、合成加压素、重组人胰岛素等合成肽也开始被开发。
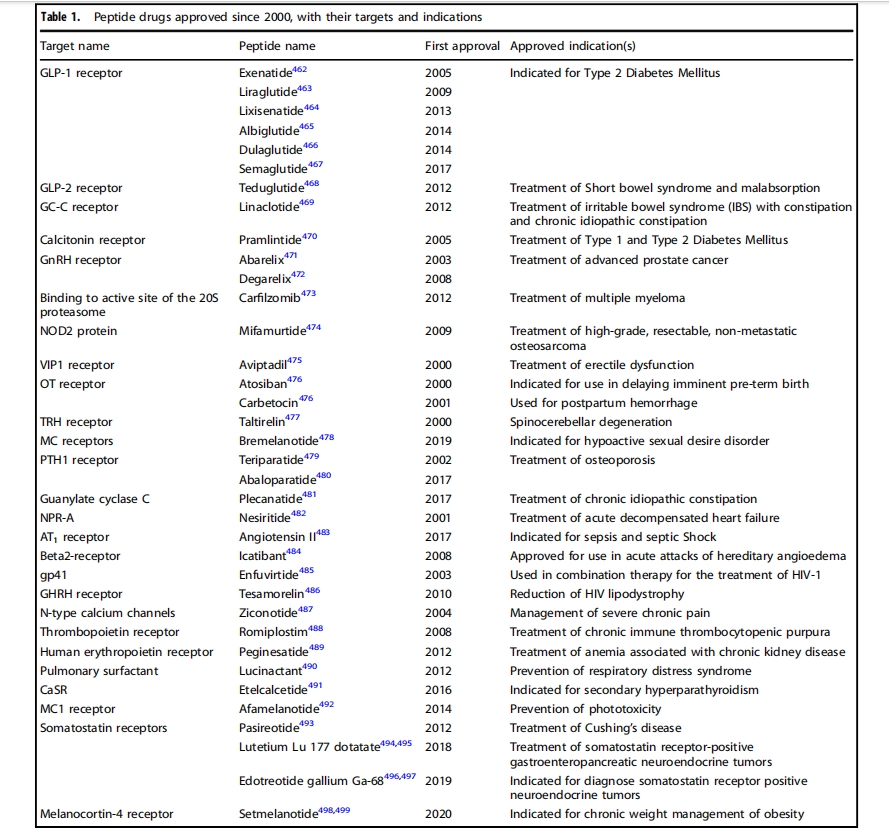
进入21世纪,多肽药物研发进入新纪元,结构生物学、重组生物制剂、新型合成分析技术的进步大大加速了多肽药物研发进程,已建立了包括多肽药物发现、药物设计、多肽合成、结构修饰、活性评价等环节的多肽药物研发体系。自2000年以来,全球共批准33种非胰岛素多肽药物(表1)。此外,这些多肽药物已不再是简单的激素模拟物或由天然氨基酸组成。例如,恩夫韦肽是一种36个氨基酸的仿生肽,模拟人类免疫缺陷病毒(HIV)蛋白,用于联合治疗HIV-1 ;齐考诺肽是一种从芋螺Conusmagus中提取的神经毒性肽,于2004年获批,用于治疗严重慢性疼痛;替度鲁肽是一种胰高血糖素样肽2(GLP-2)类似物,用于治疗短肠综合征,采用重组DNA技术改造的大肠杆菌菌株制造;利拉鲁肽是人类胰高血糖素样肽1(GLP-1)的化学合成类似物,通过将C-16脂肪酸(棕榈酸)与赖氨酸残基(序列中的位置26)上的谷氨酸间隔物连接而成,可作为GLP-1受体激动剂来治疗2型糖尿病(T2DM)。所有这些肽类药物都已用于广泛的治疗领域,例如泌尿科、呼吸科、疼痛科、肿瘤科、代谢科、心血管科和抗菌科。迄今为止,已有170多种肽类药物处于活跃的临床开发阶段(表2),还有更多肽类药物处于临床前研究阶段。
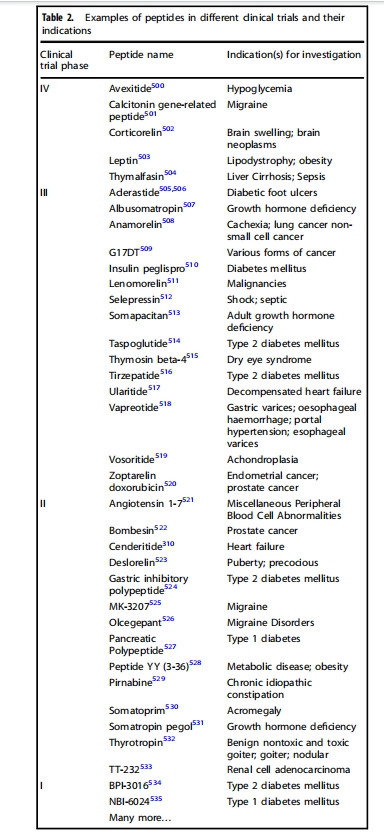
多肽药物在医药市场中占有相当大的比重,2019年全球销售额超过700亿美元,较2013年增长两倍多。据Njardarson等统计,2019年销售额排名前200的药物中,有10种非胰岛素多肽药物。有意思的是,多肽药物销售额前三的均为治疗2型糖尿病的GLP-1类似物,包括排名第19位的Trulicity(度拉糖肽),零售额43.9亿美元,排名第32位的Victoza(利拉鲁肽),销售额32.9亿美元,排名第83位的Rybelsus(索马鲁肽),销售额16.8亿美元(图1)。
本文回顾了肽类药物的历史发展和肽类药物发现的最新进展。我们重点关注治疗性肽的药理特性,并重点介绍改进肽类药物设计、合成、修饰和评估的新技术,并为肽类药物的应用提供新的视角。我们还建议读者参阅最近的几篇综述以供进一步阅读.
治疗性肽:优点和缺点
治疗性肽通常用作激素、生长因子、神经递质、离子通道配体或抗感染剂。它们与细胞表面受体结合并以高亲和力和特异性引发细胞内效应,作用方式与生物制剂(包括治疗性蛋白质和抗体)相似。然而,与生物制剂相比,治疗性肽的免疫原性较低,生产成本较低.
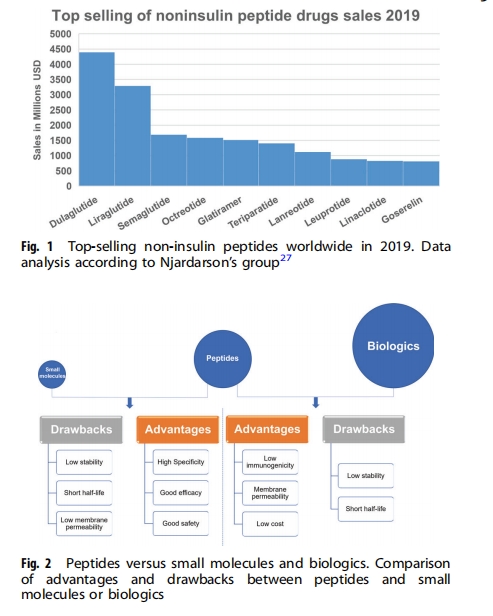
小分子药物具有悠久的治疗历史,具有生产成本和销售价格低、口服、膜穿透性好等固有优势。与肽和生物制剂(蛋白质或抗体)相比,天然提取和化学合成的小分子均具有竞争性的价格优势。口服小分子具有更好的安全性和提高患者依从性的好处,同时它们的小尺寸也使它们能够穿透细胞膜以靶向细胞内的分子。然而,它们的小尺寸也意味着它们很难有效地抑制大表面相互作用,例如蛋白质-蛋白质相互作用(PPI)。PPI 通常占据 1500–3000 A2的接触面积,而小分子由于其分子尺寸有限,只能覆盖 300–1000 A2的蛋白质表面。相比之下,肽类药物独特的物理化学性质,包括其更大的尺寸和更灵活的骨架,使它们能够作为 PPI 的强效抑制剂,小分子药物的临床应用也因特异性低于多肽类药物而受到限制,例如索拉非尼和舒尼替尼都是酪氨酸激酶抑制剂,可抑制血管内皮生长因子(VEGF)受体的酪氨酸激酶结构域活性,产生抗血管生成作用,用于治疗癌症患者;然而,它们也靶向其他激酶受体,如丝氨酸/苏氨酸激酶受体,导致细胞毒性.
作为基于天然氨基酸的治疗剂,治疗性肽具有两个固有缺点(图2) :膜不通透性和体内稳定性差,这是肽药物开发的主要绊脚石.
1、多肽的膜通透性较弱,多肽药物的膜通透性取决于多种因素,包括多肽长度、氨基酸组成等。多肽一般无法穿过细胞膜到达细胞内靶点,因此限制了其在药物开发中的应用。2018年Lau等报道,临床开发中90%以上的多肽靶向细胞外靶点,包括G蛋白偶联受体(GPCRs)、促性腺激素释放激素(GnRH)受体、胰高血糖素样肽1(GLP-1)受体。
2、肽在体内的稳定性较差。天然肽由通过酰胺键连接的氨基酸链组成,但缺乏二级或三级结构所赋予的稳定性。在没有任何保护的情况下,当暴露于环境中时,酰胺键很容易被体内酶水解或破坏。这些固有的化学性质使肽在化学和物理上不稳定,半衰期短,体内消除快。
多肽的这些内在优势与劣势既为多肽药物开发带来了挑战,也为多肽药物的设计和优化带来了机遇和方向。
治疗性肽的发展路径:发现、生产和优化
肽类药物研发
人体内的天然肽/激素
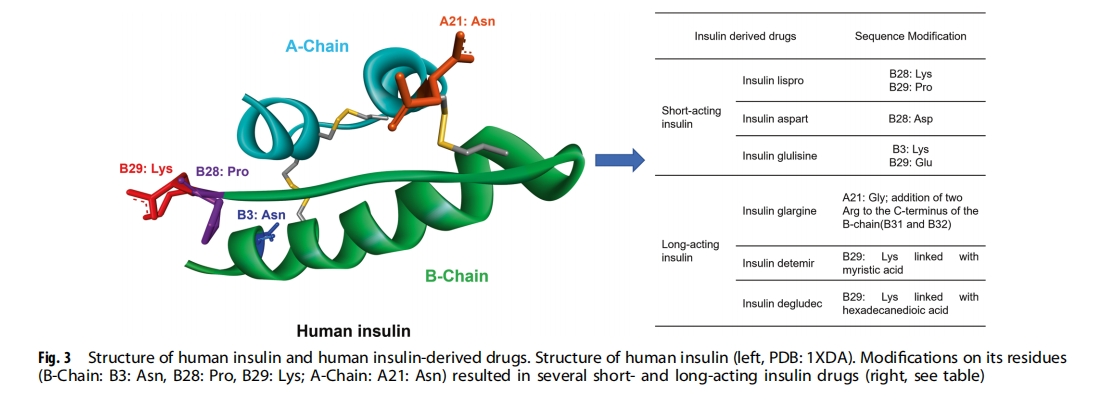
肽类药物研发的历史始于利用具有充分研究的生理功能的天然激素和肽类来治疗因激素缺乏引起的疾病,例如 1 型糖尿病或 2 型糖尿病患者缺乏调节血糖水平所需的胰岛素。糖尿病的治疗方法是注射胰岛素,或刺激胰岛素分泌相关靶点(如 GLP-1 受体)产生胰岛素。寻找天然肽类和激素或用动物同源物(如胰岛素、GLP-1、生长抑素、GnRH、8-Arg-加压素和催产素)替代它们,这是肽类药物研发的最初策略(图3))。然而,这些天然肽所存在的缺点引起了人们对优化其天然序列的兴趣,从而产生了一系列天然激素模拟肽药物。
激素模拟肽
GLP-1衍生的多肽药物(图4a):GLP-1是一种37个氨基酸的多肽,可调节胰岛素的产生和分泌,在体内的半衰期很短。人们付出了大量的努力来修改其序列,以增强这种激素的稳定性,同时保持其效力和药理作用,从而开发出三种最畅销的抗2型糖尿病多肽药物:Trulicity(度拉糖肽) 、Victoza(利拉鲁肽)和Ozempic(索马鲁肽)。
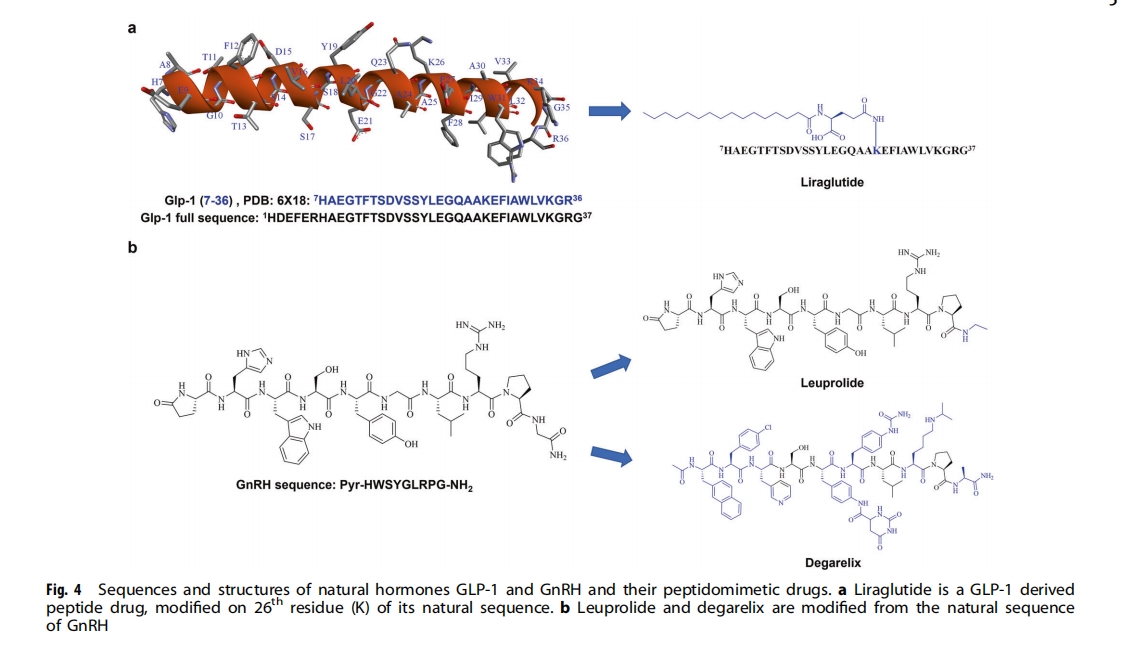
许多其他已批准的肽类药物也来源于天然激素1,包括奥曲肽,一种生长抑素模拟肽类药物,用于治疗产生生长激素的肿瘤和垂体瘤;去氨加压素,一种 8-Arg-加压素模拟肽类药物,用于治疗尿崩症和夜尿症;卡贝缩宫素,一种用于治疗闭经的催产素同源物和阿托西班,一种用于抑制早产的催产素拮抗剂。
从天然产物中鉴定的肽
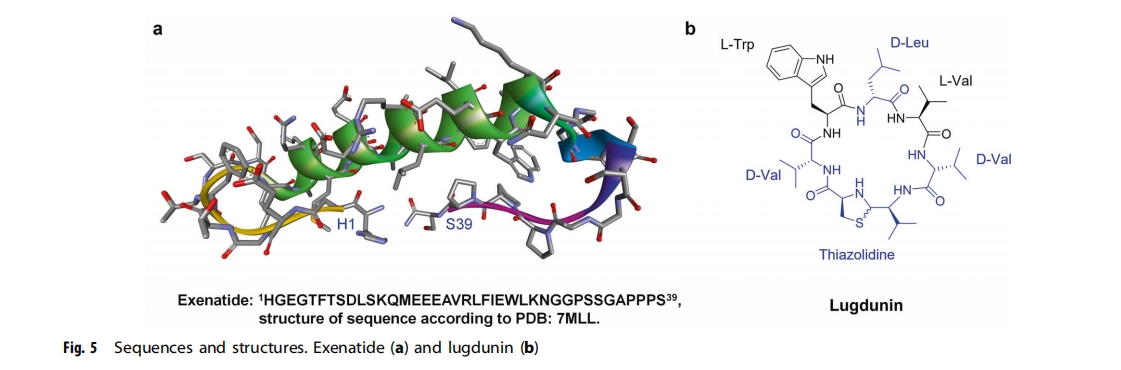
来自细菌、真菌、植物和动物的许多生物活性肽都具有治疗特性,例如蛇毒,它被认为是血管内皮生长因子(VEGF)类似物,VEGF-F或svVEGF。它们通常是二硫键丰富的环肽,残基不超过80个,可通过靶向离子通道和其他膜结合受体诱导细胞毒性。来自蛇和蝎子的毒液肽已被修饰用于治疗应用。此外,从Gila怪物毒液中优化的艾塞那肽(图5a)是一种GLP-1激动剂,而齐考诺肽是一种来自芋螺的毒液肽,已被用于治疗慢性神经性疼痛
根据蛋白质-蛋白质相互作用合理设计肽
蛋白质组学和结构生物学的发展导致发现了许多参与大多数细胞过程和生物功能的蛋白质-蛋白质相互作用(PPI) 。迄今为止,已研究了超过14,000种PPI,仅占人体所有PPI的1%左右。PPI还调节人类疾病中的许多重要细胞通路,因此是潜在的药物靶点多肽作为PPI抑制剂或激动剂与小分子、抗体等相比具有先天优势,因此基于已知PPI晶体结构发展了一种新的多肽药物发现技术:多肽的合理设计,被认为是一种很有前途的发现新型多肽药物候选物的策略。
肽的合理设计涉及基于目标PPI解析晶体结构的计算机辅助生物信息学技术。PPI结合界面的生物信息学和计算分析可以识别两种相互作用蛋白质表面的必需氨基酸。这些必需氨基酸贡献了PPI的主要吉布斯能,通常称为“热点” 。热点可能是蛋白质的连续片段,也可能是蛋白质不同二级结构上的分散残基。PPI肽调节剂的设计基于这些热点,要么直接使用连续片段,要么使用将分散残基连接起来作为初始序列的策略。然而,为了提高其活性和物理化学性质,需要进一步进行肽的开发和结构优化,包括肽环化和主链修饰。例如,通过研究结构-活性关系确定必需肽残基并提出非必需残基的替代,以及对序列进行化学修饰以稳定肽二级结构,包括转角、螺旋、发夹和延伸构象,可以增强生物活性并改善物理化学性质。
通过噬菌体展示发现肽类候选药物
噬菌体展示是一种高效、可靠的技术,用于识别生物靶标的配体,由 Smith 于 1985 年首次报道。噬菌体展示利用重组技术在噬菌体表面设计靶标配体。噬菌体中只产生含有蛋白质氨基酸的肽,而不是 NRP。这种高通量测序方法可用于识别药物线索,包括抗体和肽。噬菌体展示已广泛用于发现新的肽配体。Lerner 等人报道通过噬菌体展示发现了 GLP-1 和其他膜受体配体的强效肽类似物,包括蛋白质、肽和毒液,主要作为激动剂。此外,靶向转化生长因子 (TGF)-β1 或表皮生长因子受体 (EGFR) 的肽,以及破坏成纤维细胞生长因子 (FGF)-1-FGFR1 相互作用的肽拮抗剂是通过噬菌体展示发现的肽药物的良好例子。噬菌体展示技术的最新发展侧重于寻找更有效的筛选方案,以简化海量数据中的配体选择,例如通过减少噬菌体淘选周期。Heinis 等人利用“噬菌体上”修饰技术从传统噬菌体展示中获得化学修饰肽,获得双硫醚环肽。另一种策略涉及开发新颖的展示方法。例如,Schumacher 等人开发了镜像噬菌体展示来探索 D 手性肽,而 Szostak 等人进行 mRNA 展示以发现和选择具有非天然氨基酸的大环肽。Suga 等人利用核糖体展示来开发含有 D 氨基酸和非天然氨基酸的先导肽,包括生物活性大环肽.这些发展使得人们能够构建大量的展示文库,以发现新的候选肽。
治疗性肽的合成与修饰
发现具有治疗潜力的肽是肽药物开发的第一步,之后通过化学或生物合成肽并进行序列修饰以改善其药理特性。这里我们总结了肽生产和修饰所用到的基本技术。
肽的化学合成
肽的化学合成技术已经很发达,特别是1963年Merrifield开发的固相肽合成(SPPS)技术.SPPS技术在方法论和合成材料方面得到了显著改进,并在现代多肽生产中发挥着至关重要的作用。它通过将氨基酸偶联和脱保护结合在一个简单的反应器中来促进多肽的合成,这进一步导致了自动多肽合成仪的发明。与重组技术相比,SPPS获得的粗肽更加单调,不含其他生物化合物,如酶、DNA和RNA片段、不相关的蛋白质和多肽。此外,最终SPPS产品中的杂质很容易识别,因为它们主要来自合成过程中的不完全反应或副反应,使得后续的纯化相对简单。
SPPS包括将氨基酸的羧基偶联到固体聚合物树脂上,并将胺基从保护基中释放出来的一个循环(图6)。各种树脂,如4-甲基二苯甲基胺(HMBA)树脂、Wang树脂、2-氯三苯甲基氯(CTC)树脂和Merrifield树脂,用于将酰胺或游离羧基引入肽的C端。现代肽工业通过将树脂与不同的接头偶联,开发了各种功能性树脂,从而能够在固相中合成长肽和进行肽环化。在合成过程中,氨基酸的胺基和侧链通常受到不同化学基团的保护,这会导致肽聚集并降低粗肽的纯度。目前已开发出两种主要的SPPS策略:Fmoc-SPPS和Boc-SPPS,分别用于去除主要的胺保护基团,即芴甲氧羰基(Fmoc)和叔丁氧羰基(Boc )。
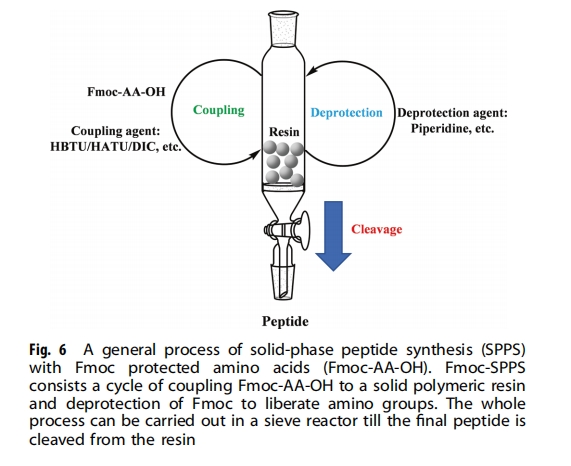
Fmoc-SPPS合成少于50个残基的肽相对常规,但较长肽(>50个氨基酸)的化学合成仍然具有挑战性,尤其是在大规模生产中。实验室规模的肽合成往往借助现代自动肽合成仪(如CEMLiberty PRIME和CSBio II)自动进行。这些新型自动肽合成仪可以提供多达192个不同序列的顺序和多平行肽合成,使用红外或微波加热以缩短反应时间,有时使用紫外线监测以确保脱保护过程。此类合成器对于实验室规模的肽合成极为有用,可以快速生产所需的肽,以供进一步的结构和功能研究。然而,由于缺乏大型设备和不均匀的过热,红外和微波加热在大规模肽制造中的应用有限,这可能导致副产物的产生。因此,大多数良好生产规范(GMP)倾向于温和的反应条件以最大限度地减少副反应和相对杂质,因此大规模生产长肽(>50个氨基酸)仍然具有挑战性。
化学肽合成技术的发展,尤其是SPPS技术的发展,大大加速了治疗性肽的开发。一些重组肽药物,如催产素和特立帕肽,采用化学合成来生产活性药物成分。肽的化学合成还允许对其进行千变万化的修饰。
肽和肽模拟物的化学修饰
多肽作为一类特殊的治疗药物,其生物活性与其化学结构密切相关,多肽合成后需要利用药物化学技术进行修饰,模拟、稳定或构建理想的二级结构,以提高其生物活性,实现多肽药物的选择性、稳定性和溶解性。
在修饰先导肽候选药物之前,必须确定具有所需生物学特性的最小活性序列。经典序列扫描,称为丙氨酸扫描,通常用于将每个残基替换为丙氨酸以产生一系列先导肽类似物,以确定哪些关键残基赋予先导肽的生物活性:活性降低表明被替换的残基很重要,而活性不显著降低表明被替换的残基是多余的。然后对先导肽的可替换残基和 C 端和 N 端进行进一步修饰,以产生最终的肽药物。
肽骨架修饰
骨架修饰的主要原因之一是提高肽的蛋白水解稳定性。肽中的蛋白水解位点可以通过稳定性研究和代谢物测定来识别。骨架修饰包括用 D-氨基酸取代 L-氨基酸、插入甲基氨基酸、以及掺入 β-氨基酸140和类肽 , 将这些非天然氨基酸引入肽序列,特别是在蛋白水解位点,是延长肽类药物血浆半衰期的有效策略。一个成功的例子是塞来加压素,它来源于加压素,具有相似的靶标选择性,但血浆半衰期更长。
肽的侧链修饰
肽的侧链修饰是在肽合成过程中用其类似物替换天然氨基酸,以提高其结合亲和力和靶标选择性。天然氨基酸类似物的变体,如高精氨酸、苄氧酪氨酸和 β-苯丙氨酸,通常是市售的,并且可以方便地用于在肽合成过程中对肽侧链进行化学修饰。几种 GLP-1 类似物药物,如利拉鲁肽和索马鲁肽,都有修饰的侧链。
通过主链和侧链修饰模拟和稳定二级结构
肽中的弱力,如氢键、范德华力和分子内疏水相互作用不足以形成稳定的二级结构构象。因此,需要对主链、N 端或 C 端或侧链进行额外的修饰,以模拟天然产物的结构或 PPI 中的热点,并稳定二级结构,以产生有前途的肽类药物候选物。
肽环化。环化是一种常见的肽修饰技术,可以包括各种策略,例如头对尾、主链对侧链和侧链对侧链环化(图7)。肽环化可以增加蛋白水解稳定性和细胞通透性,并可以模拟和稳定肽的二级结构。单个肽序列如果不与其他肽连接,就不能形成环或转角结构,但环化通过预先组织分子内相互作用促进这些二级结构的形成。肽环化也常用于稳定其他二级结构,如 α-螺旋和 β-折叠。
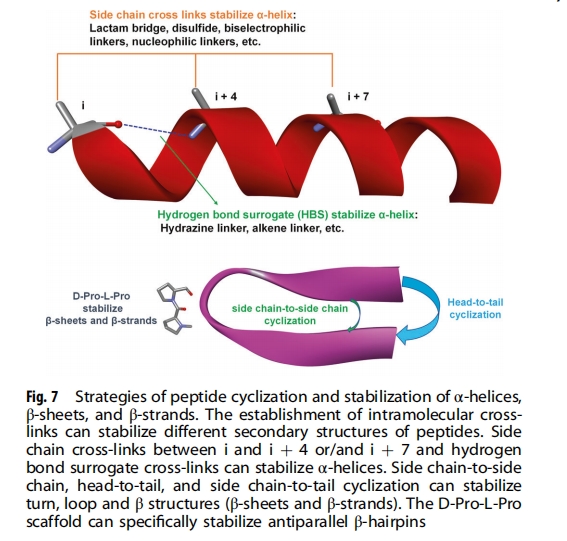
β 链和 β 折叠的肽模拟。β 折叠和 β 链代表另一类基于转角模拟的蛋白质二级结构。修饰肽以稳定 β 折叠通常是通过引入 D-氨基酸(如 D-Pro )在序列中形成转角结构来实现的。D-Pro-L-Pro 模板是众所周知的支架,用于稳定几种成功的 PPI 抑制剂中的反向平行 β 发夹 。大环化或淀粉样蛋白β 折叠模拟物也已用于创建 β 折叠和 β 链结构。
化学修饰是制备所需结构的多肽类似物的有效方法,其稳定性和活性的提高已使多种多肽药物进入临床,如赛乐加压素、利拉鲁肽、索马鲁肽等。然而有些修饰并不能同时提高蛋白水解稳定性和活性,例如插入D-氨基酸通常有助于延长多肽的血浆半衰期,但D-氨基酸修饰的多肽很少表现出有效的生物活性。
重组技术生产肽
化学合成是工业制备肽的首选方法,因为它可以引入除蛋白质氨基酸之外的多功能合成结构单元,例如非天然氨基酸和生化或生物物理探针,从而允许进一步修饰或结合。此外,化学合成过程可以完全自动化,并且易于扩大规模。它为生产短肽和中肽提供了一种方便有效的方法,但长肽的化学合成仍然具有挑战性,因此需要替代策略。
除了化学合成外,治疗性肽还可以通过各种生物方法制备,例如通过提取从天然来源分离生物活性肽、酶合成、发酵、重组 DNA 技术和半合成。这些方法可以单独应用或组合应用,具体取决于制备肽的复杂性和难度。
从天然来源分离肽类药物的实践可以追溯到20世纪20年代,当时胰岛素首次从牲畜胰腺中分离出来并用于治疗糖尿病,挽救了数十万人的生命。胰岛素的开创性成功导致公众对肽疗法的热情日益高涨,随后其他几种动物源肽类药物成功进入临床使用,例如促肾上腺皮质激素和降钙素非核糖体合成肽是另一个重要的天然来源家族,可用于鉴定和生产具有治疗潜力的肽,例如万古霉素和环孢菌素。与核糖体合成肽或蛋白质不同,非核糖体合成肽的合成由编码非核糖体肽合成酶的基因簇控制,而不是内源性翻译机制,从而产生结构和功能多样的肽,并使这些分子能够克服普通肽药物的固有局限性。毒液和毒素被认为是鉴定生物活性肽的宝贵天然来源以及其他天然来源,如环肽和肽链肽也得到了研究和利用。酶合成适用于合成短肽,如二肽和三肽,酶合成肽已成功应用于食品添加剂、药物和农用化学品的生产。发酵已被充分证明是一种生产生物活性肽的环保方法,例如在环孢菌素的生产中重组DNA技术能够生产具有确定序列和同质性的肽和蛋白质。这种方法对于制造具有多个二硫键的长肽或复杂肽特别有用,否则这些肽很难通过化学合成。人类胰岛素和生长激素是使用重组DNA技术制造的许多可用肽药物的代表性例子。此外,重组DNA技术可以与遗传密码扩展和其他新技术相结合,通过掺入非天然氨基酸将所需的功能基团引入分子中,如下所述。半合成提供了一种灵活的方法,通过连接合成肽和重组DNA表达的肽来生产大型生物活性多肽,当需要进行多次人工修改时,这是一种特别有用的方法。
通过遗传密码扩展进行多肽修饰
天然蛋白质由 20 种典型氨基酸合成,这种有限且保守的氨基酸库显著限制了蛋白质结构和功能的多样性和复杂性。遗传密码扩展是二十年前开发的一种技术,旨在克服这一限制(图8 ) 。遗传密码扩展允许在蛋白质翻译过程中将具有新化学和物理特性的非典型氨基酸 ( ncAA ) 位点特异性地掺入正在生长的多肽中,要实现这一点需要四个组成部分:1)具有所需化学和物理特性的 ncAA;2)指定 ncAA 的独特密码子,例如琥珀终止密码子 (UAG) 或四联体密码子;3)抑制独特密码子且不与其内源对应物发生串扰的正交 tRNA;4)可以将 ncAA 特异性地充电到正交 tRNA 上且不与内源性氨基酰基 tRNA 合成酶/tRNA 对正交氨基酰基tRNA合成酶发生串扰。
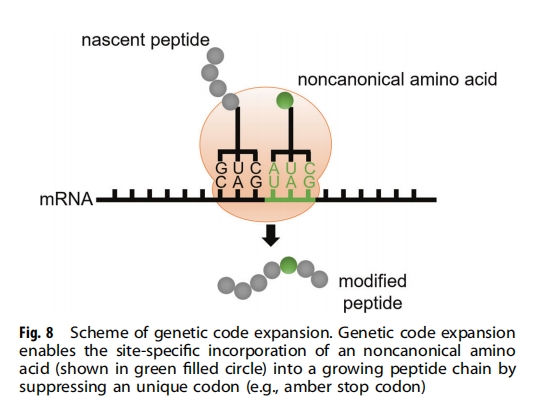
迄今为止,已有 200 多种具有不同功能的 ncAA 被基因编码到不同的生物体中,例如大肠杆菌、酵母、哺乳动物细胞、病毒甚至动物,为蛋白质研究和工程提供了宝贵的工具箱。这套扩展的构建模块包括生物正交化学结合伴侣、金属螯合剂、光交联剂、邻近交联剂、光笼蔽氨基酸、经过翻译后修饰的氨基酸(磷酸化、硫酸化、酰化等)、氧化还原活性氨基酸以及红外、核磁共振、荧光探针,已广泛应用于蛋白质的研究、操作和进化。遗传编码多种 ncAA 的能力允许合理优化和生产具有明确结构、功能和化学计量的化学修饰重组蛋白。在这里,我们重点关注遗传密码扩展在治疗性肽和蛋白质进化中的应用。
肽和蛋白质的聚乙二醇化
通过遗传密码扩展产生的短蛋白和肽治疗剂由于其药代动力学较差(包括快速血清降解和快速消除),半衰期也较短。连接聚合物是延长蛋白治疗剂半衰期的一种方法。PEG 由重复的环氧乙烷单元形成,是一种不可生物降解、无毒、低免疫原性的聚合物。PEG 化可以增加蛋白质的有效分子量,从而减少肾脏过滤的肾脏清除率。PEG 部分还可以通过增加空间位阻来保护蛋白质不被蛋白水解酶消化,并通过增加目标蛋白质的水溶性来帮助增加吸收,这些优势使得聚乙二醇化成为修饰治疗性蛋白质的普遍策略,自 1970 年代以来,聚乙二醇化已应用于优化蛋白质治疗,并取得了巨大成功。目前市场上有 10 多种聚乙二醇化蛋白质治疗剂,还有更多潜在候选药物正在临床试验中。
传统的聚乙二醇化通常发生在赖氨酸或半胱氨酸残基。然而,如果目标蛋白质包含多个反应性赖氨酸或半胱氨酸残基,由于缺乏选择性,结合可能随机发生在这些残基中的任何一个上,从而产生难以分离的异质结合产物。因此需要允许位点特异性聚乙二醇化的技术,其中聚乙二醇部分可以选择性地和位置控制地连接到蛋白质上(图9)。
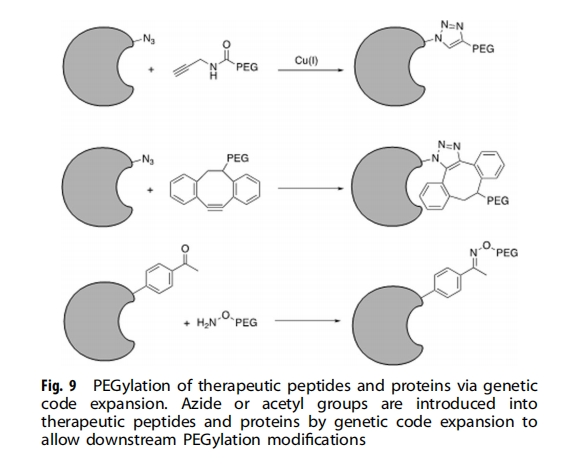
遗传密码扩展为蛋白质聚乙二醇化提供了宝贵的工具。一种方法是将含有生物正交化学手柄的 ncAA(图10)遗传编码到目标蛋白质中,然后通过生物正交反应与 PEG 结合。2004 年,Deiters 等人报道了第一种基于酵母中对叠氮苯丙氨酸 (pAzF) 的遗传整合的 ncAA 介导的单聚乙二醇化方法。通过铜 (I) 催化的炔烃-叠氮化物环加成 (CuAAC) 点击反应将炔烃衍生的 PEG 链位点特异性地连接到超氧化物歧化酶 (SOD) 上,所得 SOD 显示出与野生型蛋白质相似的酶活性。张等人表明这种单聚乙二醇化方法也可以应用于干扰素 (IFN)-α2b。将带有叠氮化物的 ncAA NEAK 位点特异性地整合到 IFN-α2b 的不同位置,从而通过无铜环加成反应与 PEG 进行正交和化学计量结合。在啮齿动物模型中,三种所得 IFN-α2b 变体显示出比其他变体和野生型分子更高的生物活性和更好的药代动力学特征。上述例子表明,单聚乙二醇化可以普遍适用于各种蛋白质。
2011 年,Cho 等人报道了通过基因密码扩展产生的重组蛋白的首次临床试验。通过在不同位置加入对乙酰苯丙氨酸 (pAcF),然后与 PEG 进行位点特异性结合,制成了 20 种人类生长激素 (hGH) 变体。一种在残基 35 处进行单聚乙二醇化的 hGH 变体,称为 ARX201,在 GH 缺乏的大鼠中表现出良好的药效学特性,并且在成年 GH 缺乏患者中具有与天然 hGH 疗法相当的疗效和安全性,但效力增强且注射频率降低。Wu 等人随后,通过在 35、131 和 145 位点处对多个 NEAK 进行遗传编码,生成了在残基 35、131 和 145 处进行组合 PEG 化的 hGH 变体。与单 PEG 化 hGH 相比,所得的多 PEG 化 hGH 变体表现出更低的免疫原性和更好的药代动力学特性,且不损失生物活性,并且在啮齿动物模型中比单 PEG 化 hGH 具有更高的稳定性。这些示例说明了遗传密码扩展对于优化治疗性蛋白质和肽的实用性。
另一种位点特异性聚乙二醇化方法是通过遗传密码扩展将含 PEG 的 ncAA 直接引入靶蛋白。Shozen 等人使用无细胞翻译系统抑制四联体密码子,位点特异性地掺入了含有 PEG4、PEG8 和 PEG12 链的 ncAA。Tada 等人使用类似的策略,通过抑制琥珀终止密码子,将 PEG4 至 PEG24 的较长 PEG 链引入多肽。Fu 等人最近将 eN-庚酰-l-赖氨酸 (HepoK) 引入 GLP-1(图10)), 所得GLP-1(HepoK)与野生型GLP-1相比, 对人血清白蛋白(HSA)的结合亲和力更强, 且降血糖作用持续时间更长, 为研究蛋白质脂化提供了有力的工具。
遗传密码扩展和 ncAA 也已用于生成不同类型的疫苗,包括肽疫苗,如亚单位疫苗、结合疫苗和减毒活疫苗。Grunewald等人首次证明将免疫原性 ncAA 整合到目标蛋白中可以打破自身蛋白的免疫耐受性并在动物模型中引发免疫反应。具体而言,将对硝基苯丙氨酸 (pNO2F) 或苯丙氨酸的单一突变引入小鼠肿瘤坏死因子-α (mTNF-α) 的第 86 位,分别产生 mTNF-α (pNO2F) 和 mTNF-α (Phe)。所得的 mTNF-α (pNO2F) 在小鼠中诱导高滴度抗体反应,而 mTNF-α (Phe) 则不会。此外,发现 mTNF-α (pNO2F) 诱导的抗体与天然 mTNF-α 高度交叉反应,并保护小鼠免受脂多糖 (LPS) 诱导的死亡。在随后的机制研究中,Grunewald 等人发现 mTNF-α (pNO2F) 突变体可产生 T 细胞依赖性多克隆抗体和抗 mTNF-α IgG 抗体反应,这种反应至少持续 40 周,并保护小鼠免受 LPS 刺激引起的严重内毒血症。这种方法还引发了对鼠视黄醇结合蛋白的高滴度 IgG 抗体反应,这表明这可能是将其他弱免疫原性自身蛋白转化为疫苗的普遍适用方法。在后续实验除 ncAA(pNO2F)外,在自身蛋白的特定位置插入体细胞突变(mTNF-α 中的 Tyr 和 EGF 中的 Phe)和翻译后修饰(3NO2Tyr 和 SO3Tyr)也会引起针对天然蛋白的强烈 IgG 抗体反应。上述结果表明,位点特异性插入免疫原性 ncAA 和某些天然翻译后修饰 (PTM) 可以打破自身蛋白的免疫耐受性并产生治疗性疫苗。
Wang 等人将多个具有苯丙氨酸骨架的 ncAA 整合到结核分枝杆菌、卡介苗和结核分枝杆菌中,以促进结核病疫苗的研究和开发。由于哺乳动物病毒的脆弱性和复杂的组装过程,使用常规化学修饰方法很难操纵完整的活病毒。为了克服这一挑战,Lin 等人报道了第一个例子,将 ncAAs 位点特异性地掺入完整和活病毒中,然后进行选择性标记,而不会丧失传染性。具体来说,一组吡咯赖氨酸类似物被遗传编码到乙型肝炎病毒 (HBV) 的包膜蛋白中,并在人肝细胞中组装成活丁型肝炎病毒 (HDV),具有严格的选择性和高效率。通过筛选不同的掺入位点,病毒的传染性得以完全保持。此外,ncAA 修饰的病毒可以通过铜 (I) 催化的炔烃-叠氮化物环加成点击反应轻松地被拉下或结合。Wang 等人还利用 ncAA 介导的基因开关开发了减毒活 HIV-1 疫苗。一组苯丙氨酸类似物被基因编码到 HIV-1 的必需蛋白质中以控制其复制,通过这种方法可以精确地打开和关闭 HIV-1 复制。在后续研究中,袁等人将 ncAA 介导的基因开关合并到病毒基因组中,并开发了基于琥珀抑制的多周期可复制 HIV-1,代表了 HIV-1 疫苗开发的重要一步。陈等人通过抑制天然蛋白质翻译系统不使用的四联密码子,实现了对 HIV-1 复制的精确控制,从而最大限度地减少了校对的可能性并提高了疫苗的安全性。该方法还应用于甲型流感病毒,并产生了安全有效的减毒活疫苗,这些疫苗在动物模型中引发了强大的保护性免疫反应,这表明 ncAA 介导的减毒活疫苗是一种普遍适用的方法。
共价肽/蛋白质药物
小分子共价药物与非共价药物相比具有许多优势,例如生化效率和效力提高、药代动力学改善、作用时间延长、剂量和给药频率减少以及对难治性靶点有强效抑制作用。由于其选择性低和共价药物-蛋白质加合物的潜在免疫原性等安全问题,人们有意避免开发小分子共价药物。然而,基于活性的蛋白质分析和其他新技术的发展意味着小分子共价药物重新受到关注,几种通过共价结合机制起作用的小分子药物已获批上市。
从理论上讲,共价蛋白药物应该具有与小分子药物相似的优势。然而,由于它们固有的无法形成天然蛋白质的共价键,因此共价蛋白药物的治疗潜力尚未得到充分的探索。Li等人最近报道了一种接近激活反应疗法(PERx)策略来开发共价蛋白药物。他们将潜在的生物活性ncAA氟磺酸- L -酪氨酸(FSY)268遗传地结合到人程序性细胞死亡蛋白1(PD-1)的129位,并表明所得到的PD-1(FSY)在体外和体内选择性地与其天然配体PD-L1形成共价键。引人注目的是,与野生型PD-1相比,PD-1(FSY)显著增强了人naïve T细胞和工程嵌合抗原受体T细胞的生物活性。在几种免疫人源化小鼠模型中,PD-1(FSY)显示出更有效的肿瘤生长抑制作用,并具有与治疗性抗PD-L1抗体相当或更大的抗肿瘤作用。然后,他们将PERx应用于fsy修饰的粘附体对HER2受体的共价抑制,说明PERx可以为开发共价蛋白药物提供一个通用平台。与非共价蛋白药物相比,PERx药物可以以其原始形式使用,不需要额外的修饰来延长其半衰期,因为共价结合使药物药效与其药代动力学解耦。此外,PERx允许PD-1 (15.6 kDa)等小蛋白生物制剂用作治疗药物,从而大大扩展了治疗蛋白的范围。此外,由于蛋白质药物与其靶标之间的内在亲和力,以及潜在生物活性ncAA的邻近驱动交联机制,PERx可以最大限度地减少脱靶效应。这些优势意味着PERx策略有潜力为开发新型共价蛋白药物提供一个通用平台。PERx策略背后的化学和更多的共价蛋白的例子已经在其他地方详细回顾.
脂质和较大的蛋白质经常被偶联以改善共价肽药物的药代动力学。已获批准的肽药物,如利拉鲁肽、索马鲁肽和德谷胰岛素,与 C 14/16/18 脂肪酸结合,这增加了它们的血浆循环时间并减少了它们在肾脏消除过程中的降解。两种血浆蛋白,血清白蛋白和免疫球蛋白,也用于通过增加其分子量来延长肽循环时间,从而超过肾小球滤过的分子量截止值。例如,这种策略被用于延长度拉鲁肽和阿必鲁肽的半衰期,每周注射一次。
肽药物输送的发展
肽修饰可使肽获得更好的活性和血浆稳定性,并变得更像药物。然而,肽的固有特性意味着它们很容易被胃肠道中的消化酶水解,因此大多数肽类药物是通过注射给药的。最近的研究已经探索了肽类药物的给药途径以克服这些缺点。
与渗透促进剂联合使用是一种很有前景的策略,可实现肽类药物的口服给药。与 C18脂肪酸结合的索马鲁肽已获准通过每周一次皮下注射给药, 其血浆稳定性优于其他GLP-1类似物。更令人鼓舞的是,索马鲁肽与N-[8-(2-羟基苯甲酰氨基]辛酸钠 (SNAC) 的复合制剂已获批用于口服治疗 2 型糖尿病。与 SNAC 的复合制剂可降低消化酶的功效,从而防止索马鲁肽在胃中被破坏。疏水性 SNAC 分子还增加了索马鲁肽的亲脂性,从而改善其通过胃膜的跨细胞吸收及其进入体循环的转运。与其他渗透促进剂、酶抑制剂和水凝胶的复合制剂也已用于允许口服其他肽类药物,如奥曲肽和胰岛素,这些药物目前正在临床试验中。目前正在研究更多策略,包括肺部给药、透皮给药和使用植入式泵,用于输送特定肽类药物,包括开发吸入式胰岛素和用于胰岛素输送的微型植入式泵。我们预计这些技术将在未来几年应用于更多肽类药物。
治疗性肽在疾病领域的发展及应用现状
治疗性肽在糖尿病治疗中的应用
2 型糖尿病是由后天胰岛素缺乏引起的,在中老年人中很常见。2 型糖尿病已成功通过肽类药物治疗,包括 GLP-1 受体激动剂 (GLP-1RA) 和最著名的肽类药物胰岛素。GLP-1 是一种由回肠 L 细胞分泌的内源性生长激素。其受体存在于胰腺 β 细胞、外周和中枢神经系统、心脏和血管、肾脏、肺和胃肠道粘膜中(图11)。GLP-1 与其受体相互作用,刺激胰岛 β 细胞分泌胰岛素,抑制胰岛 α 细胞释放胰高血糖素,增加饱腹感,并以葡萄糖依赖的方式延缓胃排空。内源性GLP-1被二肽基肽酶-4(DPP-4)降解并迅速失活。为了延长GLP-1受体的刺激时间,需合成GLP-1RAs来阻止其降解。自2005年第一个GLP-1RA——艾塞那肽被美国食品药品监督管理局(FDA)批准以来,多个GLP-1RAs进入临床,包括利拉鲁肽(2009年)、利西拉来肽(2013年)、度拉鲁肽(2014年)、索马鲁肽(2017年)。这些GLP-1RAs注射后能有效降低糖化血红蛋白和平均血糖水平,改善空腹血糖。
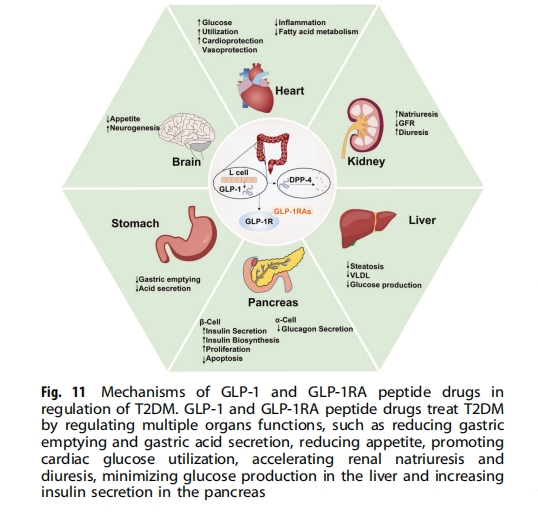
GLP-1RA治疗最常见的副作用是胃肠道相关不良反应(如恶心、呕吐和腹泻)和注射部位反应,而长效GLP-1RA副作用较少,给药频率较低,依从性更好。二甲双胍仍是临床治疗2型糖尿病的一线药物。根据欧洲糖尿病研究协会和美国糖尿病协会的建议,对于单用二甲双胍血糖控制不佳的患者,建议GLP-1RA、磺酰脲类、噻唑烷二酮类、DPP-4抑制剂、钠-葡萄糖协同转运蛋白2抑制剂和胰岛素作为补充药物,但基于GLP-1RAs除了控制血糖之外还有诸多其他益处,包括保护肾脏、降低心血管疾病风险、控制体重、无低血糖风险、对骨骼症状有益、副作用发生率低等,GLP-1RAs在未来的T2DM治疗中必将发挥不可替代的作用。
治疗性肽在心血管疾病治疗中的应用
在非传染性疾病中,心血管疾病是目前全球范围内导致死亡和发病率最高的疾病。高血压是心血管疾病的主要危险因素之一,被认为是由于肾素-血管紧张素-醛固酮系统(RAAS)和交感神经系统活性过高以及钠潴留所致。RAAS中的血管紧张素转换酶(ACE)的功能是将血管紧张素I裂解为血管紧张素II,使血管收缩,间接升高血压,而ACE2则将血管紧张素II水解为血管扩张剂血管紧张素(1-7),间接降血压。因此,针对RAAS是控制心血管疾病的理想策略。合成的血管紧张素II于2017年获得FDA批准,用于通过静脉输注增加败血症或其他分布式休克成人患者的血压。Montone等人从斜生四面体微藻中分离筛选出的四种肽(WPRGYFL、GPDRPKFLGPF、WYGPDRPKFL和SDWDRF)显示出对ACE的抑制活性。Liao等人发现来自蛋清的三肽IRW通过上调ACE2的表达来降低自发性高血压大鼠的血压。这些研究表明以RAAS为靶点的食物来源肽在治疗心血管疾病方面具有潜在的应用价值。
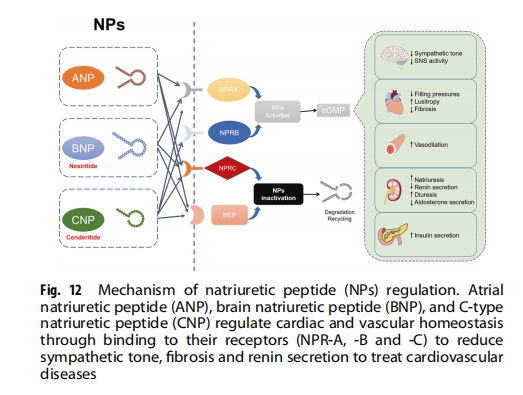
利钠肽 (NPs) ,包括心房利钠肽 (ANP)、脑利钠肽 (BNP) 和 C 型利钠肽 (CNP),是心脏和血管稳态的重要调节剂(图12)。因此,针对 NPs 是预防或治疗心血管疾病的另一种实用策略。奈西立肽是一种重组人 BNP,2001 年被 FDA 批准用于治疗静息或轻度呼吸困难患者的急性失代偿性心力衰竭;然而,由于其特异性低和安全性有限,它尚未得到广泛应用。NPs 主要通过 NPR-A 和/或 NPR-B 受体起作用,而 NPR-C 主要用于清除 NPs。Cenderitide 是一种双重 NPR-A/NPR-B 激动剂,由 CNP 和从绿曼巴蛇中分离的树眼镜蛇利钠肽的 C 端组成。Cenderitide 目前正处于临床研究中,并已显示出治疗心力衰竭和肾衰竭的安全性和潜力。此外,一些对心血管疾病有益的肽正在动物身上进行测试。例如,在大鼠中输注血管活性肠肽可增加心肌血管活性肠肽的浓度并逆转现有的心肌纤维化,环肽 RD808 可中和 β 1 -肾上腺素能受体,从而减轻 β 1-肾上腺素受体。中枢促肾上腺皮质激素释放因子 (CRF) 相关肽系统目前作为预防心血管疾病的靶点受到越来越多的关注。CRF相关肽系统与心血管系统之间存在复杂的关系,但其在心血管功能中的确切调节作用仍有待确定。此外,在 2 型糖尿病患者中,循环 DPP-4 活性增加,血流介导扩张降低。血流介导扩张是公认的内皮功能障碍的替代标志物,也是未来心血管事件的预测因子,这表明 DPP-4 可能是预防心血管疾病的潜在靶点。
治疗性肽在肠道疾病治疗中的应用
在人体中,胃肠道菌群构成复杂的微生态系统。通常,人体胃肠道菌群构成复杂的微生态系统。通常,上皮通过提供物理屏障和分泌各种抗菌因子,包括抗菌肽(AMPs)来调节肠黏膜界面肠道菌群的组成。优势菌群(生理菌群)和弱菌群(致病菌)保持动态平衡,在外来细菌、病毒、寄生虫、食物中毒、药物不良反应、遗传因素等引起的各种肠道疾病中,如肠炎、便秘、肠溃疡、炎症性肠病(IBD)等,共生菌的多样性均被破坏。抗生素的大量使用可能进一步降低共生菌的生物多样性,不利于治疗,甚至可能加重病情,例如IBD患者在确诊前2-5年内更有可能使用过抗生素。多肽药物因特异性、有效性、低毒性等特点,在该领域引起了广泛关注。
肠道正常菌群的显著改变和宿主-微生物共生关系的破坏可能是 IBD 发生发展的关键。IBD 包括克罗恩病和溃疡性结肠炎,是由肠道免疫反应引起的,相关炎症是由环境和遗传因素相互作用引起的。但 IBD 的具体发病机制尚不明确,目前尚无有效的治疗方法。IBD 患者肠道微生物多样性明显降低,两大优势门厚壁菌门(毛螺菌科)和拟杆菌门明显减少,而变形杆菌门明显增多. 大量证据表明变形杆菌门成员在 IBD中发挥关键作用。脯氨酸-精氨酸-39 是一种由猪骨髓和淋巴组织自然分泌的小阳离子 AMP,已证实具有抗菌、免疫调节和肠上皮修复功能,可能为 IBD提供安全的替代疗法。
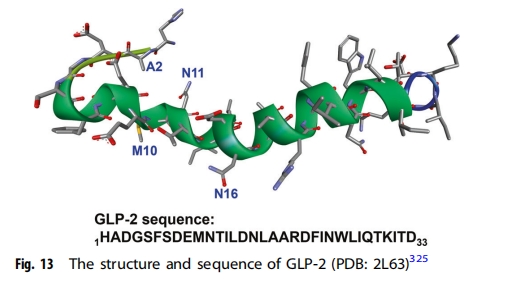
克罗恩病患者通常接受肠切除术治疗,导致短肠综合征(SBS)。小肠损伤和出生时小肠异常短小也可能导致 SBS,其定义为与残留小肠长度持续小于 200 cm 相关的症状。GLP-2 由肠内分泌 L 细胞和中枢神经系统的各种神经元产生(图13),近年来,GLP-2在SBS治疗中受到广泛关注。GLP-2已被证实具有多种有益作用,包括刺激肠隐窝细胞生长、减少肠细胞凋亡、促进肠黏膜扩张、抑制胃酸分泌和胃排空、刺激肠道血流、增强肠道屏障功能、减轻炎症损伤、促进营养和液体吸收。GLP - 2还调节氨基酸转运蛋白的表达,直接激活mTORC1,增加肠道上皮对氨基酸的吸收。一些特定的氨基酸(包括谷氨酰胺、谷氨酸、精氨酸、甘氨酸、赖氨酸、蛋氨酸和含硫氨基酸)也被证明在维持肠道完整性方面发挥重要作用,包括防止肠道萎缩、改善肠道屏障功能、减少炎症和细胞凋亡。内源性GLP-2易被DPP-4降解,但GLP-2类似物替度鲁肽通过将GLP-2 N端第二位的丙氨酸替换为甘氨酸,将半衰期从7分钟延长至约2-3小时,有效阻止其被DPP-4降解。临床研究表明,替度鲁肽可有效减少或消除对肠外营养和/或静脉输液支持的需要,而替度鲁肽在远端回肠切除的幼猪中应用则显著增加残肠单位重量和蛋白质合成。替度鲁肽于2012年被FDA批准用于SBS患者的临床治疗。Wiśniewski等人设计了一系列GLP-2类似物,包括2-甘氨酸取代、10-正亮氨酸取代、11-和/或16-疏水取代等,其中许多对GLP-2R的疗效优于天然激素,表现出良好的受体选择性和低系统清除率。其中,肽段(([2Gly, 10Nle, 11DPhe, 16Leu] hGLP-2-(1−33)-NH2 )被选为临床开发候选药物. 胰高血糖素原家族中的 GLP-1 具有与 GLP-2 相似的功能,并已被建议用于治疗 SBS。在一项研究中,五名 SBS 患者在接受 GLP-1 激动剂艾塞那肽治疗后,排便频率和形态均有所改善。同样,GLP-1 减轻了九名 SBS 患者的腹泻,但效果不如 GLP-2,而 GLP-1 和 GLP-2 的组合优于单独使用其中任何一种。胰高血糖素原家族的另一个成员肠促胰岛素似乎也参与了许多过程,例如肠内营养、运动和胃酸分泌,这表明开发肠促胰岛素样肽的前景. 其他生长因子如 EGF、促红细胞生成素和肝细胞生长因子也已显示出对 SBS 的治疗潜力。EGF 和 GLP-2 的组合增加了三种 SBS 新生猪模型的小肠长度,表明 EGF 具有治疗新生儿 SBS 的潜力。促红细胞生成素通过刺激动物模型中紧密连接蛋白的表达来保护肠道屏障功能并保护胃肠道免受缺血/再灌注损伤,肠内注射肝细胞生长因子可降低大鼠坏死性小肠结肠炎的发病率和严重程度。
囊性纤维化 (CF) 患者通常还会出现肠梗阻和便秘,可能发展为远端肠梗阻综合征。鸟苷酸环化酶 C (GCC) 受体激动剂利那洛肽于 2012 年获 FDA 批准用于治疗慢性便秘。利那洛肽还被证明可以改善 CF 模型小鼠的肠道运输,尽管还需要进一步研究来评估其对 CF 患者肠道病理的影响。NHE3 抑制剂 tenapanor 通过抑制钠吸收来改善 CF 小鼠的胃肠道运输,这表明抑制 GCC 信号转导和 NHE3可能是治疗 CF 患者便秘的合适靶点。
除了药物衍生肽外,肽也可能来自食物。Asn-Pro-Trp-Asp-Gln (NPWDQ) 是一种通过水解酪蛋白(一种主要的牛奶蛋白)获得的肽,它显著抑制了食物过敏原卵清蛋白渗透到人体肠道 Caco-2 细胞中,这表明这种肽可能改善肠道上皮屏障的功能。β-Casofensin 是一种在发酵乳中发现的肽,体内实验发现,早期服用 β-Casofensin 可通过保护杯状细胞和促进伤口愈合来减少吲哚美辛引起的肠道损伤和炎症。吲哚美辛引起的肠道损伤具有与克罗恩病相同的临床、组织学和病理生理学特征提示,β-casofensin可能是克罗恩病的潜在辅助治疗方法。
多肽药物在畜禽肠道疾病治疗中也有着广阔的前景,刘等以天然蛇胆碱为原料,研制出改良合成肽KR-32,KR-32可改善产肠毒素大肠杆菌K88感染仔猪的脂肪酸吸收不良、乙醚提取物总消化率及肠道形态,提示KR-32具有潜在的药用价值。C-BF是一种来源于抗菌肽的多肽,是AMP家族中最为突出的一个,被认为是最有前途的抗生素替代品。C-BF显著改善了断奶仔猪的生长,改善了LPS对小肠的结构和发育损伤,这表明C-BF可能是治疗LPS/病原体引起的肠道损伤的潜在药物。
治疗性肽在胃病治疗中的应用
胃黏膜是人类和动物最脆弱的组织之一,胃病是常见的问题。幽门螺杆菌感染、非甾体抗炎药、酒精、吸烟、情绪和压力是造成胃损伤的主要因素,进而导致胃炎和溃疡。胃病若不及时治疗或治疗不当,会发展成慢性病,持续的长期损伤会大大增加胃癌的风险。胃癌是目前全球第四大常见癌症,在男性和女性癌症死亡原因中分别排名第三和第五。
虽然目前还没有肽类药物被批准用于治疗胃病,但近十年来,肽类药物,包括内源性和外源性肽类药物在胃病中的作用得到了广泛的研究。降钙素基因相关肽(CGRP)广泛分布于胃肠道系统,是辣椒素敏感感觉神经的主要神经递质。这些感觉神经参与保护胃粘膜免受各种刺激,CGRP在此过程中起潜在介质作用,增加胃粘膜血流,抑制胃酸分泌,防止细胞凋亡和氧化损伤。除CGRP外,一氧化氮合酶-一氧化氮(NOS-NO)和环氧合酶-前列腺素(COX-PG)系统对胃也有类似的保护作用。CGRP、NO 和 PG 被认为是胃保护的终端介质,并介导许多内源性肽的胃保护作用。乙醇引起的胃损伤的主要发病机制是胃微血管损伤。作为神经生长因子诱导 (VGF) 基因衍生的肽,TLQP-21 由组成性 NO、PGE2 和生长抑素介导,表明中枢而非外周注射可以以剂量依赖性方式减轻乙醇引起的胃损伤, Novokinin (Arg-Pro-Leu-Lys-Pro-Trp) 是由卵激肽修饰的有效血管扩张和抗高血压肽,对血管紧张素 II 2 型 (AT2) 受体有较高的选择性亲和力。张等研究发现,novokinin 以剂量依赖性方式抑制脑室内注射后基础胃酸分泌,保护胃黏膜免受酒精引起的损伤,这是通过介导 AT2 受体-PG 通路。这些结果提示了 TLQP-21 和 novokinin 在胃损伤治疗中的价值。从废啤酒酵母蛋白水解物 (尤其是 < 3 kDa) 中获得的多肽提取物可减轻大鼠胃黏膜损伤,提示酵母多肽提取物在胃病治疗中的潜在价值。
动物应激性胃损伤常被用作研究应激性胃病机制的模型,AMP铁调素被认为是由壁细胞调节胃酸生成而产生的,敲除铁调素的小鼠胃酸分泌明显减少,提示铁调素可能与应激条件下胃溃疡的发生有关。nesfatin-1属于厌食肽家族,存在于肠道的神经元和内分泌细胞中。Alexandra等的研究表明,nesfatin-1对水浸束缚应激大鼠胃有明显的保护作用,其机制与胃液分泌减少、COX-PG和NOS-NO系统介导的充血、迷走神经、感觉神经及香草醛受体的激活有关。慢性温和应激可引起大鼠胃溃疡,生长抑素类似物奥曲肽可通过抑制细胞凋亡、炎症和氧化来减轻胃溃.中枢而非外周注射催产素能消除大鼠束缚应激引起的餐后胃收缩增强,从而减少胃排空延迟,提示催产素可能是治疗应激相关胃肠动力障碍的候选药物。
胃癌是一种严重的胃部疾病,多种多肽在胃癌治疗中显示出良好的前景。GEBP11是通过噬菌体展示技术筛选和鉴定的一种新的九氨基酸归巢肽。GEBP11选择性地与人脐静脉内皮细胞和肿瘤血管结合,提示其可能是肿瘤显像和靶向药物递送的重要候选药物。碘131标记的双歧PEG化GEBP11三聚体(131Imur2PEG- (GEBP11) 3)治疗可显著抑制裸鼠人胃癌异种移植瘤的生长,延长生存时间,提示131Imur2PEG- (GEBP11) 3可能是胃癌肽靶向治疗的合适候选物,也是胃癌抗血管生成治疗的药物载体。幽门螺杆菌感染是胃癌的重要病因之一。HP-6(Pro-Gln-Pro-Lys-Val-Leu-Asp-Ser)是从衣藻微生物水解产物中分离的活性肽,已被证明具有抵抗幽门螺杆菌诱导的致癌性。HP-6通过抑制EGFR活化,下调磷酸肌醇3-激酶/Akt信号转导和β-catenin核转位,有效抑制幽门螺杆菌诱导的人胃腺癌细胞(AGS)增殖和迁移,而不抑制细菌活力或AGS细胞侵袭。Zhang等人合成了AMP pexiganan及其纳米颗粒(PNPs),其表现出抗幽门螺杆菌活性,并且比pexiganan对小鼠胃中的幽门螺杆菌有更强的清除能力,并显示出治疗和预防幽门螺杆菌相关胃病的潜力。TFF1是一种与黏蛋白相关的胃黏膜细胞分泌肽。TFF1的表达在幽门螺杆菌感染的急性期而非慢性期在胃窦中上调小鼠感染,并且与炎症反应呈负相关,表明 TFF1 可能有助于细胞抵抗细菌和慢性炎症的发展。同属一个家族的 TFF2 已被证明能与胃泌素 MUC6 相互作用,稳定胃黏液屏障,维持胃黏膜完整性。
多肽类药物在胃动力方面也有调节作用。外周注射GLP-2通过增加CGRP和内源性PGs而非NO来增加胃肠道血流量和胃粘膜血流量。外源性GLP-1在离体全胃模型中通过神经引起NO释放到胃窦,从而降低小鼠胃动力。但已获批的GLP-1/2衍生肽是否具有类似作用仍有待研究。BNP具有扩张血管的特性,可以增加内脏灌注和氧合,重组BNP已被证实能增加胃粘膜微血管中的血红蛋白氧合. 胃动素和生长素释放肽属于同一肽家族,这些激素在胃肠道运动调节中起着重要作用。生长素释放肽和胃动素可以在体外和体内协同刺激强烈的胃收缩。胃动素以及胃动素和生长素释放肽的结合通过组胺介导的途径刺激鼩鼱胃酸分泌。
治疗性肽在癌症治疗中的应用
传统的癌症治疗方法包括手术和放疗,对晚期癌症患者疗效有限。随后靶向治疗和免疫治疗的发展,大大提高了癌症患者的生存率。靶向治疗利用肿瘤细胞对特定分子或信号通路的依赖,以“导弹”的方式杀死肿瘤细胞。免疫治疗药物并不直接攻击肿瘤细胞,而是调节患者自身的免疫系统,通过靶向免疫检查点来攻击肿瘤细胞,PD-1/PD-L1是众所周知的免疫检查点,目前已有5种针对PD-1/PD-L1相互作用的单克隆抗体被FDA批准用于治疗癌症,但抗体存在成本高、口服适应性差、免疫原性强等缺点。多肽由于分子尺寸小、亲和力高、易修饰、免疫原性低等优点,在肿瘤诊断和治疗领域也引起了人们的关注,一些修饰后的多肽还表现出良好的稳定性,例如Carvajal等人开发了稳定的α-螺旋肽作为MDM2和MDMX的抑制剂,用于治疗p53依赖性癌症。
天然肽在体内的半衰期较短,针对肿瘤细胞中各种异常表达受体的肽通常是经过修饰的肽类似物。这些肽的生产主要有三种方法,各有优缺点:1)从天然蛋白质中衍生;2)化学合成和基于结构的合理工程化;3)肽库筛选。其中,噬菌体展示技术是一种传统且应用广泛的方法,具有操作简单、能有效筛选大量不同肽的优点。
多肽在肿瘤治疗中的应用主要有四种方式:1)利用放射性同位素、染料或其他已报道的分子标记的多肽作为探针,用于肿瘤诊断和成像;2)利用肽偶联的纳米材料进行肿瘤治疗;3)利用肽疫苗激活免疫系统进行预防;4)单独使用肽作为靶向药物(图14)。
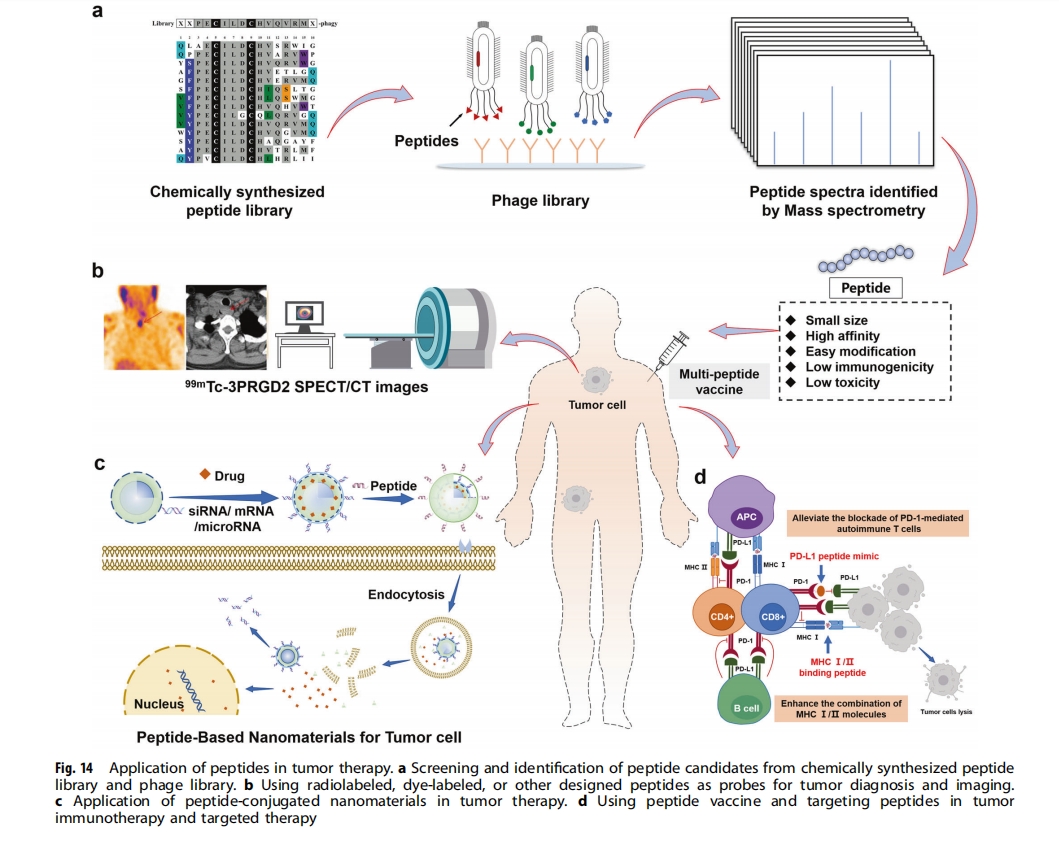
来自特定靶蛋白的抗原肽可以作为抗癌肽疫苗,通过与抗原呈递细胞上的主要组织相容性复合体 (MHC) 结合,触发辅助或细胞毒性 T 细胞的抗肿瘤作用。EGFR,例如 EGFR1 和 HER2,是众所周知的癌症治疗靶点。基于 HER2 结构的肽疫苗 TERT572Y 被用于 46 名晚期非小细胞肺癌患者。皮下注射 TERT572Y 可诱导 TERT 特异性免疫反应并显著延长生存期。Manijeh等通过PEPOP方法计算并预测潜在表位,从HER2胞外区中筛选出多种肽序列作为候选序列,通过分子对接评估这些候选肽与MHC I类和II类分子的结合亲和力,寻找肽与MHC I类和II类分子最稳定的结合结构,筛选出MHC I类和II类结合肽作为乳腺癌肽疫苗396但大多数肽疫苗临床试验未能显示出优异的治疗效果,肽疫苗也因此很少受到关注。不过,Takumi等人认为包括肽在内的大多数癌症疫苗在临床研究中未能成功的主要原因是其免疫原性较差,并建议优化肽的配方、佐剂和给药途径将获得理想的效果。肽被称为细胞穿透肽(CPP),也可以作为药物载体,将其他肽、蛋白质、DNA、小RNA和药物运送到细胞中。由Nerinetide和CPP Tat组成的CPP-药物构建体被用于将Nerinetide递送穿过血脑屏障并进入神经元. 肽还通过与抗原结合以诱导抗原特异性免疫耐受并降低脱靶反应的风险,显示出良好的传递功能 . Tsoras 使用肽纳米簇来改善肽亚单位疫苗对癌胚抗原的免疫原性 .
多肽除了作为药物载体、疫苗外,还可以通过与靶受体结合发挥抗肿瘤作用,其中最受关注的是针对PD-1/PD-L1信号通路的多肽。Boohaker等设计了一种PD-L1肽模拟物PL120131,该肽可以通过与PD-1结合来干扰PD-1/PD-L1的相互作用,在3D共培养模型中,PL120131比PD-1抗体更能维持共培养T细胞的存活和活性。Zhou等基于与PD-1和PD-L1结合的多肽,设计了自抑制肽DS-I和DS-II及其环肽形式,对PD-1表现出很强的亲和力,Abbas 等人设计了一种新的靶向 PD-1 的多肽FITC-YT-16,该多肽在体外显著增强了T细胞的抗肿瘤活性,而 Sasikumar 等人设计了多肽 NP-12,与PD-1竞争性结合 PD-L1。此外,NP-12 在黑色素瘤、结肠癌和肾细胞癌的临床前模型中,在抑制原发性肿瘤的生长和转移方面表现出与商业化 PD-1 靶向抗体相同的效果。虽然这些肽还不适合阻断PD-1/PD-L1来治疗肿瘤,但它们具有广阔的前景。来自动物的毒性肽(VP)也可能表现出抗肿瘤作用。由于VP天然靶向哺乳动物受体,它们对细胞膜上的特定离子通道和受体表现出高度的特异性和选择性。从智利蜘蛛中分离出来的肽毒素Hanatoxin-1,特异性地阻断了膜上的K +通道。在结肠癌的发展过程中观察到了K +通道的高表达,Okada等人发现从Lachesana sp中纯化的致孔肽LaFr26. 蜘蛛毒液对肺癌细胞系 LX22 和 BEN 有细胞毒性作用,这两种细胞表达内源性 K +电流。AMPs 在肿瘤中的作用也引起了人们的关注。一些 AMPs 已证明具有抗肿瘤活性,而另一些则促进肿瘤发展。Strzelecka 等人合成的简化 θ-防御素类似物在 3D 培养模型中抑制了乳腺癌细胞的生长,这表明 θ-防御素衍生物具有抗癌潜力,抗癌肽是阳离子两亲分子,通过折叠依赖性膜破裂优先杀死癌细胞。参考抗癌肽的膜特异性相互作用,Aronson 等人制备了一类新型肽脂质颗粒,它们可以与肿瘤细胞膜快速融合并介导细胞杀伤,对正常细胞几乎没有毒性,表明了一种新的肿瘤溶解策略。
虽然许多多肽在临床前和临床研究中都显示出良好的抗肿瘤效果,但目前只有两种多肽被批准用于治疗肿瘤,分别是用于骨肉瘤的米法莫替德和用于多发性骨髓瘤的卡非佐米,而针对肺癌和胃癌等更常见肿瘤的治疗性多肽的治疗策略研究仍在进行中。因此关键在于寻找更多在肿瘤细胞中特异性表达的受体靶点,并加强其医学转化。此外,针对各种肿瘤受体的多肽组合也是一个潜在的策略。
抗病毒肽
病毒寄生于所有生物,包括人类、动物、植物、细菌和古细菌。人类一直饱受病毒性疾病之苦,包括埃博拉出血热、流感和获得性免疫缺陷综合征(艾滋病)。尽管过去二十年来,人们在抗病毒药物研发方面付出了巨大努力,多种抗病毒药物已获批并投入临床使用,但艾滋病等一些疾病仍然没有有效的治疗方法。
抗病毒肽的研究已成为一个热门话题,因为肽类药物具有高度的特异性和活性。抗病毒肽主要通过靶向病毒或其宿主来阻断感染。恩夫韦肽是第一个获批的抗病毒肽,是一种 36 个氨基酸的肽,它通过结合 gp41(HIV 包膜蛋白)的七肽重复结构域来阻止其融合,从而阻断 HIV 感染。2011 年,抗病毒肽药物博赛泼维和特拉泼维被批准用于临床治疗丙型肝炎病毒 (HCV) 。它们均与 HCV NS3/4A 丝氨酸蛋白酶结合,抑制蛋白酶活性,从而阻断宿主体内的 HCV 复制. 更多关于抗病毒肽候选药物的研究正在进行临床前和临床研究中,包括针对 HBV 和 HDV 的 myrcludex B ,针对流感病毒的 flufirvitide ,以及针对 HIV-1 的 sifuvirtide。
2020年以来,新型冠状病毒SARS-CoV-2引起的呼吸道大流行性疾病严重扰乱了全世界人们的生活。自2020年初疫情开始以来,科学家们投入了大量的精力研究COVID-19的感染机制,并寻找抗COVID-19的治疗方法和药物,包括多肽类药物。COVID - 19基因组被快速测序为一种有包膜的正链RNA冠状病毒,基因组大小约为29.9kb,与蝙蝠冠状病毒和SARS-CoV病毒密切相关
疫苗被普遍认为是预防流行病传播的有效手段,目前已在许多国家获批使用,包括基于mRNA的疫苗 、重组腺病毒载体疫苗、灭活疫苗等。肽类疫苗具有特异性高、安全性好、易生产等优势,成为SARS-CoV-2疫苗研发中一个活跃的研究方向。基于感染机制,多个研究小组设计和评估了针对SARS-CoV-2的肽疫苗。他们利用免疫信息学技术分析和识别了特异性识别SARS-CoV-2刺突糖蛋白的B细胞和T细胞关键表位。Li等人和Chakraborty等人将天然表位序列作为针对SARS-CoV-2的疫苗候选物 。而Bhattacharya等人和Waqas则尝试基于来自B细胞和T细胞的表位片段构建新的肽作为COVID-19疫苗候选物 。其他研究小组也开展了类似的工作。Herst 等人尝试利用针对埃博拉扎伊尔病毒的 CTL 肽疫苗研究平台设计 COVID-19 肽疫苗,并获得了一系列肽疫苗候选物。许多其他研究集中于利用合成肽或核苷酸阻断 SARS-CoV-2 的感染过程。
在 COVID-19 疫情期间,抗病毒肽的开发引起了广泛关注,尤其是针对 SARS-CoV-2 的肽疫苗的开发。免疫信息学表征、基于表位的设计、计算机识别和分子对接等新技术已被迅速用于设计和识别肽疫苗候选物。尽管尚未有肽疫苗获批用于治疗 COVID-19,但在肽疫苗的开发方面已经积累了宝贵的经验,这些疫苗不仅针对 SARS-CoV-2,而且针对未来的新病毒。
结论与观点
近年来,多肽因其独特的生化特性和治疗潜力而成为一类独特的治疗药物。尽管多肽在某些方面优于小分子和大分子生物制剂,但由于氨基酸的内在局限性,它们往往存在膜不通透性和体内稳定性差的问题。为了克服这些缺点,人们对多肽药物的发现、生产和优化进行了广泛的研究。传统的先导肽发现方法与合理设计和噬菌体展示等新技术的结合,为在短时间内开发有效和选择性的先导肽提供了可靠的方法。化学和生物重组合成方法的单独或联合使用可以高效、可靠地大规模生产合成肽。这些肽可以通过化学合成或遗传密码扩展以位点特异性方式进一步修饰,以增强其稳定性和生理活性。
虽然治疗性肽领域始于天然激素,但此后发现和开发趋势已从简单模仿天然激素或来自自然界的肽转变为合理设计具有理想生化和生理活性的肽。分子生物学、肽化学和肽递送技术的重大突破使肽药物发现、肽生产及其治疗应用领域取得了重大进展。迄今为止,已有 80 多种治疗性肽进入全球市场,数百种肽正在进行临床前研究和临床开发。这些肽药物已被应用于广泛的疾病,例如糖尿病、心血管疾病、胃肠道疾病、癌症、传染病、以及疫苗开发。考虑到其巨大的治疗潜力、市场前景和经济价值,我们预计治疗性肽将继续吸引投资和研究力度,并取得长期成功。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。