
摘要:创伤性脑损伤(TBI)影响了超过317万美国人。治疗TBI后血管破裂引起的出血和凝血对于患者的康复至关重要。脑血管病变在TBI的潜在机制中起着重要作用。本研究的目的是评估一种用于脑损伤后受伤组织的新型再生医学。我们利用最近描述的具有血管生成潜力的合成生长因子来促进损伤部位的血管原位生长。先前的工作已经展示了这种可注射的自组装肽基水凝胶(韋斯特大学医学院在损伤部位为新生血管形成创造再生微环境。超分子组装可实现触变性;可注射药物输送系统提供持续体内疗效。本研究采用中度钝性损伤模型造成物理性血管损伤和出血。然后将血管生成性SAPH直接应用于受伤的大鼠脑。在TBI后第7天,观察到的血管明显多于假手术和损伤对照组,以及VEGF受体2的激活,表明血管生成性SAPH引发了强烈的血管生成反应。血管标志物血管性血友病因子(vWF)和α-平滑肌肌动蛋白(α-SMA)在血管生成性SAPH的反应中表现出与血管密度同时增加。此外,还检查了血脑屏障完整性和血液凝固作为指示TBI后伤口恢复的参数。通过NeuN和髓鞘碱性蛋白染色进行的神经元拯救检查表明,血管生成SAPH可能在长期恢复中提供神经保护益处。
1 介绍
创伤性脑损伤(TBI)通常由机械力或突然加速-减速引起[1]仅在2013年,美国就有约280万人因TBI到急诊室就诊,其中320万至530万人患有永久性长期残疾,近年来,TBI引起了公众的广泛关注,因为许多与运动相关的脑震荡损伤和与军事相关的钝性/弥漫性爆炸损伤——这些损伤都被认为会增加慢性创伤性脑病和其他认知障碍的风险[3]。
TBI由原发性和继发性机制组成,原发性损伤是组织的物理损伤,包括挫伤、血管穿透或轴突拉伸[4,5],继发性损伤会在几分钟内发生,并持续数年,导致神经炎症和神经退化。TBI的主要问题是创伤后早期阶段对脑血管的直接损伤,这种现象在TBI患者中观察到,并在TBI动物模型中重现[7–9]在细胞水平上,脑血管系统为扩张的神经血管单元(eNVU)贡献了几个关键组成部分,包括内皮细胞、平滑肌细胞、神经元、星形胶质细胞和周细胞。血管树的破坏会导致缺血、免疫细胞浸润、代谢物输送改变、缺氧和组织死亡。此前,我们发现出血相关凝血导致钝性TBI模型中的急性坏死性细胞死亡[5],这表明促进新血管生成的药物可能有助于增强TBI的恢复。
迄今为止,TBI的临床试验尚未专门针对原位血管生成和神经生成。脑缺血的临床前研究充斥着各种治疗策略,包括血管内皮生长因子、西地那非、阿托伐他汀、氨基甲酰化促红细胞生成素(EPO)和EPO单一疗法等。生长因子治疗也有助于eNVU重塑,改善缺血性脑损伤后的预后[18]。然而,这些全身或局部治疗在几分钟到几小时内就会被身体清除,并且没有持久的局部效果。此外,很少有策略报告产生支持性原位微环境以促进伤口愈合[19]。
自组装肽水凝胶(SAPH)是一种在局部组织微环境中呈现强效生物信号的简便方法。SAPH由化学合成的寡肽(通常长5-50个氨基酸)组成,具有多个结构域[20–23]。主要的自组装结构域(SAPH由此得名)由极性氨基酸残基组成,这些氨基酸残基位于交替的亲水性和疏水性氨基酸残基的中间区两侧,SAPH可以被设计成包含降解序列,例如中间区中的MMP-2易感-LRG-结构域,以加速体内生物降解,此外,当SAPH末端被生长因子的短肽模拟物功能化时,它可以促进细胞特异性信号传导。值得注意的是,SAPH具有附加的血管内皮生长因子(VEGF-165)模拟物QK,这种血管生成SAPH被称为SLanc,它组装成高密度显示QK表位的纤维(图1)(A–C)由于非共价相互作用,这些肽在针剪切下迅速组装和分解。

从我们以前的研究中,目前注射SAPH已经经过了检验体外细胞相容性、血管生成、后肢缺血恢复以及多种缺血性组织疾病的治疗分析。在本研究中,我们评估了受伤大鼠脑中称为 SLanc 的血管生成 SAPH,以了解其在中枢神经系统中的血管生成和神经保护作用。使用侧向液压冲击损伤模型 (FPI) 诱发中度创伤性脑损伤,伴有物理血管破裂和组织变形 [33]。FPI 后立即将 SLanc 肽水凝胶注射到损伤部位,并在损伤后第 7 天和第 14 天评估生物分布以及组织学恢复(血管生成和神经元存活率)。
2 材料和方法
2.1 肽的合成与表征
SLanc 的制备方法如上所述 [25,27]。简而言之,SLanc 采用标准 Fmoc 固相肽合成方案合成,并通过对去离子水透析2天进行纯化(见表 1)用于肽序列)。将透析的肽冷冻、冻干并以粉末形式储存在−80°C下直至配制。肽水凝胶最初以20mg/ml(2 w. %)的浓度在无菌298 mM蔗糖中制备,pH值调节至7。为了获得10 mg/ml的最终浓度,加入与蔗糖相同体积的无菌1X HBSS。该制剂可轻松用25G针头注射。
2.3 动物处理
成年雄性和怀孕雌性 Sprague-Dawley 或 Wistar 大鼠购自 Charles River Laboratory(马萨诸塞州威尔明顿)。动物饲养在室温条件下,在 12 小时暗光循环下自由进食和饮水。该方案经 NJIT-Rutgers-Newark 机构动物护理和使用委员会批准,并遵循《实验室动物护理和使用指南》中的指导原则。
2.4 皮下植入
将 1% (w/v) SLanc 注射到 200–225 克 Wistar 大鼠背部皮下空间,以评估正常生理反应体内. 注射了 200 μL SLanc(n = 3),第 7 天取出组织,并准备进行免疫荧光染色。
2.5 流体冲击损伤(FPI)
随机选取 Sprague Dawley 雄性大鼠(250-300 克;8-11 周龄)进行侧位 FPI 治疗,以造成中度 TBI [34]。假手术损伤病例作为对照。每组使用 5 只大鼠(假手术、FPI+PBS、FPI+SLanc)。所有大鼠均用氯胺酮(100 mg/kg)混合物麻醉,并通过腹膜内注射给予赛拉嗪(10 mg/kg)并放置在立体定位框架中。在左顶骨上进行开颅(3.0 mm),距离中线外侧 2.5 mm 和距离前囟尾部 3.0 mm,硬脑膜完好无损。将 Luer-lock 中心安装在开颅窗上,并用氰基丙烯酸酯凝胶固定在头骨上。通过使用甲基丙烯酸甲酯(Henry Schein,Melville,NY,USA)密封中心。一旦甲基丙烯酸甲酯变硬,Luer-lock 就会充满无菌盐水。手术后一天,将动物随机分配接受假手术或 FPI。假手术动物接受了除诱发损伤之外的所有手术程序。为了诱发 FPI,将摆锤释放到充满液体的气缸的活塞上以诱发损伤。中等 FPI(1.6-1.8 个大气压)后记录的呼吸暂停和翻正反射时间分别为 10-12 秒和 6-8 分钟。
2.6 F-SLanc 的治疗干预和生物分布
FPI 和麻醉后,将大鼠置于立体定位框架中,用 5 μl SLanc 肽水凝胶、荧光标记的 SLanc 肽或 PBS 进行治疗,作为损伤对照。根据立体定位坐标的注射位置为:AP = −3,L = 距 Bregma −2.5,背腹 (DV) = 0.5 毫米。然后移除损伤中心,缝合头部。大鼠在加热垫上恢复,然后被送回笼子。
2.7 脑池内脑脊液示踪剂输注
将荧光 FITC 示踪剂(葡聚糖,荧光素,2,000,000 MW,(Thermo Fisher)在人工脑脊液(5 mg/ml)中重构,通过小脑延髓池注入麻醉大鼠体内[三十五],处死前 2 小时。该既定方案用于追踪血管损伤,因为这种大分子示踪剂沿血管周围空间分布 [5].用注射泵(Harvard Apparatus)通过30号针头将10 μL FITC示踪剂以1 μl/min的速率输注到麻醉大鼠体内,持续10分钟。
2.8 组织处理
FPI/FPI + 治疗后 3、7、14 天,通过缓慢经心脏灌注冰冷磷酸盐缓冲盐水 (PBS) 来对大鼠实施安乐死,随后再用冰冷的 4% 多聚甲醛 (PBS) 进行灌注。将大脑浸泡在 4% 多聚甲醛中过夜,随后在 PBS 中的 30% 蔗糖中进行冷冻保护。从每个样本中处理 20 μm 厚的冠状切片,并储存在 −80 °C 下以供进一步分析。

2.9 免疫荧光和显微镜
用 PBS 清洗脑组织切片,在 -20 °C 下用丙酮-甲醇(体积比 1:1)固定 10 分钟,进行免疫荧光染色。然后用 3% 牛血清白蛋白在 25 °C 下封闭固定的载玻片 1 小时,并加入 0.1% Triton X-100。将载玻片与图 1 中所示的一抗一起孵育(表 2), 4°C 下过夜以探测相应的抗原。用 PBS 清洗样品载玻片,然后与抗小鼠/山羊/兔/绵羊免疫球蛋白-G (IgG) 结合的 Alexa Fluor 488/594 孵育 1 小时。用 PBS 清洗后,将样品载玻片安装在含有 DAPI (Thermo Fisher) 的免疫支架上。用 Leica Aperio Versa 200 数字病理级载玻片扫描仪扫描 (20 倍放大倍数) 全脑组织切片图像,并用荧光显微镜 (IX81 DSO;Olympus,新泽西州萨默塞特) 捕获详细的区域荧光图像。
2.10 蛋白质印迹法
使用超声处理将新鲜脑组织与 CellLytic-M (Sigma) 裂解缓冲液(每 10 毫克组织 500 μL 缓冲液)在冰上均质化。在冰上孵育 30 分钟后,在 4 °C 下以 13,000 rpm 的速度离心该均质物 20 分钟,收集上清液并通过二辛可宁酸 (BCA) 方法(Thermo Fisher)评估蛋白质浓度。将蛋白质以 20 μg/泳道加入 4–15% SDS-PAGE 梯度凝胶(Thermo Fisher)中,转移到 PVDF 膜上,用 5% 牛奶封闭,在 4 °C 下与一抗孵育过夜,洗涤,并在室温下与相应的辣根过氧化物酶偶联二抗(1:10000 稀释)孵育 1 小时。通过 West Pico 化学发光底物(Thermo Fisher)检测免疫反应带。使用 ImageJ 软件将数据量化为密度强度。
3 结果
3.1 血管生成肽水凝胶特性
如前所述,SLanc是通过常规Fmoc固相肽合成法合成的,并通过透析和HPLC纯化。肽在水性缓冲液中通过同时形成氢键和疏水填充自组装成纳米纤维水凝胶(图1A–C)。我们评估了SLanc的自组装、细胞相容性和血管生成潜力体外和体内(皮下和啮齿动物后肢缺血模型),从我们之前的细胞相容性试验来看体外,SLanc增加人类间充质干细胞的细胞粘附并促进内皮划痕试验中的伤口愈合[25]。在本研究中,我们严格分析了这种简便策略在创伤性脑损伤(TBI)后伤口恢复中的有效性。与这项工作相关的是,SLanc与大鼠原代神经元的细胞相容性表明在SLanc水凝胶中发现了神经突生长,图1D.进行SLanc皮下植入以研究血管生成(图S1),在对大鼠TBI模型进行评估之前,图1E.内皮细胞和平滑肌细胞的免疫染色图像显示治疗后第7天和第14天皮下具有强大的血管生成作用(图S1重要的是,在测试的浓度范围内,在任何培养物中均未观察到水凝胶的细胞毒性:在这些研究和之前的研究中,0.1w%溶液-1w%水凝胶适用于一系列细胞类型[25,27]。
3.2 血管生成水凝胶可增加受伤大脑的血管密度
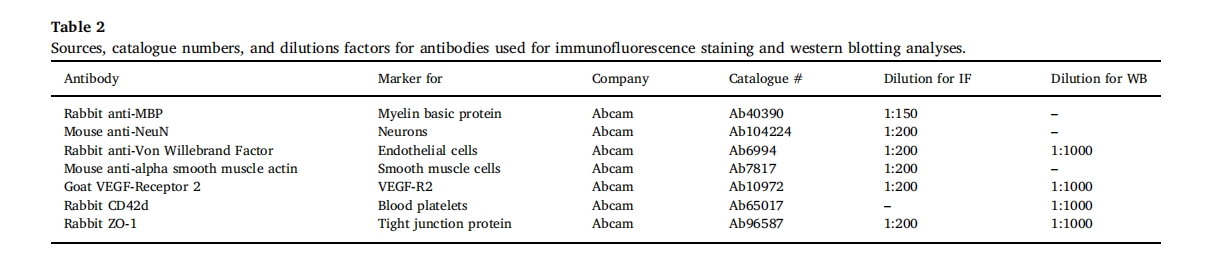
为了检查肽水凝胶在撞击部位的生物分布,在损伤部位进行 FPI 后直接将荧光标记的 SLanc 注射到颅内。注射后,肽水凝胶表现出触变性剪切稀化,并几乎瞬间恢复成原位水凝胶,注射后 1 周内大部分凝胶仍停留在局部(图 2A)。治疗后第 14 天,植入的水凝胶表现出预期的适度生物降解,部分分布在皮质、海马体,部分分布在脑室。使用肽水凝胶的意义在于在损伤部位形成持久的药物表位呈递库,用于治疗性血管生成,随后降解。SLanc 在 CNS 中的持久性可达 14 天,与之前报道的皮下和肌肉内持久性相当 [27]。
创伤性脑损伤后,苏木精和伊红 (H&E) 染色的切片清晰显示细胞浸润和血管生成(图 2B–E),在 SLanc 治疗的损伤中(图 2D)与伤害控制大脑(图 2C)和假(图 2B). 损伤对照组中观察到血管痉挛,血管周围间隙扩大图 2C. FPI 后 7 天,在水凝胶植入物附近捕捉到的放大图形(图 2E) 显示清晰的血管生成和增加的细胞浸润,表明血管生成 SAPH 促进血管再生。
3.3 TBI 后 SAPH 治疗可促进血管生成
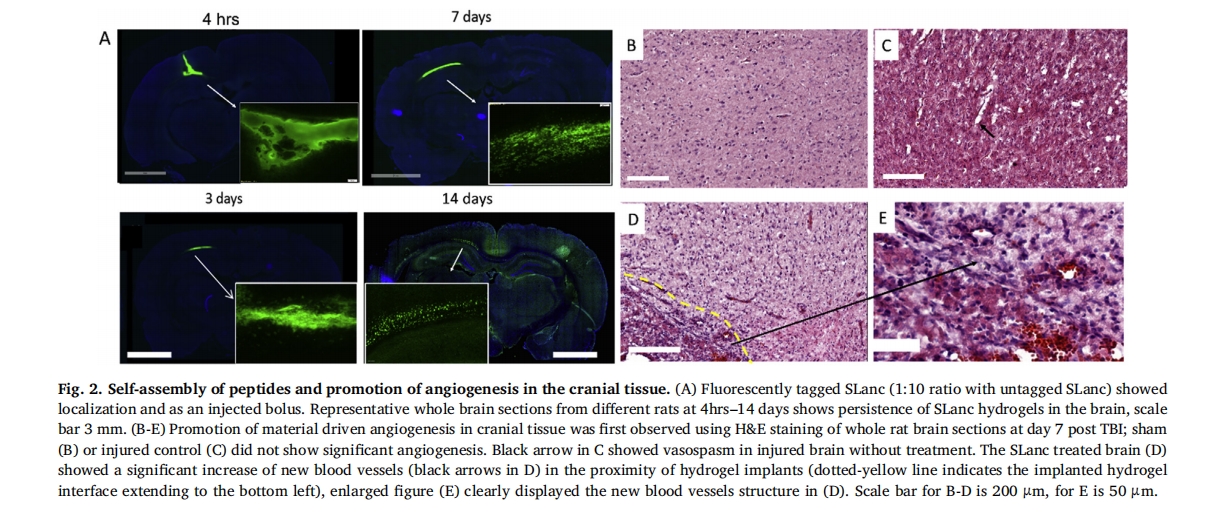
VEGF受体2有望在受伤的大脑中被激活以实现自我修复,在脑损伤的血管生成和神经保护中发挥重要作用。三十六–三十九因此,通过 VEGF 受体 2 表达来评估血管生成过程的机制理解以及新血管的识别(图 3)。研究发现,SLanc 治疗导致损伤后第 7 天 VEGFR2 表达显著增加(图 3C),与损伤对照和假脑相比(图 3A–B)。对应于组织学染色中血管数量的增加(图 2E),在血管结构中特异性地观察到阳性免疫活性(图 3D)。通过蛋白质印迹定量分析,我们还注意到 FPI 损伤大脑中 VEGFR2 上调,这是修复受损血管的天然反应,但我们的血管生成肽显著上调 VEGFR2,以促进血管生成,而不是天然伤口愈合过程(图 3E).

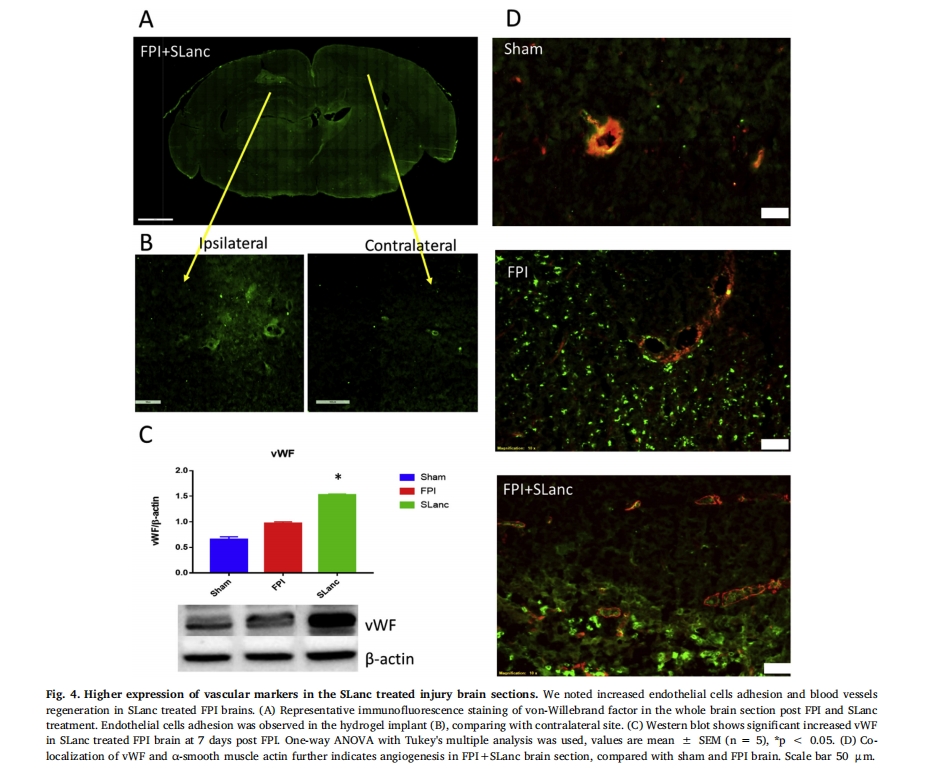
血管形成的关键是其新生/成熟度、通透性和治疗性再血管化缺血组织的能力。这是通过使用血管性血友病因子 (vWF) 和成熟小动脉/小静脉标记平滑肌细胞标记物 (α-平滑肌肌动蛋白) 对新生毛细血管内皮细胞进行染色观察到的。图 4. 在 TBI 后第 7 天,在 FPI 损伤脑内及其周围观察到 SLanc 水凝胶植入物内和周围内皮细胞数量增加(图 4A–B)。vWF 的蛋白质印迹显示,与损伤对照和假手术相比,FPI+SLanc 脑中内皮细胞的募集明显增多(图 4C). 与假手术相比,FPI+PBS 和 FPI+SLanc 在图 4D,我们观察到损伤控制中血管结构的破坏明显增多。SLanc 治疗导致内皮细胞与平滑肌细胞衬里浸润明显增多,表明成熟稳定的血管正在发育。
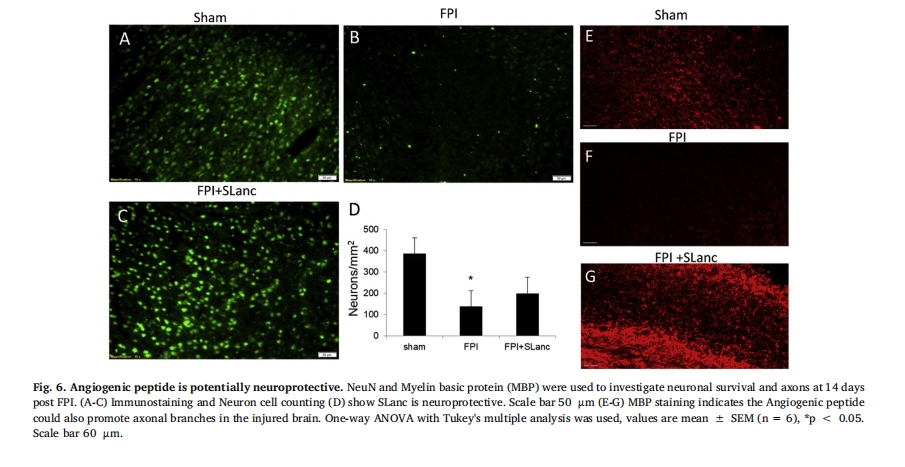
3.4 血管生成 SAPH 具有潜在的神经保护作用并减少轴突损伤
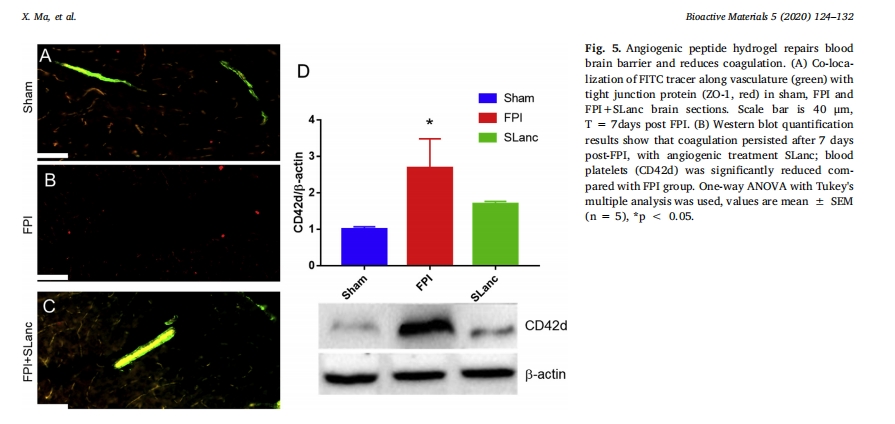
有人推测,SLanc 治疗促进的治疗性血管生成可能转化为损伤脑中神经元存活率的提高。以前的研究发现,FPI 后凝血显著增加并沿血管积聚,导致血栓性坏死 [5]。在这里,将大分子 FITC-葡聚糖示踪剂 (2000 kDa) 注入脑脊液 (CSF)(沿血管分布),以追踪血管损伤作为损伤恢复的参数。FITC 示踪剂与紧密连接蛋白 Zonula occludens (ZO-1) 的共定位进一步表明血脑屏障 (BBB) 恢复是功能恢复的参数。在受伤后第 7 天,FITC 示踪剂在 FPI 损伤脑中受损的 BBB 中的生物分布被阻断(图 5B),而假手术动物的 BBB 完整且示踪剂分布均匀。图 5C 表明 SLanc 修复了血脑屏障 (BBB) 并恢复了示踪剂在脑脊液通路中的分布。此外,在 FPI 后 7 天,血管生成肽 SLanc 发现受损大脑中的凝血显著减少,在蛋白质印迹定量分析中 (图 5D).
过去十年来,SAPH 已在许多临床前应用中得到应用[21–23,27–31,40–42],血管生成 SAPH 先前已证明对人类内皮细胞具有血管生成潜力,可促进皮下植入物快速血管化,并在后肢缺血模型中快速恢复 [21,25,27]。由于血管损伤和神经元丢失,eNVU 中断使受伤的大脑变得更加复杂。进一步推动治疗发展的紧迫性的是缺乏成功的临床治疗方式[43脑血管修复和血管生成是 TBI 治疗中经常被低估的一个方面;关键的里程碑集中在全生长因子疗法、血管扩张剂、他汀类药物和红细胞生成促进剂上[38,44-46]。在目前的研究中,我们使用了一种自组装肽基可注射水凝胶 (SLanc),其中含有可促进血管生成的 VEGF-165 模拟物。水凝胶可以在 FPI 后注射到损伤部位,并为 eNVU 的再生提供一致的愈合微环境。我们的结果表明,通过在水凝胶植入物中使用 SAPH 持续呈现 VEGF 模拟物可以引导原生脑 ECM 损伤后的轴突投射和血管生成。内皮和平滑肌的组织学染色和免疫染色表明血管生成 SAPH 诱导了强烈的血管生成反应。此外,发现潜在机制是 VEGF 受体 2 的激活和上调。这伴随着内皮细胞、平滑肌细胞和 VEGF-R2 的显着增加。重要的是,已证实 VEGF-R2 可直接激活神经元胞内信号通路,发挥神经保护作用,根据 PI3-K/Akt 通路以及 MAPK ERK 激酶/细胞外信号调节激酶通路[47],此外,在缺血动物模型中,VEGF的过度表达被证明可以通过促进神经发生和神经迁移来减少梗塞体积。[48]这些支持性研究为血管生成SAPH具有神经保护作用提供了潜在的解释。
液压冲击损伤(FPI)是一种成熟的TBI损伤模型,其损伤类型为混合损伤,包括撞击部位的局灶性和弥漫性损伤。临床TBI报告和实验模型中经常报道轴突损伤[49研究证明,针对血管生成也可以诱导神经发生,从而改善认知障碍。[37,45,46]。我们发现,在损伤和治疗后7天,SLancSAPH激活了血管生成,随后清除了凝血,修复了血脑屏障,恢复了脑脊液通路。这些都导致基于先前确定的损伤机制的神经元丢失的改善[5]。我们进一步检查了受伤和治疗后第14天的神经元存活率和髓鞘轴突恢复情况。我们注意到,随着神经血管单元的修复,与损伤对照组相比,存活的神经元更多。此外,在血管生成SAPH周围观察到神经突生长,表明SLanc具有长期神经保护作用。
在此,我们认为持续和长期局部呈现血管生成部分可以帮助保护神经功能并增强愈合。虽然许多血管生成药物也有类似的用途(例如半衰期较短的西地那非、阿托伐他汀和EPO体内),它们的短暂作用不会带来功能/持久的好处。相反,伤口愈合后过多或持续的血管生成可能会导致脑水肿或潜在的出血。虽然SLanc促进的血管内衬有内皮细胞和平滑肌细胞(表明它们的成熟度和稳定性),但受控和可定制的血管生成(按需)将是首选模式。为此,未来的研究将调查中枢神经系统(以及可能的肽序列)中的不同浓度,以了解恢复脑血管系统的时间和功能益处,以及这可能与TBI后的行为结果有何关系。
5 结论和未来方向
在本研究中,我们研究了受伤脑组织中的血管生成SAPH。可注射自组装肽水凝胶(SAPH)具有血管内皮生长因子模拟物,可在损伤部位提供持续的血管生成信号,同时为组织浸润和再生提供基质。通过免疫组织化学和血管和VEGF受体2的生物标志物进一步验证了血管生成。血管生成SAPH被证明可通过诱导内皮细胞粘附和VEGF-R2上调来激活血管生成。在血管生成SAPH内和周围观察到神经保护和轴突生长,表明神经血管单元的修复与神经元存活率增强有关。本研究确立了SAPH在受伤脑部使用的临床前潜力。追踪大型动物模型中的功能恢复和行为结果的长期研究肯定会在人体转化之前证明其有效性。总体而言,血管生成SAPH可能为神经保护、潜在神经元再生和各种其他(神经)缺血性组织疾病创造再生环境。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。