
摘要:智能构建分子的工程设计是设计智能药物递送系统的关键基础。作为一种新兴的复杂递送系统策略,肽药物偶联物 (PDC) 的强大功能归因于智能接头和多功能肽域。肽表现出广泛的功能和特性,包括易于化学合成和多种修饰、可调节的生物相容性、多样化的自组装纳米结构、特异性识别/结合以及对细胞膜/细胞外基质的深度渗透。此外,各种类型的接头使 PDC 能够根据疾病微环境或治疗需求响应性地释放药物。由于这些固有的优势,PDC 已被广泛用于药物递送。在此,综述了构建智能PDCs常用的功能肽和连接子的最新进展,旨在引起人们对PDC设计策略及其对抗击各类疾病贡献的广泛关注,并为智能PDC药物递送系统的研究提供指导。
1 介绍
精细智能药物递送系统的研究旨在保证药物安全、可控地释放,以达到最佳的药效和最小的副作用。多肽由于具有良好的生物相容性、生物降解性、自组装性和不同的化学变异性,在构建智能纳米递送系统方面引起了人们的极大兴趣。用于构建纳米药物的多肽通常长度为2-30个氨基酸残基,通过设计20个氨基酸及其衍生物的序列和结构可以获得数千种功能和结构。将功能性多肽与不同的药物以共价或非共价方式结合,构建基于多肽的递送系统,可以产生良好的治疗效果。因此,多肽在基因递送方面具有优势。[1], 寡核苷酸[2]、蛋白质[3]、小分子化疗药物[4]、无机药物[5],细胞[6]和其他治疗物质来治疗各种疾病。各种各样的氨基酸残基,如亲水性、疏水性、芳香性、酸性和碱性氨基酸,都可用于构建功能性肽序列。这些不同的氨基酸为肽提供了结构基础,以产生各种相互作用力。此外,在协同非共价相互作用的驱动下,肽可以自发形成明确的纳米结构,包括纳米棒、管、纤维、球体和甜甜圈以及胶束(图 1)[7]
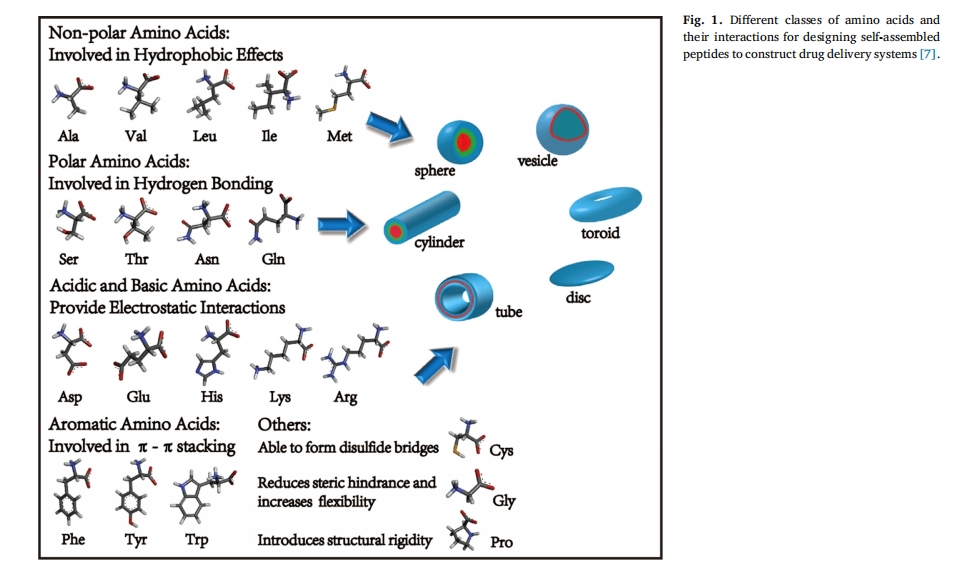
肽类除了具有复杂、可调控的自组装结构外,还具有多种反应基团,包括分解基团、氨基基团、巯基基团等,使得通过共价键连接药物运输更加容易和可行。此外,肽类还是一种参与生物体内各种细胞功能的生物活性物质,其功能是通过模仿特定的蛋白质功能域实现的。许多肽类可具有多种功能,如靶向性、归巢性、细胞穿透性和血脑屏障穿透性。
肽药物偶联物(PDC)是一种新型的前体药物策略,其优异的功能主要归功于多样化的肽结构域和响应性接头。PDC 主要由三个部分组成:功能性肽结构域、货物和接头片段(图 2)

近年来,研究人员利用PDCs的生物活性和自组装潜能,成功获得了不同的纳米结构,用于提高药物化合物的治疗效果。将药物与自组装肽序列结合后,肽片段可以带动药物组装在一起,在水中形成稳定的纳米结构,除了作为功能组装块外,还能实现靶向、归巢、穿透和响应性释放的目的。在分子水平上操控PDCs还意味着可以精确确定药物偶联反应位点的数量和位置,从而控制PDCs的结构。这种涉及PDCs的前药策略可以显著改善药物在体内的吸收、分布、代谢和释放。促进药物在体内的代谢和排泄(ADME),从而提高该类药物的疗效,这是理想药物递送载体的特性。
本综述的第一部分报道了功能性肽及其构建的PDCs的研究进展。第二部分重点介绍了连接体化学设计和合成的最新进展。第三部分重点研究了针对性强、穿透性强、响应性强的按需/触发释放智能递送系统构建的不同货物以及处于开发和临床试验阶段的PDCs。我们的目标是帮助读者掌握基于肽的智能药物递送系统的多功能性。因此,本文将不涉及治疗性肽的综述。
2 功能肽结构域
PDC 的多种功能主要取决于肽区的特性。例如,水溶性肽用于连接疏水性药物以增加溶解度和药物可药性,自组装肽形成 PDC 纳米结构;靶向肽改善靶位分布,穿透肽增强生物膜渗透性。已经研究了使用一系列功能肽赋予 PDC 所需的效果,这些例子将在后面讨论。
2.1 自组装肽
自组装是生命的一种基本现象,例如细胞膜的形成[8]、蛋白质折叠[9]以及 DNA 双螺旋结构[10]是生命最基本的组成部分之一。所有生物分子,包括肽,都是多功能的构建块,可形成明确定义结构。自组装肽设计的重点是了解各种分子间相互作用,包括氢键、静电相互作用、π-π堆积、范德华力和色散力、金属-配体复合物和熵力,例如疏水性和排斥体积相互作用[11,12] 此外,通过半胱氨酸引入二硫键也被用于驱动超分子组装[13]更重要的是,调节这些相互作用以将肽或PDCs组装成具有目标结构的递送系统是构建基于自组装肽的递送系统的决定性步骤。在本节中,我们报告了自组装肽的一级和二级结构特征的研究,总结了自组装力研究的进展,并介绍了调控PDCs形态的策略。
2.1.1 自组装肽的结构特征
自组装肽的结构包括肽的氨基酸序列的一级结构;相邻或紧密相邻氨基酸之间的分子内相互作用,产生的螺旋、β-折叠、反式或无序构象等二级结构;以及具有特定折叠结构的分子间组装[14]Costantini 等人总结了 PDBselect 数据集中氨基酸频率及二级结构状态趋势(表 1)[15]
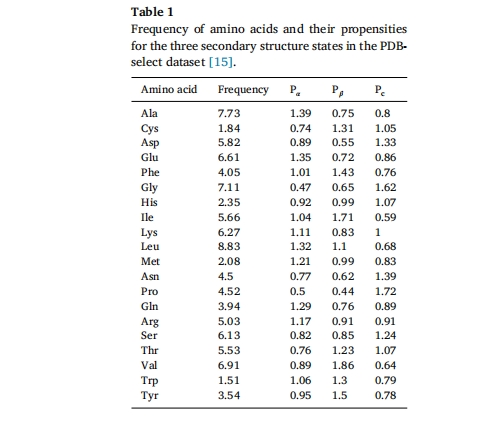
多肽的氨基酸类型和序列特征是其组装能力的基础,具有组装能力的多肽分子结构往往具有明显的特征,如两亲性、芳香性、分散电荷、不同电荷交替排列及对称性等。两亲性多肽作为一类特殊的多肽,具有与传统表面活性剂相似的性质,两亲性多肽同时含有亲水部分和疏水部分,对两相均有亲和力。根据疏水片段的组成可分为疏水片段全部由氨基酸残基组成的表面活性肽(类表面活性剂肽)和疏水链由长烷基碳链组成的两亲性多肽。表面活性肽的疏水片段一般由若干个连续的疏水氨基酸残基组成,亲水片段含有一个或两个带一个或两个正电荷或负电荷的氨基酸残基,其结构和大小与天然磷脂十分相似。对于两亲性肽而言,决定自组装形态的关键在于亲水片段和疏水片段的平衡,通过调节氨基酸的种类、数量和相对位置来改变其两亲性质,从而控制组装体的最终结构其结构和大小与天然磷脂十分相似。对于两亲性肽而言,决定自组装形态的关键在于亲水片段和疏水片段的平衡。通过调节氨基酸的种类、数量和相对位置来改变其两亲性,可以控制组装体的最终结构其结构和大小与天然磷脂十分相似。对于两亲性肽而言,决定自组装形态的关键在于亲水片段和疏水片段的平衡。通过调节氨基酸的种类、数量和相对位置来改变其两亲性,可以控制组装体的最终结构[16–18]芳香肽主要包括一类含有芳香族氨基酸的多肽,如Phe、Tyr、Trp等,它们的芳香性不仅驱动多肽自组装和凝胶化,而且可以调节体系的疏水性,芳香性作为一种强相互作用,可以提高多肽分子的自组装能力[19]证明了对称性也是自组装分子的一个关键因素,因为对称性减少了自组装分子拼接时的界面类型[20,21]。
2.1.2 自组装力
多肽可以在多种非共价键力的共同驱动下,如疏水作用、π-π堆积、静电力、氢键等自组装形成不同形貌和功能的组装体。虽然这些非共价键的作用力相对较弱,但它们共同作用时,其作用强度不容忽视。深入探究多肽的自组装行为及组装体形成的机制,首要任务是了解各种非共价键力在组装过程中的作用,为定向调控组装体的形貌和尺寸提供依据。
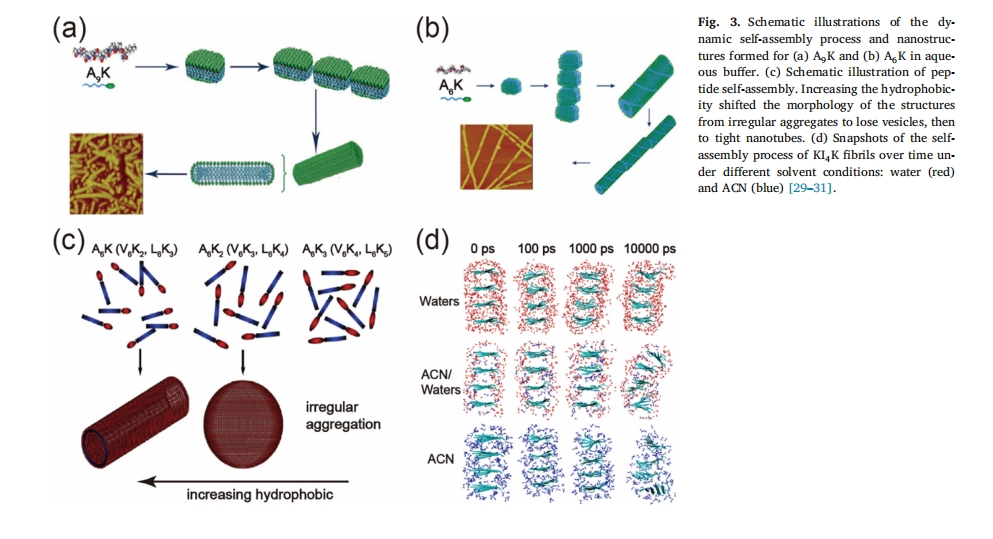
疏水相互作用是肽自组装的重要驱动力[16],疏水力的本质是熵效应[22],疏水相互作用的能量相对较小,其能量约为4–8 kJ/mol[23],多肽中疏水残基(丙氨酸、缬氨酸、亮氨酸、异亮氨酸、酪氨酸、苯丙氨酸和色氨酸)的比例和数量可显著影响多肽组装体的纳米结构。一般来说,极性氨基酸和非极性氨基酸组成的多肽序列更容易形成球形结构。非极性氨基酸在疏水力的作用下聚集形成疏水核心,亲水极性氨基酸则排列在外侧与水接触。在高长宽比结构(纤维、薄膜)的形成过程中,疏水力是促进β-折叠横向堆积的前提,而β-折叠横向堆积对于组装体宽度的进一步积累至关重要[24,25],Groot等比较了Ile-Phe-和Val-Phe两种自组装短肽的自组装行为,发现前者的自组装能力弱于后者,并证实这是由于Ile-残基少了一个CH3比Val残基高,疏水作用降低,最终导致肽自组装能力下降[26],在自组装肽分子的C端和N端引入脂肪链可以有效提高自组装结构的稳定性[27]Löwik等人发现,引入的脂肪链的长度会影响疏水相互作用的强度,从而稳定和增强自组装的能力不同[28]有研究证明,通过增加肽的疏水性或减少亲水性氨基酸的数量,自组装后形成的纳米结构可以从纳米囊泡转变为纳米管和纳米带。Wang等[29]. 使用两亲肽 A6K和A9K 探讨了疏水相互作用对肽分子自组装结构的影响。他们观察到 A9K 可以自组装成低纵横比结构,例如纳米球或短纳米棒(图 3a).然而,随着疏水比的降低,可以通过A形成高纵横比的纤维结构6钾(图 3b) 表明,当疏水比增加时,自组装肽倾向于聚集形成球形结构。相比之下,Meng 等人[30]. 发现疏水相互作用的增加会改变组装结构的形态,从不规则的聚集体变为球形囊泡,最后变为纳米管结构(图 3c), 这一看似矛盾的结论可能是由于同种电荷间存在较强的排斥力,而作为亲水组分的K,其数量越多,产生的排斥阻力越大,因此,肽的自组装形貌是由疏水相互作用和静电排斥之间的平衡决定的。Zhao et al[31]. 观察到乙腈 (ACN) 破坏疏水相互作用,并报道了其对自组装的影响。如图所示图 3d, KI 的原纤维4K由四个β-折叠组成,其中I4β 折叠片起疏水核心的作用。在水中,观察到肽分子紧密堆积形成原纤维,纤维内部充当疏水核心,水分子倾向于从两个 β 折叠片之间逸出。然而,在乙腈/水混合物(1:1 摩尔比)和乙腈中,肽分子堆积不太紧密,溶剂分子也分布在疏水核心中。分子动力学模拟进一步表明,乙腈分子可以进入肽的疏水部分并削弱疏水相互作用,从而破坏相邻折叠片之间的连续性[32]这些独特的结构不仅可以作为支架构建各种纳米器件,还可以用于装载药物,实现药物的控制释放。33,34]。
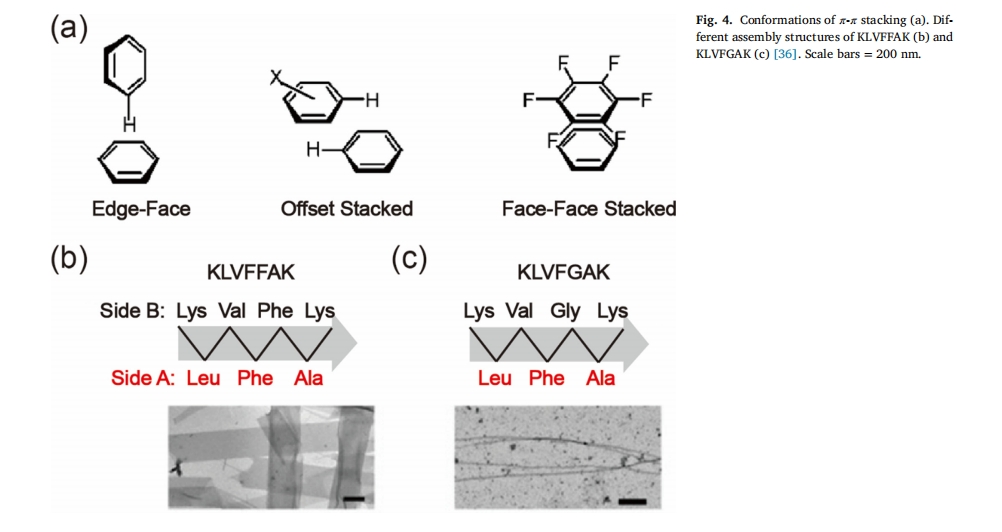
π-π堆积相互作用又称芳香相互作用,主要发生在π-π共轭体系中,其力能为8–12 kJ/mol[35],与一般的疏水相互作用不同,π-π积累相互作用具有方向性,涉及具有特定空间排列的疏水相互作用。通常有三种积累形式,包括边对面相互作用、偏移堆积构象和面对面堆积几何结构(图 4a)[36],π-π堆积主要是由芳香族氨基酸残基(如苯丙氨酸[37,38], 色氨酸[39]和酪氨酸[40]) 在肽序列中。其他芳香基团的引入[41],例如 Fmoc 基团[42]和二茂铁[43],也能产生π-π堆积。在含有芳香环的肽结构中,这种环的有序堆积引导肽组装体的定向生长,最终形成更加紧密有序的纳米结构[44,45],π-π的积累不仅提高了肽分子的自组装能力[46,47] 而且在一些病理性淀粉样蛋白聚集过程中起着决定性作用[48,49],比如,淀粉样斑块的堆积是临床判断阿尔茨海默病(AD)的金标准[50],促使淀粉样蛋白自聚集的主要力量是蛋白质中芳香族氨基酸残基之间π-π键的积累,因此,破坏淀粉样蛋白分子间的π-π相互作用常被用于抑制淀粉样斑块的形成,以探索AD的治疗策略。KLVFFAK是KLVFFAE Aβ(16–22)的一个突变体,当KLVFFAK肽段中的第二个苯丙氨酸被甘氨酸取代(KLVFGAK)后,π-π堆积作用比KLVFFAK弱得多,因此横向生长的驱动力明显减弱,自组装由较宽的带状结构变为较窄的纳米纤维结构(图 4b, c)[51],此外,π-π堆积可以降低自组装肽的临界聚集浓度,提高组装结构的稳定性和其他力学性能[52,53]。
无方向性的静电力包括同电荷吸引和异电荷排斥。静电力来源于肽序列中的酸性或碱性氨基酸。静电作用虽然比较弱,能量为0.5~4kJ/mol,但对肽自组装的影响较大。在以静电力为主导的肽结构中,同电荷产生的静电排斥力往往表现为肽自组装的阻力或稳定力。带电片段一般为亲水链,遇水膨胀,疏水片段遇水坍塌收缩聚集形成内核。所形成的胶束的尺寸取决于疏水核的表面张力与亲水壳中相邻片段的静电排斥之间的平衡。与同种电荷排斥相反,正电荷和负电荷之间的静电引力可以控制肽分子的聚集行为,并使它们以正电荷和负电荷残基彼此接近的方式自组装。Ramachandran 发现,在静电引力的作用下,带相反电荷的肽可以自发聚集并组装在一起,形成能够负载药物和功能蛋白的肽载体正负电荷间的静电引力可以控制肽分子的聚集行为,使其自组装,使带正电和带负电的残基相互靠近。Ramachandran发现,在静电引力的作用下,带相反电荷的肽可以自发聚集组装在一起,形成能够负载药物和功能蛋白的肽载体正负电荷间的静电引力可以控制肽分子的聚集行为,使其自组装,使带正电和带负电的残基相互靠近。Ramachandran发现,在静电引力的作用下,带相反电荷的肽可以自发聚集组装在一起,形成能够负载药物和功能蛋白的肽载体[54]当带相反电荷的氨基酸残基分布在肽序列的两端时,肽在自组装过程中倾向于采用反向平行的分子排列[55,56],Stupp等研究证实,带相反电荷的氨基酸残基间静电引力作用下形成的纳米纤维具有更强的热稳定性[57]. 利用蒙特卡罗模拟研究了肽自组装过程中静电相互作用对维持组装形貌的重要性。结果表明,纳米纤维亲水表面带电氨基酸残基之间的静电相互作用可以稳定纤维结构[58]通过探究分子净电荷对自组装的影响,发现整体净电荷为1最有利于自组装纤维的形成[59]。
自组装体系的pH值是影响静电效应的重要因素,调节pH值会导致多肽电荷的变化,进而改变多肽的排列方式,引发自组装从纤维到纳米管的转变。基于此规律,设计出最短自组装离子互补肽分子KFFE[60]. Honggang Cui 等人证明了肽 EF4E 和 KF4带一种电荷的 K 只能在同种电荷排斥条件下形成窄的扭曲带和细纤维。有趣的是,当带相反电荷的 E 和 K 残基被引入到同一个 EF 中时4K肽,正负电荷相互中和,屏蔽了分子间的静电排斥,组装体横向生长,最终形成一条宽带。本文前面提到的不同分子相应组装体的形成机理如图所示图 5a[61]。
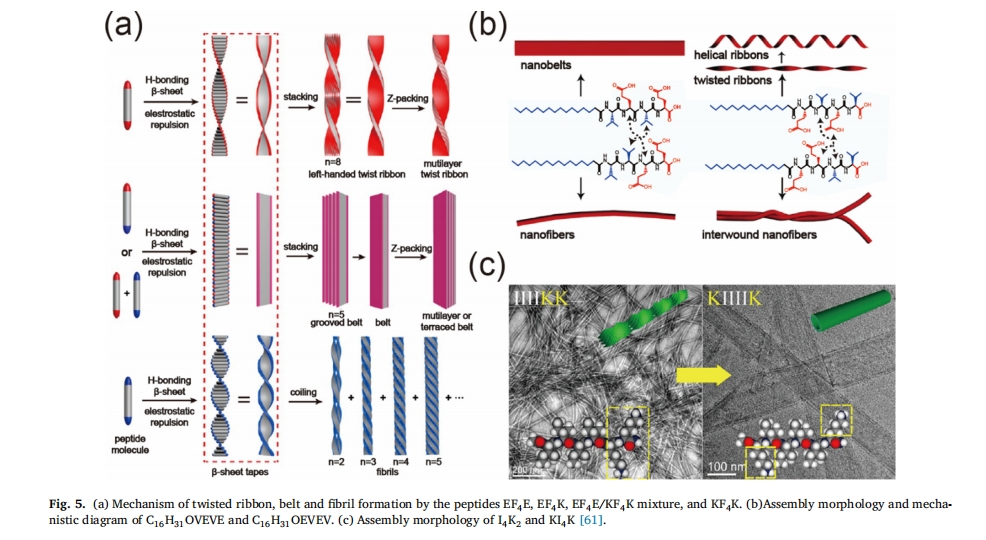
肽的氨基酸序列与其自组装结构密切相关[32,62],通过改变肽氨基酸残基的序列,可以得到完全不同的一维纳米结构[62]. 如图所示图 5b,肽C16H31 OVEVE和具有交替亲水和疏水氨基酸残基的C16H31 OEVEV可以形成更宽的带。相比之下,肽C16H31 OVVEE 和不交替排列的C16H31 OEEVV只能形成较细的纤维。这是因为VEVE和EVEV的交替排列可以很好地分散电荷,降低EE之间的排斥力。在EEVV和VVEE的连续排列中,两个带电氨基酸EE彼此靠近,静电排斥力较强。同样,研究还发现,尽管I4K2和 KI4K 具有相同数量和种类的氨基酸, 其组装形态存在明显差异 (图 5c). 对于I4K2,分子一端带正电的K残基导致体系产生强烈的静电排斥,从而削弱β-片层之间的疏水吸引力,从而形成细纳米纤维。相反,KI带电残基4K位于分子两端,对称的结构导致两端的K引起的静电斥力大大减弱,而且疏水相互作用受静电效应的影响较小。
氢键是一种特殊的范德华力,具有方向性和饱和性。通常情况下,氢键强度大于范德华力,小于共价键。肽主链之间的氢键能约为4–12 kJ/mol[23]由于肽结构中含有较多的C=O和NH基团,可以形成较多的氢键(N-H…O)。氢键是影响肽二级结构的重要因素,分为分子内氢键和分子间氢键。与传统表面活性剂的结构相比,两亲性肽最大的区别在于分子骨架中存在大量氢键,促使组装体沿长轴方向生长,这也是为什么表面活性剂一般倾向于形成球形或棒状结构,而肽倾向于形成纤维状结构的原因。Zhu et al[63]证明氢键能使具有交替亲水性和疏水性氨基酸残基的肽形成β-折叠结构,该结构垂直于纤维的长轴排列,从而避免纤维的扭曲或弯曲。因此,由氢键驱动的β-折叠的形成导致肽分子自组装和聚集,形成具有高长径比的圆柱形纳米纤维、纳米带和纳米管[63–67],Pahrump 等人发现纳米纤维核心中四个氨基酸残基之间的分子间氢键可以使肽倾向于形成垂直于纳米纤维长轴的 β 片层结构。由此揭示了富含氢键的分子倾向于形成高纵横比的纤维结构[68],相比之下,远离核心的氨基酸残基在自组装和维持纤维稳定性和结构刚性方面的作用较弱。氢键的破坏或改变导致圆柱形纳米纤维的结构发生变化,例如长纤维的几何形状发生改变,导致球形胶束,甚至自组装肽形态消失[69]。
肽的自组装是由多种非共价键力驱动的,这些力决定了肽分子向不同方向生长,从而形成不同形貌的组装体。只有在充分理解上述非共价键力的基础上,才能通过调节各种非共价键力的相对大小来有效控制组装体的形貌和尺寸。
2.2 采用PDCs的可转化纳米药物
将药物与自组装肽结合可形成各种纳米递送系统,可适应靶向性、长期滞留性和提高药物稳定性。此外,粒径和形态对纳米递送系统的清除率、穿透效率、靶向滞留和细胞器分布有相当大的影响[70]例如,约100纳米的纳米粒子有利于增强渗透性和保留效应(EPR)的血管外渗[71],但不利于深入肿瘤组织。小纳米粒子(<20纳米)具有深入肿瘤组织、核膜通透性好的优势,但粒径太小不易被机体清除,在肿瘤内蓄积不足[72],与球形颗粒相比,具有高长径比的纳米纤维和棒状形状在肿瘤部位保留和细胞摄取方面具有明显优势[73]相比之下,较大的纤维状和棒状纳米结构更容易被网状内皮系统捕获,静脉给药后存在栓塞风险[74],因此,寻找一种集成多种形态优势的智能形态转化递送系统引起了广泛的研究兴趣。对于自组装的PDCs,可以通过调控自组装力实现形态转化,赋予PDCs优越的治疗效果。
最近,越来越多的研究兴趣转向调控PDC自组装力,根据特定疾病治疗的需要定制自组装肽的纳米结构,甚至让自组装纳米结构根据疾病的特征响应性地发生形态变化,并被预期和证实可达到更好的效果。基于形态对药物ADME的影响,研究人员致力于开发各种可变形纳米粒子(NPs)。各种响应策略已被利用来触发PDCs的尺寸和形状变化,例如体内交联或壳分离[75]。
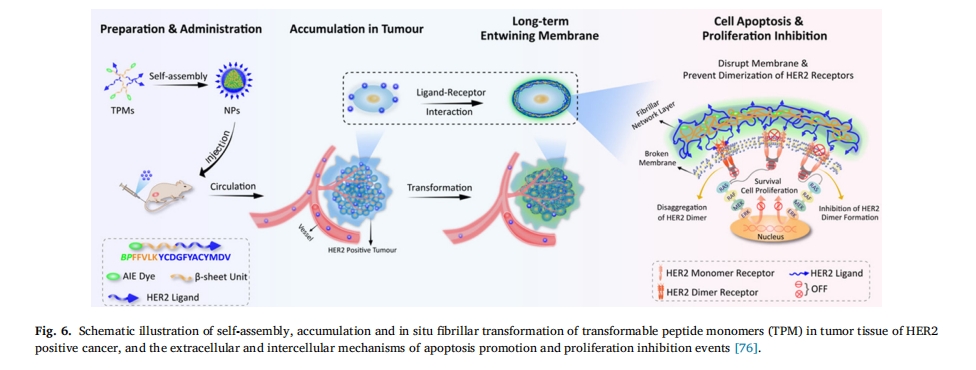
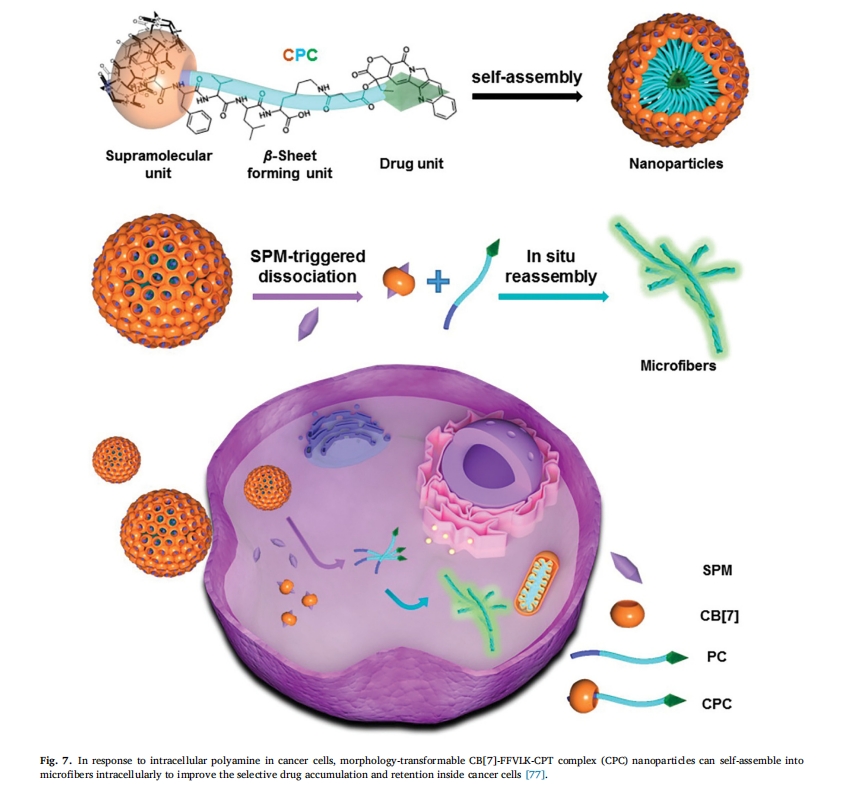
例如,Zhang等人设计的一种无毒可转化肽[76]。这些肽能够在水溶液中自组装成可注射的球形胶束,注射后一旦靶向结合癌细胞上的 HER2,它们就会交联形成纳米纤维,在癌细胞表面形成响应。交联纤维的覆盖有效地破坏了 HER2 二聚化并导致癌细胞凋亡(图 6). Chen 等报道了由多胺引发的形态可转变的超分子肽纳米药物,其由超分子单元(葫芦[7]脲 (CB[7]))、β-片层形成单元(肽 FFVLK)和药物单元(喜树碱 (CPT))组成。FFVLK-CPT 共轭物通过 CB[7]-Phe-主客体相互作用与 CB[7] 非共价复合,随后自组装成 NP,当 CB[7] 通过癌细胞中过表达的细胞内精胺解离时,NP 可以转化为微纤维,显著增强 CPT 在癌细胞中的积累和保留,并降低体内系统毒性(图 7)[77]. 龚等人[78]将疫苗与肽结合,设计出一种具有可改变形态的高效抗肿瘤疫苗。肿瘤的酸性微环境可诱导纳米疫苗发生显著的形态变化,从纳米球(直径约 100 纳米)到纳米片(长度或宽度为几微米)。成熟的组装体可以机械地破坏内体膜,抗原肽被直接运送到细胞质中。重新组装的纳米片还通过激活特定的炎症途径来增强肿瘤免疫力。
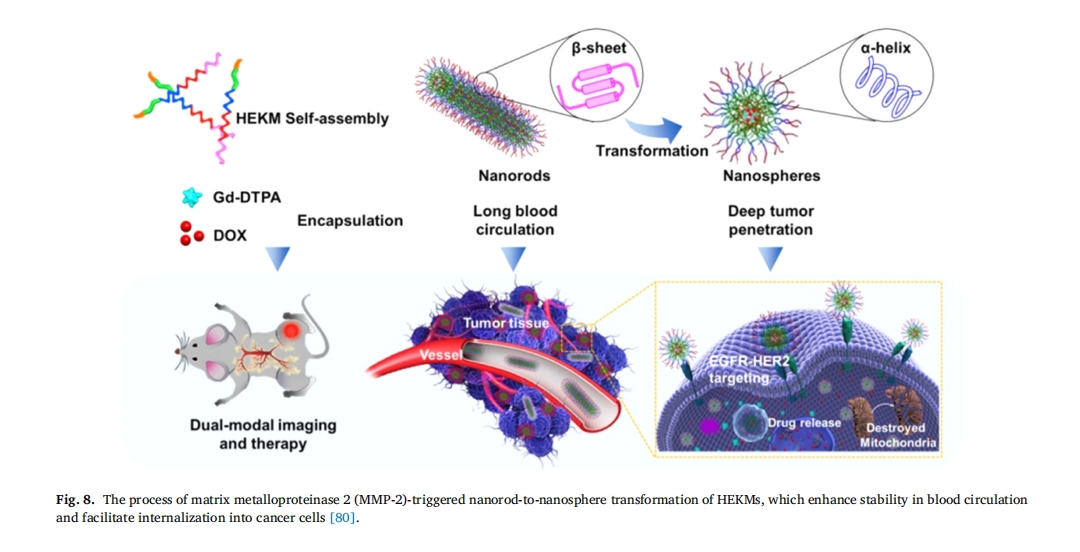
大量研究表明,棒状纳米粒子循环时间较长,有利于药物在病灶内持续蓄积,而球形纳米粒子具有深度细胞穿透能力[79]。因此,Wang 等人[80]. 开发了一种基于肿瘤调控的智能胶束系统,称为HEKM,该系统由棒状颗粒组成,这些颗粒受肿瘤微环境调节而转变为更小的胶束。纳米球形胶束足够小,可以在肿瘤中聚集,实现深层渗透。这种棒球转化的纳米递送系统增强了阿霉素(DOX)的细胞靶向性、内化性和肿瘤治疗能力,提高了治疗效果(图 8)。
2.3 靶向肽
PDCs 的应用目标是通过延长较短的循环半衰期和提高靶向效率来增强化疗药物的疗效。常用的靶向策略包括通过 EPR 效应被动靶向肿瘤组织,以及利用靶位高表达或特异性表达的受体实现靶向药物递送。与传统抗体等高分子量和复杂结构的靶向配体相比,小分子靶向肽受到越来越多的研究关注。基于在肿瘤血管上广泛过表达的整合素家族成员,最典型的肿瘤归巢肽基序是 RGD[81]. 科伊武宁[82]等报道α5β1整合素结合剂均含有RGD,环状肽表现出比线性结合更强的结合力。随后,发现了许多具有肿瘤穿透能力的RGD序列(记为iRGD,“i”代表内化)[83],在过去的几十年里,iRGD 在许多肿瘤模型中增强了药物的积累和疗效[84,85].2018年,iRGD作为吉西他滨和abraxane的胰腺癌添加剂进入I期临床试验(临床试验号:NCT03517176)。
另一种肿瘤靶向肽是细胞外基质 (ECM) 靶向肽,因为 ECM 的成分在几乎所有实体肿瘤中都过度表达。关于 ECM 靶向肽的报告包括纤连蛋白域外 B (EDB-FN) 和肌腱蛋白-C 结合肽 [86,87], 层粘连蛋白-巢蛋白复合物结合肽[88]、基质金属蛋白酶靶向肽、结缔组织生长因子 (CTGF/CCN2) 结合肽[89]以及源自胎盘生长因子 (PlGF-2) 的 ECM 结合肽[90]Hubbell 及其同事通过模仿天然配体开发了 ECM 结合肽,这些肽在癌症治疗方面具有令人兴奋的应用。另一个具有巨大潜力的例子是 Bicycle Therapeutics 开发的肽-药物偶联物 (BT1718)[91]BT1718由双环配体组成,通过二硫键可裂解的连接体与美登木素偶联,可靶向ECM中的基质金属蛋白酶14(MMP-14)。BT1718的I/IIa期试验正在基于晚期实体瘤患者(三阴性乳腺癌和非小细胞肺癌;临床试验编号:NCT03486730)进行。
此外,病变部位特异性表达的不同受体也是靶向肽的重要靶点。例如,乳腺癌、卵巢癌、子宫内膜癌和前列腺癌等癌症中过表达的LHRH受体,为靶向药物输送提供了极好的策略。将DOX和2-吡咯烷-DOX与LHRH靶向肽结合,可以增加癌细胞的靶向性,降低药物毒性。Lindgren等[92]. 链接 YTA2和 YTA4肽与甲氨蝶呤结合形成PDC。与游离甲氨蝶呤相比,结合复合物使靶酶二氢叶酸还原酶的作用增加了15-20倍。源自细胞表面蛋白的细胞间粘附分子-1(ICAM-1)肽序列可以被白血病T细胞特异性地内吞。ICAM-1肽可以与治疗药物连接,从而可以提高药物在癌症和自身免疫治疗中的有效性。这种疾病的治疗效果减少了化疗的副作用。Jeffrey等人发现10和20聚体的天冬氨酸和谷氨酸在靶向骨折方面非常有效。他们的实验表明,酸性氨基酸的短寡肽可以将肽有效载荷定位到骨折处91。比对照非靶向肽有效载荷有效 9 倍[93]. 更多的酸性肽结合物正在研究中用于选择性地将各种药物输送到骨骼,包括激素、抗生素、小干扰 RNA (siRNA) 和基因治疗[94–98]表 2。
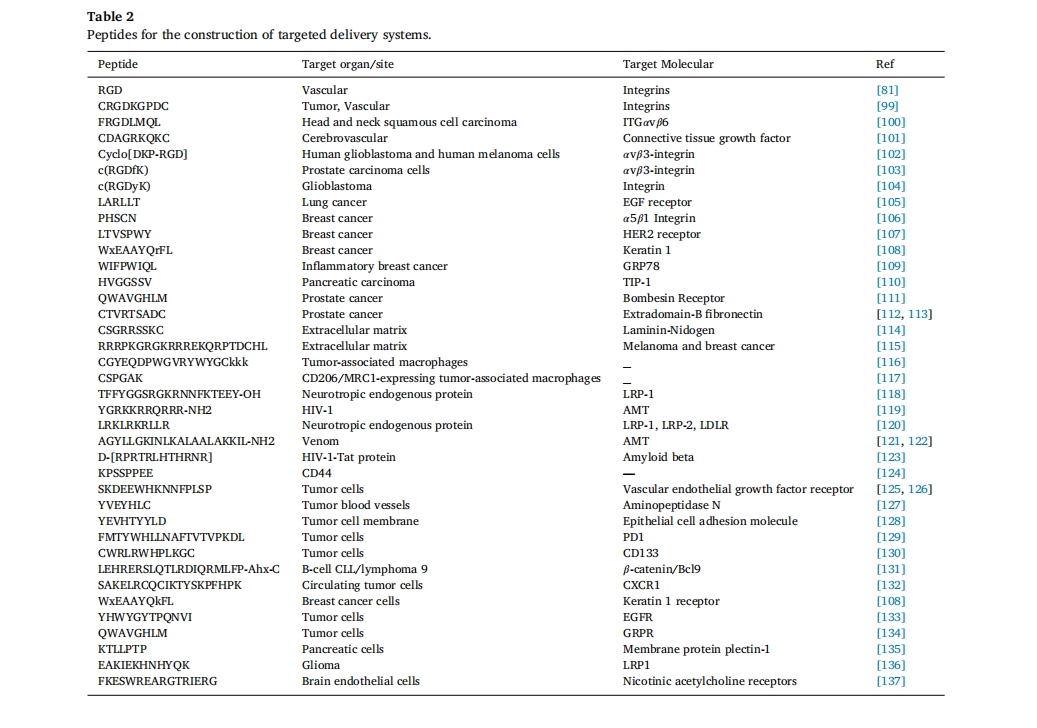
总结了用于构建靶向递送系统的肽的最新研究。
2.4 细胞穿透肽
细胞膜是一道重要的生理屏障,限制了许多蛋白质、核酸等生物大分子和纳米载体(脂质体、胶束、纳米颗粒)跨质膜运输,因此提高药物透过细胞膜的效率尤为重要。细胞穿透肽(CPPs)来源于转运蛋白的转导结构域,是一类能穿透细胞膜的小分子短肽,一般由5~30个氨基酸残基组成。穿透肽富含精氨酸、赖氨酸等碱性氨基酸,具有生理条件下带正电荷、两亲性、穿透细胞膜能力强等特点。它可以在体内和体外快速导致药物及其载体跨越细胞膜屏障,是最有前途的药物输送载体之一[138]自1994年Fawell等报道第一个来源于HIV-1蛋白(RKKKRRQRRR)的细胞穿透肽Tat以来,已发现多种细胞穿透肽,包括TAT、MAP、transportan和富含Arg/Lys残基的信号转导肽VP22。CPP内化的多种模型已被提出,与CPP跨膜相关的被广泛认可的机制主要是能量独立的直接跨膜机制(包括倒胶束模型[139],孔隙形成[140]以及“地毯”模型[141,142]);另一类是能量依赖性内吞作用(包括小窝和网格蛋白非依赖或依赖性途径[143–145]和巨胞饮作用[146])CPP 内化模型的摘要如下:图 9a。
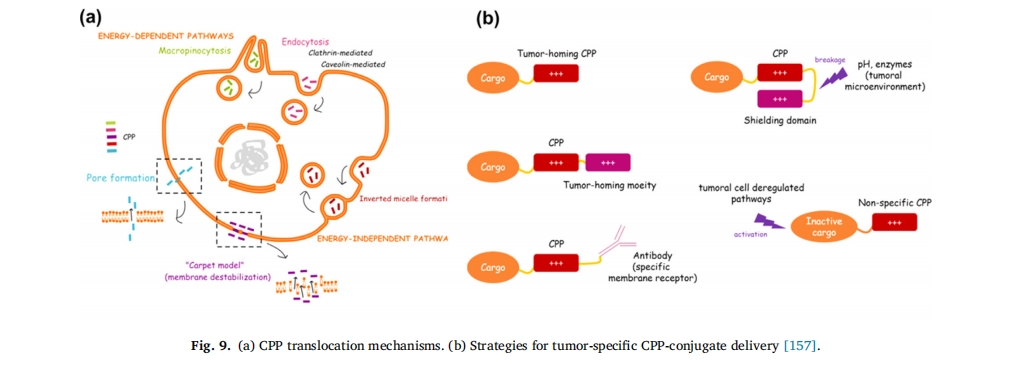
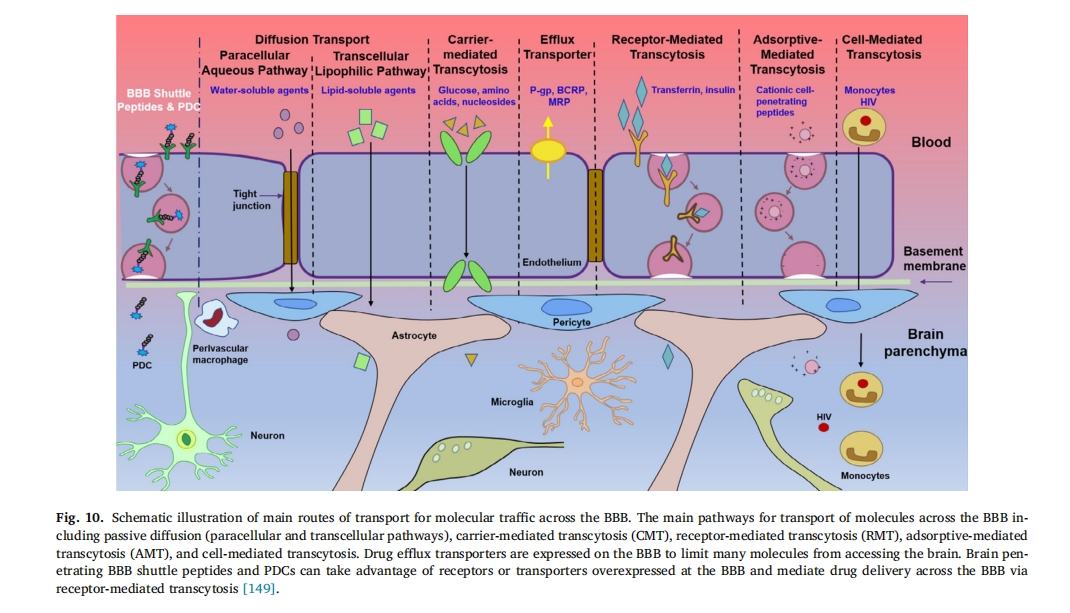
随着CPPs作用机理的逐渐阐明,大量更高效的功能性渗透剂序列被合成[147],肿瘤渗透仍然是 CPP 研究的重点,肿瘤特异性 CPP 结合物递送策略如下图 9b. 此外,跨越血脑屏障是 CPP 开发的另一个有希望且具有挑战性的领域。已发现更多 CPP 能够将神经治疗药物运送到脑实质中。这些 CPP 无需受体即可穿透血脑屏障,由短的两亲性和/或阳离子序列组成,具有通过吸附介导的转胞吞机制跨越细胞膜的能力[148]此外,基于 CPP 的其他功能也得到了发展,以增强跨 BBB 能力,包括对特定受体的强亲和力和介导转胞吞作用的能力[149](图 10)。Kwon等人设计了一种基于穿透肽TAT-天冬酰胺酶复合物的针对淋巴细胞白血病的有效递送系统[150]. 除了增强肿瘤渗透性之外,CPP 还被用于口服胰岛素的尝试。据报道,R8 肽被用于修饰胰岛素 NPs 以克服粘液和上皮屏障,使胰岛素生物利用度提高 1.9 倍,因此显示出口服肽/蛋白质递送的巨大潜力[151]从之前的开创性工作来看,CPPsite 2.0 数据库包含大约 1850 个 CPP 序列,预计这一数字将继续增加[152]. 超过 25 种 CPP 结合药物正在临床开发中,用于治疗炎症、疼痛、癌症、心脏病和衰老等多种疾病[153–156]表 3。
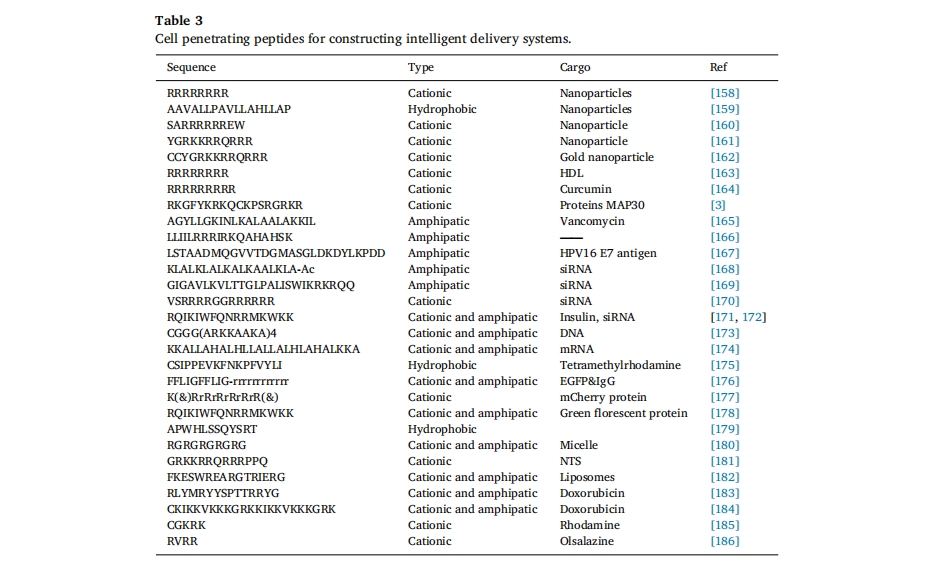
总结了近几十年来报道的大量细胞穿透肽的研究,这些肽已成功应用于增强蛋白质、核酸和小分子药物的功效。
2.5 反应肽
响应性肽将受到系统/外部环境变化的影响,以刺激肽自组装或药物释放,包括温度、pH、酶、GSH 和离子浓度等,为肽药物输送系统的构建提供可控性。温度响应性肽通常用于构建可注射的热响应水凝胶,用于药物输送和细胞封装。例如,来自弹性蛋白 (ELP) 的五肽序列 VPGXG 的寡聚重复序列在低于 35°C 的温度下溶解,在体内注射后在体温 (37°C) 下形成水凝胶。因此,ELP 样肽可使细胞和其他治疗剂在室温下与溶液中的自身结合,并在生理温度下形成凝胶状基质,用于组织工程和其他医疗应用。有几种疾病会导致 pH 平衡改变,例如炎症和癌症。肽也可以合理设计以响应酸性,然后释放被捕获的分子,例如药物、蛋白质和核酸。癌细胞的局部细胞外 pH 值可能比健康细胞低 0.5-1 个 pH 单位,这允许使用 pH 响应肽对酸性患病组织而不是健康组织具有更高的靶向特异性肽也可以合理设计,使其对酸性作出反应,然后释放被捕获的分子,如药物、蛋白质和核酸。癌细胞的局部细胞外 pH 值可能比健康细胞低 0.5-1 个 pH 单位,因此,通过使用 pH 响应肽,可以对酸性患病组织(而不是健康组织)实现更高的靶向特异性肽也可以合理设计,使其对酸性作出反应,然后释放被捕获的分子,如药物、蛋白质和核酸。癌细胞的局部细胞外 pH 值可能比健康细胞低 0.5-1 个 pH 单位,因此,通过使用 pH 响应肽,可以对酸性患病组织(而不是健康组织)实现更高的靶向特异性[187]. 梁等人[188]成功制备了一种新型 pH 响应肽两亲纳米组装体;在这里,它的二级结构可以从 pH 7.4 时的 β 片层变为 pH 5.0 时的 α 螺旋,从而导致形态从纳米球演变为纳米纤维。Matthew 等人报道了一种 pH 响应肽基纳米纤维组装体,该组装体利用葡萄糖氧化酶 (GOx) 通过消耗形成的生理葡萄糖“燃料”来降低局部 pH 值,从而驱动非平衡肽水凝胶网络。在低血糖发作期间,血糖下降导致 GOx 产生的葡萄糖酸减少,生理环境中的 pH 值升高。pH 响应肽水凝胶随着 pH 值的升高而溶解并释放胰高血糖素,提供葡萄糖-pH 响应纳米纤维水凝胶方法来输送胰高血糖素来对抗低血糖[189]。
一些反应性肽可作为酶底物,其药物递送特性会受到体内酶的影响。据报道,多种酶在肿瘤部位和缺血区域聚集的频率更高,例如 MMP、组织蛋白酶和碱性磷酸酶。Jin Zhang 等[190]. 开发了MMP-2响应嵌合肽,该肽可以在生理条件下自组装成球形NP,当酶MMP-2在肿瘤部位过表达时,通过降低CAC值转化为长纳米纤维。球形到纤维的转变可以增加肿瘤中的货物Gd 3+浓度,从而改善MRI信号。此外,Jinseong Kim等人制备的前药NP[191].由自组装的蛋白酶B特异性可裂解肽(FRRG)和DOX结合物组成,通过癌细胞中过度表达的蛋白酶B介导的酶促降解特异性释放DOX。
3 连接片段
连接基是延长PDC循环时间和控制货物响应性释放的关键,一般选择多肽末端(包括多肽的N端或C端)和半胱氨酸端基作为连接位点,由于末端连接对多肽功能影响不大,马来酰亚胺-半胱氨酸Michael加成反应具有反应动力学快、选择性高、反应条件温和等特点,被广泛用于PDC合成反应位点[192]。此外,由于许多肽在序列中仅含有一个半胱氨酸残基作为反应位点,因此可以提高偶联效率。连接子必须在循环中表现出稳定性,以防止药物过早和非特异性释放,这对PDCs在体内运输过程中的稳定性起着至关重要的作用。连接子的设计取决于涉及PDCs的机制和疾病治疗的需要。连接子的变化赋予递送系统多种功能,这将对整个系统的性能和药物负载产生重大影响。用于PDCs的连接键类型多种多样,可分为可裂解和不可裂解形式[193]可裂解的连接键包括酶或化学介导的裂解以及涉及 pH 和三肽谷胱甘肽 (GSH) 的微环境微反应裂解表4。
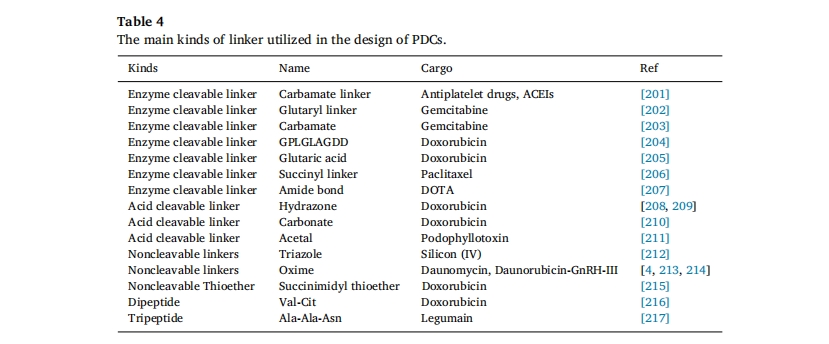
总结了PDCs设计中主要使用的连接体类型,连接体在体内的稳定性已得到证实,从大到小的顺序为:酰胺>氨基甲酸酯>酯>碳酸酯[194]。
健康组织细胞的pH值为7.4,而实体肿瘤组织内微环境的pH值低于正常组织。195,196]。利用肿瘤微环境的温和酸性,许多pH敏感的化学键被用于控制治疗药物从靶位PDCs中的释放。这些键在体内循环pH下是稳定的,但可以在酸性pH下水解,包括缩醛、亚胺、肼和各种酸响应性肽片段。GSH可以裂解一系列可掺入接头的化学键,包括二硫键、硫酯/硒化物/碲、二硒化物/二碲化物、二茂铁和金属硫醇接头。肿瘤中的GSH水平很高。在药物递送方面,局部增加的GSH浓度有利于控制有效载荷的释放。升高的GSH浓度以促进接头的裂解被用于多种肿瘤靶向策略。酶切连接物是治疗 PDC 的另一种常见策略。二肽 Val-Ala 或 Val-Cit 是广泛使用的酶切连接物。这两种二肽在人体循环中都表现出良好的稳定性,并且仅在组织蛋白酶或羧酸酯酶 1 存在下才会被切割[193]MMP 广泛存在于体内,已成为众多研究的主题。例如,Tang 等人[197]等利用MMP-2敏感肽(PVGLIG)作为药物紫杉醇与肽偶联物的连接序列,这种新的给药系统可以控制紫杉醇的释放,从而在胶质瘤患者中获得更好的抑制效果。朱等研究了对MMP-2敏感的八肽(GPLGIAGQ),它能在肿瘤部位释放胶束、siRNA等,减少药物在非靶组织的释放[198,199此外,还可以通过接头的设计来增加药物负载[200]。
4 处于开发和临床试验阶段的 PDC
4.1 货物
评价哪些候选药物可以转化为PDCs的标准主要包括增强循环稳定性和提高效率的证据。可裂解连接子释放的货物必须有一个可行的连接点。一般来说,候选药物的IC50较低50溶解性极差[218].PDC 中使用的货物示例包括 DOX[219]、紫杉醇(PTX)[220–222], 柔红霉素[223]和吉西他滨[224]涉及这些肿瘤治疗剂的主要障碍与水溶液中的溶解性差、对肿瘤组织的渗透性差以及对健康细胞的不良影响有关。为了解决这些问题,传统上会使用赋形剂来溶解不溶性药物,但这种策略会带来进一步的问题,例如添加溶剂的毒性作用。例如,除其他副作用外,Kolliphor EL 已用于“溶解”紫杉醇 (Taxol) 作为乳剂,并且与过敏反应和周围神经病变有关[225]将抗癌药物与亲水性肽结合不仅可以缓解这种溶解度问题,还可以提供引入额外功能的机会[226]。
为了克服化疗药物DOX循环时间有限和脱靶毒性的局限性,Chilkoti等人[209]. 开发了一种白蛋白结合肽缀合物ABD-DOX。PDCs可使肿瘤部位DOX的富集浓度增加4倍,并可进一步将DOX的药效持续时间延长120倍。水溶性差和毒性大限制了鬼臼毒素(PPT)在临床癌症治疗中的应用。周等[227]设计了一种基于肽的PPT缀合物,提高了药物的溶解度,大大降低了游离PPT的溶血活性,显著提高了抗癌疗效。吉西他滨的快速血浆降解、全身毒性和耐药性大大削弱了其作用并显著降低了其疗效。最近开发的改进常规化疗的方法之一是基于PDCs将化疗药物直接靶向癌细胞,大大提高了吉西他滨的治疗指数。此外,对于许多生物大分子如蛋白质和核酸以及纳米载体(脂质体、胶束和纳米颗粒)来说,细胞膜是制约它们跨膜运输的重要生理屏障。因此,提高药物的细胞膜穿透效率至关重要。将疏水性药物与亲水性肽组合可以改变分子极性,有效提高膜穿透能力。许多细胞穿透肽已被成功用于增强蛋白质、核酸和小分子药物的功效。例如,带正电荷的细胞穿透肽已被用于连接带负电荷的核酸大分子,以构建纳米递送系统来治疗各种遗传疾病。此类方法可以提高核酸大分子在体内的稳定性和跨膜能力。许多穿膜肽已被成功用于增强蛋白质、核酸和小分子药物的药效。例如,带正电荷的穿膜肽已被用于连接带负电荷的核酸大分子,构建纳米递送系统来治疗各种遗传疾病。此类方法可以提高核酸大分子在体内的稳定性和跨膜能力。许多穿膜肽已被成功用于增强蛋白质、核酸和小分子药物的药效。例如,带正电荷的穿膜肽已被用于连接带负电荷的核酸大分子,构建纳米递送系统来治疗各种遗传疾病。此类方法可以提高核酸大分子在体内的稳定性和跨膜能力。228,229段氏等设计了一种具有强膜穿透性和抗肿瘤活性的穿透肽-PTX偶联物,增强了PTX的抗肿瘤活性,同时克服了PTX溶解性差和肿瘤耐药性的问题[230]。
4.2 临床试验中的 PDC
尽管 PDC 的结构与抗体-药物偶联物 (ADC) 相似,但这些功能性肽偶联物比 ADC 具有多种优势,包括选择性、更深的肿瘤渗透、快速外渗和更慢的肾脏清除。PDC 药物 Lu-dotatate177 已获得美国食品药品监督管理局 (FDA) 批准用于治疗胃肠道胰腺神经内分泌肿瘤[231]。然而,还有更多的PDCs处于开发阶段,例如TH1902,一种装载多西他赛的PDC,用于治疗三阴性乳腺癌和卵巢癌。TH1904是一种装载DOX的PDC,可用于治疗卵巢癌。这两种PDC都靶向癌症中sortilin 1 (SORT1)受体的过度表达,包括三阴性乳腺癌、卵巢癌、肺癌、结直肠癌、皮肤癌和胰腺癌[232]另一种基于称为自行车肽的组合物的 PDC 药物也非常受欢迎。自行车肽通常长度为 9-20 个氨基酸,序列中有三个半胱氨酸残基。这些半胱氨酸残基与小分子接头反应,将肽限制为刚性构象。自行车毒素结合物可用作药物分子的转运蛋白。药物附着在自行车肽上,以确保构象不受阻碍[233]. 多种自行车疗法已进入针对特定肿瘤的临床试验[234]表 5。
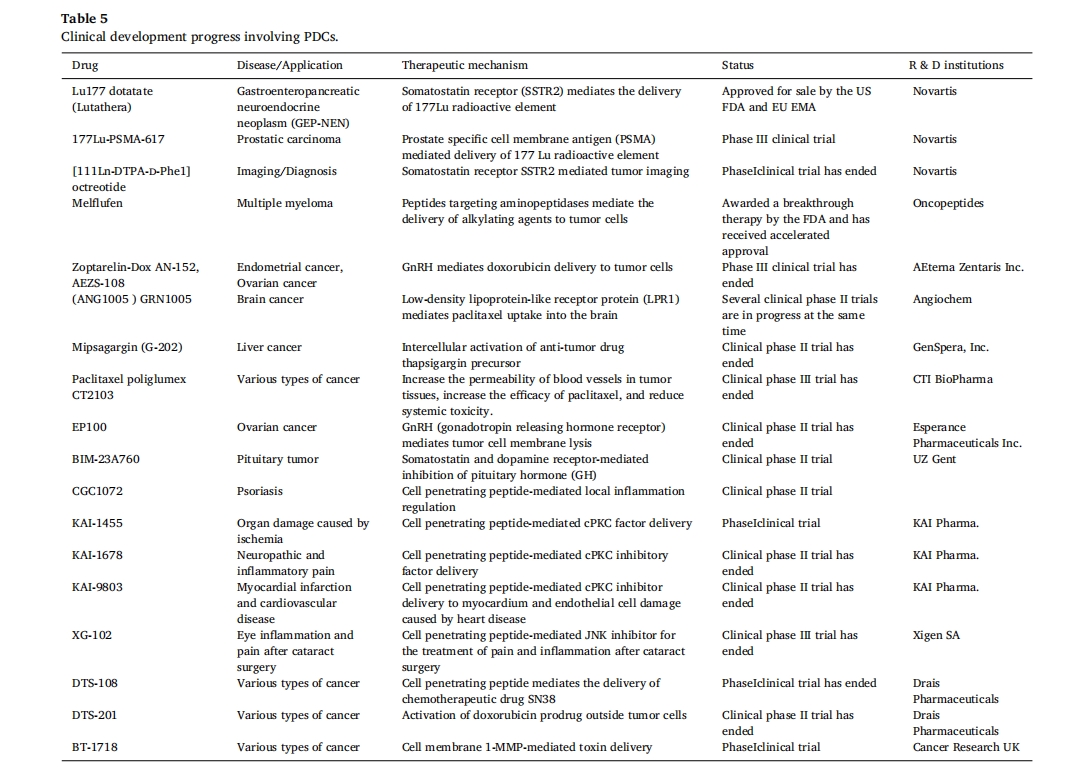
总结了美国FDA网站上发表的涉及PDCs的临床研究进展报告(https://www.fda.gov/)。
5 结论和未来展望
本综述强调了PDC作为构建改进的智能药物输送系统的多样化工具的潜力,包括其易于合成、功能多变、药物负载广泛、形态多样性和可调性。与ADC相比,由于肽区和连接片段的出色多功能设计,PDC具有更多的机会和可能性。尽管具有这些优势,PDC在进入临床时仍面临许多挑战。主要挑战之一是其稳定性差和肾脏清除速度快。PDC必须在循环中保持稳定,以防止细胞毒性有效载荷的预先释放和随之而来的全身暴露。为了治疗实体瘤,通常需要更长的PDC循环时间,以便有足够的时间将PDCs递送至恶性组织并穿透。NP封装的PDCs和PEG化代表了延长PDCs在体内半衰期的有吸引力的策略。除了传统的剂型和给药途径(如静脉或肌肉注射)外,还应探索新的给药策略,如鼻腔和舌下PDC给药,以避免PDC降解。在抗菌领域,虽然在设计和优化更有效的抗菌肽或药物方面取得了越来越多的成就,但设计PDCs以选择性地靶向特定种类的细菌而不是广谱细菌仍然是一个关键挑战。限制PDC研究的另一项关键技术是缺乏用于PDC测试的专有药代动力学方法。开发高效的PDCs需要设计出具有多种功能的功能肽,利用人工智能系统的海量数据分析能力,探索组装形貌与氨基酸类型和序列之间的关系,实现PDCs自组装结构和药物释放的精准调控。促进PDCs的科学转化,还需要在合成技术上做出努力,包括控制杂质、保证药物的稳定性等。实现PDC自组装结构和药物释放的精准调控。促进PDCs的科学转化,还需要在合成技术方面下功夫,包括控制杂质、保证药物的稳定性等。实现PDC自组装结构和药物释放的精准调控。促进PDCs的科学转化,还需要在合成技术方面下功夫,包括控制杂质、保证药物的稳定性等。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。