
摘 要 近年来,多肽自组装因其结构多样性及在生命科学领域中良好的应用前景而逐渐成为人们研究的热点。本文总结了目前国内外多肽自组装方面的研究进展,并对肽类自组装形成的多种形态结构进行了介绍,同时也就自组装机制和影响因素进行了分析和探讨。
分子自组装现象在自然界中十分普遍,在生物进化以及维持物种多样性方面起着重要作用,已经成为多学科的交叉点。肽类分子自组装材料由于其良好的生物相容性,近年来备受关注。肽分子源于生物体,其基本结构单元是α-氨基酸,在体内可降解,代谢终产物无毒,因此在材料科学、生物医药及临床医学等领域都有广阔的应用前景。
1 肽类自组装的机制及其构象变化
构成多肽和蛋白质的天然α-氨基酸有20种,除 甘氨酸外,其余均为手性分子,L构型,具有相同的 基本骨架结构,差别在于α-碳原子上的取代基不同。通过对肽序列的设计以及对肽链的修饰可以实现对 多肽自组装的控制,在新材料研究开发中具有重要 意义。多肽分子之间可通过非共价键作用自发地形 成稳定结构。亲疏水作用、氢键、静电等分子间作用 力虽然较弱,但其相互协同仍能形成稳定的高级结 构。肽分子之间通过亲水或疏水区域的相互作用可以产生不同的聚集态结构,如胶束、囊泡、纤维和纳米管等[1—3]。调节亲疏水氨基酸的种类、数量、位置等可以得到不同形态的自组装体。肽分子也可以被疏水性的烷基链修饰形成两亲性分子进行自组装,疏水烷基链之间的相互作用是两亲性肽自组装的主要驱动力,对稳定二级和三级构象起着重要的作用[4—10]。肽分子之间的静电相互作用也是自组装体形成的重要因素,带电荷的氨基酸残基之间相互作用、介质的离子强度都对自组装产生影响[11—14]。氢键在肽分子之间很常见,有一定的方向性,肽分子主链上酰胺键以及侧链功能基都易形成氢键,使其具有一定的构型特征,分子间的氢键可以稳定自组装体的构型[15—17]。
多肽分子的常见构象包括α-螺旋、β-折叠、β-转角等,自组装可使多肽分子的构象发生变化。一种16肽Ac-ADADADADARARARAR-NH2 (DAR16-Ⅳ)在温度升至70℃以上时,构象由β-折叠不经过无规 卷曲状态直接变成稳定的α-螺旋结构,且该过程动 力学不可逆[18]。原因可能是温度升高破坏了原本 自组装形成的β-折叠结构的水凝胶[19] ,而具有电荷取向性的α-螺旋结构对新形成的构象有稳定作用。同理,改变溶液的pH值也能使该肽的构象发生变 化。pH值降低,天冬氨酸的侧链羧基质子化,失去 分子间的电荷相互作用,也会打破稳定的离子互补 型β-折叠结构的自组装体,所形成的α-螺旋结构,即 使在低浓度下仍会保持稳定。相反,与DAR16-Ⅳ结 构相似的Ac-AKAKAKAKAEAEAEAE-NH2 (KAE16- Ⅳ)和Ac-AEAEAEAEAKAKAKAK-NH2 (EAK16-Ⅳ)在加热时则不发生从β-折叠至α-螺旋的突变,这可 能是由于这两种肽可形成非常稳定的β-折叠自组装 体,在加热条件下无法打破,而单一DAR16-Ⅳ形成 的自组装体的稳定性则较弱[18]。这种从β-折叠至α-螺旋的构象转变对研究某些神经性疾病的发病机 制很有意义。序列稍短的肽Ac-AEAEAEAEAKAK- NH2(EAK12-d)和氨基酸序列颠倒的Ac-DADADAD- ARARARARA-NH2(DAR16-Ⅳ*)也会在某些条件下 发生从β-折叠至α-螺旋的构象突变;而序列稍长的 肽Ac-ADADADADARARARARADADADADARARA- RAR-NH2(DAR32-Ⅳ)虽具有β-折叠和α-螺旋两种构 型,但只能是从HPLC中分离出两种不同构象的肽, 不能由一种构象直接转变成为另一种[20]。
多肽自组装过程中可能出现不同于初始及最终构象的中间体。Zhang 等[21] 研究了八肽 Ac-FKFEFKFE-NH2 (KFE8)自组装的过程中出现的一种左手螺旋条带状的中间体,这种中间体出现在自组装的初期,最终消失。肽刚溶解在水溶液中时,具有典型的β-折叠结构,但随着时间的增加,反平行的β-折叠结构逐渐取代平行的β-折叠结构。他们认为这种中间体的出现是由于肽骨架上氢氧原子不对称分布阻碍了分子间氢键的形成,单螺旋的β2折叠条带不够稳定,两条β2折叠的条带将疏水部分夹在中间,形成左手双螺旋的β2折叠结构,最终自组装成纤维状结构。Caplan等[22,23]用DLVO理论预测了KFE系列肽在改变氨基酸的疏水性、侧链电荷性质和重复序列对自组装行为的影响以及盐浓度对临界聚集浓度的影响,并用实验进行了验证。
Ganesh等[24,25] 研究了CH3 (OCH2CH2)3OCH2CO(ILe)3OCH3 (A)和CH3 (OCH2CH2)3OCH2CO(ILe)3NH(CH2CH2O)3CH3 (B)两种被化学修饰的短肽在甲醇中的自组装。两种肽在较低浓度时均为无规和α-螺 旋的混合构象,浓度升高时α-螺旋构象比例随之升 高。当甲醇浓度逐渐降低时,含有更多极性基团的 B比A更易形成构象的转变,β-折叠构象比例急剧 增加,其构象为翻转的反平行β-折叠,而A为平行 的β-折叠。在凝胶状态时,氢键是自组装过程中的 主要驱动力,A形成刚性棒状非交联的结构,而B形 成松散、有交联结构、类似淀粉样蛋白的纤维状聚集 体。Yamada小组[26]详细研究了疏水烷基链修饰的 三肽自组装体的构象。通过调节三肽的氨基酸以及 修饰的烷基链的数目、位置和溶剂等因素可形成平 行及反平行的β-折叠结构自组装体,并通过将两条 方向相反的两亲性肽混合得到反平行的结构。Dublin等[27]报道了多肽TZ1H在pH值高于组氨酸 的pKa 时,组氨酸去质子化,形成类似异亮氨酸拉 链的结构,可形成三股卷曲螺旋构象;在pH值低于 组氨酸的pKa 时,由于质子化的组氨酸电荷斥力的 作用而不能形成三股卷曲螺旋构象。在银离子存在 时,通过银离子与组氨酸的相互作用也能诱导肽形 成三股卷曲螺旋结构,并随银离子浓度的增加,螺旋 构象的比例逐渐增大,且此过程具有可逆性。Przybyla等[28] 报道的[ProHypGly]4 [ProLys(bipyridyl) Gly][ProHypGly]4 肽链是将胶原蛋白中常见序列 ProHypGly中的一个羟脯氨酸换成了双吡啶基修饰 的赖氨酸,这种肽上的双吡啶基与二价铁离子之间 的配位作用可以使三重螺旋结构进一步聚集形成胶 原纤维簇。
2 多肽自组装的结构多样性
1993年,Zhang等[11,12]报道了一种16肽Ac-AEAEAKAKAEAEAKAK-NH2(EAK16-Ⅱ)在盐诱导下可自组装形成稳定的膜结构。肽链中疏水的丙氨酸与亲水的谷氨酸和赖氨酸交替排列,谷氨酸和赖氨酸具有电荷互补性,在盐诱导下形成高稳定性的膜,在水溶液中具有典型的β-折叠构象。这种自组装主要是分子间静电相互作用的结果,在水溶液中丙氨酸残基位于一侧,谷氨酸和赖氨酸位于另一侧,肽分子之间交错形成离子键,丙氨酸的侧链通过疏水相互作用咬合在一起,形成稳定的膜结构。这种自组装受外界离子(特别是一价金属离子)的影响很大,这可能是由于一价金属离子的尺寸适合参与膜的形成。肽链的长度也会影响自组装,EAK12可形成少量的膜结构而EAK8则不能形成膜结构。这种自组 装膜可以作为一个模型,对于一些由肽自组装所产 生的疾病研究有重要意义,比如淀粉样蛋白形成互 相缠结的纤维结构引起的Alzheimer 症等[11]。EAK16-Ⅱ和另一种肽Ac-RARADADARARADADA-NH2(RAD16-Ⅱ)在水溶液中都具有β-折叠结构,均 可通过一价金属离子诱导形成稳定的膜结构。RAD16-Ⅱ也具有与EAK16-Ⅱ相类似的性质,从结构 上看,精氨酸与天冬氨酸代替了谷氨酸与赖氨酸,并 且电荷顺序也与EAK16-Ⅱ相反。这两种肽自组装 形成的膜对于多种哺乳动物的细胞都有较强的吸附 作用[29]。Biesalski等[30]研究的一种两亲性肽可以在 空气和水的界面上经紫外引发聚合形成单层膜,这 种膜在转移到疏水性的云母基底上后,鼠纤维原细 胞可在其上吸附并且扩散。一些结构类似于表面活 性剂的肽也可以在某种条件下形成膜状的聚集 结构[3]。
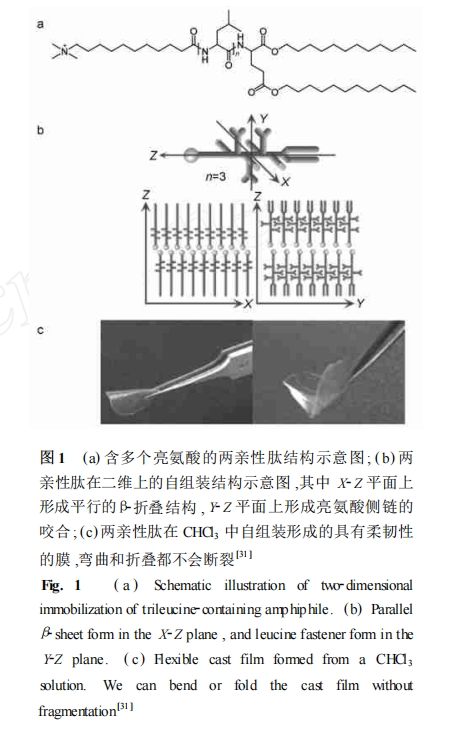
可自组装形成纳米管或纳米囊的多肽一般是结构类似于表面活性剂的肽。这类肽分子通常含有7—8个氨基酸,和表面活性剂一样有亲水的头部和 疏水的尾部。其头部可以是带负电荷的天冬氨酸、谷氨酸,也可以是带正电荷的赖氨酸、组氨酸或精氨 酸,尺寸约2.5nm,接近天然的磷酯。这些肽虽然结构序列不同,但有一个共同的特性:头部都含有1—2个亲水性的氨基酸,尾部含有4个以上连续的疏 水性氨基酸。表面活性剂类肽头部和尾部的氨基酸 可替换为其他天然氨基酸或一些非天然的氨基酸。利用磷酯丝氨酸作为头部,丙氨酸和缬氨酸作为疏 水的尾部可以模拟磷酯在水中的自组装,具有不同 的临界聚集浓度。与普通脂质体不同,表面活性剂 类肽中的疏水性氨基酸侧链通过疏水相互作用以及 沿骨架方向的分子间的氢键紧密结合。

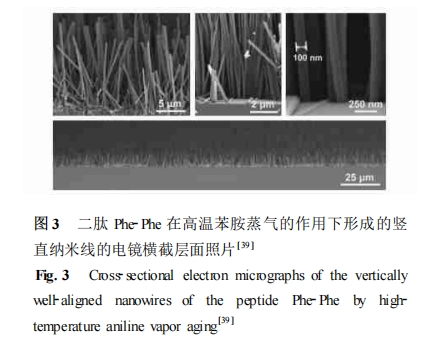
Biesalski等[40]研究了一种包含可与整联蛋白受体有特殊相互作用的RGD序列,并含有可聚合二炔脂肪链的两亲性肽的自组装。该两亲性肽与未修饰的含有二炔的脂肪酸在溶液中自组装,经过光照引发聚合形成稳定的囊泡。与特定的受体α5β1 相互作用后,能产生肉眼可见的颜色变化。Krysmann等[41]发现一种源自淀粉样蛋白β肽的序列KLVFF延长两个丙氨酸形成的肽AAKLVFF,在甲醇中可以 自组装形成β-折叠构象的纳米管,苯丙氨酸芳香基 团的相互作用在自组装中起主要作用。Lee等[42]将 十肽菌素脂化形成的两亲性肽,可以自组装成微米 级的管状结构,这种紧密排列的结构可以将酶结合 位点保护起来,避免被胰蛋白酶水解,在肽类药物的 递送以及一些不稳定的药物前体在特定位置的缓释 等方面有潜在应用价值。Bitton等[43]研究了可结合 DNA的两亲性肽的二级结构对其聚集行为的影响。该化合物包括三部分结构单元:可结合DNA 的 GCN4(KDPAALKRARNTEAARRSRA RKLQRMKQLE)区域,一个短的卷曲螺旋式的成核序列,可聚合的甲基丙烯酸的烷基尾部。在溶液中,这种两亲性肽形成螺旋状的条带或中空的管状物,结合DNA后形成层状结构,头部的特殊相互作用对自组装体的聚集状态有很大影响。
多肽最常见的自组装形式是纳米纤维 ,及由纤 维进一步形成的水凝胶结构 。这种肽自组装形成的 水凝胶通常含水量很高 ,在生物医学以及组织工程 中有很大的应用前景 。一些未被修饰的多肽或被疏 水烷基链修饰的多肽都可以在某些条件下自组装成 纤维或凝胶 。
可自组装成纳米纤维并进一步形成水凝胶的肽 有特殊的结构特点,一般有亲水面和疏水面两个表 面,可以在水溶液中形成稳定的β-折叠结构。疏水 面在水溶液中互相靠近屏蔽水分子,亲水面具有排 列规则的正负电荷重复序列形成互补的离子键促进 其自组装,分子之间还可以形成氢键加固自组装体。由于其亲水面和疏水面就象积木的孔和楔一样,可 以排列出不同的结构,因此被形象地称为“肽积 木”。由这类肽自组装成的三维纳米纤维支架可用 于细胞培养和再生医学的研究,或用于药物、蛋白质 及DNA等分子的递送[11] 。这类肽带电荷的氨基酸 排列顺序可分为以下几种模式:模式1,- + - + - + - + ;模式2,- - + + - - + + ;模式3,- - - ++ + ;模式4,- - - - + + + +等。这些分子在 水溶液中自组装成纳米纤维结构,并进一步形成由纤维组成的支架材料,孔径约5—200nm,其中一种Ac-RADARADARADARADA-NH2 (RAD16- Ⅰ) 已经成为商品化的生物支架材料(PuraMatrix)。此类多肽自组装形成的水凝胶含水量非常高,不仅能使细胞存活和移动,还能使生长因子和营养素等缓慢地扩散出入,是可控制细胞分化的理想细胞培养基质和再生医学及药物控制释放的理想材料。
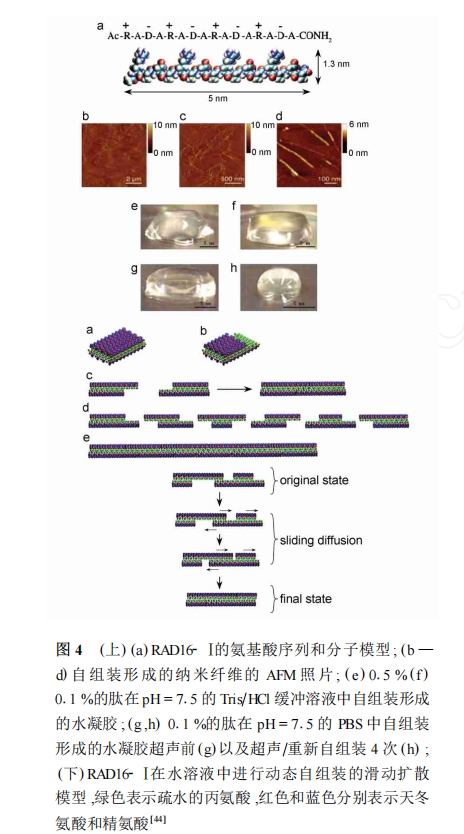
Hong等[13]报道了EAK16-Ⅱ和EAK16-Ⅳ两种肽在不同pH值下形成不同类型的自组装体。在pH值为6.5至7.5时,EAK16-Ⅳ形成球形自组装体而EAK16-Ⅱ形成纤维状自组装体;在pH值低于6.5或高于7.5时,EAK16-Ⅳ自组装体由球形转变为纤维状,而EAK16-Ⅱ自组装体则一直保持纤维状的结构,其原因可能是由于在中性环境中,EAK16-Ⅳ形成了β-转角的构象。全部由D型氨基酸组成的D-EAK16-Ⅱ也可以形成纤维状自组装体并进一步凝胶化,且形成的水凝胶含水量可达到99%。圆二色光谱显示D-EAK16-Ⅱ具有与L-EAK16-Ⅱ近乎对称的类似螺旋构象的图谱。D-EAK16-Ⅱ形成的自组装体可以有效地抵抗体内一些天然蛋白酶的降解作用,可以作为一种很好的组织工程支架来使用[54] 。
其他类型未经修饰的多肽自组装形成纤维和水凝胶也有诸 多报道。Tan 小组报道 了 Ac-RATARAEARATARAEA-NH2 (RATEA16)可以自组装形成pH敏感的水凝胶,含水量可达到99.5%。随pH值的变化,RATEA16肽溶液可以观察到溶液-凝胶-沉淀三种可逆的相变过程[14] 。这种pH敏感的水凝胶可以结合模型蛋白药物分子胰岛素,并在一定的pH条件下释放出来[55] 。Kisiday等[56] 研究了Ac-KLDLKLDLKLDL-NH2 (KLD12)自组装形成的水凝胶作为软骨细胞外基质以及细胞在水凝胶内的分裂。KLD12也是一种极性与非极性氨基酸交替出现的肽,且极性氨基酸带正负电荷的残基交替排列,类似于EAK和RAD的结构。包封在水凝胶内的软骨细胞经过四周的离体培养,不仅保持原来的形状而且产生了富集蛋白聚糖和Ⅱ型胶原蛋白的类似软骨的细胞外基质。随着培养时间的增加,材料的刚性也随之增加,这种肽自组装形成的水凝胶有望作为软骨细胞的细胞外培养基质在软骨修复中获得应用[56] 。
最近 , Zhou 等[57 ] 研 究 了 两 种 短 肽 Fmoc-FF 和 Fmoc-RGD 共组装形成的水凝胶 。两种肽通过 Fmoc 基团的π-π堆积形成稳定的β-折叠构象的柱状纤 维 ,纤维之间相互交织形成水凝胶 ,这种水凝胶可以 作为贴壁依赖性细胞的培养支架用于体内的组织再 生研究 。
肽分子经过化学修饰后 ,其性质和自组装行为 都会受到这些修饰基团的影响 。目前 ,研究最多的是经疏水烷基链修饰的肽 ,称为两亲性肽 。肽链部 分可以设计成含有多个生物活性序列的功能区域 , 使自组装体具有特定的功能 。疏水烷基链之间的相 互作用是两亲性肽自组装的主要驱动力 ,可以使两 亲性肽自组装成具有高度规则性界面的拟生态的 膜 ,提高稳定二级和三级构象的能力 , 促进细胞黏 附 、扩散 、移动 、增殖及分化 。
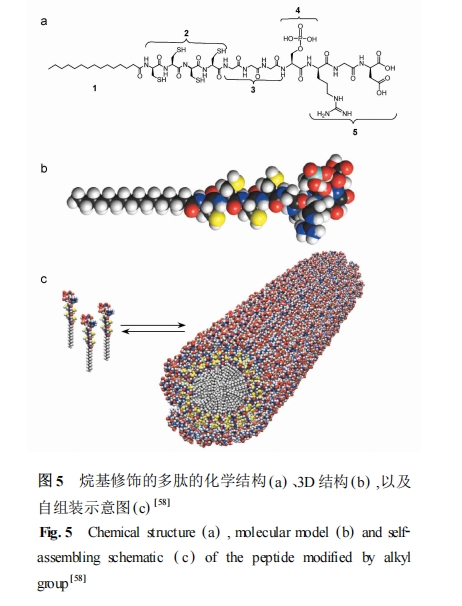
两亲性多肽的组成会对自组装结构产生较大影 响 。对于 CCCCGGGS(PO4) RGD 序 列 分 别 连 接 0 , 6 , 10 , 16 , 22 个碳的烷基链的两亲性肽自组装研究发 现 :烷基链碳数目为 10 以上的样品在浓度为 0. 25 % 时 ,缓慢酸化可以自组装形成水凝胶 ,但当这些分子 用二硫叔糖醇不完全还原或是被 I2 氧化 ,酸化则不 能形成凝胶 , 只能得到灰白色的沉淀 ; 10 —22 个碳 烷基链修饰的肽形成的沉淀可观察到浓密的网状纤 维 ;6 个碳烷基链修饰的样品只能观察到无规的聚集体 ;没有烷基链修饰的样品对 pH 不敏感 ,而含有 6 个碳烷基链的样品由于烷基链过短 , 不能形成组 装体 。当 10 —22 个碳烷基链修饰的肽被部分氧化 形成分子间的二硫键时不能形成凝胶 , 说明分子间 由于二硫键产生的构象变化对自组装有较大的影 响 。当用丙氨酸替换半胱氨酸后 , 带有 10 或 16 个碳烷基链的肽在浓度达到 0. 2 %或以上时都可以通 过酸化形成凝胶 , 说明半胱氨酸在凝胶的形成中没 有特殊作用 。但是 ,含有 10 个碳烷基链的肽更易形 成平行的纤维簇状结构 ,而含 16 个碳烷基链的肽则 不易出现平行的纤维簇[59 ] 。当均含有 16 个碳烷基 链修饰的下列 5 种肽序列 CCCCGGGS(PO4) ,CCCCGG- GS(PO4) KGE , CCCCGGGS(PO4) RGDS , CCCCGGGSRGD , CCCCGGGEIKVAV 无论是否具有细胞黏附作用 ,还 是含有不同的黏附基团 ,或是否进行磷酸化 ,都不会 影响纳米纤维组装体的形成 , 只是纤维的长度和强度有所差别[60 ] 。类似的两亲性肽 , 如 alkyl-C4 G3 S(P) RGD-COOH ,可以在多价金属离子诱导下 , 自组装形 成由纳米纤维组成的水凝胶 。在含有悬浮细胞的培 养液或人造的生理溶液中多价离子诱导下自组装形 成的水凝胶 ,可将细胞包封在水凝胶内 ,细胞可以在 其中继续存活至少三个星期 , 并可以繁殖增生[61 ] 。C 端含有支化的阳离子氨基酸 、阴离子氨基酸以及 RGDS 功能性序列 , 尾部含有烷基链的两亲性肽与 多臂碳纳米管相互作用 ,在一定的 pH 值范围内 ,可 以使碳纳米管包封在肽自组装形成的纤维内部 , 从 而增加了碳纳米管在水中的溶解性[62 ] 。肝素可通 过两亲性肽头部的 LRKKLGKA 序列与肝素分子上 特定区域的作用结合在自组装纤维的表面 ,将其原 有的β-折叠构象改变为与肝素结合后成为α-螺旋构 象 。复合物的自组装纤维加入生长因子可促进新血 管的形成[63 ,64 ] 。含有可促进神经突的生成及生长的 功能性头部序列 IKVAV 的两亲性多肽自组装形成 的支 架 可 以 使 神 经 元 细 胞 在 其 上 进 行 分 化[65 ] 。IKVAV 序列连接 1 个谷氨酸使之带负电荷 ,顺序连 接 4 个丙氨酸 ,3 个甘氨酸和 1 条含有 16 个碳的烷 基链形成两亲性肽 。这种两亲性肽在一定条件下自 组装形成的水凝胶 ,可作为三维的细胞培养以及组 织再生支架 。该两亲性肽在水溶液中自组装成纳米 纤维使具有生物活性的部分露置在表层 ,这些具有 很高的长径比以及表面积的纤维束形成三维的网状 结构 ,产生类似于水凝胶的固体 。当 1wt %的肽溶 液与神经祖细胞的悬浮液按 1 ∶1 混合时 , 几秒钟便 可形成凝胶状固体 ,将细胞封闭在其中 。该体系可促进神经元细胞快速分 化 , 且 具 有 一 定 的 细 胞 选 择性 。
带有不同电荷的两亲性肽之间可以通过电荷相 互作用进行共组装 。Stupp 小组研究了 16 个碳饱和 烷基链修饰的含两种相反电荷多肽之间的共组装 。含有酸性或碱性氨基酸的肽单独存在时只能在一定的 pH 值下 , 中和自身的净电荷后依靠疏水相互作 用自组装成柱状的胶束 。当两种相反电荷的肽共同存在时 ,在中性 pH 值下即可自组装成柱状的胶束 ,进而形成同时拥有两种功能基的纤维。这种组装形式说明 ,中性条件下自组装的驱动力主要是静电相互作用 ,而不是简单的疏水相互作用[66 ] 。两亲性肽形成的β2折叠结构与纤维的长轴平行 ,从疏水性的核内部放射性的堆积排列 ,其内部有序程度依赖于分子结构和肽序列。化合物的分子结构和肽序列的变化可以调节自组装形成纤维的物理生物学特性[67 ] 。Behanna 等研究了亲水端连接荧光基团的两 亲性肽与含互补电荷的不含荧光基团的两亲性肽的 共组装 ,这种共组装体系可以调节纳米纤维组装体 表面的荧光强度 ,生物活性分子 ( 如肝素) 可以方便 地结合在两亲性肽上 , 为研究材料与蛋白的相互作 用和设计新的生物活性材料提供了理论基础[68 ] 。他们还研究了含有自由 N 末端的两亲性肽和与其 电荷互补的含有自由 C 末端的两亲性肽的共组装 体系 。与常规的 N 末端修饰烷基链不同 , C 末端烷 基修饰的肽末端含有相反电荷的氨基酸序列 。当两 种带有互补电荷的肽链混合时 ,可以形成含有稳定 的β-折叠结构单一构型的共组装体 ,而单独存在的 情况下则不能形成 。这是因为相反电荷相互作用以 及烷基链末端的疏水相互作用导致体系可以形成β- 折叠的氢键[69 ] 。头部和尾部分别连接亲水性基团 而中间被疏水性的间隔臂隔开的两亲性肽分子 , 也 可以在水溶液中自组装成纳米纤维结构 。其中心的 核部分以及表面都是亲水的 ,而中间的链段是疏水 的 ,这种自组装体的形成主要依靠氢键作用[15 ] 。
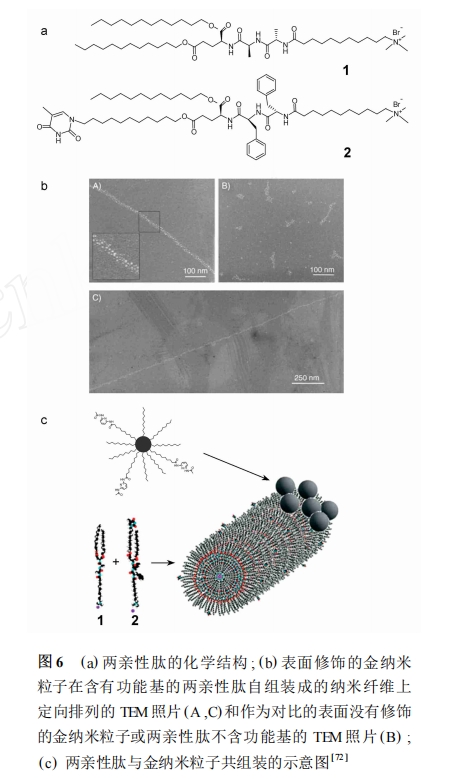
近来 ,研究者们将电子特性引入到两亲性多肽 中 ,使电子特性与生物活性相结合 ,为探索新的多功 能材料提供了新思路 。2008 年 , Stupp 小组[74 ] 研究 了将含有丁二炔的烷基链共价连接到肽尾部后形成 的两亲性肽的自组装行为 。他们发现 ,这种结构的 两亲性肽可以自组装成柱状纤维 , 并可以在某些条 件下形成水凝胶 。疏水性的烷基链在纤维的内部 , 经过紫外光照射可以形成聚丁二炔 ,这种双键与三 键交替出现的共轭体系具有特殊的电学特性 ,在外 观上显示出规则排列的 π-体系特有的蓝色 。在溶 液中或形成凝胶的状态下 ,两亲性的肽均处于一种 有序的排列状态 , 自组装成的柱状纤维在聚合后可 以保持聚合前的纤维状结构 。无论聚合前后 ,支化 的肽都比线性的肽聚合程度低 , 因为支化的肽在自 组装时纤维内部疏水性烷基链的密集程度不如线性 肽 。2009 年 ,Mata 等[75 ] 发现含有 RGDS 功能序列的 这类两亲性肽自组装体可通过二炔的聚合得到具有生物活性的微米尺度的水凝胶 ,这类具有显微结构 的水凝胶可用于成骨细胞的培养 。
Hartgerink 课题组[76 ] 研究了含有酶作用位点的 两亲性肽自组装的纳米纤维在酶作用下的降解 。两 亲性肽包括细胞介导的酶敏感部位 (GTAGLIGQ) ,C 端可结合钙离子的羧酸以及细胞黏附配体 RGDS。由于肽序列中含有特殊的基质金属蛋白酶切割位 点 ,使细胞可以介导纤维的蛋白质分解 ,从而获得移动的通道 。这种两亲性肽可以在钙离子的诱导下 , 在生理条件下自组装成由网状纳米纤维组成的水凝 胶 ,将细胞包封在内 。细胞产生的酶可使水凝胶发 生降解 ,使细胞获得空间进行扩散和移动[76 ] 。进一 步研究发现 ,一系列支化的头部含有细胞黏附功能 序列 RGDS ,尾部连接十六酸的两亲性肽均可在生理溶液或其他相关溶液 ( 如滑液或 DNA 等) 存在下 自组装形成纳米纤维 , 并进一步形成水凝胶 。对肽 链中的色氨酸进行荧光各向异性的检测发现 , 与线 性两亲性肽相比 ,支化的化合物上的色氨酸具有一定的移动空间 。支化的头部含有 RGDS 功能片段的 两亲性肽自组装成的纤维在细胞黏附以及扩散等方 面都优于线性的两亲性肽 ,这是由于支化的化合物自组装体的表面可以提供更多的可黏附细胞的活性 位点 ,并在空间上不是特别紧密堆积 ,使得体系具有 一定的移动空间 ,利于细胞的接近[77 ,78 ] 。这些支化的两亲性肽还可以在 PGA 组织支架上进行自组装 , 并在细胞培养环境中可保留在 PGA 支架上 , RGDS 功能肽片段位于支架表面 。研究表明 ,相对于线性 两亲性肽覆盖的支架和没有两亲性肽覆盖的支架而 言 ,人类的膀胱平滑肌细胞优先选择黏附在有支化 两亲性肽自组装纤维覆盖的区域 ,这个体系为膀胱 组织的再生提供了理论上的可能[79 ] 。
Ramani 等[80 ] 研究了聚 (L-组氨酸) 与十二烷基 苯磺酸复合物的自组装 。按化学计量的多肽与表面 活性剂形成的自组装体为层状结构 ,具有 Polypro Ⅱ 型的左手螺旋结构 。这种复合物形成的自组装体具 有明确的玻璃化转变温度 ( rg ) , 当自组装体升温至 rg 以上再冷却至原温度后 ,原层状结构中含有磺酸 基与肽的酰胺基之间形成的氢键作用消失 ,体系重 新排列形成更加有序的结构 。Sureshbabu 等[81 ] 研究 了淀粉样蛋白β-肽在十二烷基磺酸钠作用下形成的 球状聚集体结构 , 从而推测了 Aβ1 —42 与细胞膜中的 磷脂 相 互 作 用 后 构 象 发 生 改 变 的 机 制 。Imanishi 等[82 ] 研究了多肽与磷脂之间的共组装形成的双层 膜结构 ,疏水的具有α-螺旋构型的多肽在磷脂双层 膜中以螺旋轴垂直于双层膜表面的形式存在 。Paramonov 等[83 ] 报道了两亲性肽可以与磷脂分子共 组装形成纤维状结构 , 当磷脂分子的含量 (mol %) 达 到 5 %时 ,所形成凝胶的储能模量达到最大值 , 同时 平均残基椭圆率也达到最大值 。随着磷脂分子含量 的增加 ,两个值都急剧下降 ,虽然两者的混合物在磷 脂分子含量达到 75 %时仍能观察到纳米纤维状自组装体结构 , 但含量达到 20 %时 , 就已不能形成水 凝胶 。当其含量为 5 %时 , 恰好形成了最为稳定的 β-折叠结构 ,这说明 , 磷脂分子参与了自组装 , 且增 加磷脂分子的含量会破坏β-折叠结构 ,使形成的水 凝胶储能模量下降 。这种自组装形成的水凝胶是依 靠疏水相互作用以及氢键作用 , 当破坏了氢键作用 ,水凝胶的机械强度就随之减弱。两亲性肽在脂质体内部通过光引发也能自组装形成纳米纤维 ,这种体系有可能将具有生物活性的肽靶向递送到特殊的组织[84 ] 。Yuwono 等[85 ]研究了末端疏水烷基链修饰的两亲性肽催化的二氧化硅纳米管的形成。两亲性肽自组装形成纳米纤维 ,并可以诱导四乙氧基硅烷矿化 ,形成以肽纳米纤维为核 ,四乙氧基硅烷为壳的复合纳米纤维。经过焙烧除去肽后 ,可形成中空的二氧化硅纳米管 ,这种方法有望扩展到其他纳米材料的制备中。
3 影响多肽自组装的因素
pH 值或离子强度的改变可以使多肽上的氨基 酸侧链的电荷性质发生变化 , 从而对其自组装行为 产生影响[11 —14 ,27 ,29 ,59 ,73 ,86 —88 ] 。Schneider 等[86 ] 报 道 了 一 种 肽 VKVKVKVKVDPPTKVKVKVKV-NH2 ( MAX1) 的自组装行为对溶液 pH 值的依赖 。肽链主要由具 有高度β-折叠倾向的缬氨酸和赖氨酸组成 ,在碱性 条件下肽链 9 —12 位的 VD PPT 序列采取 Ⅱ′型的翻 转构象 ,亲水性的赖氨酸和疏水性的缬氨酸交替排 列 ,整个分子具有β-发夹结构 ,这种分子内的折叠结 构可以促进分子间自组装形成水凝胶 ;在酸性条件 下 , 由于赖氨酸残基上的氨基被质子化而带电荷 ,分 子间的静电斥力使这种折叠结构被破坏 , 不能自组 装成水凝胶 。这类水凝胶可用于包封模型药物分 子 ,通过调节多肽的浓度或对肽序列进行调整可改 变凝胶的孔径 , 进而调节药物分子的释放速度[89 ] 。Guler 等[87 ] 将模型分子芘共价连接在两亲性肽的疏 水链端 , 在 pH = 4 时化合物呈现无规卷曲的状态 , 当 pH= 10 时 , 含亮氨酸的两亲性肽自组装形成纳 米纤维 ,将芘分子包封在纤维内部 , 芘分子规则排 列 。如果将亮氨酸替换成了脯氨酸 , 由于失去了分 子间氢键的作用 ,不能自组装成柱状纤维 , 只能形成 球形胶束 , 芘分子排列与 pH = 4 时相同 。将 RGDS 肽序列连接在亲水端 ,将胆固醇或十六酸连接在疏 水端 ,这些两亲性肽与芘混合后都可以自组装成纳 米纤维 ,芘则被包封在纤维内部 。这个体系有成为新的疏水性药物靶向递送载体的可能 。支链含有胸 腺嘧啶肽核酸的两亲性肽 (KK( KTTTTTTTK) GGGA- AA( K) OCC15 H31 ) 也能在不同 pH 值下表现出不同的 自组装行为 。当 pH = 4 时 , 肽核酸P两亲性肽溶于 水 ;当 pH = 7 时 , 体系变成由网状自组装纤维组成 的凝胶态 。带有胸腺嘧啶的肽核酸与两亲性肽形成 的缀合物可自组装成纳米纤维 ,其中肽核酸部分与 互补的寡聚核苷酸结合 ,其结合力比相应没有形成 缀合物的肽核酸更强 。这种自组装形成的材料可用于 RNA 干 扰 研 究 , 以 及 mRNA 分 离 和 纯 化 等 领 域[88 ] 。他们还将支化的两亲性肽和线性的两亲性 肽用生物素进行修饰 ,研究了它们自组装形成的纳 米纤维与亲合素之间的相互作用 。与线性的两亲性肽形成的纤维相比 ,支化的两亲性肽形成的纤维由 于空间效应 ,排列不够紧密 ,提供了更多的表位用来 结合亲合素受体[90 ] 。Pires 等[91 ] 报道了一种 N 端和 C 端分别被氮基三乙酸和两个组氨酸修饰的 , 具有 胶原三股螺旋结构的肽在金属离子诱导下形成的球 状自组装体 。在二价金属离子存在下 , 多肽通过与 金属离子之间的配位作用形成微米级的聚集态结 构 ,在金属离子螯合剂 EDTA 存在时 ,该自组装过程 可逆 。
温度对多肽自组装体的形成以及自组装类型的改变起着重要的作用[5 ,6 , 18 ,92 ,93 ] 。一般来说 , 温度升高将破坏体系中的氢键 ,使自组装体的构象发生变化 ,从而影响自组装体的稳定性 。Schneider 等[92 ] 报 道了 MAX1 和将 MAX1 的 7 , 16 位上的缬氨基替换 成苏氨酸 的 两 种 肽 VKVKVKVKVD PPTKVKTKVKV- NH2 ( MAX2 ) , VKVKVKTKVD PPTKVKTKVKV-NH2 (MAX3) 自组装形成温敏性的水凝胶 。其中 MAX3 序列在温度由 5 ℃升至 80 ℃时 ,分子内先发生折叠 , 然后自组装成水凝胶 , 温度降至 5 ℃时又变成非折 叠的状态 ,过程可逆 。当 7 位和 16 位上的苏氨酸替 换成疏水性更强的缬氨酸后 , 凝胶化的温度升高 。当用L-脯氨酸替换 10 位的D-脯氨酸后 , 由于不能形 成β-转角构象 , 在相同条件下不能凝胶化 。MAX2 和 MAX1 虽然可以凝胶化 ,但与 MAX3 相比凝胶化 的过程没有可逆性 。Yu 等设计了含有胶原模型肽 序列头部和双烷基链尾部的两亲性肽[5 ,6 ] ,这种肽在 水中可自组装成类似于 Polypro Ⅱ型的三股螺旋结构 。氢键作用是三股螺旋结构组装体形成的主要原 因 , 因此自组装受温度的影响很大 , 当以疏水烷基链 修饰后 ,烷基链的疏水相互作用可以大大提高自组装体的稳定性 。对于 ( Gly-Pro-Hyp) 4-[ IV-H1 ]-( Gly- Pro-Hyp) 4 这个可以形成三股螺旋结构的序列来说 , 烷基 链 的 修 饰 对 于 结 构 稳 定 性 的 提 高 至 关 重 要 ( IVH1 的序列为 GVKGDKGNPGWPGAP) 。以黑色素 瘤细胞作为模型系统的研究表明 , 由上述结构的两亲性肽自组装成的层状结构可促进细胞黏附和扩散 ,并可诱导细胞的信号传导 。
本质上,肽的一级结构是肽自组装成高级结构的功能基础,多肽中某个位置氨基酸的改变或是用于修饰多肽烷基链的长短、位置、构型等都会对多肽的自组装行为产生影响 。Hartgerink 研究组[17 ] 通过 研究一系列被 16 个碳烷基链尾部修饰的两亲性肽 的自组装 ,揭示了肽链中具体位置上氨基酸形成的 氢键对自组装的影响 。两亲性肽的结构式为(C15 H31 CO) GGGGGGGERGDS , 当靠近疏水性烷基链的 1—4 位置进行选择性的甲基化则不能自组装成纳米纤 维 ,说明 1 —4 位置的氢键对于形成纤维状结构有非 常重要的作用 。1—4 任何一个位置的 G 替换成具 有手性的 A 时 , 圆二色光谱研究表明 , 1 —4 位置的 氨基酸与邻近位置的氨基酸形成的氢键构象为β-折 叠 ,方向沿着纤维的 z 轴 ,对于形成长的纳米纤维自 组装体非常重要 ,破坏这些氢键则不能形成纤维状 自组装体 ,而是形成球形胶束或无规聚集 。与纳米 纤维的核距离较远的氨基酸对构象没有影响 ,对于 稳定自组装的纳米结构以及形成宏观的水凝胶结构 的影响也不大 。
Yu 等[10 ] 研究了单烷基链修饰的两亲性肽烷基 链的长度对于自组装体构象稳定的影响 。当单烷基 链的碳原子数从 0 逐渐增加至 16 时 ,其构象从三股螺旋 到无规卷曲的转变温度从35. 6 ℃增加至69. 8 ℃。Forns 等[94 ] 研究了具有三重螺旋构象的肽 序列( Gly-Pro-Hyp) 4-[ IV-H1 ]-( Gly-Pro-Hyp) 4 和α-螺 旋构象的肽 KAEIEALKAEIEALKA-NH2 ( 16r) 被不同 碳数的烷基链修饰对自组装体性质的影响 。16r 本 身在溶液中不能形成特殊的构象结构 , 但被 C6 和 C16 烷基链修饰后可形成α-螺旋结构 , 并且 C16 修 饰的 16r 比 C6 修饰的热稳定性高 ,这与碳链诱导聚 集相关 ,长的碳链之间的相互作用使自组装体结构更稳定 。( Gly-Pro-Hyp) 4-[ IV-H1 ]-( Gly-Pro-Hyp) 4 也 得到了类似的结果 ,这说明在某种程度上引入烷基链诱导自组装 ,提高其稳定性的方法具有一定的普 适性 。IVH1 可形成三股螺旋构象结构 ,而重复序列Gly-Pro-Hyp 对三股螺旋构象起稳定作用 。研究发现 当用 一 条 或 两 条 烷 基 链 修 饰 ( Gly-Pro-Hyp) 4-IVH1 时 , 自组装体的几何形状与烷基链的长短以及温度 有关 。单烷基链修饰的肽均形成球形胶束 ,两条烷 基链修饰的肽当烷基链碳数为 12 、14 时也形成球形 胶束 ,但当碳数为 16 、18 、20 时则形成盘状胶束 , 并 且相互堆积形成扩展的带状结构 。温度对于自组装 体的几何形状影响很大 , C18 与 C20 链的结晶可以破 坏头部三股螺旋结构[93 ] 。L.wik 等[95 ] 详细研究了疏水尾部的长度对两亲性肽 Cn-GANPNAAG 自组装行 为及所形成自组装体二级结构的影响 。GANPNAAG 序列是源自疟原虫的环子孢子蛋白 , 具有β-折叠结构 。疏水相互作用和氢键是该两亲性肽自组装的两 种主要控制因素 ,其聚集和形成的高级结构可受 N 端修饰的烷基链的长度影响 。自组装体形成稳定的 类似β-折叠的结构 ,这种疏水作用力由于高级结构 的形成又被进一步加强 。C16 修饰的两亲性肽甚至 加热至 90 ℃仍能保持类似的β-折叠结构 。他们还 将具有β-折叠结构的肽序列 KTVIIE 的 C 端和 N 端 分别修饰不同碳数目的烷基链 ,研究了自组装体的热稳定性 。当烷基链的碳数目达到 12 或 12 以上 时 ,所形成的自组装体热稳定性较强[96 ] 。其他因素 也可能影响多肽的自组装行为 , 因篇幅所限在此不 再赘述 。
肽类自组装材料由于其良好的生物相容性 ,非常适合作为医用材料 , 因此 ,在生物医学领域有广阔 的发展空间和应用前景 。肽类的自组装虽已是炙手 可热的研究领域 ,但仍有很多问题需要研究 ,很多机 理尚需阐明 。肽类自组装材料还存在价格昂贵 ,制 备困难等问题 ,在一定程度上制约了其应用 。尽管 如此 ,肽类自组装形成的新材料仍然极有希望成为 新一代的生物材料 , 为材料化学以及生物技术领域 注入了新的活力 , 从而引发材料科学领域革命性的改变 。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。