
摘要 以高活性两亲性α-螺旋型阳离子抗癌肽A12L/A20L(多肽P)为模板,在其亲水面进行氨基酸定点取代,获得了一系列带有不同净电荷的多肽类似物,研究了净电荷对螺旋型抗癌肽生物活性的影响. 结果表明,抗癌肽净电荷的改变对其溶血活性影响较小(最大差异为2倍),而对抗癌活性和选择性的影响显著(最大差异为10倍). 抗癌肽P的净电荷最适范围为+7到+8,分子间静电排斥作用的最佳数目为3~5个,高于或低于此范围,其抗癌活性和选择性均明显降低. 与人的正常细胞相比,负电性的癌细胞膜对于抗癌肽的净电荷变化更敏感,表明两亲性螺旋型抗癌肽针对癌细胞与正常细胞表现出良好的选择特异性.
目前,癌症已经成为人类健康和生命安全的最大威胁. 由于传统抗癌药物的低选择性、不同程度的副作用及癌细胞通过自身变异以及环境、药物诱发其变异导致癌细胞产生抗药性,在很大程度上加剧了人类对新型抗癌药物需求的紧迫性. 研究结果表明,很多阳离子抗菌肽(Antimicrobialpeptides,AMPs)不仅具有高效的杀菌作用,还具有抗癌及抗病毒活性[1,2]. 具有抗癌活性的阳离子肽被称作抗癌肽(Anticancerpeptides,ACPs). 抗癌肽以高度保守的细胞膜为作用靶点,通过破坏细胞膜的完整性杀灭癌细胞,针对癌细胞表现出高效、广谱的活性及特异性,这为新型抗癌药物的研究提供了新方向.
抗菌肽的种类繁多,具有抗癌活性的抗菌肽大致分为2类[1] :(1)能有效杀灭细菌和癌细胞而不杀伤正常细胞的多肽;(2)对细菌、癌细胞和正常细胞都有毒性的多肽. 尽管不同抗癌肽具有高度的异源性和较大的二级结构差异,但它们仍然具有正电性、疏水性和两亲性等共同特征[1,3]. ACPs通过其正电荷与带负电的癌细胞膜发生静电吸附,再利用其两亲性的结构特点,通过疏水面与细胞膜磷脂的疏水相互作用,引起细胞膜的裂解或细胞凋亡而发挥抗癌作用[4,5]. 影响抗癌肽作用的因素很多,包括多肽的氨基酸序列、电荷、两亲性、疏水性、二级结构、多肽浓度和细胞膜组成等,这些因素对抗癌肽的生物活性具有重要影响.
迄今,关于电荷对抗癌肽生物活性影响的研究鲜见报道. 本文以前期工作[6]获得的高活性抗癌肽A12L/A20L为模板,命名为母肽P,从电荷角度出发,在保持其疏水面不变以维持其高疏水性的同时,通过在其亲水面进行丝氨酸或赖氨酸相互替换,使多肽的净电荷升高或降低,研究了净电荷变化对抗癌肽生物活性的影响. 本文结果对进一步提高抗癌肽的靶向选择性,设计出高效低毒的抗癌肽药物具有一定的指导意义.
1 实验部分
HeLa 299 人宫颈癌细胞株购自美国 ATCC 细胞库 ; 血红细胞用新鲜血液提取.
LC-20A分析型高效液相色谱仪和LC-6A制备型高效液相色谱仪(日本岛津公司);SW-CJ-2D超净工作台(苏州安泰净化设备有限公司);LDZX-30FB型立式电热压力蒸汽灭菌器(上海申安医疗器械厂);MCO-15ACCO2 培养箱(日本Sanyo公司);IMT-2倒置显微镜(日本Olympus公司);ZD-85A恒温振荡器(江苏金坛荣华仪器厂);GF-M3000酶标仪(山东高密彩虹分析仪器有限公司);FD-1D-50真空冷冻干燥机(北京博医康实验仪器有限公司);96孔板;Enppendof可调移液器;细胞计数板等.
1 . 2 . 1 多肽的合成与纯化 采用 Fmoc 固相多肽合成法合成多肽序列[7] . 合成的多肽通过反相高效液 相色谱进行分离纯化 , 经冷冻干燥后的多肽样品纯度可达 95% 以上. 多肽样品通过电喷雾质谱和氨基 酸组成分析进行定量确证后 , 进行生物物理及生物活性测定[8] .
1 . 2 . 2 多肽疏水性和二级结构的测定 在 25 ℃ 下 , 采用反相高效液相色谱分析多肽纯品 , 以保留时 间表示多肽的相对疏水性. 色谱条件参见文献[6] . 在 25 ℃ 下 , 使用石英比色杯测定多肽的圆二色光 谱以表征其二级结构. 使用平均残基摩尔椭圆率[ 兹]估计多肽的二级结构 , 采用 a-螺旋特征峰 222 nm 下的[ 兹] 值计算多肽的相对螺旋性. 具体方法参见文献[6] .
1 . 2 . 3 抗癌活性测定 采用 MTT 法检测抗癌肽对人宫颈癌细胞 HeLa 的体外杀伤作用[6] .
1 . 2 . 4 细胞毒性( 溶血活性) 测定 参见文献[6] 方法测定抗癌肽对人血红细胞的细胞毒性.
2 结果与讨论
在前期工作[6] 中 , 系统研究了疏水性对螺旋型抗癌肽生物活性的影响 , 通过扫描电子显微镜及共 聚焦显微镜对其抗癌机理进行了初步的研究. 为进一步了解抗癌肽的抗癌作用过程 , 本文以前期工作 中得到的高活性抗癌肽 A12L/A20L 为模板多肽 P , 从电荷角度进行改造 , 设计了带有不同电荷的抗癌 肽类似物. 在多肽的设计过程中 , 为保证抗癌肽发挥抗癌作用所需的较高疏水性 , 保持其疏水面不变 , 选取其亲水面进行氨基酸定点取代以实现多肽净电荷的升高或降低. 在增加净电性的多肽组中 , 采用 赖氨酸取代亲本的丝氨酸来完成 , 设计出 3 个单取代多肽( S4K , S11K , S25K) 、2 个双取代多肽( S4K/ S11K , S11K/S25K) 和 1 个三取代多肽( S4K/S11K/S25K) , 多肽的净电荷从亲本的+7 升高到+10 ; 在 降低净电性的多肽组中 , 采用丝氨酸取代亲本的赖氨酸 , 设计出单取代多肽( K14S) 、双取代多肽 ( K10S/K14S) 和三取代多肽( K7S/K10S/K14S) 各 1 个 , 多肽的净电荷从亲本的+7 降低到+4. 实验中 的具体多肽序列如表 1 所示. 图 1 为所设计的多肽的螺旋网状图.


2 . 2 抗癌肽的二级结构
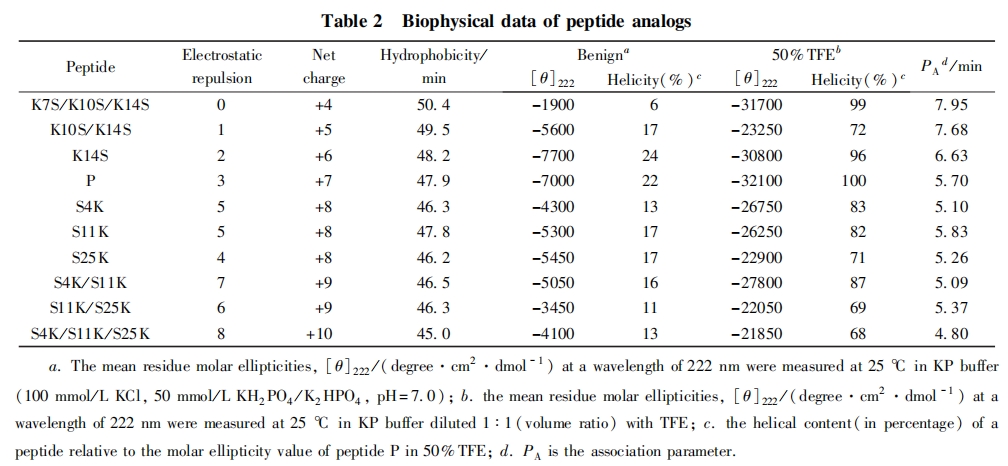
多肽的二级结构通常利用圆二色光谱来表征,实验中采用KP缓冲液和含50%(体积分数)TFE的KP缓冲液分别模拟温和的亲水环境和细胞膜的疏水环境. 图2为多肽在不同环境中的圆二色光谱图. 可见,在亲水环境中,大多数多肽只形成轻微程度的螺旋结构或以无序结构存在;而在疏水环境中,所有多肽的螺旋程度均明显增强,表现出典型的α鄄螺旋结构特征吸收峰(195~200nm的正吸收峰,208和222nm很强的负吸收峰). 以222nm处的摩尔椭圆率数值为指标,定义疏水环境下摩尔椭圆率最大的模板肽P的螺旋度为100%,计算出其它多肽的相对螺旋度,所得数据列于表2.
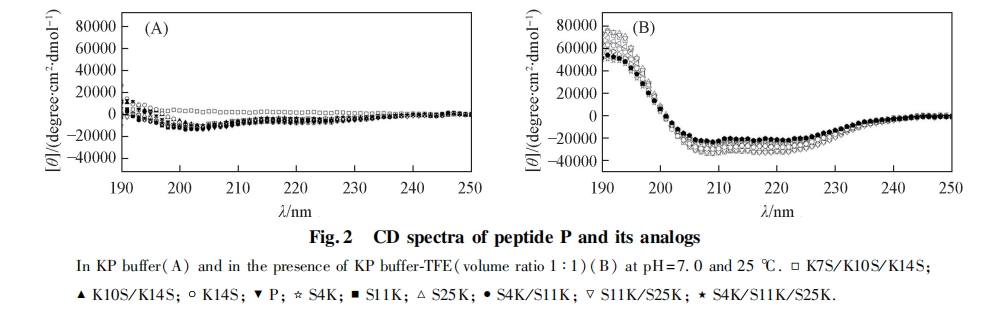
多肽的二级结构数据表明,螺旋型抗癌肽在疏水环境中被诱导产生了典型的a-螺旋结构.当多肽的净电荷由+7增加到+10时,多肽分子内的静电排斥作用数目由3个升高到8个,多肽的相对螺旋度总体降低,净电荷为+10时达到最低.相反,多肽的净电荷由+7降低到+4,多肽分子内的静电排斥作用数目由3个降至0 个,多肽的螺旋度整体维持在高水平,与高净电荷组相比,表现出更完整的螺旋.这可能是由于分子内部正电性氨基酸之间的静电排斥作用影响了多肽折叠和a-螺旋的稳定性
2 . 3 抗癌肽的相对疏水性和分子自我相互作用能力
多肽与反相高效液相色谱(RP-HPLC)非极性固定相(脂肪族烷基链结合在硅基质支持物上)之间的疏水相互作用对多肽的构象变化具有很高的灵敏性, 因此,利用多肽在反相高效液相色谱上的保留行为可以测定多肽的相对疏水性.
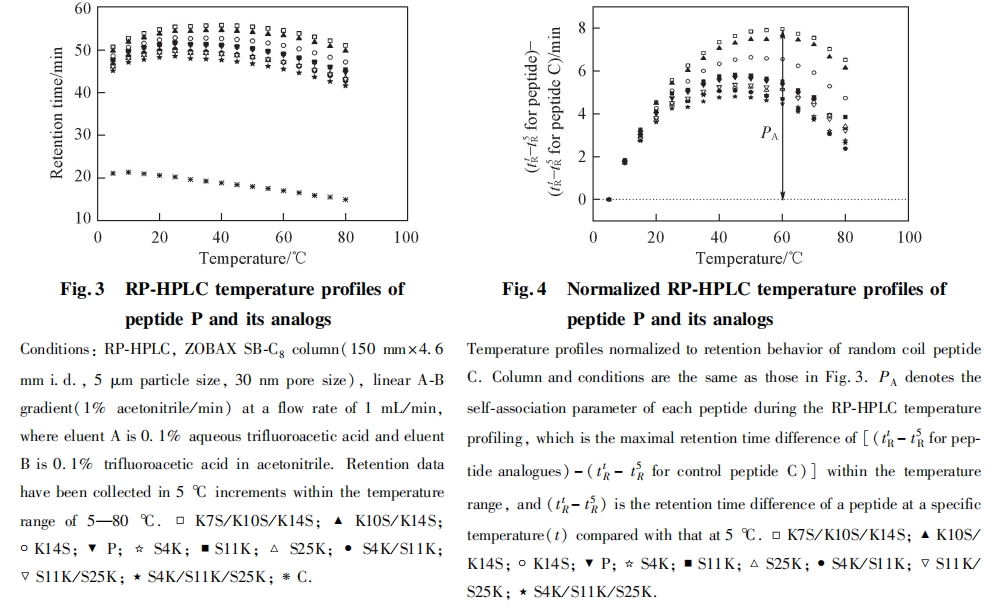
RP-HPLC温度监控技术是利用多肽在反相色谱中的保留行为研究多肽分子自我相互作用能力的新方法.在较低温度下,两亲性a-螺旋多肽的疏水面在水溶液中通过疏水作用相互结合,形成二聚体形式.此时的水溶液中只有很少的单体存在,二聚体-单体的平衡向二聚体形成的方向偏移.随着温度的升高,单体-二聚体的平衡状态逐渐被打破,二聚体开始不断解聚成为单体.能够与色谱固定相的疏水基质相结合的多肽分子总是以单体的形式存在.当温度升高到某一数值时,二聚体多肽完全转变为单体形式,保留时间达到最大值.超过此临界温度后,温度继续升高会引起多肽变性,在某种程度上引起两亲性a-螺旋去折叠,保留时间下降.另外,随着温度的升高,流动相的黏度降低,固定相与流动相间的物质转移速率增加,这些变化会影响多肽在色谱上的保留行为. 为了排除温度升高对这些性质的影响,设计了一条在亲水环境和疏水环境下均为无规卷曲结构的多肽C(序列为Ac-ELEKG-GLEGEKGGKELEK-amide), 通过扣除肽C的保留行为得到两亲性a-螺旋型多肽本身构象变化与程序升温的关联,测定多肽分子自我相互作用的能力(见图3和图4).参数PA表示多肽分子自我相互作用的能力,PA值越高表示多肽自我相互作用的能力越强.由表2和图4可见,当抗癌肽的净电荷由+4升高到+10,疏水性从50.4降至45.0,PA值由7.95min降到4.80min,即随着多肽净电荷的增加,多肽的疏水性维持在较高水平,但多肽自我相互作用明显降低. PA值的这种变化与多肽整体的疏水性的降低有一定的相关性. 此结果与Jiang等[11]得到的多肽整体疏水性降低的同时增加亲水面的正电荷,可使多肽自我相互作用降低的结果一致. 如果多肽在水溶液中自我相互作用能力太强,会形成稳定折叠的二聚体,使疏水面被包埋,多肽与靶细胞膜的作用就会大大降低,不利于多肽进入细胞膜中破坏细胞膜. 因此,合理调节多肽的自我相互作用,对提高多肽的杀伤力具有重要意义.
2 . 4 抗癌肽的生物活性
影响ACPs临床应用的最大障碍是其细胞毒性. 利用 Minimal hemolytic concentration( MHC) 表示多 肽对真核细胞的细胞毒性 , 即不发生溶血现象时所能允许的最大多肽浓度. MHC数值越大 , 表示多肽 的毒性越小. 抗癌肽的抗癌活性采用MTT方法测定 , 以杀灭50%的活细胞的多肽浓度即 IC50 值表示 , IC50值越小 , 表示多肽的抗癌活性越高. 为了更直观地反映抗癌肽针对癌细胞的选择性 , 研究者普遍采 用治疗系数(Therapeutic index) , 即MHC与IC50的比值来表示 , 治疗系数数值越大 , 表示ACPs对癌细 胞的选择性越高. 因此 , 可以通过降低其细胞毒性( MHC 值升高) 或提高其抗癌活性( IC50值降低)来增强抗癌肽的选择特异性 , 获得高效低毒的抗癌肽. 表 3 列出了不同电荷的抗癌多肽生物活性的数据.
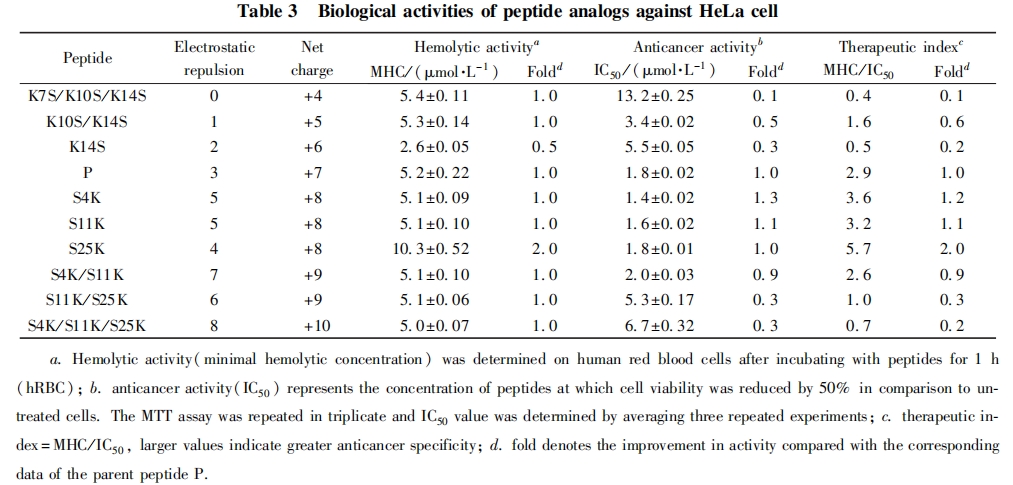
表3中结果表明,正常细胞和癌细胞受抗癌肽净电荷变化的影响不同,稍显负电性的癌细胞膜对ACPs的净电荷更加敏感. 随着多肽净电荷的数目由+4升高到+10,分子内静电排斥作用数目从0升高到8个,多肽的溶血活性未发生显著变化(倍比稀释2倍范围内);但对于HeLa细胞的抗癌活性,其IC50值变化幅度较大(13.2~1.4umol/L),与亲本相比,最大变化幅度为10倍. 当抗癌肽的净电荷为+7和+8时,分子内静电相互作用数为3-5个,获得的抗癌多肽表现出很好的抗癌活性(IC50 <2umol/L),同时无明显的溶血现象,增加1个正电荷得到的S4K,S11K和S25K都表现出与亲本相当的抗癌活性和选择性,说明多肽P存在一个最适范围保证抗癌肽的高效抗癌活性和选择性. 进一步降低或升高多肽的净电荷,即多肽的净电荷小于+7或者大于+8,抗癌活性逐渐减弱(见图5和图6). 这可能是由于多肽的净电荷过低,削弱了多肽与癌细胞负电性的细胞膜之间的静电识别相互作用;而净电荷过多,又增加了分子内部和分子之间的静电排斥作用,影响了多肽的二级结构,进而影响多肽与癌细胞的相互作用. 由图5和图6可见,该多肽的净电荷存在一个最适范围,高于或低于此范围都将导致活性降低和选择性下降,而多肽的溶血活性则未发生明显变化. 这可能与保持多肽P疏水面的完整性,只针对其亲水面进行取代有关,这与之前报道的多肽疏水面的改变对其溶血活性影响更加显著的结论一致[12].
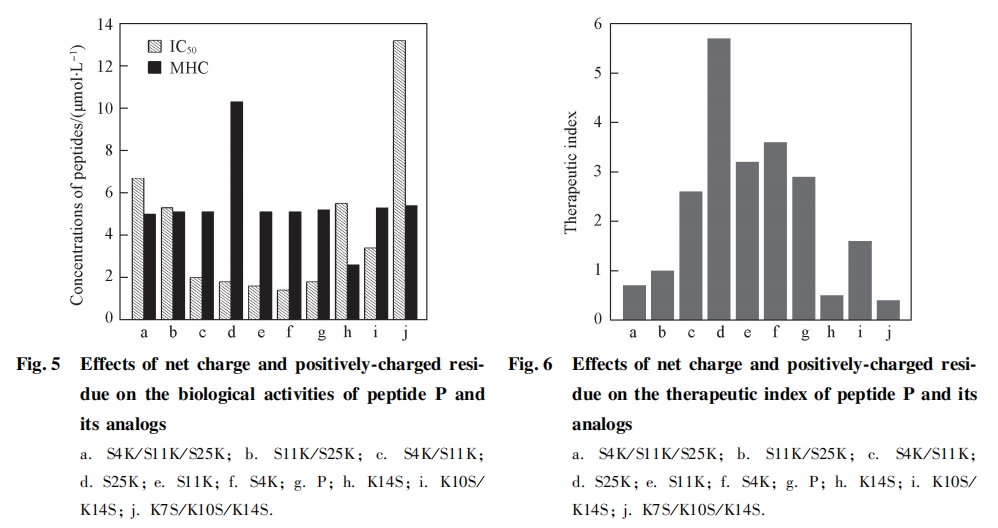
多肽对癌细胞的选择性不仅取决于癌细胞膜表面所带的负电性,还依赖于多肽自身的结构及物理化学性质,以及癌细胞膜的组成和性质,如膜流动性和跨膜电位等[18,19]. 研究结果证实,多肽的序列长度和分子质量对多肽的选择性无直接影响[20,21],而且ACPs直接侵入癌细胞的细胞膜,与细胞膜的相互作用不存在特异性的配体受体结合过程[15]. 与正常细胞相比,癌细胞对于多肽所带的净电荷更敏感,说明癌细胞与正常细胞的细胞膜所带电荷的差异是影响抗癌肽抗癌特异性的重要条件. 螺旋型抗癌多肽对细胞的识别和结合是发挥其生物功能的重要环节,其结合能力的强弱决定其活性高低,通过对癌细胞负电性脂膜的识别,赋予了抗癌肽对癌细胞的选择性,合理的净电荷调节能够有效地提高抗癌肽的抗癌活性和选择性.
综上所述,螺旋型抗癌肽的净电荷对其生物活性具有明显的影响,多肽的净电荷和分子内的静电排斥作用数目存在一个最适范围. 多肽的净电荷过低,削弱了多肽与癌细胞负电性的细胞膜之间的静电识别相互作用,活性和选择性均显著降低;而净电荷过多,又会增加分子内部和分子之间的静电排斥作用,影响多肽的二级结构,进而影响多肽与癌细胞的相互作用和抗癌活性. 通过合理设计,适当调节螺旋型抗癌肽的净电荷,能够有效地提高抗癌肽的抗癌活性和选择性,为进一步提高抗癌肽的选择特异性和设计高效低毒的有应用前景的抗癌肽药物分子提供了新的思路.
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。