
摘要 近年来,中枢神经系统(central nervous system,CNS)疾病已经严重威胁了人类的生命健康,血脑屏障(blood⁃brain barrier,BBB)的存在阻止了大部分药物进入大脑,这使得CNS疾病的治疗成为当今医学和药学领域的重大难题。纳米技术的出现使得药物具有穿透BBB的潜力,小干扰RNA(small interfering RNA,siRNA)药物的快速发展也给CNS疾病患者带来了曙光,但是纳米载体向脑部递药会遇到许多障碍,作为siRNA纳米载体进行脑部递送的条件也非常苛刻。本文主要综述了脂基纳米粒、壳聚糖纳米粒、聚乙烯亚胺纳米粒、树状大分子纳米粒、纳米凝胶、纳米胶束、纳米乳、外泌体、细胞、siRNA缀合物等作为siRNA脑部递药系统的研究进展及优缺点,以期探寻一种合适的siRNA纳米递送系统,用于BBB的穿透。
随着全球人口日益老年化以及工作压力等外界因素的增加,中枢神经系统(central nervous system,CNS)疾病的发病率不断上升[1]。其中脑卒中的高死亡率已经超越了冠心病,成为了全球第二大死因[2];此外,阿尔茨海默病也造成了严重的经济和健康负担[3]。由于血脑屏障(blood⁃brain barrier,BBB)的存在,很多疾病都没有有效的治疗方法和治疗药物,CNS疾病成为21世纪人类健康的主要威胁之一[4]。
小干扰RNA(small interfering RNA,siRNA)是1个长为21~25个核苷酸序列的双链RNA,能够与目的基因序列互补并诱导降解相应的mRNA,使得mRNA无法翻译成蛋白质,从而达到治疗疾病的目的[5]。因此,siRNA若通过合理的序列设计,理论上可以沉默任何与疾病相关的基因表达,包括导致CNS疾病发生的基因[6]。siRNA具有对致病靶点的高度特异性、高效性,以及候选药物开发的快速、简单性,这使得siRNA对CNS疾病的治疗具有独特的优势[7]。但是裸露的siRNA也存在着一些问题,比如粒径小,容易被肾脏过滤[8];稳定性差,易被血液中的核酸内切酶水解,免疫细胞的吞噬降解[9⁃10];虽然siRNA本身在沉默基因时具有强的靶向性,但是它在传递过程中没有靶向性,这就可能造成一些靶外效应,产生一些无法估计的不良反应[11];siRNA带负电荷,很难穿透BBB和靶细胞,无法彻底发挥出siRNA的基因沉默作用[12];即使siRNA进入细胞内,也没有办法逃逸内涵体和溶酶体[13⁃14]。因此siRNA需要一个合适的载体,来克服其自身存在的缺点。随着纳米技术的发展,载体的种类变得多样化[15],这为实现siRNA药物脑部递送提供可能。本文主要对siRNA脑部递送的纳米递送系统进行综述,分别论述纳米载体在体内传送过程中所遇到的障碍,并总结每种载体的优缺点,试图探寻适用siRNA脑部递送的载体。
1 siRNA纳米递送载体的传递障碍
siRNA纳米递送系统在体内传递过程中,一般会遇到3大障碍:体循环障碍、BBB、溶酶体和内涵体屏障。
1.1 体循环屏障
siRNA的递送载体在进入体循环后要在血液中保持一定的稳定性。但是纳米载体作为外源性物质,容易被各种血浆蛋白标记,经过调理素作用,容易被单核吞噬细胞系统(mononeuclear phagocyte system,MPS)吞噬降解[16]。纳米载体的大小也会影响其在血液中的传递。研究表明,小于10nm的纳米颗粒会被肾脏清除,大于200nm的纳米颗粒会聚集在肝脏、脾脏及骨髓中,一般认为小于100nm的纳米颗粒适合脑内给药[17]。纳米载体表面的Zeta电位小于-10mV时,容易被网状内皮系统(reticuloendothelial system,RES)摄取。Zeta电位大于10mV时则容易吸附血浆蛋白,也会增加在外周细胞的摄取,除此之外,还会造成溶血和血小板的聚集现象[18]。接近中性的纳米粒,具有更长的循环半衰期,不良反应更少。因此,大部分学者认为,纳米载体的亲水性修饰或者多肽修饰后,可以改善纳米载体的表面性质,从而减少与血浆蛋白的结合[19]。因此,纳米载体的尺寸、表面电荷及表面修饰等特性,直接影响其体内分布及循环时间的长短。
1.2 BBB
1.2.1 BBB的结构与功能
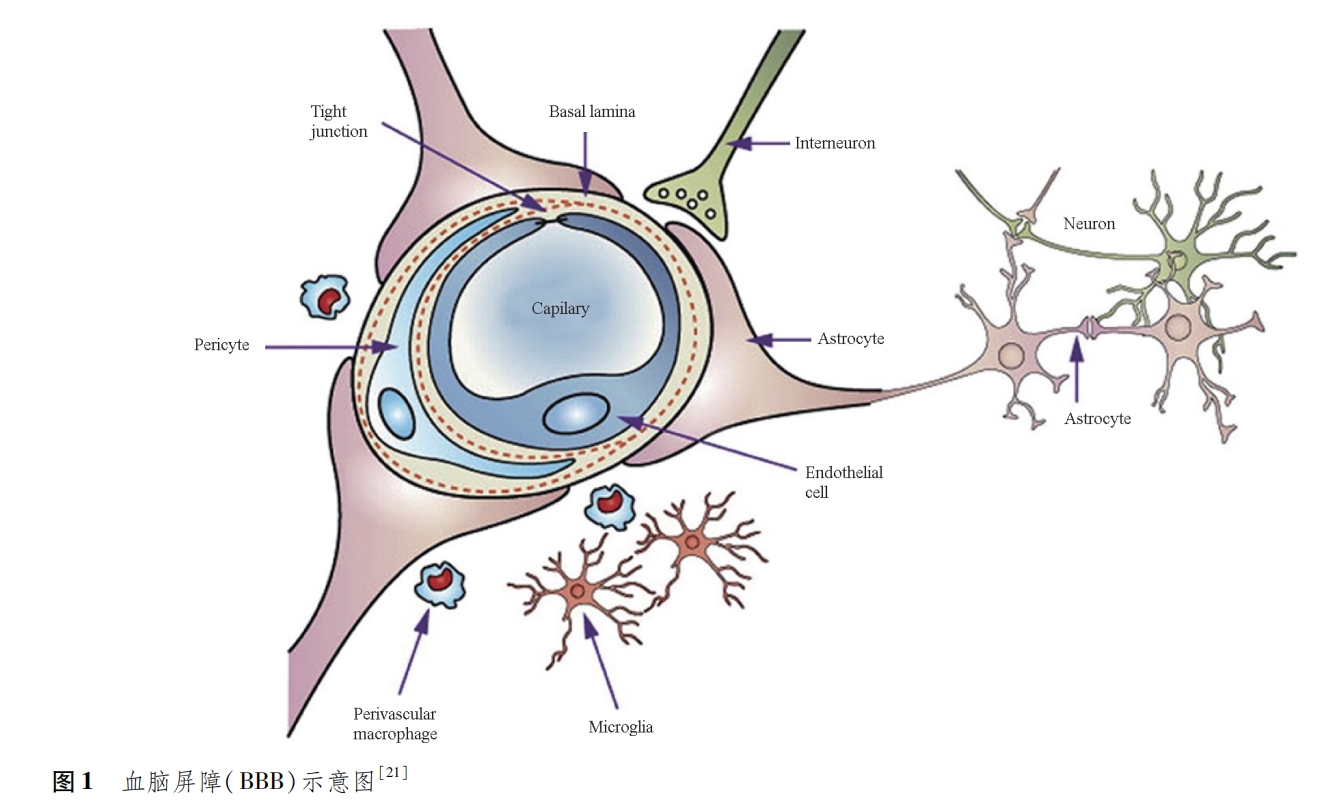
在CNS中已经形成了多种生理屏障,来保护大脑免受病毒、细菌,以及其他有害物质的侵害,这些屏障主要包括了BBB、血⁃脑脊液屏障(blood⁃cerebro⁃spinal fluid barrier,BCSFB)、血⁃视网膜屏障(blood⁃retinal barrier,BRB)、血⁃脊髓屏障(blood⁃spinal cord barrier,BSCB)[20]。BBB位于脑实质和血液循环之间,由脑毛细管内皮细胞(brain capillary endothelial cells,BCECs)、细胞外基膜、周细胞、星形胶质细胞等组成(图1[21]),是限制98%小分子和近100%大分子药物进入大脑的主要屏障[22⁃23]。
1.2.2 生理转运机制
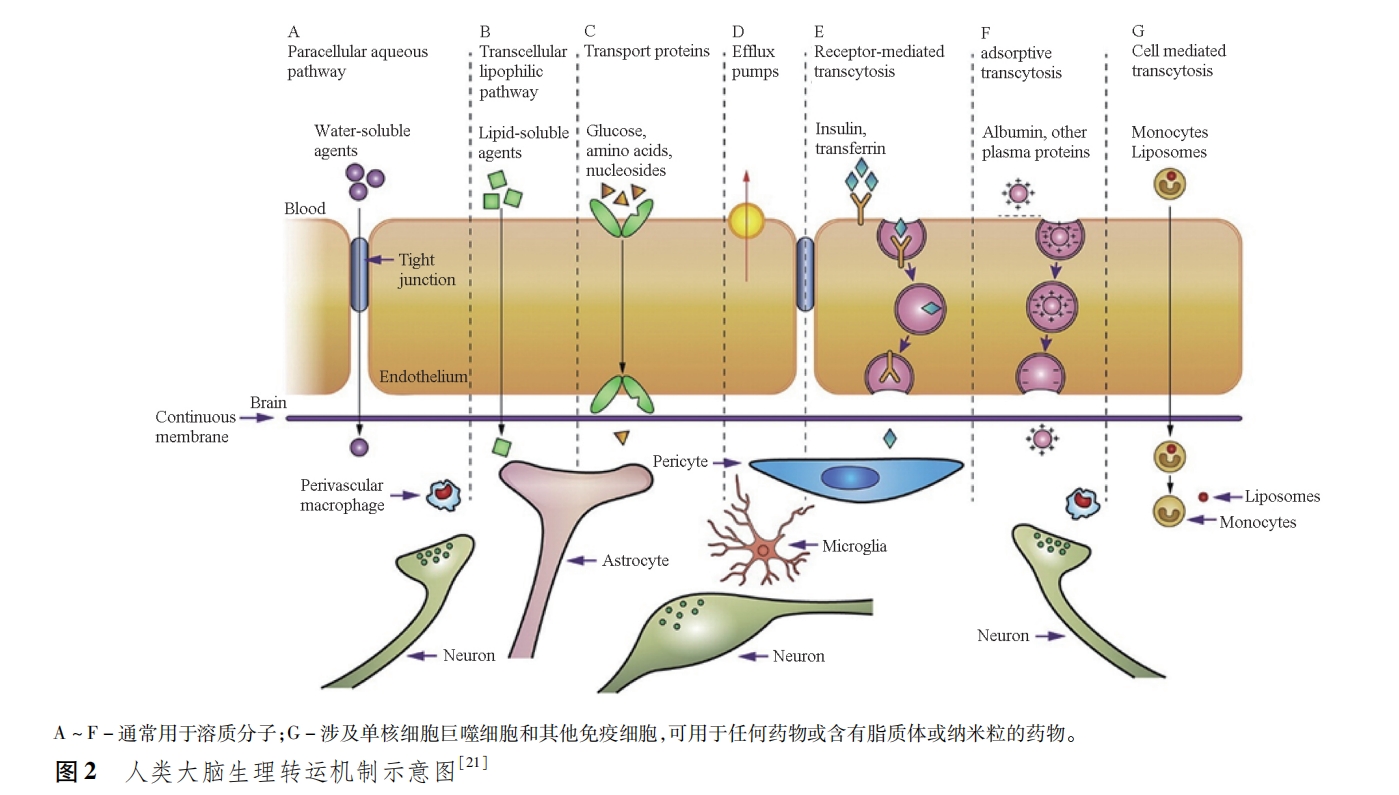
人类大脑在生理状态下吸收营养物质以及排出废物主要依赖生理转运途径来完成(图2)[21]。
①简单扩散:部分水溶性的小分子依赖紧密连接处的细胞旁路途径的简单扩散完成运输(图2A)[24]。②跨细胞亲脂途径:相对分子质量<400~600的脂溶性分子可直接溶解在细胞膜中而穿透BBB,这类物质主要有乙醇、麻醉剂、尼古丁、苯二氮类等物质(图2B)[25]。③载体介导(carrier⁃mediated transcytosis,CMT):人体中许多极性营养物质,如葡萄糖、氨基酸、核苷酸、维生素等无法通过简单扩散和跨细胞亲脂途径穿过BBB,但是脑毛细血管内皮细胞上存在大量内源性载体,可以将内源性物质和营养物质通过高选择性的膜结合载体系统在血液和脑组织之间进行物质交换[21](图2C)。④外排泵:外排泵是产生耐药性的主要原因(图2D),也是大脑清除毒素关键因素,产生这2种作用的关键蛋白主要是多药耐药蛋白(multidrug resistance protein,MRP)和P⁃糖蛋白(P⁃glycoprotein,P⁃gp)[26],尽管抑制外排泵策略能达到增加药物入脑的效果,但是也同样增加了有害物质进入大脑的风险[24]。⑤受体介导(receptor⁃mediated transcytosis,RMT):RMT的跨细胞转运是摄取胰岛素、转铁蛋白、抗体、多肽等大分子物质的主要途径(图2E)。RMT的内吞转运主要分3个步骤完成:首先,药物与脑内皮细胞的受体特异性结合,诱导受体发生交联或构象变化,此时细胞向内凹陷,产生内吞,形成细胞内小泡;然后,细胞内小泡在内皮细胞胞质中移动至细胞的另一侧;最后,在脑内皮细胞的近腔侧,核内体酸化后受体与配体解离,排出化合物,从而实现物质的跨细胞转运[22]。⑥吸附介导(adsorptive mediated transcytosis,AMT):AMT的跨细胞转运则是利用带正电的多肽与带负电的细胞膜之间的静电作用进行的跨细胞转运(图2F)。与RMT相比,AMT虽然具有穿透性能好、容量大的优点,但也存在一定的风险比如缺乏组织选择性、外周毒性、BBB的破坏等[25]。⑦细胞介导:血管周围巨噬细胞和吞噬细胞可以频繁在BBB的内外两侧迁移,以保护CNS免受病原体侵袭,特别是脑部炎症反应的病理状态下,比如卒中、多发性硬化症等,这种迁移的频率会增加(图2G)[21]。细胞介导虽然是一种新的、有效的跨BBB转运途径,但是细胞的稳定性差、载药量低,限制了其在脑部应用[27]。
1.2.3 穿透BBB的方法
依据上述的生理转运途径,科学家们已经找到了2种穿过BBB的方法,侵入性与非侵入性[21,25]。侵入性的方法主要包括脑室内灌注(intra⁃ce⁃rebro⁃ventricular infusion,ICV)、对流增强递送(convection⁃enhanced delivery,CED)、植入CNS后直接释放治疗药物的聚合物或微芯片系统、采用物理化学等方法(聚焦超声、微波能量、电磁脉冲、甘露醇、阿拉伯胶、缓激肽等)进行BBB的瞬时破坏,但是这些方法可能会造成BBB的完整性和生理功能永久丧失,导致有害物质在大脑中积累,最终对大脑造成不可逆的损伤。阿拉伯糖、内酰胺等渗透促进剂的使用可能会造成脑水肿以及癫痫发作。保证BBB完整性是安全入脑的必要条件,因此AMT、RMT、CMT跨细胞转运途径、抑制外排泵途径、细胞介导途径等非侵入性穿过BBB是一种相对安全的方法。
1.2.4 鼻脑转运通路
除上述途径外,非侵入性的方法还包括鼻脑转运通路。鼻腔给药主要是通过嗅球、三叉神经、脉管系统、淋巴系统绕过BBB到达神经中枢,是一种无创、安全、有前途的治疗方法,但这种途径的转运剂量和转运效率都很低[28⁃29]。
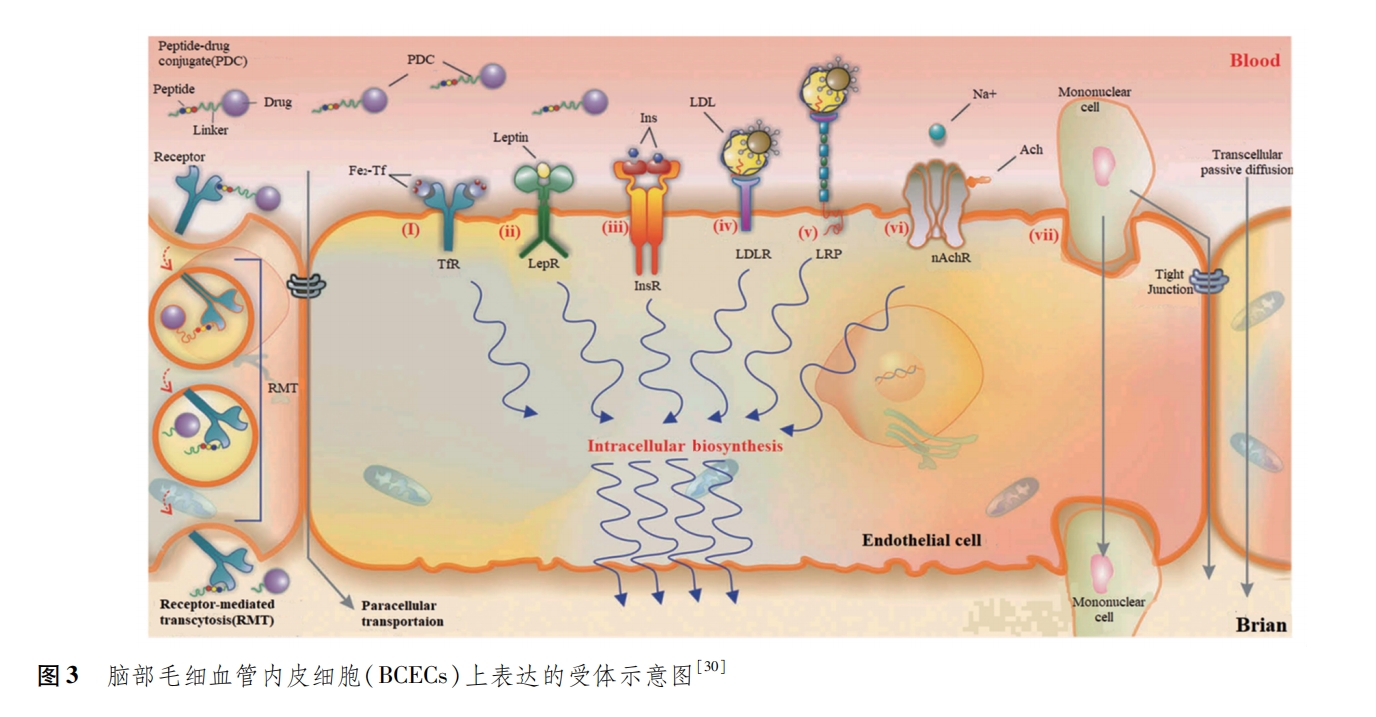
由于AMT的非选择性,CMT、细胞介导、鼻腔给药的局限性,抑制外排泵的危险性,RMT的跨细胞途径成为研究者们的首选方法。RMT地跨BBB方式不仅有很高的选择性,且该转运方式既可以转运特定的配体,也能转运配体功能化的偶联物或者纳米粒子,因而成为纳米药物靶向穿过BBB的最重要方式[30]。BBB的血管内皮细胞表达多种受体(图3),比如转铁蛋白受体(transferrin receptor,TfR)、低密度脂蛋白受体(low density lipoprotein receptor,LDLR)、低密度脂蛋白受体相关蛋白(low density lipoprotein receptor related protein,LRP)、烟碱乙酰胆碱受体(nicotinic acetylcholine receptors,NAchR)等,而且在某些特定病理条件下表达上调[24]。
1.3 内涵体与溶酶体屏障
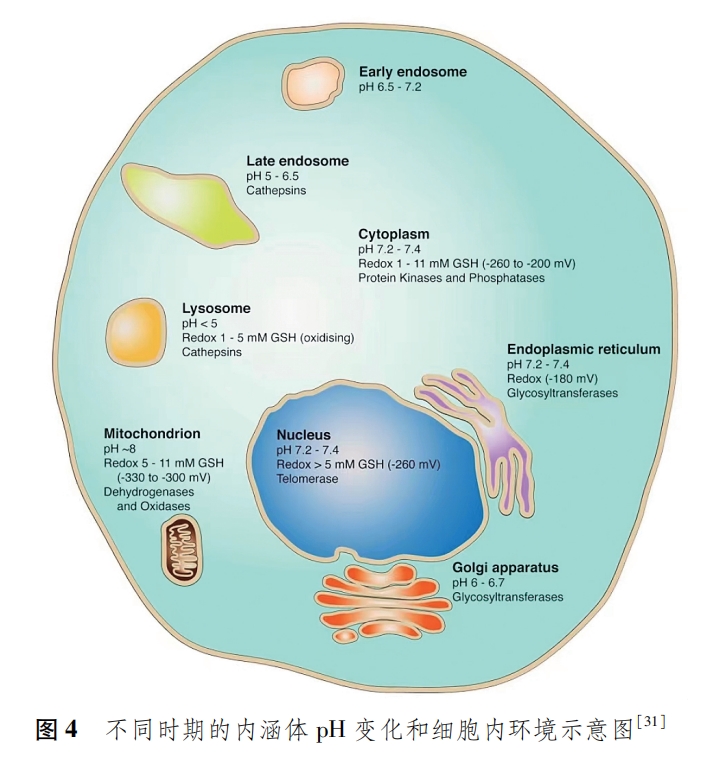
siRNA纳米递送载体穿透BBB进入细胞时形成早期内涵体,此时的pH在6.5~7.5;随后在内涵体中的ATP质子泵的作用下,大量的H+被泵入到早期内涵体中,使pH进一步降低至5~6.5,促进了晚期内涵体的形成;晚期内涵体进一步与溶酶体融合,siRNA浸润在酸性和各种消化酶的环境中,导致siRNA降解失活[31⁃33](图4)。因此,siRNA必须快速地从内涵体或溶酶体中逃逸出去,才能使siRNA保持活性。但不幸的是,大部分被细胞摄取的siRNA纳米载体都被困在晚期内涵体和溶酶体中,只有1%~3%的siRNA成功完成内涵体和溶酶体的逃逸[34⁃35]。目前逃逸内涵体和溶酶体的机制主要有质子海绵效应、降低膜的稳定性(膜融合、孔洞形成)、光化学内化[36⁃37]。其中质子海绵效应已经成为siRNA逃逸内涵体的主要途径[38]。因此,一个优良的siRNA纳米载体是实现高效脑部递送,并在靶细胞快速释放的关键。
2 纳米递送系统的研究进展
目前获得FDA批准上市的siRNA药物(表1)已经有5种[39],siRNA药物的成功,也再次证明了载体的重要性,但已上市药物中没有1种用于治疗CNS疾病。
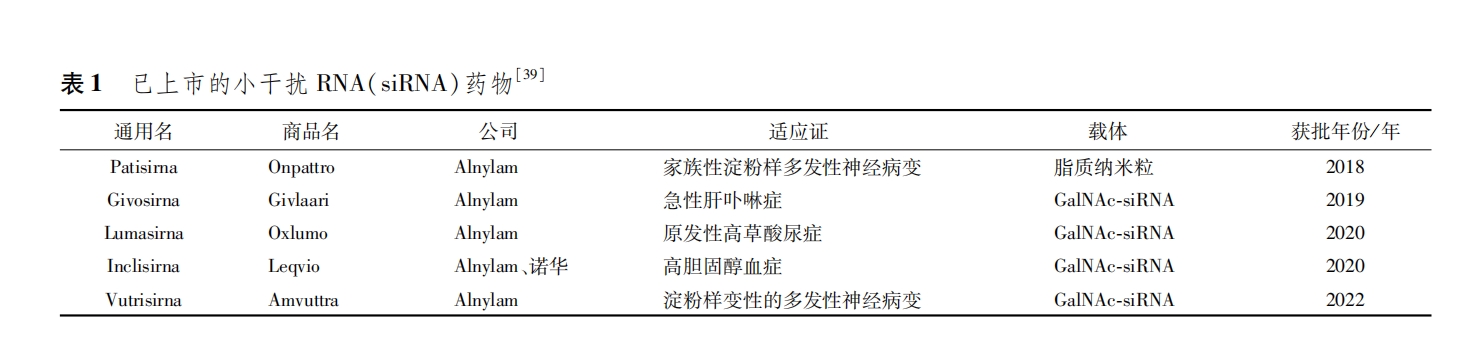
下面笔者将详细介绍脂基纳米粒、壳聚糖纳米粒、聚乙烯亚胺纳米粒、树状大分子、纳米凝胶、纳米胶束、细胞及外泌体等作为siRNA药物载体用于脑部药物递送的研究进展及其优缺点。
2.1 脂基纳米粒
2.1.1 脂质体
脂质体主要是由磷脂及正电荷脂质及胆固醇组成的双分子层密闭囊泡,其形状类似球形,粒径在100~200nm,囊泡中的疏水层和亲水层可以包裹不同性质的药物,因此脂质体可以作为绝大多数药物载体,其中最著名的就是1995年上市的多西环素脂质体[40⁃41]。作为基因药物载体,阳离子脂质体具有良好生物相容性、较低免疫原性、易修饰便于主动靶向,进而受到研究者们的广泛关注[42⁃43]。
脂质体用于穿过BBB研究主要通过脂质体表面的功能化,如多肽、抗体或小分子等生物活性配体的修饰,使得脂质体具有靶向穿透BBB的能力[43]。G⁃TechnologyⓇ是脂质体包载阿片肽(DAMGO)一种新技术,其表面修饰的聚乙二醇(PEG)⁃谷胱甘肽,使得脂质体不仅能够长循环,还能与BBB表面大量表达的谷胱甘肽受体特异性结合促进药物进入大脑,使得DAMGO在大鼠大脑中的摄取量增加1倍[44]。狂犬病病毒肽(rabies virus glycoprotein,RVG)肽来源于狂犬病毒的糖蛋白,能够特异性靶向BBB、鼻腔及神经细胞共同表达的烟碱乙酰胆碱受体(acetylcholine receptors,ACHR),因此受到研究者们的广泛关注[45]。Bender等[46]将siRNA以静电方式与阳离子脂质体结合,并将狂犬病毒糖蛋白片段肽(RVG⁃9R)多肽修饰在脂质体的表面,用于BBB的穿透以及神经退行性疾病的治疗。实验结果表明,该纳米递药系统成功地将siRNA主动递送至神经元中,并显著降低了该神经元中致病基因的表达。此外双肽修饰脂质体使得BBB和肿瘤细胞的穿透能力进一步增强[47]。血管肽Angiopep⁃2是源于Kunitz结构域的一种配体,可同时被BBB表面表达的LDLR和胶质瘤(glioblastoma multiforme,GBM)表达的LRP受体的识别,且无内源性,与转铁蛋白和乳铁蛋白等其他蛋白质相比,具有更强的脑穿透能力[48]。Angiopep⁃2与紫杉醇的偶联物已经进入临床,这再次证明Angiopep⁃2在脑靶向中的地位[49]。但是Angiopep⁃2只能用来靶向GBM的表面,无法穿透GBM的深层组织,因此Yang等[50]将Angiopep⁃2肽和肿瘤归巢肽(tLyP⁃1)同时修饰脂质体的表面,并负载siRNA用于胶质母细胞瘤的治疗,体内近红外荧光成像表明,双肽修饰的脂质体在大脑中的荧光分布最为强烈;BBB模型表明,一定浓度的脂质体在体外穿过BBB时对紧密连接无明显影响,因此,这种双肽修饰的脂质体系统为siRNA穿透BBB并靶向GBM提供了一种安全、无创的途径。
作为siRNA递送载体,脂质体不适合脑部递送。原因是可以与其他带有负电荷的细胞内组分(例如血清蛋白和酶)进行非特异性的相互作用,会导致细胞黏附下降、溶血和转染效率降低。另外,在制备阳离子脂质体的过程中可能会引入乙醚、氯仿等有机试剂,会对细胞和组织造成伤害[51⁃52]。
2.1.2 固体脂质纳米粒(solid lipid nanoparticles,SLNs)
SLNs是20世纪90年代初发展起来的新一代亚微粒给药系统,这种类型的纳米颗粒主要以固态天然或合成的类脂如卵磷脂、三酰甘油等为载体,具有良好的生物相容性与低细胞毒性。该载体可以将药物包裹或夹嵌于类脂核中制成实心固体胶粒给药系统,因此在结构上与脂质体存在显著区别[23,53]。该纳米载体经过表面修饰后可显著提高BBB的穿透效率[54]。Rassu等[56]设计了一种高效的鼻腔给药系统,用于阿尔茨海默病的治疗。他们先将RVG肽与带正电的精氨酸偶联组成RVG⁃9R复合物,该复合物可以与siRNA通过静电作用相互结合;接着,将RVG⁃9R⁃siRNA复合体包裹在SLNs中,极大提高了siRNA的稳定性;为了延长SLNs在鼻腔中的停留时间,又在其表面添加了壳聚糖涂层。单层Caco⁃2细胞渗透性实验表明,该纳米递送系统显著促进siR⁃NA在BBB的渗透。然而,它们的疏水性促进了网状内皮系统的清除,从而降低了纳米颗粒的有效性[23]。
2.1.3 纳米乳
纳米乳液是由表面活性剂稳定的“水包油”(O/W)或“油包水”(W/O)组合物的非均相分散体。这些纳米粒子的表面也可以用生物活性配体进行修饰,通过受体介导的细胞内吞穿透BBB。与其他纳米载体相比,纳米乳剂对BBB渗透的优势是能够使用安全的油脂,因而产生的毒性更小[23]。最近,纳米乳已广泛用于鼻腔给药的研究,原因是鼻腔给药可以有效地避免肝脏的首过代谢,减少药物在非靶向组织的蓄积,从而将全身副作用降至最低[57]。Elizan⁃dra等[58]使用卵磷脂、(2,3⁃二油酰基⁃丙基)⁃三甲基氯化铵(1,2⁃Dioleoyl⁃3⁃trimethyl ammonium⁃propane chloride,DOTPA)等材料采用高压均质法制备了阳离子纳米乳。DOTPA通过静电结合的方式与siRNA结合,经过吸附、封装到达水相中,这种方法既简单又实用,可以很好地解决siRNA稳定性差等劣势。通过鼻腔给药,绕开BBB,到达中枢细胞发挥基因沉默作用[59]。纳米乳液的热力学不稳定性缺陷,仍然需要进一步考虑[23]。
2.1.4 脂质纳米粒(lipid nanoparticles,LNP)
与SLNs类似,LNP是一种具有球形结构、粒径在10~1000nm、包含脂质成分的纳米粒子,作为基因药物(mRNA疫苗、siRNA、质粒DNA)的递送载体一直备受大家的关注[60]。其实LNP作为药物载体一直用于肝靶向。第1个获得FDA批准的药物(ONPATTRO)就是以LNP作为siRNA载体治疗家族性淀粉样多发性神经病变[61]。处方组成主要有胆固醇、二硬脂酰基磷脂酰胆碱(Distearoyl phosphatidylcholine,DSPC)、Dlin⁃MC3⁃DMA、聚乙二醇脂质[(R)2,3⁃bis(octadecyloxy)propyl⁃1⁃(methoxy polyethylene glycol2000)carbamate,PEG2000⁃C⁃DMG]。胆固醇用于调节脂质膜流动性;DSPC组成脂质膜结构,包裹药物;DLin⁃MC3⁃DMA是具有专利保护的新型材料,它最大的优点就是在酸性条件下可以和siRNA发生静电结合,在人体内保持电中性,使毒性减少,被细胞吞噬后,内涵体中的酸性环境使组分中的氨基质子化,质子化后的聚合物带有正电荷可以和带负电荷的内涵体膜融合,使siRNA逃逸并释放到细胞质中[62]。除此之外,DLin⁃MC3⁃DMA还可以避免被巨噬细胞吞噬,以及在肝脏中聚集,这是目前用于沉默肝脏靶点的“金标准”阳离子脂质[60]。PEG2000⁃C⁃DMG的使用延长了siRNA在体内的循环时间,增加了siRNA进入到靶细胞的可能[63]。
LNP在脑部递送方面与肝脏类似,均是利用LNP中的阳离子脂质吸附内源性的载脂蛋白E(apolipoprotein E,ApoE)从而完成脑部穿透[64]。然而采用静脉注射LNP后,可能造成肝部积累,无法到达脑部。所以鞘内和脑室间给药成为LNP siRNA系统的另外一种给药方式,用于治疗严重的神经系统疾病,但这种给药方式存在一定危险性[60]。Bruun等[65]设计出一种安全性高、穿透性能好的LNP用于传递siRNA并进行脑胶质瘤的治疗。此载体的关键点在于将Angiopep连接到LNP表面,以实现BBB和脑胶质瘤的双级靶向;其次,带正电的LNPs被带负电荷的聚乙二醇化的可裂解脂肽掩盖降低了载体的毒性,这种可裂解肽会被在肿瘤微环境和炎症性BBB表达的基质金属蛋白酶(MMPs)识别并切割,从而触发LNP电荷从弱负电荷转变为正电荷,有利于细胞内吞和siRNA的释放,从而实现高沉默效率[65],然而LNP的毒性一直没有得到很好的解决[15]。
2.2 壳聚糖纳米粒
壳聚糖是天然的生物大分子,具有良好的生物相容性,细胞摄取率高,载药量大。分子链上的氨基、羟基、N⁃乙酰氨基等均可与siRNA链形成分子间氢键,因而被广泛应用于siRNA等核酸类药物的递送[66]。Gao等[67]用一种三甲基壳聚糖(trimethylated chitosan,TMC)作为药物载体,并用RVG肽进行修饰,构建了一种高效、低毒的siRNA纳米递送系统。该研究表明,三甲基化的壳聚糖提高了自身的溶解度以及对siRNA的紧密压缩,不仅增加了siRNA血清稳定性,降低细胞毒性,而且能够产生高效的细胞摄取和有效的基因沉默效率。Sarvaiya等[68]详细描述了壳聚糖及其衍生物作为siRNA载体在治疗阿尔茨海默病(Alzheimer's disease,AD)中的巨大优势。AD是一种慢性疾病,需要药物在大脑中缓慢地释放并发挥作用,纳米载体在体内的降解速率是治疗该疾病的关键。该文章表明使用三聚磷酸钠(sodium tripolyphosphate,STPP)作为载体的交联剂,比使用戊二醛交联壳聚糖纳米颗粒降解更慢,因此可以获得更好的缓释效果。另外,壳聚糖的相对分子质量也是影响药物缓释作用的关键,实验证明高、中相对分子质量的壳聚糖比低相对分子质量的壳聚糖缓释效果更明显。TMC在治疗AD方面的优势,因为带有正电荷的TMC会和BBB上的阴离子唾液酸残基发生静电结合,从而促进纳米颗粒穿透BBB。此外,壳聚糖聚乙二醇化后并用聚山梨酯80包裹也能促进药物穿透BBB[68]。
尽管壳聚糖在安全性方面得到很好的保证,但是作为siRNA的递送载体,与某些优良的载体相比提升转染效率有限[69],在siRNA递送应用方面受到了一定的限制。
2.3 聚乙烯亚胺纳米粒
PEI是一种阳离子聚合物,是研究最多的基因载体材料之一,它具有良好的溶解度,在内涵体/溶酶体途径中具有pH缓冲能力,能与带有负电荷的siRNA发生静电结合形成纳米复合物[70]。高相对分子质量PEI的优势主要有提高细胞摄取和溶酶体逃逸,增强药效,但是PEI有个很大的缺点就是对细胞产生毒性作用[71]。因此具有低毒性的低相对分子质量(1800)[72]、线性的PEI[73]开始受到人们的关注。德国马尔堡菲利普大学的研究人员[74]就是选用一种名为PEI⁃F25⁃LMW低相对分子质量的PEI作为药物载体,实验证明这种载体具有低细胞毒性和高生物活性。为了使整个纳米载体具有一定的靶向性,他们选用了一种在BBB细胞、胶质细胞、神经元细胞高表达的白喉素受体(diphtheria toxin recep⁃tor,DTR)的配体(CRM197)偶联到PEI⁃F25⁃LMW上,通过RMT的内吞作用进入细胞。实际上PEI产生毒性的原因就是因为未被修饰的聚合物表面带有很多正电荷,正电荷的存在会转染到其他细胞中,造成严重的毒性。即使使用低相对分子质量的PEI也不能完全避免毒性的产生。因此用聚乙二醇(PEG)对纳米粒子进行修饰,PEG不仅可以屏蔽表面电荷还可以减少多聚体的形成[75]。Park等[76]开发了一种名为聚甘露醇共PEI基因转运蛋白[poly(mannitol⁃co⁃PEI)gene transporter,PMT]的聚合物载体用作siRNA的转运,来治疗阿尔茨海默病。PMT在生理条件下水解成低相对分子质量的PEI和甘露醇,甘露醇的使用一方面屏蔽了PEI剩余的正电荷降低毒性,另一方面还能刺激小窝介导的内吞作用,避免溶酶体对siRNA降解。PEG的使用也是为了降低载体的非特异性穿透,RVG靶向肽的修饰大大增加了纳米粒子的靶向穿透BBB的能力。单层膜跨上皮电阻(transepithelial electrical resistance,TEER)值测定实验表明,纳米该载体对BBB的损害较小,可以忽略不计,并且通过RVG介导的内吞作用进入细胞。整体来说RVG⁃PEG⁃PMT能成功穿透BBB,并抑制淀粉蛋白前β⁃分解酶1(serum beta⁃secretase1,BACE1)基因发挥抗AD的治疗作用。
2.4 树状大分子纳米粒
树枝状大分子由内部核心、内部支化官能团及外部表面基团3部分组成,高度支化,呈辐射状,具有精确的三维空间结构。内部的空腔及内部支化官能团可用于携带基因药物分子,作为定向运输的载体,外部表面基团经靶向修饰后可提高药物的稳定性,并增强主动靶向效率[77]。阳离子型聚酰胺⁃胺树枝状大分子(polyamidoamine dendrimer,PAMAM)活性氨基所携带的正电荷和分支性结构为siRNA的包封和压缩提供了便利。在水溶液中,PAMAM可与siRNA通过静电作用结合形成纳米复合物,所得纳米复合物具有稳定的结构和生物可降解性;同时该载体所携带的正电性的氨基可增加细胞摄取和溶酶体逃逸能力[66]。
Huang等[78]利用PAMAM作为基因药物的递送载体治疗脑胶质瘤,并通过Angiopep⁃2肽的修饰,使载体具有主动靶向功能。实验结果表明,用Angiopep⁃2修饰后的纳米粒在脑部肿瘤的分布比未修饰的纳米粒显著更多。后来研究者们将RGD肽[79]、tLyp⁃1[80]肽与PAMAM连接,用于BBB的穿透和脑部肿瘤的治疗。但是PAMAM的毒性一直没有得到很好的解决,研究者[81]用一种聚⁃L⁃赖氨酸(poly⁃l⁃ly⁃sines,DGLs)树状大分子来代替传统的聚酰胺⁃胺树状大分子,原因是DGLs有着更高的基因转染能力、更低的细胞毒性、更好的生物降解的能力。T7肽修饰之后,使得载体具有可同时靶向脑毛细血管内皮细胞和许多恶性肿瘤细胞上过度表达的转铁蛋白受体的能力,而且这种配体与转铁蛋白相比具有较好的稳定性、较小的空间位阻、临床应用潜力大等特点,使得载体穿透BBB的优势更加明显[82]。体内外实验都证明了该载体具有良好的靶向穿透BBB和胶质细胞瘤的能力。
2.5 纳米凝胶
具有三维网状结构的纳米凝胶在载药方面有很多优点,比如高载药量、避免酶对药物的降解、降低被网状内皮系统吞噬的风险。若将纳米凝胶作为siRNA的药物载体可增强siRNA的稳定性,避免核酸酶的降解,还可以通过表面修饰增强靶向性和安全性[66]。
Ding等[83]设计了1种包覆多巴胺(PDA)的核酸纳米凝胶,作为siRNA介导的低温光热疗法的治疗复合物,极大提高了siRNA的稳定性。聚N⁃异丙基丙烯酰胺(Poly N⁃isopro⁃pyl acrylamide,PNIPAM)是一种热响应性聚合物,在其低临界溶解温度(lower critical solution temperature,LCST)下表现出疏水⁃亲水相变,因此在特定温度下可以形成纳米凝胶[84]。通过该材料形成纳米凝胶不仅具有无毒、高载药特性,而且能与BBB表面表达的清道夫受体结合,实现BBB的高效穿透[85⁃86]。Jiang等[87]将siRNA与PNIPAM通过二硫键偶联制备出一种新型无阳离子siRNA纳米载体,该纳米载体不仅具有更长的血液循环时间、强大的BBB渗透、有效的细胞摄取,还能够促进siRNA在细胞中释放,保证siRNA药效的发挥。但是制备纳米凝胶需要高昂的设备,以及在生产过程可能带来一定的毒性[24]。
2.6 纳米胶束
聚合物胶束是由合成的两亲性嵌段共聚物在水中自组成的一种热力学稳定的胶束溶液。胶束作为药物载体有很多优点,它可以增加难溶药物的溶解度,具有高渗透长滞留(enhanced permeability and retention effect,EPR)效应,提高药物的生物利用度,若在亲水外壳用叶酸、多肽、抗体等修饰可使靶向性增加,亲水段的PEG部分具有长循环的效果[88⁃89]。
Huo等[90]选取了PEG化的聚天冬氨酰肼衍生物形成的聚离子复合胶束用于siRNA脑内转运。为了解决跨BBB的问题,他们选用RVG作为靶向穿透肽,实验结果表明RVG修饰的胶束比未修饰的胶束在Neuro2a细胞的摄取率更高,体内生物分布研究表明用RVG修饰胶束,可以通过BBB。总的来说,该纳米载体有着良好的分散性,较低的细胞毒性,血清稳定性好,体外沉默效率高。然而,胶束在水性环境中热力学稳定差,稀释后容易解聚,且在血液环境中不够稳定,提升胶束稳定性及递送效率是目前重要的研究方向[23]。
2.7 外泌体
外泌体是活细胞吞噬异源物质后以出芽方式向内凹陷形成的含有多个小泡的多泡体,再由多泡体与细胞膜融合而释放的小囊泡,是细胞外囊泡的1个亚型,直径在40~100nm[91]。外泌体最初是在绵羊红细胞的上清液中发现,当初被认为是活细胞分泌的“废物”,后来发现外泌体携带遗传物质、蛋白质及脂质等多种生物大分子,所以被用来当作各种药物载体[92]。外泌体负载siRNA的方法并不是像传统阳离子载体一样通过静电吸附,而是利用孵育、电穿孔、转染试剂等措施来实现。外泌体作为siRNA药物载体在脑部的应用也有不少文献报道。
EL⁃Andaloussi等[93]通过实验发现,用RVG修饰到树突状细胞分泌的外泌体表面可以穿透BBB。Yang等[94]首次用脑内皮细胞来源的外泌体作为siRNA载体并穿透BBB。脑内皮细胞分泌的外泌体表面含有四跨膜蛋白Tetraspanin、CD63、CD81、CD9,依靠这些蛋白可以和BBB、原代胶质细胞相互作用,促进细胞间的交流。激活细胞流式细胞术和免疫细胞化学染色研究表明,野生型外泌体显著增加了脑内皮细胞中荧光标记siRNA的摄取;转运研究中,外泌体还增强了罗丹明123在共培养的脑内皮细胞bEND单层中的通透性,此外,在异种移植脑瘤模型中,外泌体递送的VEGF siRNA斑马鱼大脑中标记癌细胞的荧光强度。脑内皮细胞来源的外泌体可能被用作外源性siRNA脑传递的天然载体。2019年,Reynolds等[95]利用小胶质细胞分泌的外泌体通过BBB向目的细胞递送siRNA。该研究主要是通过沉默Tspan2基因,来降低Tspan2控制的CXCL12和CXCR4的水平,来减少由HIV⁃1感染所造成的神经炎症。外泌体是一个非常有前景的药物载体,但是目前还处于研究阶段[92]。
2.8 细胞
细胞作为药物载体具有免疫原性低、血液循环时间长、特异性靶向、高安全性及突破生理屏障等特点,已成为现代药物载体研究的热点[27]。目前,红细胞、血小板、巨噬细胞、中性粒细胞、淋巴细胞、干细胞及癌细胞等都被用作药物载体,治疗炎症、癌症、代谢紊乱等不同种类的疾病[96⁃97]。
在穿透BBB的应用中,部分研究者利用免疫细胞对脑部疾病产生炎症的趋向性以及可穿透BBB的特性,直接以单核细胞、巨噬细胞和中性粒细胞作为药物载体穿透BBB[57]。Xue等[98]以嗜中性粒细胞作为药物载体,负载紫杉醇脂质体,用于胶质母细胞瘤治疗。其优势在于降低脂质体毒性的同时,将紫杉醇安全递送至肿瘤部位,减缓了肿瘤的生长,提高小鼠的存活率。曾有研究用单核细胞介导超顺磁氧化铁纳米粒子SHP30的转运,并渗透进入脑部炎症区域[99]。未被修饰的细胞展现出了良好的脑部递送能力,被配体修饰的细胞则进一步增加了穿透BBB的能力。Fu等[100]将T7肽和NGR肽修饰在红细胞膜的表面,并负载长春新碱SLNs,使载体不仅具有高度仿生能力,还拥有双重靶向能力。实验结果表明该纳米递送系统具有良好的抗胶质瘤作用。此外,配体修饰红细胞或者其他细胞完成高效的脑部递送还有很多[101⁃103]。
但是很多学者表示,尽管细胞递送展现出无穷大的潜力,但是载药量低、过早释放及稳定性差等缺点限制了细胞作为药物载体的广泛应用[104]。
2.9 siRNA缀合物
早期siRNA缀合物的出现,是为了增加siRNA的稳定性,即通过化学合成的方法将不同的化合物分子共价结合在不影响siRNA药效的正义链或反义链上[105]。这类载体主要有特定功能化的小分子⁃siRNA缀合物、多糖⁃siRNA单缀合物、磷脂⁃siRNA单/双缀合物、胆固醇⁃siRNA单缀合物、肽⁃siRNA单/双缀合物、PEG⁃siRNA单缀合物、抗体/适配体⁃siRNA单缀合物、芳香环系⁃siRNA单缀合物、交联枝化聚合物⁃siRNA单缀合物、垂悬枝状聚合物⁃siRNA单缀合物及聚合物⁃siRNA双缀合物等[106]。现如今,多肽⁃siRNA缀合物已经开始用于脑部递送,这里主要集中在细胞穿透肽(CPPs)⁃siRNA和配体⁃siRNA。
2.9.1 CPPs⁃siRNA
细胞穿透肽(cell⁃penetrating peptides,CPPs)由5~30个氨基酸组成,在生物学中得到广泛应用。一般来说,含有赖氨酸或精氨酸残基的CPPs在生理pH水平上带正电荷,以便有效地与带负电的细胞膜相互作用[107]。Yu等[108]曾用低相对分子质量的鱼精蛋白作为细胞穿透肽,中间接枝PEG,并通过二硫键与siRNA共价结合。该研究表明,与传统的静电吸附CPPs/siRNA聚集体相比,这些偶联物不会产生凝血作用,且表现出更好的RNA干扰效力和细胞内递送。虽然CPPs来增加分子货物通过细胞屏障的运输具有显著的优势,但由于高浓度下的相关毒性,这些高效的载体一直存在争议。此外,CPPs或阳离子蛋白的非特异性摄取可能导致血管和外周器官中积累更多[22]。
2.9.2 配体⁃siRNA
在上述的讨论中可以发现,配体修饰的纳米载体具有极佳的脑靶向能力。配体与siRNA的直接偶联,简单易操作,因此越来越受到科学家们的青睐。
He等[109]合成了1种甲氧基修饰的siRNA,并通过其正义链中5′端的巯基与环状精氨酸⁃天冬氨酸(cRGD)中的马来酰亚胺基团发生特异性加成反应,形成cRGD⁃siEGFR偶联物,用于脑胶质瘤的治疗。体内外数据表明,该偶联物具有毒性低、抗肿瘤作用强等特点,有望成为很有前途的药物。研究者还发现人黑素转铁蛋白(MTf)穿透BBB的效率要大于转铁蛋白和牛血清蛋白。但是完整的MTf与其他大型蛋白质载体一样具有局限性,比如无法批量生产、改变偶联药物的特性等[110]。Singh等[111]筛选了一种高度保守的12个氨基酸的多肽,称为MTfp,它保留了穿透完整BBB和进入脑部细胞的能力,同时不影响药物的理化特性,并且具有批量生产的能力。Eyford等[112]直接以MTfp与siRNA进行化学连接,生成一种新的多肽⁃寡核苷酸结合物(POC),并首次证明了在BBB保持完整的CNS疾病模型前提下,有效地穿透BBB,下调脑卒中致病基因NOX4,从而为目前难以治疗的各种神经病理中潜在的氧化应激神经炎症提供了新的治疗手段。

由于多肽偶联的siRNA纳米载体仍然使siRNA完全暴露在外部环境中,其稳定性受到科学家们的质疑[30]。
3 总结与展望
通过RMT的siRNA纳米递药系统穿透BBB,相较于其他物理、化学、鞘内注射等方式,具有显著的优势和前景。纳米载体的优缺点见表2,设计优质、高效的纳米递药系统需要尽可能地达到以下要求:①载体材料的安全性:人的大脑是一个特殊的组织器官,对载体的安全性有很高的要求,所以良好的生物降解性和生物相容性是必要的条件。②不会在血液中聚集和解离,要保持较长血液循环时间。③要有良好的载药和释药能力。④非免疫原性。⑤要有偶联基团,便于连接其他配体等功能性基团。⑥要能够有效、安全地穿透BBB,而不是完全的破坏。⑦要具有良好的靶向能力和内涵体/溶酶体逃逸能力。此外,纳米载体的表面性质,例如粒径大小、表面电荷以及所修饰的配体的密度、配体的亲和性等都会影响纳米载体在体内的分布以及穿透BBB的效率。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读中国药学杂志2024年2月第59卷第4期