
摘要:肽核酸(PNA)是一类以多肽骨架替代DNA的戊糖磷酸骨架的寡核苷酸类似物,基本的骨架是N-(2-氨基乙基)甘氨酸。肽核酸具有良好的理化性质和生物学特性,如稳定性高\杂交特异性强\不被核酸酶和蛋白酶水解等,但其水溶性差,细胞膜通透性低。笔者从骨架\碱基\骨架和碱基的连接方式与位置等方面对修饰性肽核酸的合成研究进展进行综述,使肽核酸具有更好的应用前景。
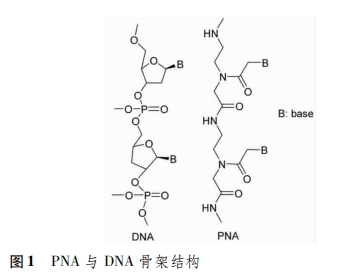
肽核酸(peptide nucleic acid,PNA)是一种全新的DNA类似物,首先是由Nielsen等[1]发表于《science》杂志中的以中性的肽链酰胺2-氨基乙基甘氨酸键取代DNA中的戊糖磷酸二酯键骨架(图1),合成了肽核酸。PNA不带负电荷,与DNA和RNA之间不存在静电斥力,提高了结合的稳定性和特异性;另外,它与DNA和RNA杂交表现出很高的稳定性和特异序列识别能力。PNA可以作为分子生物学和功能基因工具、诊断和检测的探针以及生物传感器等,应用前景广泛[2-3]。
PNA具有优良的物理化学性质以及生物学性质,被广泛地运用于疾病的诊断和治疗。但它的水溶性较低、细胞膜通透性差,为此,人们对PNA结构进行了修饰和改造,以期有更好的应用前景。笔者对近十年来修饰性PNA的合成进展进行综述。
1 aeg pNA
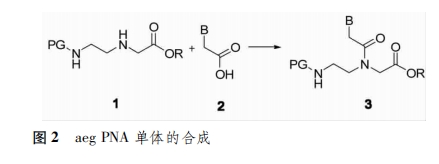
aegPNA(N-2-aminoethylglycine peptide nucleic acid)的基本骨架是N-(2-氨基乙基)甘氨酸,单体的合成主要包括骨架的合成、碱基的保护以及将碱基连接到骨架未受保护的氮上(图2)。
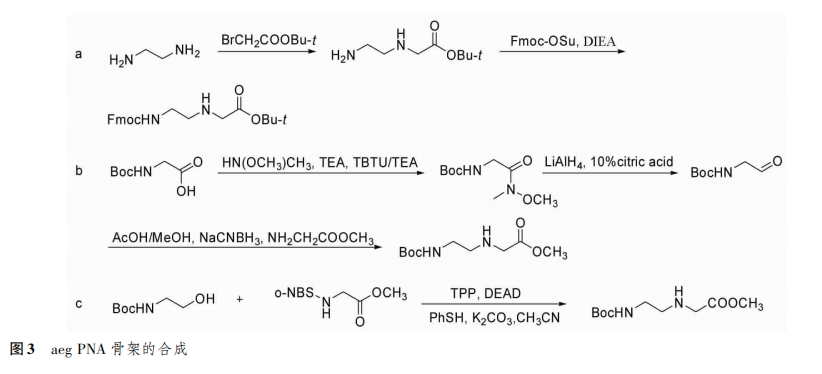
骨架的合成方法主要有3种[4]:①以乙二胺或乙腈为原料,与卤代乙酸衍生物进行烷基化反应(图3a);②还原希夫碱反应(图3B);③采用氨基乙醇与保护的甘氨酸甲酯进行MitsunoBu反应(图3c)。
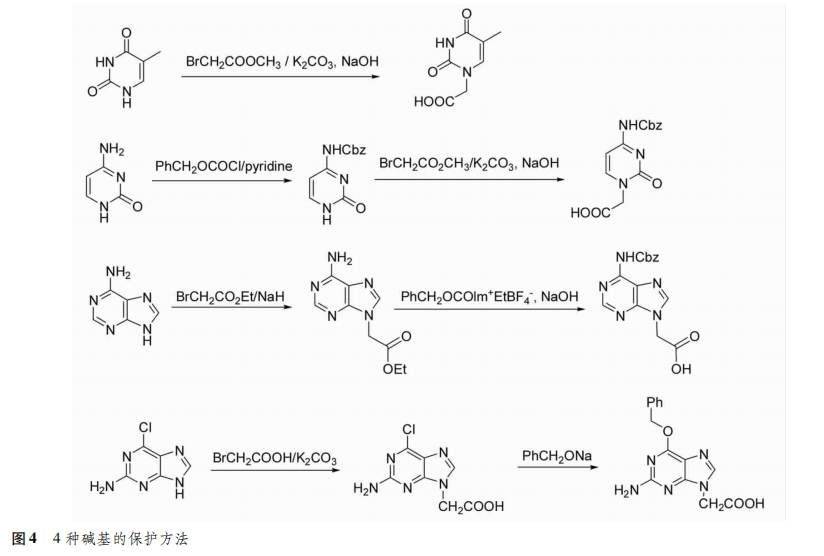
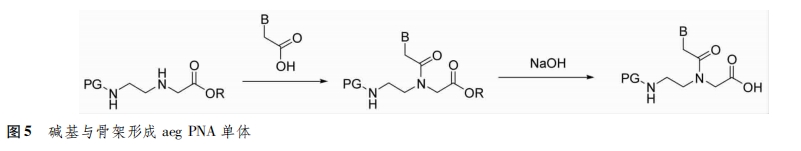
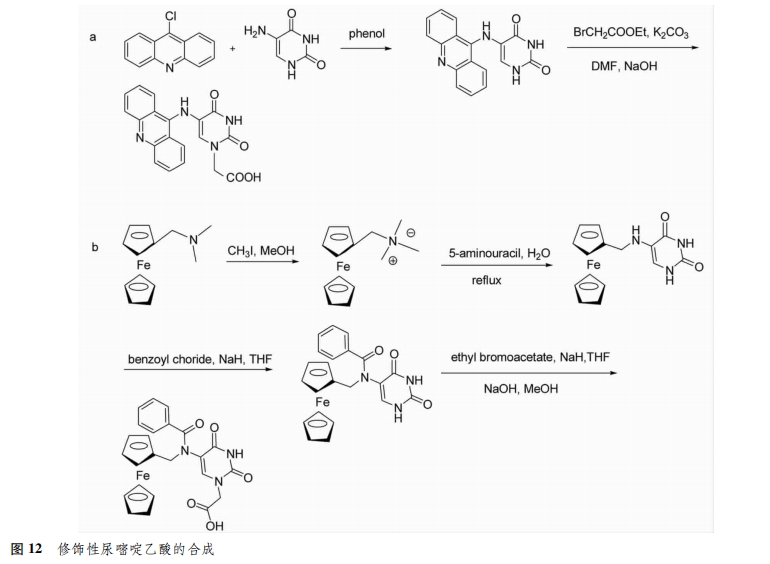
4种碱基中胸腺嘧啶不需要进行保护,直接与卤代乙酸酯进行烷基化反应,再经皂化得到胸腺嘧啶乙酸;胞嘧啶和腺嘌呤因其结构上有活泼的氨基,需要先对其进行保护;鸟嘌呤的保护过程较为复杂,常用的方法是以2-氨基-6-氯嘌呤为原料,烷基化反应后再将氯水转化为羰基[5](图4)。将碱基的乙酸衍生物通过酰胺键与骨架上未受保护的氮原子相连,就得到了aeg PNA单体(图5)。
2 修饰性PNA
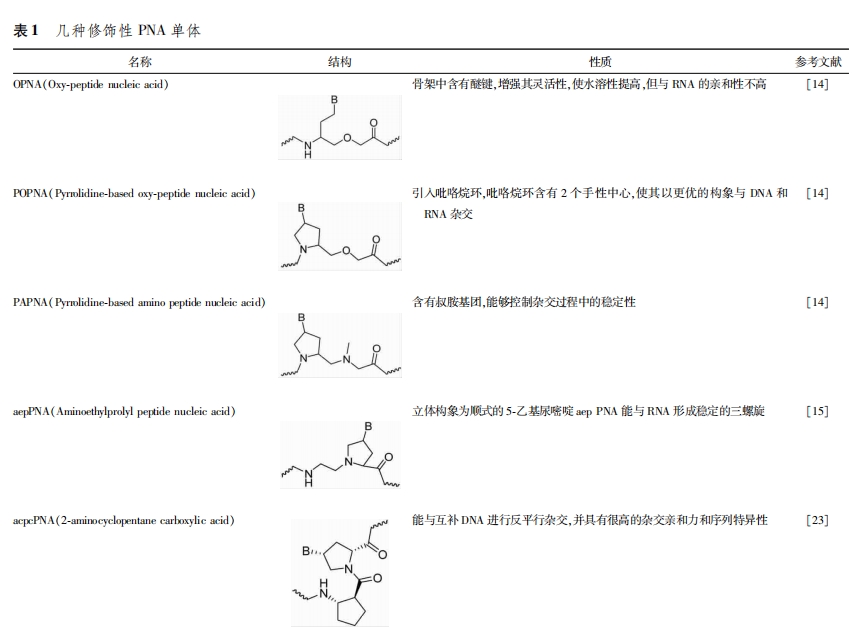
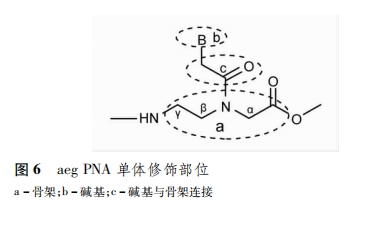
目前,研究者主要从骨架、碱基以及碱基与骨架的连接方式和位置3个方面对aegPNA的结构进行改造(图6),修饰后的PNA表现出更好的生物学和药动学特性。常见的几种修饰性PNA单体见表1。
2.1.1 引入手性支链的骨架 aeg PNA骨架为N-(2-氨基乙基)甘氨酸,众多研究者分别在α、β、y位引入手性支链来改善其缺点,使PNA在生物学、生物技术、医学等领域具有更好的应用前景。
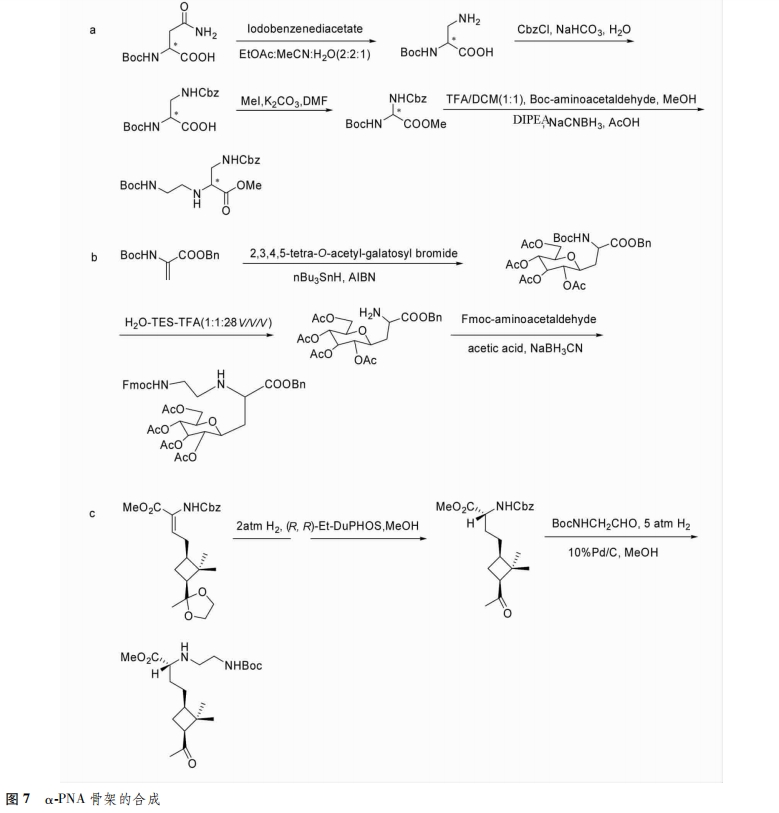
α位引入手性支链:aeg PNA具有较低的水溶性,与cD-NA/RNA杂交的方向性不强(平行/反平行)。Mitra等[6]在PNA骨架的α位引入氨基亚甲基侧链,增加了与cDNA杂交的稳定性,并且能够有效的穿过细胞膜,对细胞的毒性较小(图7a)。Hamzavi等[7]报道合成了α碳糖基化的新型PNA单体。由于糖和细胞表面的相互作用,该修饰获得的α-PNA骨架增强了选择生物分布以及细胞定位特性(图7B)。Aguado等[8]将环丁基羰基连接到骨架的α位上,合成了新型的具有光学活性的PNA,提高其在体内的生物利用度,优化在细胞中的定位和传递(图7c)。
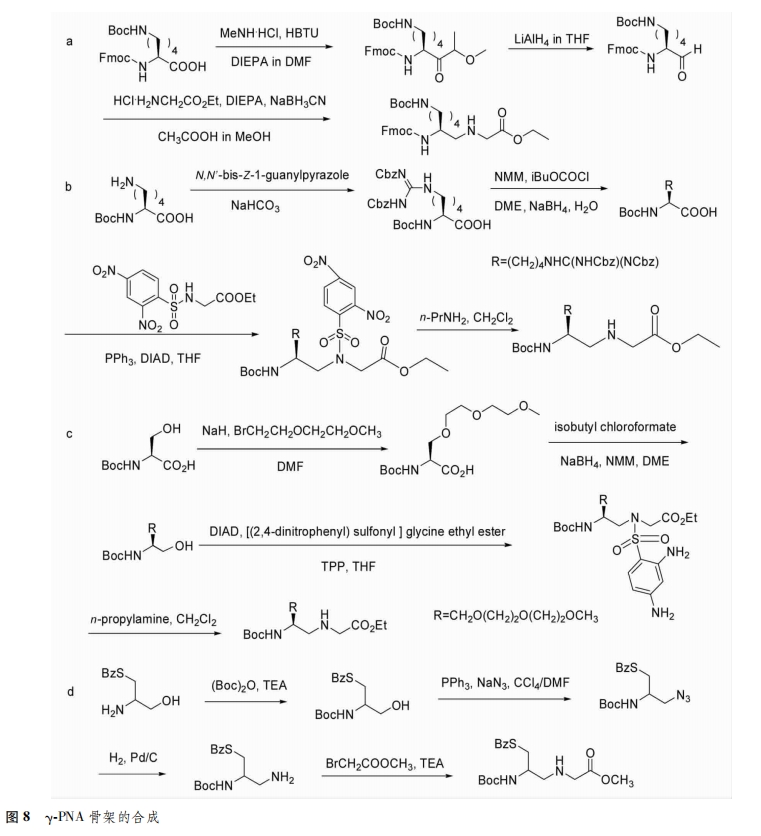
y位引入手性支链:除了在PNA骨架的α位引入取代基外,越来越多的研究者对PNA的y位进行结构修饰。与α位相比,y位的修饰更有利于提高PNA与DNA结合的亲和力[9]。Huang等[10]首次报道合成了y位上含有赖氨酸的PNA单体,并采用手性HPLC分离得到中间体和单体(图8a)。2009年sahu等在PNA骨架的y位引入胍基(yGPNA),与DNA和RNA杂交具有更高的亲和力和序列选择性,并且容易被哺乳动物细胞摄取(图8B);2011年该研究团队又将二甘醇单元引入到PNA骨架的y位上,与DNA和RNA杂交也表现出很高的亲和力和序列选择性,同时增加了水溶性[11](图8c)。Pensato等[12]采用稳定的中间体(叠氮和胺)合成了y位上含有巯基甲基PNA单体(图8d)。
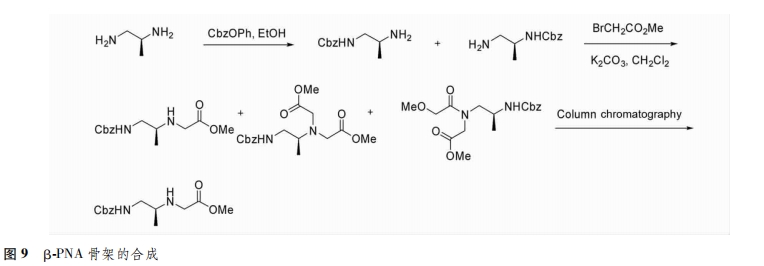
β位引入手性支链:PNA骨架的β位对应于DNA中脱氧核糖部分上的C4,,C4,是手性碳原子,因此,在β位引入手性中心可能会影响PNA与DNA的结合能力。除了骨架上引入环状结构使β碳原子成为手性碳,只在β位引入单一取代基的β-PNA直到2011年才被合成出来[13],其热变性和圆二色谱研究表明,S构型能与DNA形成稳定的杂交,为进一步合成具有更优特性的β-PNA提供基础(图9)。
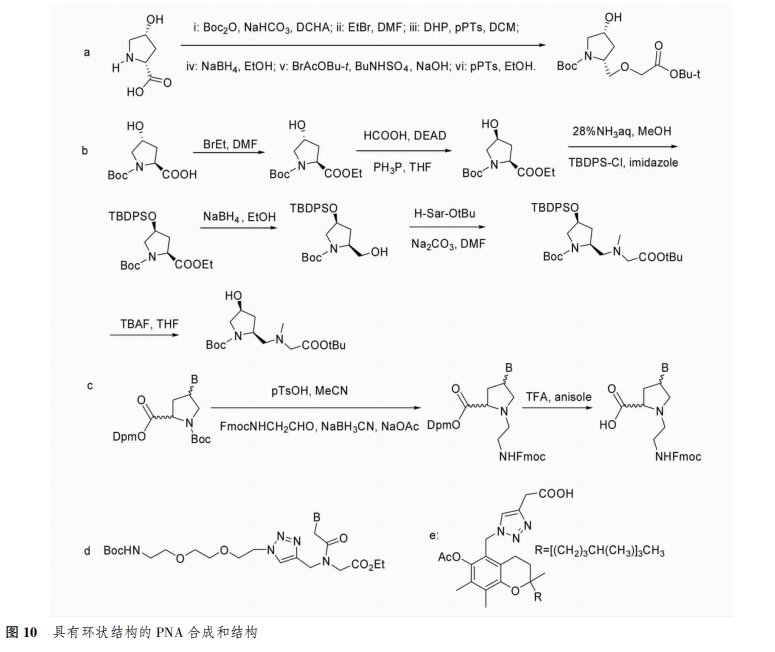
2.1.2 引入环状结构的骨架 PNA骨架中不含有离子键,与核酸杂交时表现出较高的亲和力和稳定性。但中性骨架使PNA水溶性较低,因此使PNA在医药和其他方面的应用受到一定程度的限制。氧基肽核酸(OPNA)中含有醚键,增强了主链的灵活性,使其水溶性提高,但对RNA的亲和性不高。为了进一步优化OPNA的结构,kitamatsu等将吡咯烷基引入到骨架中形成了吡咯烷氧基肽核酸(POPNA)(图10a)。在此基础上,该研究团队合成了主链中含有叔胺基团的新型肽核酸(PAPNA),它能够控制杂交过程中的稳定性[14](图10B)。Ngamwiriyawong等[15]采用新的还原烷基化反应合成了氨基乙基脯氨酰肽核酸(aepPNA),实验研究表明,立体构象为顺式的5-乙基尿嘧啶aepPNA能与RNA形成稳定的三螺旋(图10c)。
2.2 碱基的修饰
除了对PNA骨架进行修饰外,人们也对其形成PNA的碱基部分进行了改造,以期提高修饰后PNA的生物学活性,以拓展PNA的应用前景和专一性。
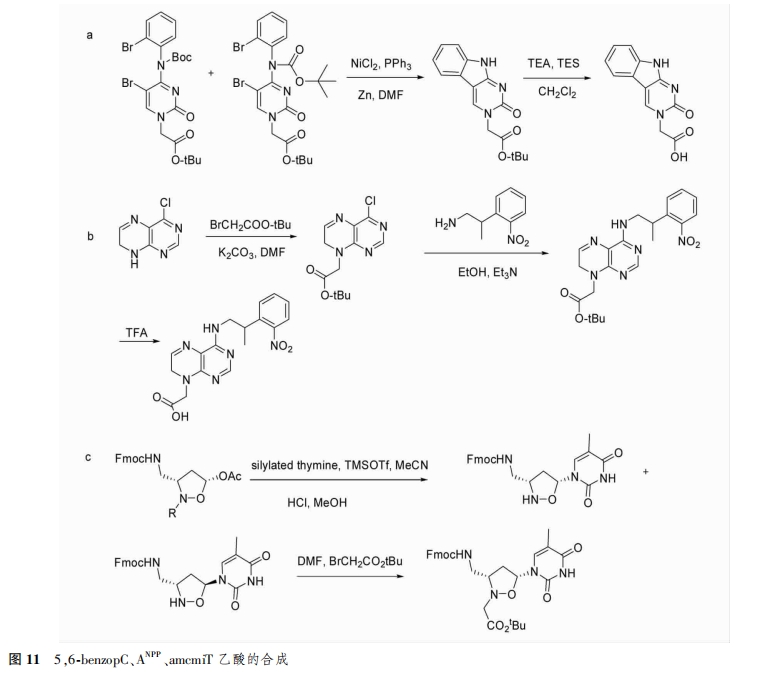
2.2.1 DNA的4种碱基 DNA的A、T、C和G4种碱基中,鸟嘌呤乙酸衍生物的合成较为复杂,对其进行修饰具有一定的挑战性,人们主要研究的对象是其他3种碱基的修饰。suchy等[18]采用还原镍介导的环化反应,在胞嘧啶环上引入另一环状结构(5,6-BenzopC),使PNA与DNA和RNA杂交时具有很强的序列稳定性,并且本身具有荧光特性,不需要单独荧光标记(图11a)。Guha等[19]将2-(邻硝基苯基)-丙基(NPP)引入到腺嘌呤环中(ANPP),仍然可以通过Watson-Crick碱基互补配对的形式与DNA或RNA杂交(图11B)。Merino等合成了3-(氨甲基)-2-(羧甲基)异恶唑烷基胸腺嘧啶[(3-aminomethyl)-2-(carBoxymethyl)isoxazolidinylthymine,amcmiT](图11c)。Wojciechowski等对胞嘧啶环进行结构修饰,合成了PhpC(6-phenylpyrrolocytosine),该PNA单体与DNA或RNA杂交时增强了结合亲和力。此外,WatanaBe等[20]在胞嘧啶环的4-位氨基上引入(6-溴-7-甲氧基香豆素)-4-甲氧基羰基,提高了PNA的光化学特性。
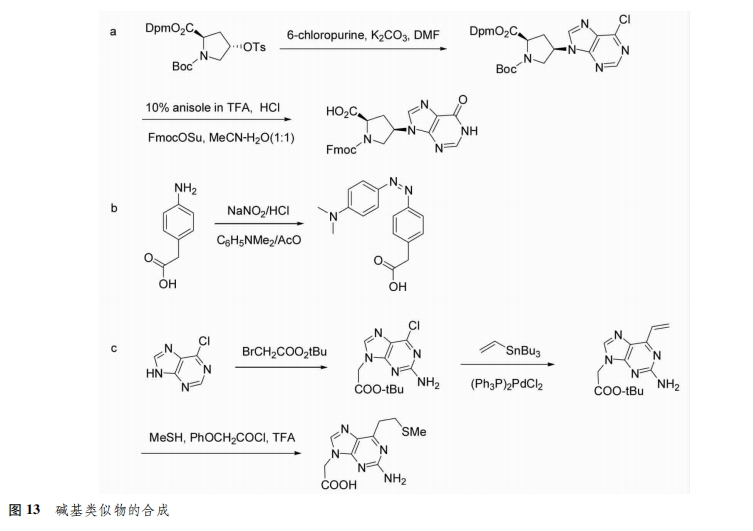
2.2.3碱基类似物 近年来,随着人们对PNA的不断研究,许多的碱基替代物被合成出来,它们都能和DNA杂交。vilaivan等[23]以次黄嘌呤作为碱基,合成了次黄嘌呤 acpcP-NA[D-prolyl-(1s,2s)-2-aminocyclopentanecarBoxylic acid],它在与DNA杂交过程中能代替G与C互补配对,从而解决了GPNA合成困难、容易形成二级结构等缺点(图13a)。Moustafa等[24]以4-(4-二甲氨基苯基)偶氮苯为碱基替代物,该偶氮苯PNA单体能与核酸形成稳定杂交,并且荧光信号强度增强100倍(图13B)。Imoto等[25]以2-氨基-6-乙烯基嘌呤作为碱基替代物,将其连接到PNA骨架中,期望成为新的生物学工具调控基因表达(图13c)。
2.3 碱基与骨架的连接
PNA中碱基一般通过乙酰基与骨架结合。改变碱基与骨架的连接方式和位置,使PNA的结构发生一定变化,可能会影响杂交的稳定性。
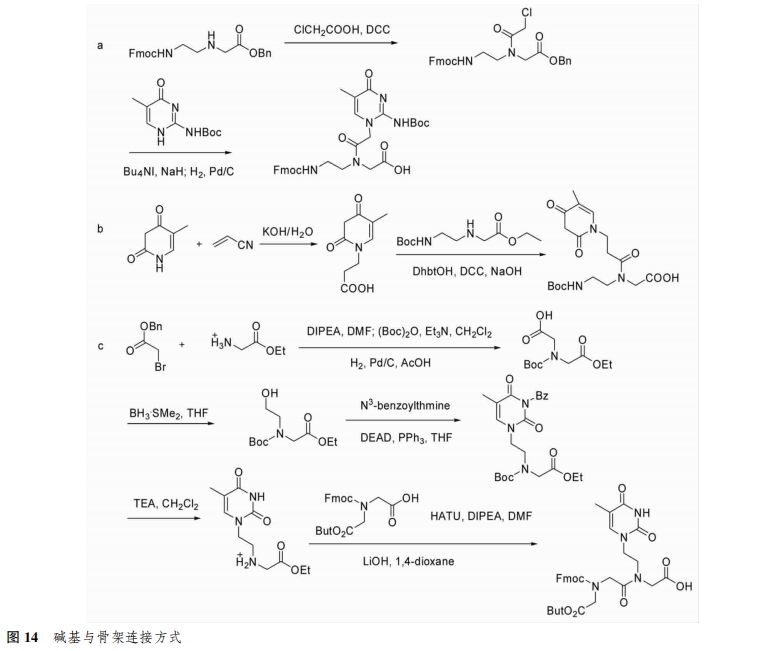
2.3.1 连接方式 aeg PNA单体通常是先将碱基形成碱基乙酸,再通过缩合方式连接到骨架上的未受保护的N原子上。然而,zengeya等[26]先将骨架上未受保护的N与氯乙酸反应形成酰氯,再直接与碱基反应(图14a)。Buchardt等[27]用丙酰基替代乙酰基将胸腺嘧啶连接到PNA骨架中(图14B)。zarra等[28]用乙基替代乙酰基连接,并且在骨架中引入羧酸酯,增强PNA的水溶性(图14c)。
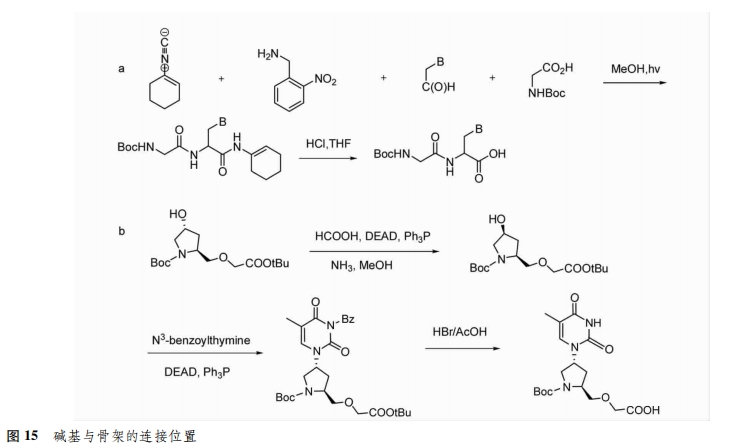
2.3.2 连接位置 除了改变连接方式外,碱基还可以通过改变连接位置与骨架结合。Huang等[29]采用U-4CR法合成了新型的PNA单体,将其碱基连接到骨架的α位上(图15a)。kitamatsu等[30]通过环状结构将碱基与PNA骨架进行连接(图15B)。
3 展望
通过对骨架、碱基以及骨架和碱基连接方式与位置的改造,大量修饰的PNA已经被合成出来。这些新型的PNA明显改善了水溶性、提高杂交亲和力等,实现了研究者的PNA药学功能和目的。目前,修饰后的PNA作为分子生物学工具在基因诊断与检测、基因芯片和生物传感器等方面的应用已经逐步成熟;但是,作为反义药物和反义试剂,用于疾病的诊断和治疗中仍然受到一定限制。主要原因是PNA细胞摄取率低、细胞内靶向性差等。因此,为满足实际临床应用的需要,今后PNA结构修饰的重点,其一应该是加强对改善细胞膜通透性功能的结构修饰研究;其二,实现PNA在细胞内的准确定位仍需要进一步的研究;其三,PNA是抗病毒新药,针对具有抗特异性病毒的修饰太少,真正可实现临床应用的修饰性PNA还需要不断地研究。
修饰性PNA主要还是以甘氨酸为骨架,用其他氨基酸代替甘氨酸骨架,对PNA结构进行深入的修饰和改造,进一步研究其新陈代谢途径、药动学和药效学特性,不断完善它的物理化学及生物学特性,以满足PNA真正成为药物运用于临床的需要,仍然是今后研究的重点。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读中国药学杂志2015年11月第50卷第22期。