
摘要:生物分子参与生命体的整个生命活动周期, 对其进行定量分析是深入研究其生物合成、信号通路和生物与非生物胁迫反应分子作用机制所关注的重要问题. 尽管同位素稀释法以其在绝对定量分析结果精准方面的优势在生物分子定量分析领域得到广泛认可, 但受到同位素内标化合物的限制无法得到广泛应用. 近 10 年来同位素标记技术得到迅猛发展, 尤其在定量蛋白质组、代谢组研究领域. 蛋白质、多肽和其他生物小分子能够通过细胞或组织培养, 或者利用化学手段, 通过对特定官能团的化学反应实现同位素标记, 如细胞培养氨基酸稳定同位素标记技术(SILAC), 15N/14N 及相对和绝对定量同位素标记技术(iTRAQ)等实现同位素标记, 并结合色谱/质谱技术实现目标生物分子的定量分析. 本文对上述同位素标记技术的优缺点进行了系统论述和比较. 基于高效、高通量和低成本同位素标记技术的生物分子相对定量研究是未来的发展方向, 也是深入了解各种生命现象分子作用机制的重要手段.
生物分子定量分析是生物学和分析化学领域共同关注的重要研究内容, 通过对参与调控生物生长发育过程的蛋白、多肽及重要的信号分子进行定量分析, 可以深入了解生物系统发挥作用的分子机制, 同时, 在复杂生物基质条件下准确获取这些极低含量重要生物分子的定量分析结果也是分析科学家所面临的重大挑战.
目前, 随着质谱(MS)技术的发展和普及, 基于MS 技术的定量分析方法日益成为生物分子量化关系研究的主流. MS 分析法的基本原理是利用离子化技术, 将物质分子转化为离子, 按其质荷比 m/z 的差异进行分离测定, 从而对研究体系进行定性或者定量分析[1]. 利用 MS 对不同 m/z 离子的区分和检测能力, 所建立的基于同位素标记内标化合物的同位素稀释法(isotope dilution)和基于同位素标记技术的相对定量分析方法能够对目标生物分子进行定量分析. 前者是通过向分析体系中直接施加稳定同位素(15N, 13C, 2H, 34S 和 18O 等)标记的目标化合物, 将其作为内标, 然后比较内源性目标化合物与内标化合物的 MS 响应来实现目标物质的绝对定量; 后者是通过对生物样品及对照组分别予以轻质同位素和重质同位素分别进行标记, 然后比较不同标记形式的目标化合物在两组样本中的 MS 响应差异来实现相对定量.
同位素稀释法中所使用的稳定同位素标记的内标化合物与待分析的内源性生物分子其结构完全相同, 具有几乎完全相同的物理化学性质, 是一种准确可靠的绝对定量分析方法. 但是, 由于稳定同位素标记的内标化合物合成困难, 其使用受到很大限制, 在实际应用中难以普及[2~5]. 近年来, 为了摆脱对同位素标记内标化合物的依赖, 一些研究小组尝试利用体内(in vivo)或体外(in vitro)手段同位素标记方法, 对相应的生物样本及其对照组分别进行重质和轻质同位素标记, 然后利用色谱/质谱联用技术对分别标有重质同位素和轻质同位素的目标组分进行比较, 确定样品组和对照组中生物分子的相对含量变化. 这种基于同位素标记技术的相对定量分析方法, 不仅能够克服同位素稀释法对于同位素内标化合物的依赖, 还具备标记对象的广泛性, 能够系统性地对生物模型中某类具有相同标记反应特性的内源性生物分子进行相对含量比较, 因此有着更为广泛的应用前景.
目前, 生物分子相对定量分析中所用到的同位素标记手段主要包括稳定同位素标记和放射性同位素标记两大类, 稳定同位素标记(stable isotope labels, SIL)是利用非放射性的稳定同位素对代谢途径或体内发生的生化反应进行标记, 并与非放射性的普通同位素标记的组分进行比较分析, 确定相对含量变化; 放射性同位素标记是利用放射性同位素对上述生理过程及中间体进行标记, 利用对放射性同位素衰变后所发出的辐射强度进行测量来对标记物进行检测分析. 受到放射性同位素使用安全性的限制, 稳定同位素标记技术在生物分子相对定量分析领域的应用更为广泛. 稳定同位素标记依据引入途径、引入阶段和标记试剂的特点可以分为以下 3 类: (1) 根据引入途径, 分为 3 种: 代谢标记、酶解引入、化学标记[6,7]; (2) 根据 SIL 引入的阶段, 分为 2 种: 体内标记和体外标记. 体内标记指代谢标记, 体外标记包括酶解引入、化学标记等; (3) 根据 SIL 本身分子量是否相同, 可分为 2 类: 质量差异标签(mass difference tags[8])和等质量标签(isobaric tags[9]). 其中, 使用前者的标记方法称为差异同位素标记(differential isotope labeling, DIL[10]).
同位素标记技术的主要应用对象是生物大分子, 但近年来在生物小分子定量分析领域也取得积极进展. 例如, 通过衍生化手段, 可对目标小分子化合物的氨基或羧基等官能团进行同位素标记, 借助所引入的同位素标签, 不但能实现上述生物分子的相对定量分析, 更为提升部分目标化合物的检测灵敏度提供可能. 本文根据同位素标签引入途径的不同, 重点对近年来发展的稳定同位素标记技术的原理在相对定量分析研究中所取得的进展及最新发展动态进行综述.
1 体内标记(in vivo)
体内标记又称代谢标记, 主要是通过细胞或者生物体(主要是指简单的生物体)正常的生长代谢实现目标生物分子的稳定同位素标记, 其操作简便、高效、相对准确. 该方法的优点是: 由于稳定同位素的引入是在细胞或生物体生长过程及蛋白质转换中引入, 对蛋白质样品标记较完全. 样品组和对照组样品可以在单独收集后直接合并进行后续的样品处理液质分析, 重质和轻质同位素标记的同一蛋白质互为内标, 避免了在样品标记、处理及分析等过程出现的误差, 因而确保了相对定量结果的准确性[11]. 它是最早被引入蛋白质组学研究领域的同位素标记技术. 而其主要缺点是要求该方法的生长条件精细可控, 由于受到饲喂条件限制, 主要适用于较为简单的单细胞生物体, 如细菌、酵母及细胞培养体系的蛋白质相对定量研究, 不适用于复杂组织、器官的样品分析. 虽然随着研究的深入, 代谢标记技术也逐步在多细胞生物体系中得以应用, 如新杆状线虫、黑腹种果蝇[12]、大鼠[13]、小鼠[6]和植物[14~17]中, 但实验难度大幅增加.
1.1 15N/14N 标记技术
通过控制生物培养体系中的 14N/15N 来源, 可实现对生物样品及其对照组分别进行系统性的 14N 和15N 标记, 用于比较含 N 生物分子的相对含量变化. Oda 等人[18]首先将该方法应用到酵母实验中, 将两组酵母分别在含有 14N 和 15N 同位素的培养基中进行培养, 然后将在这两种不同培养基中的酵母细胞等量混合、处理, 并对目标肽段进行提取, 通过比较MS 图中特征性同位素峰对(经 14N 和 15N 标记的肽段)的峰强度的比值来确定不同生长条件下蛋白质表达的差异. 随后, Conrads 等人[19]用 15N 代谢标记技术结合半胱氨酸亲和标签分别对异常球菌属和鼠的 B16黑毒瘤细胞中含有半胱氨酸的肽段进行定量研究.
14N/15N 标记技术最初只能应用于对简单的单细胞生物和体外培养细胞的标记上, 后逐步扩大到多细胞生物体研究上. Ippel 等人[20]和 Krijgsveld 等人[12]先用标记氨基酸饲喂细菌或酵母作为多细胞生物(果蝇和线虫)的饲料, 间接地将同位素标签引入到多细胞生物的蛋白质中, 最终比较了新杆状线虫和黑腹种果蝇的蛋白表达水平的差异. Wu 等人[13]从整体水平上对哺乳动物组织的蛋白质进行定量, 该方法可以检测出对药物有反应时蛋白组部分的改变, 对于利用此动物模型进行疾病研究具有积极意义. 利用稳定同位素标记小鼠和大鼠对结肠肿瘤相关的转录组学和蛋白组学的研究过程, 证明了用啮齿动物模型研究人类相关疾病的可行性[6].
在植物学研究领域, 可通过控制含 15N(或 14N)无机盐作为唯一氮源的培养基培养植物组织(植株), 对实验体系进行同位素标记, 实现含氮生物分子的相对定量分析, 这种标记策略已被用于拟南芥细胞的细菌响应鞭毛蛋白 flg22, 木聚糖酶[21]以及镉胁迫条件下质膜蛋白质组学的差异研究中. Lanquar 等人[15]通过 15N/14N 代谢标记的方法对拟南芥细胞进行同位素标记后, 研究发现经过镉接触的拟南芥细胞与未经过镉接触的拟南芥细胞的细胞质膜蛋白相比有 5倍的上增性调节. Hebeler 等人[11]用 15N/14N 标记的方法对拟南芥早期的衰老叶片中的蛋白变化进行定量分析. 他们用 2D-DIGE和 15N代谢标记技术揭示了拟南芥叶片衰老过程中的 21 个差异表达蛋白质点(12种蛋白质). Kline 等人[17]也对植物激素 ABA 诱导的拟南芥体内蛋白磷酸化进行了研究.
然而, 研究发现富含同位素的培养基一定程度上会影响细胞的正常生长, 对某些生物体系进行代谢标记存在难度, 难以获取可靠的相对定量分析结果; 同时, 代谢标记过程中, 如果发生不完全标记, 则会造成标记和非标记生物分子质量差值不可预测, 加大 MS 谱图解析难度并影响定量结果的准确性[22].
1.2 细胞培养氨基酸稳定同位素标记(SILAC)
为了克服上述标记策略的不足, Ong 等人[23]在细胞培养过程中将稳定同位素标记的氨基酸直接添加至细胞培养体系中, 利用细胞培养体系对氨基酸的代谢吸收, 实现该体系的同位素标记, 后经分离、酶解等步骤, 再结合后续的 MS 技术能够对蛋白表达进行相对定量分析, 所建立的方法称之为细胞培养氨基酸稳定同位素标记技术(stable isotope labeling with amino acids in cell culture, SILAC) (图 1). 由于该技术通过细胞的正常生长代谢将稳定同位素标记的氨基酸引入到蛋白质中, 这就大大简化 MS 定量分析前人工处理的复杂度 . 目 前 , 通 过 SILAC 技 术可实现细胞培养体系的 2H,13C 以及 15N 等稳定同位素的标记.

Ibarrola 等人[24]通过赖氨酸标记的方法比较两株不同前列腺癌细胞系表达的微粒体差异蛋白, 鉴定了 1000 个蛋白质, 也发现了多种与前列腺癌细胞转移表型相关的新蛋白, 这是首次利用 SILAC 技术对两种细胞系进行的比较研究, 为前列腺癌的早期诊断奠定了实验基础. Gruhler 等人[25]还将 SILAC 技术应用到植物蛋白组学的研究中, 通过标记拟南芥细胞, 分析由于水杨酸的刺激而引起的谷胱甘肽转移酶的表达变化, 实验证明可以利用此技术对植物细胞的复杂生物过程进行研究.
由于 SALIC 依靠在培养介质中加入稳定同位素标记的必需氨基酸(如赖氨酸或精氨酸等)实现稳定同位素标记和相对定量分析, 因此更适用于基于培养的细胞体系以及简单的单细胞生物体系, 对于代谢周期长、结构复杂的动物及人体组织样本, SALIC技术的实际应用受到很大限制; 同时, 考虑到植物细胞本身可以合成这些必需氨基酸, 植物细胞体系进行 SALIC 标记时, 会发生标记不完全的现象, 因此SALIC 技术方法不适合于植物蛋白质组学研究. 而15N/14N 标记能够弥补 SALIC 方法的不足. 值得注意的是, Zhang 等人[26]研究发现, 如果采用基于 2H/H 同位素体系的 SILAC 技术进行同位素标记时, 氘标记目标组分存在同位素效应, 在色谱分离过程中其保留时间会发生轻微改变, 从而影响最终分析结果的准确性. 此外, 还有利用 13C[27]和 34S[28]等同位素进行体内标记的研究报道.
2 体外标记(in vitro)
与利用生物体生长代谢实现同位素标记的体内标记技术不同的是, 体外标记技术采用化学手段在样品取材后的处理过程中实施目标生物分子的同位素标记, 主要包括酶解标记和化学标记 2 大类. 酶解标记是在蛋白质酶解过程中加入含有稳定同位素的试剂, 将含有重同位素基团或者分子引入到蛋白质或者肽段中, 主要适用于蛋白质等大分子. 化学标记需要根据目标生物分的特定官能团结构特点, 通过人工设计合成能够与之发生专属性化学反应的稳定同位素标记的衍生化试剂, 实现同位素标记, 该策略能够实现对蛋白质、肽段或其他小分子的标记, 较酶解标记使用领域更为广泛.
相对如上的体内标记来说, 体外标记有如下优点: (1) 所使用的稳定同位素标记试剂易于合成且相对便宜; (2) 可供选择的标记位点多, 可通过分子设计, 合成特异性标记羧基、氨基和巯基等多种基团的同位素标记试剂; (3) 部分目标分子经体外标记后, 所引入的分子片段(分子标签)能够改善目标化合物的色谱保留行为, 降低基质效应干扰, 并能提升离子化效率, 提高 MS 响应; (4) 体外标记技术适用范围广, 可广泛适用于所有蛋白质样品(包括人体的组织、器官、体液等)和小分子化合物.
尽管体外标记技术优势明显, 但与体内标记技术相比, 同位素标记步骤发生在样品处理阶段, 无法彻底消除或避免样品前处理步骤(如组织研磨、提取、及混匀前)所引入的实验误差, 从而影响结果的准确度. 同时, 在生物大分子标记过程中, 会发生标记不完全的现象, 仅有含特定官能团的肽段可以被标记, 导致肽谱覆盖率下降[29]. 需要注意的是, 有些标记反应是可逆的, 会对相对定量分析的结果带来负面影响[30], 标记反应也会引入副产物及未完全反应的标记物, 噪音增加, 增加了谱图解析的难度. 上述特点是在实施体外同位素标记实验过程中需要特别加以注意的.
2.1 酶解标记
(ⅰ) 18O/16O-H2O. 蛋白质样品发生胰蛋白酶酶解反应时, 反应体系中 H2O 的 O 会与酶解肽段 C 末端羧基中的 2 个氧原子发生交换反应, 当对照组和实验组的蛋白样品分别在 18O-H2O 和 16O-H2O 中进行酶解反应时, 经过酶解标记, 所得到的对应肽段在分子量上会相差 4 Da, 通过比较一级 MS 谱图中肽段的峰强度或峰面积, 实现肽段的相对定量. 18O 标记法定量具有较高的准确性、且标记效率高; 可以标记多种不同类型的样品, 对样品类型没有局限性, 如组织、尿样、血清等; 该方法中所采用的 18O/16O 标记策略不会改变肽段的物理性质, 不会产生重同位素标记肽段的色谱峰漂移.
Yao 等人[30]首先将 18O 标记法应用到定量蛋白质组学上, 通过对不同血清型的腺病毒进行研究, 证明了该方法的可行性. Smith 课题组[31]用 18O 标记法研究人的乳腺上皮细胞, 有 603 个蛋白被鉴定及定量. Rao 等人[32]发现, 在他们所使用的 Lys-N 酶解 18O 的标记方法, 确定只结合了 2 个 18O 原子, 提高了标记效率, 能够同时鉴定 584 种蛋白质并对其中的 562 种蛋白质进行相对定量分析. 利用反转标记(inverse labeling), Wang 等人[33]通过对两组样品进行 18O/16OH2O和16O/18O-H2O体系分别进行酶解标记, 然后分别混合进行 MS 鉴定. 两组正反双向标记实验进一步验证了 18O/16O-H2O 酶解标记策略的可行性, 并使此方法对体系复杂程度的耐受性大大增加. 但当标记后样品进行混合后容易发生标记物 18O-16O的交叉互换, 影响相对定量结果的准确性. 为此, 必须对混合样品快速鉴定分析, 尽量消除交叉互换对结果的影响.
(ⅱ) 整体内标技术. Chakraborty 和 Regnier[34]针对蛋白质样品酶解肽段的初级胺, 使用 2H3/H3- NAS 试剂对酶解肽段进行衍生化, 实现同位素标记, 并命名为整体内标技术(global internal standard technology, GIST). 与 18O/16O-H2O 酶解标记技术相比, GIST 中的酶解步骤与同位素标记步骤分开进行, 但在本文中仍归类于酶解标记类别, 作者利用此方法对大肠杆菌中的过表达的-半乳糖苷酶进行了鉴定和定量分析. 但是, 此方法在自动批量化分析体系中存在一定的困难, 这主要是 2H3/H3-NAS 可以标记必需氨基酸和肽段的 N 末端, 对于存在多个乙酰化位点的肽段, 会造成质量差的不固定(3~13 Da), 对定量分析结果产生影响. 另外, 用 13C/12C-NAS 代替2H/1H-NAS, 可消除重氢在液相分离中存在的同位素效应. 此技术也在蛋白质修饰研究中有很多报道[35].
2.2 化学标记
同位素标签衍生化技术 (stable isotope coded derivatization, ICD)[36]可以将不同同位素标记形式的质量差异标签引入目标组分进行相对定量分析, 其基本原理是: 将一种同位素标签与一份样品衍生化反应, 另外一个质量差异的标签需要与另外一种样品衍生化, 然后将同时被轻质同位素和重质同位素标记的样品按比例混合后用液质联用技术(LC/MS)分析, 最后根据被不同同位素标记的分析物产生离子对的峰面积比值对样品中的待测组分进行相对定量分析. 利用同位素标签衍生化技术, 可以对含有相同功能基团的系列组分实现同位素标记, 是解决多组分代谢相对定量分析的有效方法. 尤其适用于对复杂基质样品里的目标成分进行准确地定量分析, 需要说明的是, 如果一组样品是已知浓度的标准品, 那么就可以用这种方法对样品中的待测组分进行绝对定量, 其工作流程见图 2.
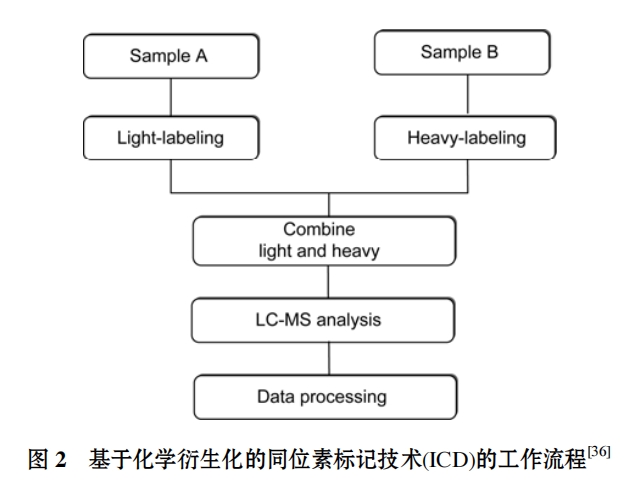
选择合理的 ICD 试剂需要符合以下要求: ICD 试剂要易于合成, 并且能够以较低成本实现 ICD 试剂中的同位素替换; 对目标官能团可实现特异性衍生化标记, 并且反应效率一致; 同时, 衍生化反应条件温和, 不破坏体系中内源性目标化合物的存在形式; 衍生化产物能有效地离子化以实现 MS 检测; 被“轻” “重”同位素试剂标签标记的分析物色谱行为一致, 能够有效地降低保留时间飘移带来的基质效应影响.
化学标记方法的优点是: 通过衍生化反应实现对待测组分的同位素标记, 在目标生物分子结构中引入含有易离子化基团的 ICD 分子片段, 不但能够实现目标生物分子的相对定量分析, 同时, 还能够大幅提升目标生物分子的检测灵敏度, 特别是对于某些珍贵的材料中的重要生物信号分子的定量研究分析. 此外, ICD 分子片段的引入, 使得目标生物分子的质荷比发生改变, 在某些情况下可以改善共流出组分带来的基质干扰.
目前, 稳定同位素标记技术不仅在蛋白和多肽定量分析研究领域有着广泛的应用, 还逐步应用于重要的小分子化合物领域, 如胺类、羧酸类等. 下面将分别对蛋白质、多肽和小分子化合物的同位素化学标记技术的发展进行评述.
(ⅰ) ICAT技术. 1999年, Gygi等人[29]利用其发明的同位素亲和标签(isotope-coded affinity tag, ICAT)技术对酵母蛋白质组进行了系统研究分析, 比较了在不同碳源生长条件下的酵母细胞中蛋白质表达水平上的相对表达量差异, 并对其进行确证. 该技术中所采用的 ICAT 试剂主要由 3 部分组成: 第一部分是由生物素构成的亲和标签, 用于分离经 ICAT 标记后的肽段; 第二部分是用来引入稳定同位素的连接子; 第三部分是用来特异结合肽段中半胱氨酸残基的巯基的活性反应基团. 试剂分为两种形式: 一种是被重质同位素(连接子含有 8 个氘, d8)标记, 另一种是被轻质同位素(连接子含有 8 个氢, d0)标记, 而由 8 个氘原子和 8 个氢原子分别标记的 ICAT 质量正好相差 8 Da (图 3). 同位素标签被引入标记对象后, 利用 MS 对两种标记形式的肽段进行响应强度比较, 确定其相对含量变化. ICAT 技术发明后, 陆续有多项研究采用了此项技术. Jenkins 等人[37]用该技术对微粒体代谢酶细胞色素 P450 进行了相对及绝对定量研究 . Griffrin 等人[38]用 ICAT 技术结合基质辅助激光解析电离-四级杆飞行时间串联质谱(MALDI-QTOF-MS)对酵母细胞的蛋白组变化进行定量分析, 阐明了此项技术在相对定量蛋白质组学研究应用中的有效性.
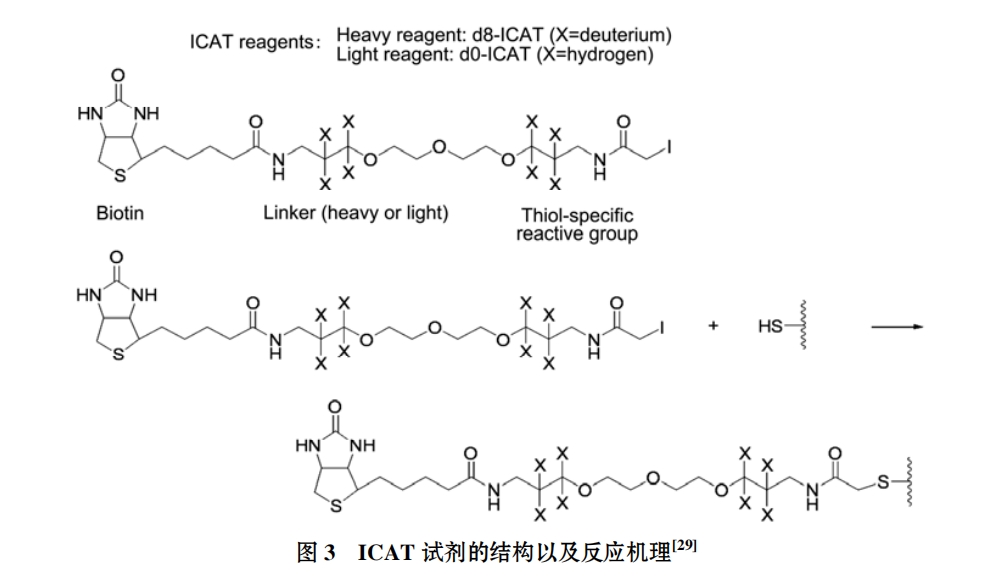
作为质量差异标签的代表, ICAT 试剂出现解决了困扰已久生物分子定量分析的难题, 只需对含半胱氨酸残基的肽段进行分析即可获取目标生物分子的相对含量信息, 降低了分析的复杂性, 标记后的肽段能够耐受多种生化和物理的分离方法, 可以分析来自不同细胞、组织、体液等绝大部分蛋白质, 具有良好的兼容性, 一经报道即引起广泛关注并得到广泛应用. 但是需要注意到是, ICAT 技术也存在一些缺点: 无法分析不含半胱氨酸的蛋白质; 生物素-同位素结合标签质量过大, 进行 MS 分析时, 保留在肽段上的标签会使得分析过程复杂化, 会影响肽段检测; 过量标记或者内源生物素都会由于彼此的竞争而影响亲和的效率等
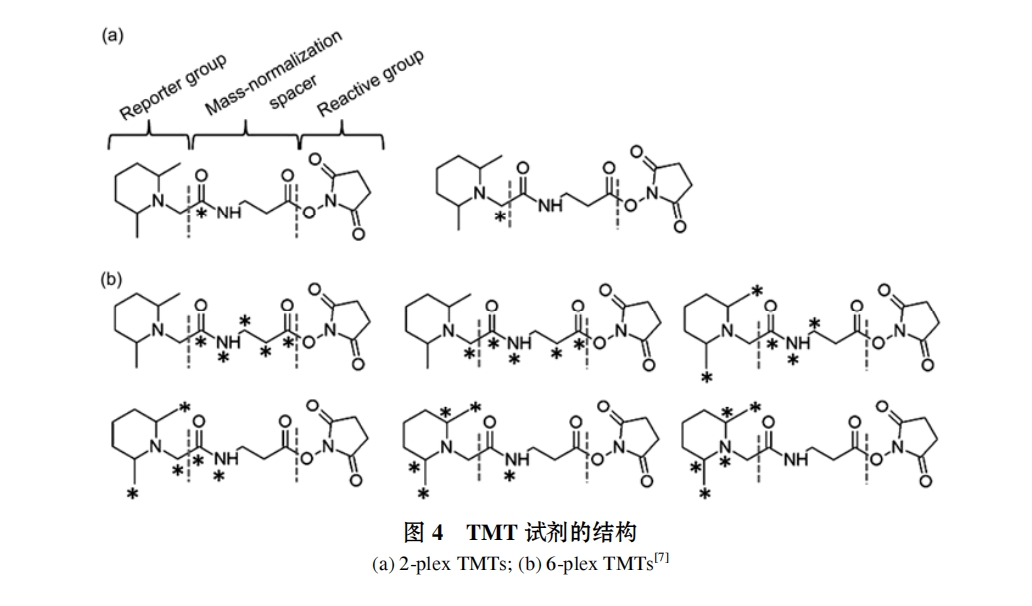
(ⅱ) TMT 技术. 为了解决 ICAT 技术的缺点, Thompson 等人[39]合成了 TMT(tandem mass tags)标签, 首次合成的 TMT2 和 TMT6 是最早的商业化的等质量标签(isobaric tags), 由于 TMT 试剂主要采用 13C 进行标记, 合成步骤多、价格昂贵, 而且产率较低, 实验成本较 ICAT 高. 在此基础上, Dayon 等人[40]又合成了第二代 TMT 标签, 虽然产率有所提高, 但是合成步骤仍然有 7 步之多, 价格仍然昂贵, 使其使用受到限制, 目前商业化的 TMT 分子结构如图 4 所示. TMT由质量报告区(mass reporter region, M)、可裂解连接区 (cleavable linker region, F)、质量平衡区 (massnormalization region, N)和蛋白质反应基团(protein reactive group, R)4部分构成, 其 R部分能够特异性地结合肽段的-NH2 基团, 在对多组蛋白质样品进行相对定量分析时, TMT 试剂特有的 M-F-N-R 的结构特征能够使得不同同位素标记形式的目标分子具有完全相同色谱行为和一级 MS 特征, 通过二级质谱(MS/MS)扫描, 不同标记形式的目标肽段在 F 区域发生解离, 形成不同的报告离子, 通过比较报告离子的强度, 即可确定不同来源样本中目标蛋白的相对含量变化.
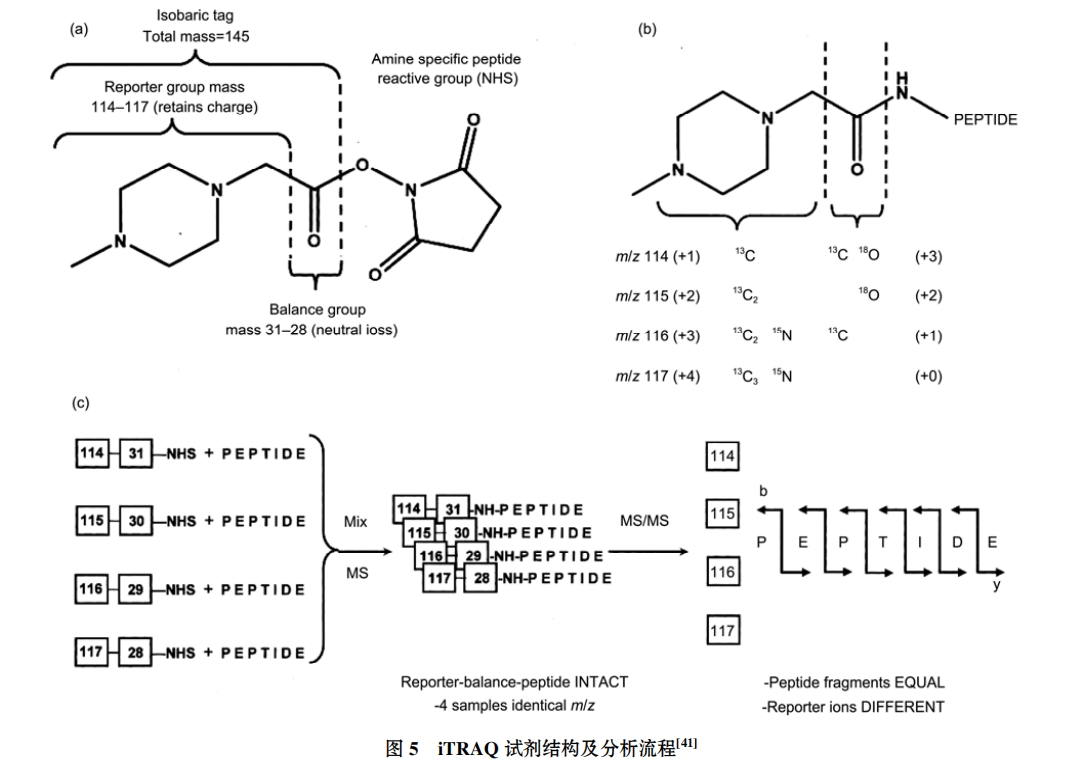
iTRAQ 技术优势明显, 所涉及的报告离子表现为不同质荷比(m/z 114~117)的峰, 这些分布在低质荷比区域的报告离子易于与分布于高质荷比区域的普通肽段离子进行区分, 其相对定量分析结果更为直接和清晰. iTRAQ 标记作为等质量标签同位素标记技术的代表, 自其开发以来, 以自身独特的优势在蛋白质组学定量研究中得到广泛应用 , 通过对iTRAQ 试剂加以改进, 已可同时对多达 8 种样品进行相对定量分析, 应用范围得到进一步扩大. 但是, iTRAQ 试剂较为昂贵, 会大幅增加研究成本; 同时, 由于 iTRAQ 试剂几乎能与样本中所有蛋白结合, 所以容易受到样本中一些蛋白质杂质的影响, 故需要对样本进行预处理, 尽量减少污染带来的影响, 这无疑会增加实验的操作难度.
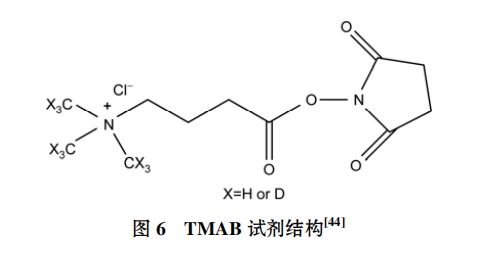
(ⅳ) TMAB 技术. 考虑到 ICAT 试剂无法对不含半胱氨酸的蛋白或肽段进行定量, 而 iTRAQ 试剂的标记位点是 N 末端以及赖氨酸的-NH2 部分, 上述两种技术都不能实现对所有肽段或蛋白的定量分析, 据此 Che 和 Fricker[44]设计了可针对所有含氨基的蛋白或肽段进行同位素标记和定量分析的标签试剂 4-三甲基丁酰胺(4-trimethylammoniumbutyryl, TMAB), 结构如图 6 所示. 用 D 和 H 标记的试剂对肽段或蛋白可以进行定量分析. 利用 TMAB 能够弥补 ICAT 和iTRAQ 技术的不足.
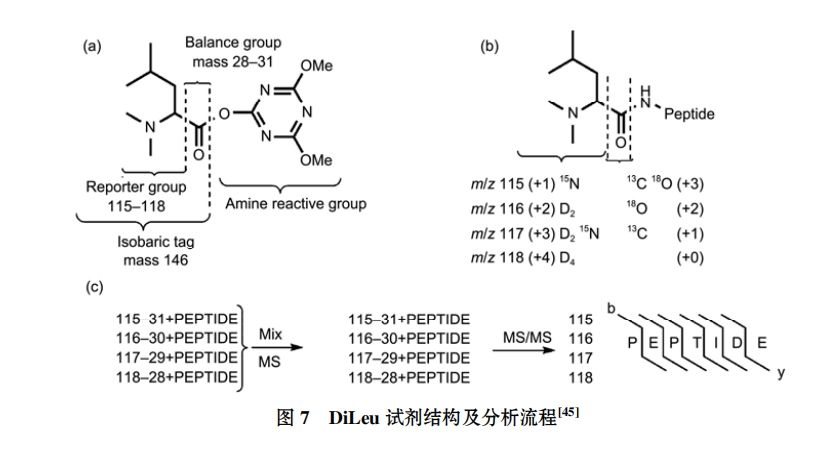
(ⅴ) DiLeu 技术. Xiang 等人[45]在 iTRAQ 和TMT 标签的基础之上合成了 N,N-二甲基亮氨酸(N,N- dimethyl leucine, DiLeu)-4 丛标签, 也是等质量标签的一种. 这种标签主要结合肽段的赖氨酸侧链N 末端以及-氨基酸基团, 包括平衡子和报告子, 结构如图 7 所示, 此技术基本保持了 iTRAQ 试剂的基本性质, 而优点是合成步骤简便、标记效率高, 并且与之前的等质量标签比较碎裂效率明显增强, 费用也不高, 与现在的商业化标签试剂 TMT 和 iTRAQ 相比有其独特的优势. 这对以后的一些多标签在蛋白和肽段方面的定量研究提供了新的思路.
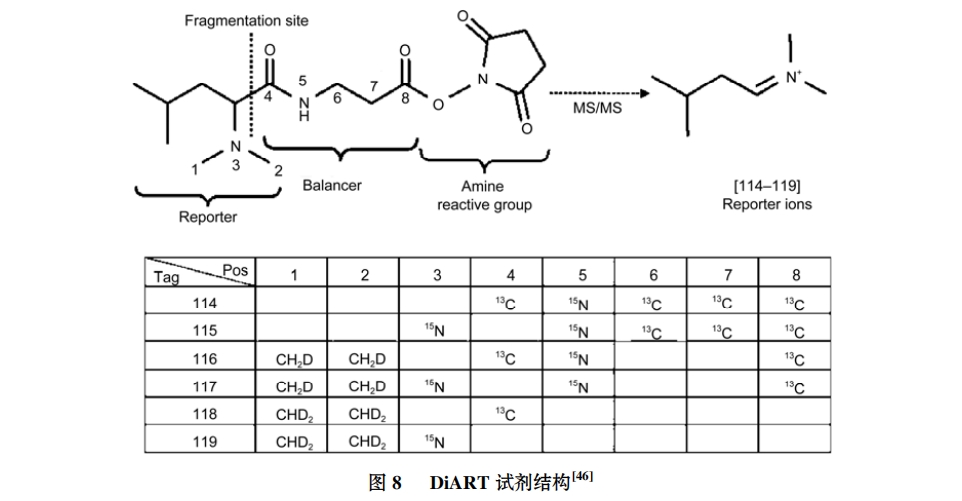
(ⅵ) DiART 技术. DiART(deuterium isobaric amine reactive tag, 氘代等质量氨基反应标签)技术是Zhang 等人[46]针对 iTRAQ 标签在复杂生物样品中的蛋白相对定量分析过程中会产生偏差的缺陷而设计的等质量标签同位素标记技术; 同时, DiART 试剂(图 8)的 2H 标记仅需 5 步就可以合成, 且标记效率可高达 97%, 产率也可达到 40%, 解决了 TMT 和iTRAQ 等试剂合成过程中采用 13C 和 15N 标记所带来的成本过高问题. 具备 6-plex特征的 DiART试剂, 能够同时对 6 种蛋白质样品展开分析, 极大地扩大了DiART 技术的应用范围. 这种新研发的 DiART 试剂主要针对胺基, 既可用于大分子蛋白, 也可用于小分子胺类, 由于 DiART 试剂具备系列化的同位素标签形式, 也可用于多组样品的比较研究.
以上同位素标签主要用于大分子蛋白质或肽段, 蛋白组学或蛋白相对定量研究. 近年来 Li 课题组[47]首次将此思路用在小分子羧酸类的代谢组学研究中, 扩大了稳定同位素标签试剂的应用, 推动了代谢组学及小分子在复杂体系的相对定量研究. 除了在组学方面的应用, Huang 等人[48]还将该方法加以改善, 应用在小分子植物激素 JA 的相对定量分析上. 下文就体外同位素标记技术在小分子化合物的相对定量研究领域的应用进行简要评述.
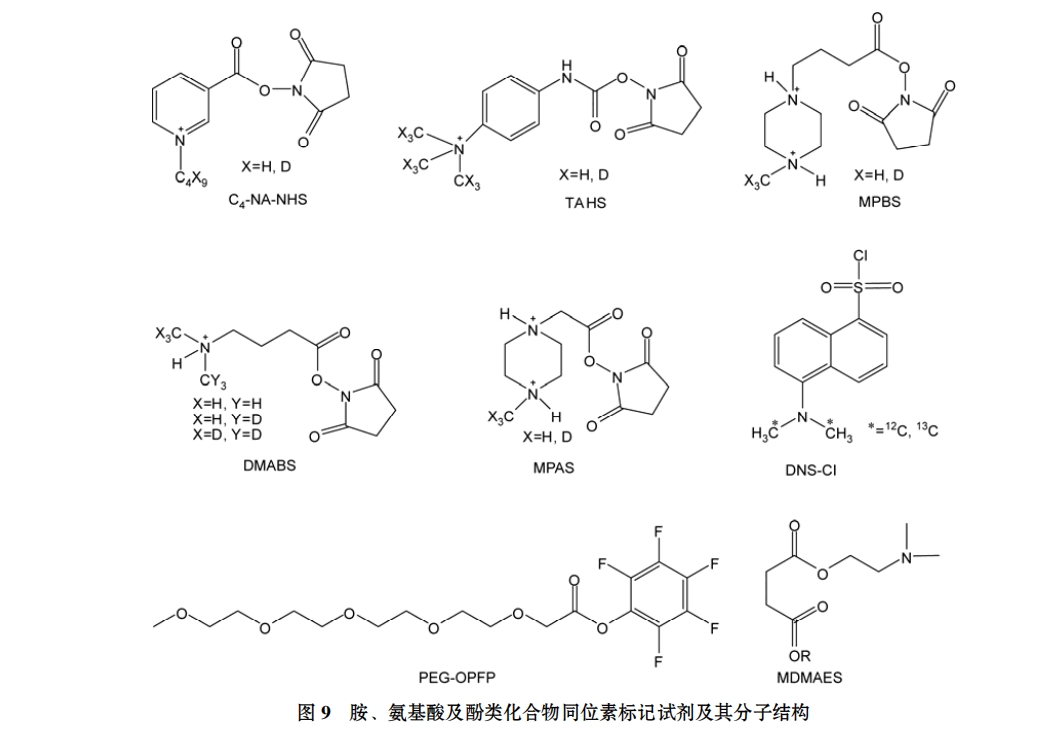
(ⅶ) 胺类、氨基酸、酚类化合物的同位素标记. 胺类和酚类是代谢组学研究领域关注的重要生物小分子代谢组分. 近年来, 此类生物小分子化合物的分析方法也在不断演变, 应用较为广泛的技术手段是采用柱前衍生化结合反相色谱分离的方法, 来实现此类化合物的定量分析. 其中, 已有多种用于氨基酸和胺类小分子化合物的衍生化试剂, 如丹磺酰氯、苯基异硫氰酸盐等, 通过衍生化, 可以改善目标化合物的色谱分离行为, 并可以增强这些化合物的检测灵敏度. 若将衍生化试剂进行同位素标记, 即可通过衍生化反应实现对胺类、氨基酸和酚类化合物的同位素标记, 对上述化合物实施相对定量分析研究.
Yang 等人[49]合成的(C1-C4)NA-NHS 试剂(N-烷基烟碱酸-N-羟基琥珀烟酰胺酯)能够高效地对含有–NH2–基团的目标生物分子进行同位素标记. 衍生化反应过程中, (C1-C4)NA-NHS 试剂中–C–O–键发生断裂, 与氨基发生反应, 最终形成–C–N–键并实现目标化合物的同位素标记, 实现定量分析. 由于该试剂也可对含有–OH(酚羟基)的化合物进行衍生化, 该研究小组[50]在后期又用“轻” “重”同位素标记试剂 C1-NANHS和 C1-NA-NHS-d3对人体肺泡上皮细胞的代谢物进行了同位素标记研究, 并最终确定人体肺泡上皮细胞 A549 的-生育酚的代谢情况.
Shimbo 等人[51]研发的柱前衍生化试剂 TAHS (p-N,N,N-trimethylammonioanilyl-N′-hydroxysuccinimi dyl carbamate iodide, p-N,N,N-三甲基氨基-N′-羟基丁二胺亚酰甲酸酯碘化物)也能够用于氨基酸分析, 分别被轻质同位素和重质同位素标记的 TAHS 试剂用于样品组和对照组样品的同位素标记, 所引进的亲水基团, 如苯基、萘基或吡啶等基团, 会增强氨基酸在反相色谱上的保留, 改善分析结果的可靠性. Johnson[52]提出 MPAS(4-methylpiperazineacetic acid, 四甲基哌嗪乙酸)、MPBS(4-methylpiperazinebutyryl succinimide, 四甲基哌嗪丁酰琥珀亚酰胺)试剂, 除能够实现目标化合物的同位素标记外, 还可提高目标化合物的质谱响应, 改进的 DMABS (dimethylaminobutyryl succinimide, 二甲氨基丁酰琥珀亚酰胺)试剂在目标生物小分子质谱响应改善方面, 优势更为显著. Abello 等人[53]开发的衍生化标签试剂 PEG-OPFP (pentafluorophenyl-activated esters of poly (ethylene glycol), 聚乙二醇-五氟苯酚活化酯)可应用于肽段以及含有初级胺官能团的生物分子的同位素标记, 系统比较了暴露在香烟诱导氧化条件下人体肺部上皮细胞的谷胱甘肽和细胞内氨基酸的定量分析研究, 实验中采用的 PEG-OPFP 试剂包括两部分: PEG 链和OPFP 部分, 13C/12C 同位素是借助于导入 PEG 链来实现标签试剂的多元化和系列化, PEG-OPFP 不仅适用于小分子的定量分析, 也适于肽段的研究. Guo 和Li[10] 合成的同位素标记的丹磺酰氯标签试剂(13C/12C-DNS-Cl)能够实现对一级胺、二级胺以及含有酚羟基的生物分子的衍生化和同位素标记, 并且13C/12C-DNS-Cl 的合成简单, 衍生化反应条件温和, 在 60℃的温浴条件下振摇 60 min 即可高效地对上述生物分子进行衍生化, 具有广阔的应用前景. 作者通过对人体尿样中的代谢物进行标记研究分析, 共检测到 672 种代谢物. O’Maille 等人[54]利用氨基化试剂13C4/12C4-MDMAES 对人体血清的代谢提取物进行了同位素标记和相对定量分析, 为探讨全身炎症反应综合征和败血症的临床研究提供了极具借鉴意义的实验结果. 此外, 对于难以直接进行定量分析的胆固醇和脱氢胆固醇类化合物, Johnson 等人[55]利用MDMAES 试剂对患有 SLOS 疾病的人体血浆进行了同位素标记和定量分析, 为 SLOS 疾病的临床诊断提供了有价值的线索. 这些近年来报道的同位素标记试剂对于改善氨基酸类化合物的检测灵敏度, 实现复杂样品基质中此类化合物的定量分析方面均起到积极推动作用, 其结构可参考图 9 所示.
(ⅷ) 羧酸类化合物的同位素标记. 在对生物学分子实施同位素标记过程中, 羧基是被重点关注的共同特征之一, 例如蛋白组学的研究中, 所有的蛋白及酶解肽段均含有羧基; 某些羧酸类小分子化合物也是生物体内天然存在的重要信号分子, 因其在生物体内发挥的重要作用而被广泛探讨研究. 因此, 有研究者便据此设计合成了一系列能够与羧基类生物分子进行专属性反应的同位素标记衍生化试剂, 实现对目标生物分子的同位素标记, 达到相对定量的目的.
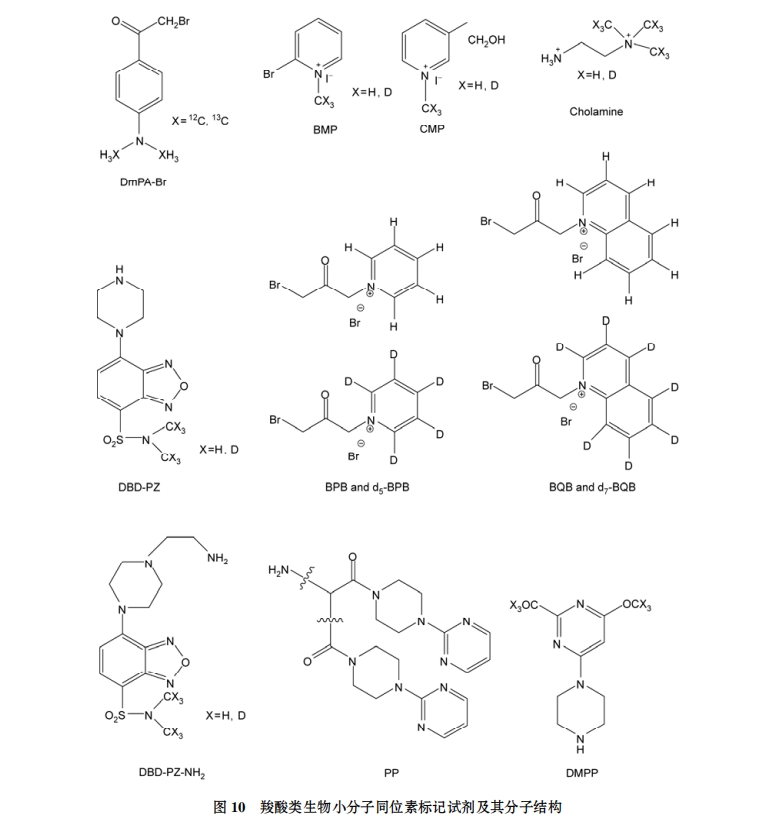
Lamos 等人[56]合成的重同位素标记的胆胺(2H3- cholamine)反应适用于含有羧酸的代谢组分的同位素标记, 包括小分子和肽段等, 衍生化反应简单易行, 能够同时对补充物饲养鸡的鸡蛋中 12 种脂肪酸进行相对定量分析. Yang 等人[57]开发的 BMP 和 CMP 衍生化试剂均具有季铵结构, 目标生物分子的羧基经过衍生化后, 其 MS 检测灵敏度有显著提升. 除能够实现相对定量分析外, 还可对目标化合物进行绝对定量分析, Adamec 等人[58]分别利用此方法对人血清中的脂肪酸和灵芝属种菌类中的灵芝酸等化合物进行了绝对定量分析. Guo 和 Li[59]利用 12C/13C-DmPABr 试剂结合LC/MS 的方法对人体尿样中的羧酸类化合物进行分析, 确证了其中 43 种羧酸类化合物. Huang 等人[48]利用合成的同位素质量标签 2H5/H5- BPB 在温和的反应条件下对盐胁迫处理的水稻植物样品以及早衰突变体中茉莉酸生物合成途径的变化进行了同位素标记和相对定量分析, 标记效率能够达到 80%~98%. 根据此研究思路, 他们还利用 2H7/ H7-BQB 对人体尿液中的硫醇和被氧化的硫醇进行了定量分析, 这种方法不仅增强了目标物检测灵敏度, 而且对于未来人类疾病(包括癌症、炎症、心血管等疾病)的诊断研究提供了更便利的条件, 进一步验证了此技术的应用广泛性[60]. Tsukamoto 等人[61]合成了一种测定具有苯并呋喃结构的羧酸类化合物的衍生化试剂 DBD-PZ-NH2, 对两种鼠血清中的脂肪酸的相对含量进行测定.
Xu 等人[62]提出了一种专门针对含有羧基的肽段进行分析的衍生化试剂 PP, 该试剂不仅产率高而且还可以增强磷酸肽的离子化效率, 与其他方法相比, 该方法所用样品量少、耗时短, 但其应用范围还只局限在生物大分子分析上. Leng 等人[63]在此基础上对其加以改进, 设计合成 DMPP, 将其适用对象扩展为所有含有羧基的化合物, 其衍生化反应条件非常温和, 仅需在室温条件下涡旋 15 s 即可完成, 实验易于操作、重复性好、没有副反应, 非常适合热不稳定的生物分子, 利用该技术, 作者成功地对尿液中的脂肪酸进行了分析, 并对两个合成的肽段进行了确证.
上述衍生化反应的共同特点是简便、迅速、产率高且没有副反应. 主要适用对象集中在含有羧基的代谢组分上, 应用模型涉及植物生理、疾病等领域, 对植物生理和疾病机理探讨, 早期疾病诊断等研究方向具有很强的指导意义(相关结构见图 10).
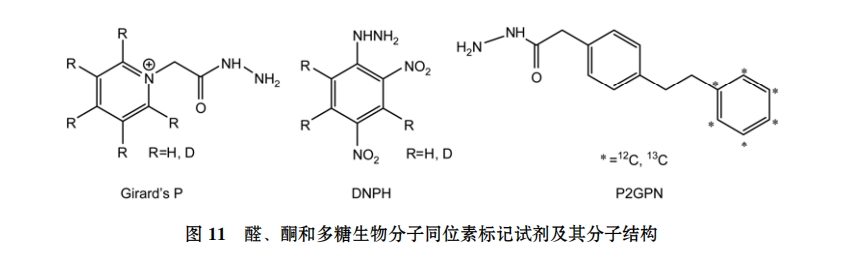
(ⅸ) 醛、酮以及多糖化合物的同位素标记. Mirzaei 和 Regnier[64]合成了同位素标记的 Girard’s P试剂, 用来对含羰基的化合物进行同位素标记和定量分析. 该衍生化试剂主要由能够特异性地与羰基进行反应的含肼的部分和用于改善目标化合物的色谱行为和质谱行为的季铵 2 部分组成, 通过与目标物羰基进行反应, 形成希夫碱, 实现目标化合物的同位素标记. Manini 等人[65]合成了针对醛和酮的轻重同位素标记的 DNPH 试剂, 借此对呼出气冷凝样品中的丙二醛及 4-羟基壬稀醛的肼的衍生物进行检测. Girard’s P 和 DNPH 试剂主要用于复杂基质样品中未修饰肽段的鉴别和一些生物组分的绝对定量研究上, 相信未来对于一些没有标准品无法进行定量分析的样品, 利用 Girard’s P 和 DNPH 进行相对定量分析也是可行的.
Walker 等人[66]用稳定同位素标记的疏水性酰肼试剂(12C/13C-P2GPN)对复杂基质样品如混合血浆中的 N 连接的多糖进行相对定量测定. 该试剂可以将疏水性的特质引入到多糖上, 以此增加离子化效率MS 检测; 通过轻重同位素标记后在 MS 上的可区别的检测来实现目标分析物的相对定量分析(相关结构见图 11).
3 同位素标记技术的分类及特点
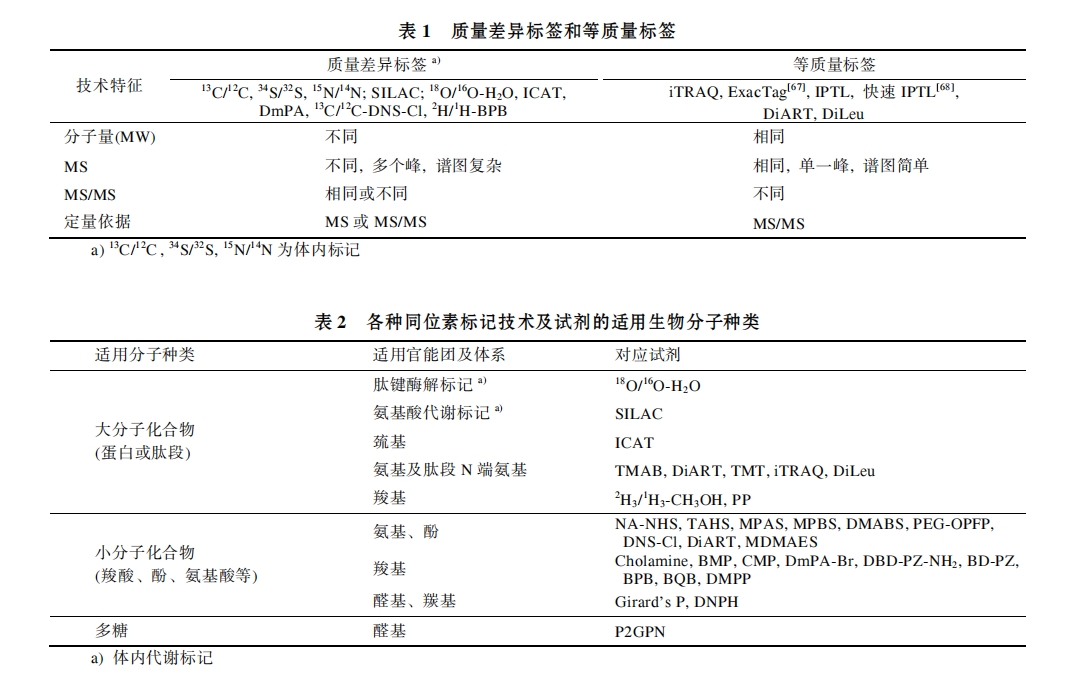
根据同位素标记试剂自身结构特征, 可将同位素标记技术划分为 2 大类, 质量差异标签和等质量标签, 根据其定量分析过程中展现的技术特点, 对其分子量、一级及二级质谱特征信息进行比较, 其汇总结果如表 1 所示.
依据同位素标记试剂的适用对象, 上述同位素标记技术可细分为大分子、小分子和糖类化合物标记技术, 每种标记技术均针对目标生物分子的特定官能团或者其特征结构进行区分, 利用体内或体外标记方法, 实现对目标生物分子的同位素标记, 其具体分类可参见表 2.
基于 MS 进行稳定同位素标记的生物分子相对定量方法原理及要考虑的因素, 对质量差异标签而言, 由于标签本身分子量不同, 目标生物分子被轻质同位素和重质同位素标记后, 会在 MS 中表现为具有特定的质荷比差、可区分的 MS 峰, 可利用高分辨MS 直接进行相对丰度比较或者后续的定性分析, 推断目标化合物的分子结构; 同时, 亦可利用 MS/MS监控目标化合物子离子或多反应离子监控(MRM)的峰强度或面积比进行相对定量, 用以确定目标化合物的相对含量变化. 对等质量标签而言, 标记后的产物具有相同的质荷比, 因此在 MS 谱图中无法区分其同位素标记产物, 必须通过 MS/MS 分析, 比较所得到的不同质荷比的特征同位素碎片峰强度, 以此进行相对定量分析.
上述同位素标记技术中所用到的标签试剂, 最早出现的是质量差异标签, 如 ICAT 和 SILAC 试剂. 由于每个同位素标记的肽段或代谢物在 MS 中出现一对或一组峰, 增加了谱图的复杂性和分析的难度, 当标签试剂质量偏大时, 被标记的生物分子的分子量增加较大, 对质谱仪的质量检测范围提出更高要求. 而 TMT 和 iTRAQ 等质量同位素标签, 不仅可以克服上述缺点, 还能够提升目标化合物 MS 图的母离子信号强度, 改善低丰度肽段或代谢物的检出, 后续MS/MS 分析则由于报告离子的低质荷比, 降低了基质干扰, 由于用于定量的碎片离子的质荷比位于低质量端, 可选择的质谱仪范围有所扩大, 但实验成本有所增加[46,69],
不论选用何种标签, 都要谨慎对待同位素效应的存在, 尤其是 2H/H 体系, 不合适的氘标记会带来明显的色谱行为差异, 从而导致不同标记形式的目标分子面临完全不同的基质效应, 影响相对定量分结果的准确性, 此外, 2H/1H 体系稳定性较差, 某些标记条件下会发生 2H/H 交换反应, 导致同位素标记失败[26,45,47]. 用 13C, 15N 等同位素标记可解决如上问题, 但是标签试剂的合成难度大、成本高[70]; 作为替代, 可以采取降低 2H 标记数量, 并将 2H 标记位点选择在亲水基团附近, 可有效避免或消除其同位素效应带来的不利影响, 如 DiART. 因此, 在实际实验设计中, 需要根据研究体系的特点, 选择合适的同位素标记试剂, 实现对目标生物分子的同位素标记和定量分析, 标签试剂的设计、选择及同位素效应的考察对确保结果准确至关重要.
4 前景展望
本文探讨的同位素标记技术都有各自的适用范围及特点, 彼此之间具有一定的互补性. 利用同位素饲喂方式实施的代谢标记操作简便、高效、准确性高, 但目前阶段更适于特定培养条件下的细胞或者简单的生物体的同位素标记. 与体内标记技术相比, 体外标记成本较低, 适用范围广泛, 几乎适用于所有蛋白质、多肽和常见的生物小分子化合物, 对复杂的组织及体液样品能够直接利用衍生化反应进行同位素标记和定量分析. 体外同位素标记试剂的结构多样, 可针对不同的生物分子有选择地进行同位素标记, 部分携带易于离子化基团的同位素标记试剂在对目标生物分子进行同位素标记的同时, 还能够显著提升目标分子的质谱响应, 特别适用于含量低、质谱响应差的生物分子检测分析. 但是, 体外标记技术依赖于样品处理阶段才引入同位素, 实现目标生物分子的同位素标记, 无法避免和消除前样品处理过程中带来的实验误差, 影响定量分析结果的准确性.
随着科学技术的发展, 生物学家和化学家对生命科学领域研究的不断深入, 重要生物分子的定量分析日益重要, 通过生物分子相对定量信息的获取, 能够深入理解这些生物分子在生命过程中扮演的角色及分子作用机制. 尽管稳定同位素稀释法以其稳定可靠的定量分析优势在某些生物分子定量分析研究领域仍然具有不可替代的位置, 然而对于种类繁杂、结构多样的生物分子, 均受到同位素内标化合物可获取性的限制, 这些同位素标记内标化合物合成困难、成本高昂, 极大地影响了同位素稀释法的广泛应用. 近几年来, 生物分子的稳定同位素标记技术正是针对同位素稀释法的不足, 利用体内或体外标记策略, 实现对目标分子的同位素标记和相对定量分析. 尤其是在蛋白组学和代谢组学研究领域的发展, 印证了此项技术的发展潜力, 为结构多样、样本来源复杂的生物分子相对定量分析提供了好的思路. 但是, 现有技术对生物样本的全蛋白分析和重要信号分子, 尤其是对于缺少可修饰官能团的重要信号分子的同位素标记和相对定量分析, 仍存在诸多不足. 因此, 同位素标记技术在未来发展应该侧重于改进现有标记技术和试剂的不足, 沿着生物分子同位素标记相对定量分析的自动化、高通量化的发展思路进行, 经过发展和改进, 同位素标记技术必将为阐明生物体内重要生物分子的合成代谢途径、重要信号分子的作用机制研究提供更全面、可靠的信息, 并得到更为广泛的应用.
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。